高效液相流动相缓冲盐选择

下面内容综合了Agilent 和网上查到的一些资料:
一般来说,反相HPLC 的流动相包括有机相和水相,有机相常用的为色谱甲醇和乙腈,不太常用的还有四氢呋喃和异丙醇。甲醇有其性价比的优势,但是甲醇活性高,可能与某些样品发生反应,而且甲醇在低波长下有紫外吸收,会降低分析方法的灵敏度;乙腈虽然价格很高,毒性比甲醇大,但是洗脱能力比甲醇强,很少与样品发生反应,用作流动相系统压力要比甲醇低很多,且截止波长比甲醇低20nm ,增加了检测出在低波长下才有吸收的杂质的可能性,所以我们一般倾向于多用乙腈,少用甲醇。但是当样品峰形不好或者分离不好时,更换溶剂是一个很好的选择,因为不同的溶剂可提供不同的选择性。 在反相色谱中,流动相中水相的pH 和离子强度在开发对条件微小变化不敏感的耐用方法中非常重要。对于离子型化合物,典型样品的保留随pH 改变而明显变化,因此控制pH 对于保留和选择性的稳定非常重要,通常在pH2~4的条件下,保留时间对pH 的微小改变稳定性最高,因此建议将这一pH 范围作为大多数样品方法开发的起始pH ,包括碱性化合物和一般的弱酸。考虑到重现性,所用的pH 应高于或低于待分析物pKa 或pKb 上下一个pH 单位。当待分析物pKa 或pKb 未知时,应测试一种以上流动相pH (如pH2.0和pH6.5缓冲盐溶液),可提供最好结果。
对流动相的优化主要体现在水相上。流动相pH 值对色谱分离的影响有多钟方式,根据待分析物的结构性质,pH 可能影响选择性、峰形和保留。如果是非极性较强或中性的化合物,pH 对分离度和保留的影响一般不明显。如果是可离子化的化合物,如酸或碱,保留因子和选择性随pH 改变非常明显。 (1) 酸性分析物,应选择低pH 缓冲液流动相,以防止分析物离子化。了解分析物的pKa ,才能有效的选择流动相pH 。缓冲范围应在其缓冲液离子pK 值±1 pH 单位,使流动相的优化具有一定的灵活性。例如,醋酸盐的pKa 为
4.8,缓冲范围为pH3.8~
5.8。
(2) 碱性化合物,在高pH 条件下才能得到其非离子形态,但这对色谱柱不利。通常许多碱性化合物在低pH 条件的保留就已经满足要求了,所以可选择低pH 条件。如果选择高pH 条件,则注意需选择耐强碱的色谱柱。
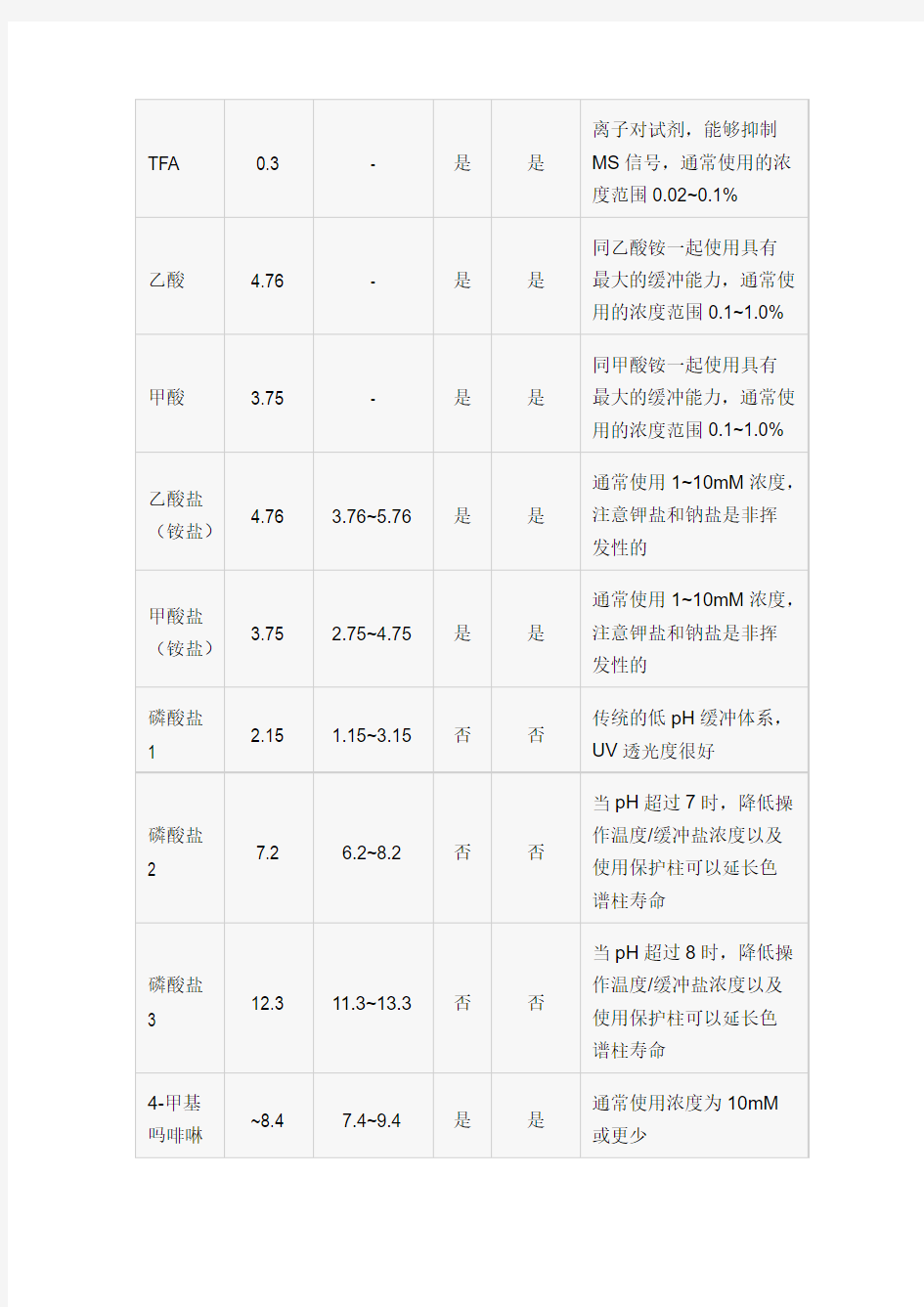
水里可以加酸、加碱、加盐,从而改变pH 值、改善峰形、提高分离度。常用的酸有磷酸、三氟乙酸、甲酸、乙酸、高氯酸、甲基磺酸等。单纯做液相时,低波长下磷酸最合适;而做液质时首选三氟乙酸,或甲酸、乙酸。开发液相分析方法时流动相可首选0.1%的磷酸水溶液,然后再以此为基础做优化。在单独用酸不行的时候再考虑使用缓冲盐,缓冲盐的选择原则是:简单、稳定、缓冲能力强、配制简单,需要调pH 值时要有相应的酸或碱。常用的缓冲盐是磷酸盐,主要是钾盐和钠盐,还有醋酸盐,常用的盐浓度在10~20mM 左右(根据实际情况,有时可以选择更低或更高浓度,建议最高浓度不超过50mM )。
TFA 0.3 - 是是离子对试剂,能够抑制MS信号,通常使用的浓度范围0.02~0.1%
乙酸 4.76 - 是是同乙酸铵一起使用具有最大的缓冲能力,通常使用的浓度范围0.1~1.0%
甲酸 3.75 - 是是同甲酸铵一起使用具有最大的缓冲能力,通常使用的浓度范围0.1~1.0%
乙酸盐(铵盐)4.76 3.76~5.76 是是
通常使用1~10mM浓度,
注意钾盐和钠盐是非挥
发性的
甲酸盐(铵盐)3.75 2.75~4.75 是是
通常使用1~10mM浓度,
注意钾盐和钠盐是非挥
发性的
磷酸盐1 2.15 1.15~3.15 否否
传统的低pH缓冲体系,
UV透光度很好
磷酸盐2 7.2 6.2~8.2 否否
当pH超过7时,降低操
作温度/缓冲盐浓度以及
使用保护柱可以延长色
谱柱寿命
磷酸盐3 12.3 11.3~13.3 否否
当pH超过8时,降低操
作温度/缓冲盐浓度以及
使用保护柱可以延长色
谱柱寿命
4-甲基吗啡啉~8.4 7.4~9.4 是是
通常使用浓度为10mM
或更少
氨水碳酸氢铵
9.2
10.3(H
CO3-)
9.2(NH
4+)
8.2~10.2
8.2~11.3
是是
通常使用浓度为
5~10mM(用于MS工作
时保持离子源温度超过
150℃)。用氨水或乙酸
调节pH值,在pH10时
具有很好的缓冲能力。
乙酸铵9.2 8.2~10.2 是是通常使用浓度为1~10mM
甲酸铵9.2 8.2~10.2 是是通常使用浓度为1~10mM
硼酸9.2 8.2~10.2 否否降低温度,减少浓度并使用色谱柱来延长柱寿命
CAPSO (3-环
己胺基-2-羟基丙磺酸9.7 8.7~10.7 否否
两性离子缓冲液,同乙腈
互溶,通常使用浓度为
1~10mM,气味小
Glycine 甘氨酸2.4,9.8 8.8~10.8 否否
两性离子缓冲液,比使用
硼酸盐对柱子的损伤更
小些
1-甲基哌啶10.2 9.3~11.3 是是
通常使用浓度为
1~10mM
CAPS 10.4 9.5~11.5 否否两性离子缓冲液,同乙腈互溶,通常使用浓度为1~10mM,气味小
三乙胺(乙酸10.7 9.7~11.7 是是
通常使用浓度为
0.1~1.0%。当使用乙酸滴
液相色谱柱的选择
液相色谱柱的选择、使用、维护和常见故障及排除液相色谱的柱子通常分为正相柱和反相柱。正相柱大多以硅胶为柱,或是在硅胶表面键合 -CN,-NH3等官能团的键合相硅胶柱;反相柱填料主要以硅胶为基质,在其表面键合非极性的十八烷基官能团(ODS)称为C18柱,其它常用的反相柱还有C8,C4,C2和苯基柱等。另外还有离子交换柱,GPC柱,聚合物填料柱等。本文重点介绍反相色谱柱的选择和使用: 一、反相色谱柱的选择 1.柱子的PH值使用范围 反相柱优点是固定相稳定,应用广泛,可使用多种溶剂。但硅胶为基质的填料,使用时一定要注意流动相的PH范围。一般的C18柱PH值范围都在2-8,流动相的PH值小于2时,会导致键合相的水解;当PH值大于7时硅胶易溶解;经常使用缓冲液固定相要降解。一旦发生上述情况,色谱柱人口处会塌陷。同样填料各种不同牌号的色谱柱不尽相同。如果流动相PH较高或经常使用缓冲液时,建议选择PH范围大的柱子,例如戴安公司的Acclaim柱PH 2-9或Zorbax的PH 2-11. 5的柱子。 2.填料的端基封尾(或称封口) 把填料的残余硅羟基采用封口技术进行端基封尾,可改善对极性化合物的吸附或拖尾;含碳量增高了,有利于不易保留化合物的分离;填料稳定性好了,组分的保留时间重现性就好。如果待分析的样品属酸性或碱性的化合物,最好选用填料经端基封尾的色谱柱。 3.戴安公司Acclaim柱子介绍—极性封尾C16固定相柱 戴安公司有28种类型的柱子,Acclaim反相柱填料高纯,金属含量极低,完全封尾。PH 2-9范围内兼容,低流失,高柱效。尤其是2003年推出的Acclaim极性封尾C16柱,是最先商品化的磺酰氨-O链接键的色谱柱,具极低的硅羟基活性,能在极性溶剂甚至100%水的条件下长期使用。对酸
高效液相色谱的色谱柱的类型和流动相的选择方法_徐红
高效液相色谱的色谱柱的类型和流动相的选择方法The Choicing W ays of Chromatographic Colum n and Mobil Phase about HPLC 徐 红 侯 健 (新疆昌吉州产品质量检验所,新疆昌吉831100) 摘 要:高效液相色谱仪的核心是色谱柱。另外,流动相对改善分离效果也有重要的辅助效应。色谱柱的关键内容是制备出高效的填料。现代高效液相色谱填料多使用键合固定相。色谱柱的填充技术直接影响柱效的发挥。在研究制定一个高效液相色谱方法时,选择适宜的流动相也很重要。 关键词:高效液相色谱;色谱柱;填料;流动相;溶剂 色谱柱的关键内容是制备出高效的填料。这些填料装成的色谱柱既要有好的选择性,又要有高的柱效。要提高柱效是现代高效液相色谱的又一重要问题。所以填料和装柱技术是关键问题。 现代高效液相色谱填料多使用键合固定相,其固定相膜很薄,因而大大提高了柱效。高效液相色谱填料的基质有以下几种:(1)全多孔硅胶。现代高效液相色谱填料绝大多数用键合的方法把活性基团接枝到基质上,全多孔硅胶是使用最为普遍的基质。全多孔硅胶的孔径有三种类型:①微孔全多孔硅胶,孔径<2nm;(2)中孔全多孔硅胶,孔径<50nm,>2nm;(3)大孔全多孔硅胶,孔径>50nm。高效液相色谱填料使用中孔和大孔全多孔硅胶,在分离低分子量的混合物时,选择(6~15)nm孔径的全多孔硅胶,其比表面相当于(500~200)m2/g。在分离合成聚合物或生物大分子时,要使用(15~100)nm的全多孔硅胶。如果使用<2nm的全多孔硅胶,色谱峰就会拖尾。(2)其他金属氧化物基质。由于硅胶有一些缺点:在碱性介质中(pH>8)不稳定;在孔隙中大分子扩散困难,降低柱效;硅胶表面上的剩余硅羟基有离子交换作用。为此近年来用氧化铝、氧化锆、氧化钍和氧化钛作为高效液相色谱填料的基质有很大的H PLC应用前景。高效液相色谱固定相有以下几种:(1)硅胶表面键合或涂渍各种聚合物。(2)其他氧化物表面上涂渍聚合物。(3)无孔单分散填料。(4)有机高聚填料。(5)灌注色谱填料。(6)手性固定相填料。 色谱柱的填充技术直接影响柱效的发挥。如果色谱柱填充不好,如填料颗粒之间不均匀、不密实,就会使涡流扩散项增加,导致柱效下降。高效液相色谱柱的性能主要决定于固定相填料,但是色谱柱的填充好坏也有很大的影响。填充色谱柱的方法有干法和湿法两种,一般大颗粒的(如外径>20nm)可以用干法填充;一般小粒径的填料宜用湿法填充。湿法填充也称作匀浆法,即用密度和填料相近的液体或混合液作分散介质,用超声波处理此浆液,然后用高压泵快速压入色谱柱管中,这样就可以制备出高效的色谱柱。 在研究制定一个高效液相色谱方法时,选择适宜的流动相也很重要。在选择流动相溶剂时,首先要考虑的是溶剂的物理性质,其次要考虑溶剂对所要分离样品的容量因子,最后是所使用的溶剂要有分离能力。用作高效液相色谱流动相溶剂,首先要满足以下几点要求:(1)容易得到;(2)适合于所用的检测器;(3)纯净、有一定的惰性;(4)无毒、使用安全;(5)对所分离的样品有一定的溶解性能。 下面介绍选择流动相的要点: (1)首先要考虑溶剂对检测器的适应性。 高效液相色谱在多数情况下要使用紫外检测器,所以必须考虑所用溶剂在紫外波段的吸收。如使用示差折光检测器,要考虑溶剂的折光率。 (2)溶剂的活性 有许多溶剂可能与样品发生反应,或在某些固定相的存在下产生聚合,他们就不能作为流动相使用。 (3)溶剂的沸点和粘度 溶剂的沸点和粘度密切相关,低沸点的溶剂通常其粘度也低。通常选用沸点高于柱温(20~50)℃、粘度不大于5×10-4Pa.S的流动相。 (4)高效液相色谱流动相溶剂的极性 在分配色谱和吸附色谱中,溶剂的极性是用混合溶剂的比例来调节的,一个极性强的溶剂和一个极性弱的溶剂经过适当的混合可以得到一定极性的混合溶剂。 (5)溶剂的选择性和溶剂的分类 选择流动相的极性能使被分离样品的分配容量在1~5之间,这时如果有两个或几个色谱峰重叠,可以通过调节溶剂的选择性来解决。 选择合适的色谱柱和流动相是高效液相色谱的关键。 参考文献 [1]富玉,陈能武.高温液相色谱的原理及研究进展.中国测试技术, 2006(3)36. 作者简介:徐红,女,副高级工程师,所长。工作单位:新疆昌吉州产品质量检验所。通讯地址:831100新疆昌吉市健康西路17号。 侯健,新疆昌吉州产品质量检验所(昌吉831100)。 收稿时间:2009-10-16 10 《计量与测试技术》2010年第37卷第2期
液相色谱流动相的选择经验
一.关于液相色谱仪紫外检测器中分析波长的选择一般来说应该遵循以下原则: 1、你的分析目的,也就是你的目标组分是什么,是主要组分还是杂质组分。 2、确定目标组分之后,一般选择目标组分的特征波长。按照朗伯-比尔定律来说只有在特征波长处的吸光度才可以和浓度成正比关系。 3、确定了特征吸收波长之后,根据灵敏度的不同来选择是选择最灵敏度线还是选择次灵敏度线。有时有的组分灵敏度过高,会造成标准曲线的弯曲,所以要选择次灵敏度线。 4、确定了吸收波长之后,根据样品的实际情况来选择定量方法。 二.最好是246nm,甲醇,乙腈等吸收都在190左右了,210距离太近,仪器平衡时间常是当然的了,如果选用210,环境一定要稳定才行啊。 不知道你是怎样定量,其他物质在246处是否都出峰呢? 三.最大吸收波长处的干扰过大,选择肩峰位置的吸收波长是可行的,很多文献就是这么处理的。 四.不知道你使用的流动相有哪些成分,经常使用的甲醇乙腈和水在此波长下是没有紫外吸收的,我经常使用210nm这个波长测定物质含量.在低波长基线不大稳,干扰比较大的情况我也遇到过,在低波长下好多物质都有吸收,经常出现很多未知峰.有的检测器氘灯使用一段时间后,在低波长下检测也会出现上述情况,换到高波长基线就好许多.我觉得你应该再去系统的尝试一下. 五.要求最佳吸收波长做,但不一定是最大吸收波长,最适合的才是最好的六.DAD收集200-400(700)nm全部数据,分别进空白和标准样品,三维谱图可以清晰地帮助你选择吸收波长。原则是:干扰物吸收尽量小,目标物尽量吸收尽量大! 推荐 326nm 276nm 同时采集不就可以啦,分别能得到分辨率高的色谱图!只要标准样品和试样在同样的采集参数下测试,对于结果的测定没有什么影响!
怎样选择色谱柱
怎样选择色谱柱 现代高效液相色谱中,分离效果好坏很大程度上取决于色谱填料的选择。但 是色谱填料的选择范围很宽,要做合适的选择,必须对此有一定的认识和了解。 1、正相色谱 正相色谱用的固定相通常为硅胶(Silica),以及其他具有极性官能团,如胺基团 (NH2,APS)和氰基团(CN,CPS)的键合相填料。 由于硅胶表面的硅羟基(SiOH)或其他团的极性较强,因此,分离的次序是依据样品 中的各组份的极性大小,即极性强弱的组份最先被冲洗出色谱柱。 正相色谱使用的流动相极性相对比固定相低,如:正乙烷(Hexane),氯仿(Chloroform),二氯甲烷(Methylene Chloride)等。 2、反相色谱 反相色谱填料常是以硅胶为基础,表面键合有极性相对较弱的官能团的键合相。 反相色谱所使用的流动相极性较强,通常为水,缓冲液与甲醇,已腈等混合物。 样品流出色谱柱的顺序是极性较强组合最先被冲出,而极性弱的组份会在色谱柱上有 更强的保留。 常用的反相填料有C18(ODS)、C8(MOS)、C4(B)、C6H5(Phenyl)等。 二、聚合物填料
聚合物调料多为聚苯乙烯-二乙烯基苯或聚甲基丙酸酯等,其主要优点是在PH值为1~ 14均可使用。 相对与硅胶基质的C18填料,这类填料具有更强的疏水性;大孔的聚合物填料对蛋白 质等样品的分离非常有效。 现在的聚合物填料的缺点是相对硅胶基质填料,色谱柱柱效较低。 三、其他无机填料 其它HPLC的无机填料色谱柱也已经商品化。由于其特殊的性质,一般仅限于特殊的 用途。如石墨化碳也用于正逐渐成为反相色谱填料。这种填料的分离不同与硅胶基质烷基 键合相,石墨化碳的表面即是保留的基础,不再需其它的表面改性,该柱填料一般比烷基 键合硅胶或多孔聚合物填料的保留能力更强,石墨化碳可用于分离某些几何导构体,又由 于HPLC流动相中不会被溶解,这类柱可在任何PH与温度下使用。氧化铝也可用于HPLC, 氧化铝微粒刚性强,可制成稳定的色谱柱柱床,其优点是可在PH高达12的流动相中使用。 但由于氧化铝与碱性化合物作用也很强,应用范围受到一定的限制,所以未能广泛应用, 新型氧化锆填料也可用于HPLC,商品化的仅有聚合物涂层的多孔氧化锆微球色谱柱,应 用PH范围1~14,温度可达100℃。由于氧化锆填料几年才开始研究,加之面临的实验难 度,其重要用途与优势尚在进行中。
高效液相色谱仪流动相配置操作规程
高效液相色谱仪流动相配制标准操作规程1.目的 明确高效液相色谱法流动相配制过程,保证操作过程的规范性。 2.适用范围 适用于实验室高效液相色谱法流动相配制。 3.职责 实验室分析人员负责按本规程进行操作。 4. 内容 4.1流动相批号的编写原则:流动相批号按配制日期编制,如批号20150609,代表2015年06月09日配制。 4.2流动相配制 4.2.1含水流动相和不含水流动相的配制所用量筒应区分开,配制不含水的有机溶剂类流动相所用量筒必须是干燥状态,不得有水。 4.2.2根据样品分析方法所规定的流动相体积比例配制,在清洁的带塞量筒中分别倒入相应的溶剂,若该流动相需加入适量的酸或碱,则戴上一次性手套,用专用注射器吸取规定体积的酸或碱,加入量筒,盖上塞子摇匀,振动过程应主要排气。 4.2.3含盐的缓冲液类流动相的配制应根据规定比例配制,分别秤取规定重量的盐于清洁的带塞量筒中,加入适量纯水,振摇,待固体完全溶解后,再加纯水至规定刻度,盖上塞子,摇匀。 4.2.4若该流动相对PH值有特殊要求,根据流动相配制规定的体积比例,用酸或碱调节PH值,用PH计测定直至规定范围内。
4.3流动相抽滤 4.3.1含水流动相和不含水流动相的抽滤装置应区分,抽滤不含水的有机溶剂类流动相所用装置必须是干燥无水的。 4.3.2抽滤装置准备:将过滤器套在三角烧瓶上,用镊子夹取0.45μm的水系或有机滤膜一张,放在砂芯过滤器上(注意:滤膜应将过滤面完全覆盖);再将量杯压在滤膜上,量杯边缘和过滤器的边缘对齐;用配套的夹子将过滤器和量杯接头边缘固定(注意夹子位置应避开抽滤嘴);将抽滤软管套在抽滤嘴上。 4.3.3抽滤:将少量配置好的流动相倒入量杯内,观察是否有漏液现象,若出现漏液须重新固定过滤器和量杯。如未漏液则继续倒入流动相(注意不要超过量杯最大刻度线),开启真空泵抽滤。抽滤结束先拔掉与抽滤嘴连接的真空软管,再关闭真空泵。 4.3.4脱气:将抽滤好的流动相转入流动相试剂瓶内(少量润洗一次倒入废液桶内再盛装),盖上瓶盖(瓶盖不得拧紧),常温下超声波超声15至20分钟。4.4流动相储存及标识 流动相全部转入专用试剂瓶内后拧紧瓶盖,及时填写《流动相标签》贴于试剂瓶身中间位置,备用。 4.5流动相有限期如下: 4.6流动相配制工具清洁 4.6.1配制含水流动相用器具:先用自来水清洗一次,再用纯化水清洗3次,沥干后封口备用。
液相色谱流动相基础知识-扫盲篇
液相色谱流动相基础知识-扫盲篇 一、液相色谱流动相的性质要求 一个理想的液相色谱流动相溶剂应具有低粘度、与检测器兼容性好、易于得到纯品和低毒性等特征。 选好填料(固定相)后,强溶剂使溶质在填料表面的吸附减少,相应的容量因子k降低;而较弱的溶剂使溶质在SPME填料表面吸附增加,相应的容量因子k升高。因此,k值是流动相组成的函数。塔板数N一般与流动相的粘度成反比。所以选择流动相时应考虑以下几个方面: ①流动相应不改变填料的任何性质。低交联度的离子交换树脂和排阻色谱填料会计考试有时遇到某些有机相会溶胀或收缩,从而改变色谱柱填床的性质。碱性流动相不能用于硅胶柱系统。酸性流动相不能用于氧 化铝、氧化镁等吸附剂的柱系统。 ②纯度。色谱柱的寿命与大量流动相通过有关,特别是当溶剂所含杂质在柱上积累时。 ③必须与检测器匹配。使用UV检测器时,所用流动相在检测波长下应没有吸收,或吸收很小。当使用示差 折光检测器时,应选择折光系数与样品差别较大的溶剂作流动相溶剂瓶,以提高灵敏度。 ④粘度要低(应<2cp)。高粘度溶剂溶剂瓶会影响溶质的扩散、传质,降低柱效,还会使柱压降增加,使 分离时间延长。最好选择沸点在100℃以下的流动相。 二、液相色谱流动相的pH值 采用反相色谱法分离弱酸(3≤pKa≤7)或弱碱(7≤pKa≤8)样品时,通过调节流动相的pH值,以抑制样品组分的解离,增加组分在固定相上的保留,并改善峰形的技术称为反相离子抑制技术。对于弱酸,流动相的pH值越小,组分的k值越大,当pH值远远小于弱酸会计考试的pKa值时,弱酸主要以分子形式存在;对弱碱,情况相反。分析弱酸经济师样品时,通常在流动相中加入少量弱酸,常用50mmol/L磷酸盐缓冲液和1%醋酸溶液;分析弱碱样品时,通常在流动相中加入少量弱碱,常用50mmol/L磷酸盐缓冲液和30mmol/L 三乙胺溶液。 注:流动相中加入有机胺可以减弱碱性溶质与残余硅醇基的相互网上培训作用,减轻或消除峰拖尾现象。 所以在这种情况下有机胺(如三乙胺)又称为减尾剂或除尾剂。 三、液相色谱流动相的选择 在化学键合相色谱法中,溶剂的洗脱能力直接与它的极性相关。在正相色谱中,溶剂的强度随极性的增强而增加;BR>正相色谱的流动相通常采用烷烃加适量极性调整剂。
高效液相色谱流动相选择
高效液相色谱流动相选择 流动相 流动相的性质要求:一个理想的液相色谱流动相溶剂应具有低粘度、与检测器兼容性好、易于得到纯品和低毒性等特征。 流动相选择 1:由强到弱:一般先用90%的乙腈(或甲醇)/水(或缓冲溶液)进行试验,这样可以很快地得到分离结果,然后根据出峰情况调整有机溶剂(乙腈或甲醇)的比例。2:三倍规则:每减少10%的有机溶剂(甲醇或乙腈)的量,保留因子约增加3倍,此为三倍规则。这是一个聪明而又省力的办法。调整的过程中,注意观察各个峰的分离情况。 3:粗调转微调:当分离达到一定程度,应将有机溶剂10%的改变量调整为5%,并据此规则逐渐降低调整率,直至各组分的分离情况不再改变。 选择流动相时应考虑以下几个方面: ①流动相应不改变填料的任何性质。低交联度的离子交换树脂和排阻色谱填料有时遇到某些有机相会溶胀或收缩,从而改变色谱柱填床的性质。碱性流动相不能用于硅胶柱系统。酸性流动相不能用于氧化铝、氧化镁等吸附剂的柱系统。②纯度。色谱柱的寿命与大量流动相通过有关,特别是当溶剂所含杂质在柱上积累时。③必须与检测器匹配。使用UV检测器时,所用流动相在检测波长下应没有吸收,或吸收很小。当使用示差折光检测器时,应选择折光系数与样品差别较大的溶剂作流动相,以提高灵敏度。④粘度要低(应<2cp)。高粘度溶剂会影响溶质的扩散、传质,降低柱效,还会使柱压降增加,使分离时间延长。最好选择沸点在100℃以下的流动相。⑤对样品的溶解度要适宜。如果溶解度欠佳,样品会在柱头沉淀,不但影响了纯化分离,且会使柱子恶化。⑥样品易于回收。应选用挥发性溶剂。 流动相的pH值 采用反相色谱法分离弱酸(3≤pKa≤7)或弱碱(7≤pKa≤8)样品时,通过调节流动相的pH值,以抑制样品组分的解离,增加组分在固定相上的保留,并改善峰形的技术称为反相离子抑制技术。对于弱酸,流动相的pH值越小,组分的k值越大,当pH值远远小于弱酸的pKa值时,弱酸主要以分子形式存在;对弱碱,情况相反。分析弱酸样品时,通常在流动相中加入少量弱酸,常用50mmol/L磷酸盐缓冲液和1%醋酸溶液;分析弱碱样品
高效液相色谱仪的操作步骤及注意事项
高效液相色谱仪的操作步骤及注意事项 一、操作步骤: 1.开机前先将流动相过滤和超声:水流动相用混合滤膜(0.2μm)过滤,有机流动相用有机滤膜过滤,之后超声脱气15-20分钟。(过滤的目的是除去流动相里的杂质,以免杂质进入色谱柱堵塞色谱柱;超声的目的是排除流动相里面的气体,以防气体进入色谱柱损害色谱柱,影响柱效能) 注:试验过程中由于只有0.45μm的混合滤膜,第一次使用时感觉效果不好,于是过滤水时同时使用两张混合滤膜过滤水流动相。 2.超声结束后,将流动相放置到规定位置(1号泵接水流动相,2号泵接有机流动相),开机逐个排气(先启动泵,排气结束后再打开检测器)。 3.排气结束后,关闭所有排气阀。先用纯有机流动相冲洗色谱柱20-30分钟,基线走稳之后,再打开水流动相(注意:水流动相和有机流动相流速之和为1ml/min),继续走基线,直到基线平稳。 注意:实验结束后,再用纯有机流动相冲洗色谱柱20-30分钟,冲出色谱柱内残留的样品物质,预防长时间不使用仪器样品的残留物质沉积在色谱柱内,导致下次使用难以冲出,色谱柱柱压偏高,基线不稳,出现大量鬼峰。(不同规格的色谱柱其所允许的最大流速之和不同) 4.走基线时,应将进样阀处于Load状态,用注射器进样时应快速进样,进样后将进样阀立即扳回到Inject状态,此时液相系统开始进入采样状态。采样结束后,可在数据分析里面查看分析结果并可进行编辑,也可以在脱机状态下查看样品的分析结果并编辑。 二、使用中常见的问题及注意事项 1.过滤时有时会出现流动相漏液。可能的原因是滤膜放置不正确(有点偏)和接头有点错位,导致流动相从缝隙中漏出。 注意:操作时,应先向滤瓶内倒入少量流动相,观察是否漏液并开始过滤,若未漏液,再向滤瓶中添加流动相。 2.超声时,瓶外液体的液面应高于瓶内流动相的液面,否则流动相内的气体可能无法排出液体,气体仍然残留在流动相内,以致开机排气时无气泡排出。
常用高效液相色谱柱SOP
常用高效液相色谱柱SOP 1 目的: 色谱柱的使用和保养:液相色谱仪由高压液体泵、检测器及液相色谱柱等三部分组成,其中液相色谱柱的正确安装和使用,是液相色谱工作的关键;也是液相色谱工作者获得正确可靠的实验数据的必经之路。 建立高效液相色谱柱日常维护与保养规程,保证能正常使用。 2 适用范围: 本规程适用高效液相色谱柱的维护与保养。 3 责任人: 液相色谱柱使用者。 4 液相色谱柱的安装: 4.1 液相色谱柱的结构: 4.1.1 液相色谱柱由柱管、压帽、卡套(密封环)、筛板(滤片)、接头、螺丝(封头)与柱填料等组成。 柱管:多用不锈钢制成,若果使用时柱压不高于70 kg/cm2时,也可采用厚壁玻璃或石英管,管内壁要求有很高的光洁度。用于柱填料的装填。空柱各组件均为不锈钢材质,能耐受一般的溶剂作用。但由于含氯化物的溶剂对其有一定的腐蚀性,故使用时要注意,柱及连接管内不能长时间存留此类溶剂,以避免腐蚀。 压帽:即色谱柱两端套合于柱管端外壁的塑性圆柱帽,中部有小孔,多为聚四氟乙烯制成,用于固定筛板。 密封环:位于接头螺旋环内壁的弹性环,多为聚四氟乙烯制成,用于色谱柱两端压帽与柱外壁的密封。 4.1.2柱填料: 液相色谱柱的分离作用是在填料与流动相之间进行的,柱子的分类是依据填料类型而定。 正相柱:多以硅胶为柱填料。根据外型可分为无定型和球型两种,其颗粒直径在3-10 μm的范围内。另一类正相填料是硅胶表面键合-CN,-NH2等官能团即所谓的键合相硅胶。
反相柱:主要是以硅胶为基质,在其表面键合十八烷基官能团(ODS)的非极性填料。也有无定型和球型之分。 常用的其他的反相填料还有键合C8、C4、C2、苯基等,其颗粒粒径在3-10 μm之间。 4.2色谱柱的安装: 4.2.1拆开柱包装盒,确认色谱柱的类型、尺寸、出厂日期以及柱内贮存的溶剂。 4.2.2拧下柱两端接头的密封堵头放回包装盒供备用。 4.2.3 按柱管上标示的流动相流向,将色谱柱的入口端通过连接管与进样阀出口相连接(如条件允许,建议在柱前使用保护柱);柱的出口与检测器连接。连接管是外径为1.57 mm、内径为0.1-0.3 mm的不锈钢管。连接管的两端均有空心螺钉及密封用压环。在接管时一定要设法降低柱外死体积。连接管通过空心螺钉、压环后尽量用力插到底,然后顺时针拧紧空心螺钉,直到拧不动为止。 5 液相色谱柱的使用: 色谱柱在使用前,最好进行柱的性能测试,并将结果保存起来,作为今后评价柱性能变化的参考。但要注意:柱性能可能由于所使用的样品、流动相、柱温等条件的差异而有所不同;另外,在做柱性能测试时是按照色谱柱出厂报告中的条件进行(出厂测试所使用的条件是最佳条件),只有这样,测得的结果才有可比性。 5.1样品的前处理: 5.1.1最好使用流动相溶解样品。 5.1.2使用予处理柱除去样品中的强极性或与柱填料产生不可逆吸附的杂质。 5.1.3使用0.45 μm的过滤膜过滤除去微粒杂质。 5.2 流动相的配制: 液相色谱是样品组分在柱填料与流动相之间质量交换而达到分离的目的,因此要求流动相具备以下的特点: 5.2.1流动相对样品具有一定的溶解能力,保证样品组分不会沉淀在柱中(或长时间保留在柱中)。
高效液相色谱习题及参考答案
高效液相色谱习题及参考答案 一、单项选择题 1. 在液相色谱法中,按分离原理分类,液固色谱法属于()。 A、分配色谱法 B、排阻色谱法 C、离子交换色谱法 D、吸附色谱法 2. 在高效液相色谱流程中,试样混合物在()中被分离。 A、检测器 B、记录器 C、色谱柱 D、进样器 3. 液相色谱流动相过滤必须使用何种粒径的过滤膜? A、0.5μm B、0.45m C、0.6μm D、0.55μm 4. 在液相色谱中,为了改变色谱柱的选择性,可以进行如下哪些操作? A、改变流动相的种类或柱子 B、改变固定相的种类或柱长 C、改变固定相的种类和流动相的种类 D、改变填料的粒度和柱长 5. 一般评价烷基键合相色谱柱时所用的流动相为() A、甲醇/水(83/17) B、甲醇/水(57/43) C、正庚烷/异丙醇(93/7) D、乙腈/水(1.5/98.5) 6. 下列用于高效液相色谱的检测器,()检测器不能使用梯度洗脱。 A、紫外检测器 B、荧光检测器 C、蒸发光散射检测器 D、示差折光检测器 7. 在高效液相色谱中,色谱柱的长度一般在()范围内。 A 、10~30cm
B、20~50m C 、1~2m D、2~5m 8. 在液相色谱中, 某组分的保留值大小实际反映了哪些部分的分子间作用力() A、组分与流动相 B、组分与固定相 C、组分与流动相和固定相 D、组分与组分 9. 在液相色谱中,为了改变柱子的选择性,可以进行()的操作 A、改变柱长 B、改变填料粒度 C、改变流动相或固定相种类 D、改变流动相的流速 10. 液相色谱中通用型检测器是() A、紫外吸收检测器 B、示差折光检测器 C、热导池检测器 D、氢焰检测器 11. 在环保分析中,常常要监测水中多环芳烃,如用高效液相色谱分析,应选用下述哪种检波器 A、荧光检测器 B、示差折光检测器 C、电导检测器 D、紫外吸收检测器 12. 在液相色谱法中,提高柱效最有效的途径是() A、提高柱温 B、降低板高 C、降低流动相流速 D、减小填料粒度 13. 在液相色谱中,不会显著影响分离效果的是() A、改变固定相种类 B、改变流动相流速 C、改变流动相配比
如何选择流动相
流动相的调节是搞液相分析最重要的环节,也是液相水平高低的度量,每一种液相都有影响它的主要因素,抓住主要因素,问题就容易解决。欢迎大家讨论。一则可以为新手传播知识,二则大家相互学习共同提高! 先开个头:常用的是化学键合相色谱,分离中性化合较简单,主要是调节溶剂强度,可从有机相的比例合种类两个方面入手,例如:有机相占的比例大,出峰就早。分离酸碱化合物就就复杂一点,增加了添加剂,明白了添加剂的作用,然后从溶剂,酸碱性,添加剂等方面入手。问题就容易解决。 液相色谱采用键合硅胶可以分离绝大多数的分析物质,针对不同化学性质的单体采用不同的键合硅胶,现在有什么十八烷、氨基柱、氰基、苯基太多了,再加上不同流动相也就是加入不同的抑制剂可以测许多成分,比如:酸性的可以用十八烷加入酸,加缓冲盐;碱性物质可以加缓冲盐,以个人来讲用离子对的形式较多,并且效果也很好,现在分析生物碱是比较难做的,我现在就有一个难题,就说盐酸水苏碱吧,在低波长的吸收,UV是不行了,用蒸发光检测器,但是分离又成了问题,我试了十八烷,氨基柱、氰基、都不理想,并且用过日本的shodex(C18)柱PH9 -10不好。不好做呀,在郁闷中………………… 如用反相色谱柱时,一般先改变有机相与水相的比例;再考虑改变pH值,酸性物质将pH值调低,碱性物质将pH值调高;如两者都无效,可考虑加入离子对试剂,如庚烷磺酸钠用于(碱性药物) 我觉得溶剂过滤器抽滤时抽走一部分有机相使保留时间相差较大。 其实流动相的调节也是很难的,一个条件下来是非常的不易呀,从查文献到,条件成熟,有一次我做麻黄就是二个月呀,最后才定下来,现在的水苏碱又是一个大头,现在为什么生物碱这样的难做呢,柱前衍生我是考虑过,但对柱子是有影响的,同时处理也麻烦。 对于流动相的抽滤对测定是没什么影响的,一个稳定的条件,是不计较那一点损失的,如果抽滤对于测定的影响非常之大这个条件是不稳的。 现在的流动相在检验所比例是可调的,但酸碱不变,所以我个人认为在一定的比例范围内,耐用性一定要好。有高手的话对我的水苏碱给一点意见 一. 反相HPLC中的溶剂优化:1.首先应调整k’值:强溶剂→20%递减→选择合适的溶液强度,使得k’在1~20(tR:3~35min)。一种方法是首先试用一种可能过强的流动相,在后面的试验中逐渐减小溶剂强度以增大k’。当所有谱峰符合1<k’<20的范围时,从溶剂强度的观点来说,其流动相已接近最佳了。(观察待分离组分的分离度)。(反相色谱——溶剂极性弱洗脱能力强,组分k’减小)。另一种方法是首次用梯度洗脱试验。通过这一实验,有可能估计出使样品的k’值符合1<k’<20范围的大概溶剂成分。2.改变选择性(á):根据分子间作用力将溶剂分组。不同组的溶剂选择性不同,根据溶剂分组改变溶剂种类即可改变选择性。 二. 离子对HPLC中的溶剂优化: 离子对色谱法是分离离子,或可电离的分子的一种色谱技术。关于离子对色谱的机理,至今仍不十分明确,但己提出三种机理:离子对形成机理,离子交换机理,离子相互作用机理。在以下讨论中,采用离子对形
HPLC流动相选择
液相色谱的柱子通常正相柱和反相柱。正相柱以硅胶为柱,或是在硅胶表面键合-CN,-NH3等官能团的键合相硅胶柱;反相柱填料主要以硅胶为基质,在其表面键合非极性的十八烷基官能团(ODS)称为C18柱,其它常用的反相柱还有C8,C4,C2和苯基柱等。另外还有离子交换柱,GPC柱,聚合物填料柱等。本文重点介绍反相色谱柱的选择和使用: 一、反相色谱柱的选择 1.柱子的PH值使用范围 反相柱优点是固定相稳定,应用广泛,可使用多种溶剂。但硅胶为基质的填料,使用时一定要注意流动相的PH范围。一般的C18柱PH值范围都在2-8,流动相的PH值小于2时,会导致键合相的水解;当PH值大于7时硅胶易溶解;经常使用缓冲液固定相要降解。一旦发生上述情况,色谱柱人口处会塌陷。同样填料各种不同牌号的色谱柱不尽相同。如果流动相PH较高或经常使用缓冲液时,建议选择PH范围大的柱子,例如戴安公司的Acclaim 柱PH 2-9或Zorbax的PH 2-11. 5的柱子。 2.填料的端基封尾(或称封口) 把填料的残余硅羟基采用封口技术进行端基封尾,可改善对极性化合物的吸附或拖尾;含碳量增高了,有利于不易保留化合物的分离;填料稳定性好了,组分的保留时间重现性就好。如果待分析的样品属酸性或碱性的化合物,最好选用填料经端基封尾的色谱柱。 3.戴安公司Acclaim柱子介绍—极性封尾C16固定相柱 戴安公司有28种类型的柱子,Acclaim反相柱填料高纯,金属含量极低,完全封尾。PH 2-9范围内兼容,低流失,高柱效。尤其是2003年推出的Acclaim极性封尾C16柱,是最先商品化的磺酰氨-O链接键的色谱柱,具极低的硅羟基活性,能在极性溶剂甚至100%水的条件下长期使用。对酸性和碱性化合物有极为尖锐的好的色谱峰形,与现有的一流色谱柱相比有好的立体选择性。(下图是Acclaim极性封尾C16柱和市售极性封尾一流色谱柱分离酸性化合物谱图的比较) 二、液相色谱柱的使用 色谱柱在使用前,最好进行柱的性能测试,并将结果保存起来,作为今后评价柱性能变化的参考。在做柱性能测试时要按照色谱柱出厂报告中的条件进行(出厂测试所使用的条件是最佳条件),只有样,测得的结果才有可比性。 但要注意:柱性能可能由于所使用的样品、流动相、柱温等条件的差异而有所不同。 1、样品的前处理 a、最好使用流动相溶解样品。 b、使用预处理柱除去样品中的强极性或与柱填料产生不可逆吸附的杂质。
液相色谱柱的选择和介绍
液相色谱分离速度提高及选择性优化
安捷伦液相色谱柱介绍与选择
1
How to fast your LC separation Agilent LC colmns 2008.10.23 Dalian
液相色谱方法开发中如何选择色谱柱 液相色谱方法开发中如何选择色谱柱?
1.根据样品特性选择分离模式 2 色谱柱的适应性和选择性 2.色谱柱的适应性和选择性 3.色谱柱规格的选择
我要一根ODS柱
2
How to fast your LC separation Agilent LC colmns 2008.10.23 Dalian
HPLC模式选择
溶于有机溶剂
硅胶的正相色谱 溶于正己烷 用不同键合相的正相色谱
溶于甲醇或甲醇/水 或乙腈或乙腈/水
用不同键合相的反相色谱 用不同键合相的反相色谱
分子量<2,000
溶于四氢呋喃
低分子凝胶渗透色谱 用不同键合相的反相色谱
溶于水
非离子化
抑制电离反相键合相色谱 离子对键合相的反相色谱
样品
离子化 硅胶基质的反相色谱 离子交换色谱 溶于有机溶剂 凝胶渗透色谱 凝胶过滤色谱 溶于水 大孔填料的离子交换色谱 用大孔填料的反相色谱
分子量>2,000
3
How to fast your LC separation Agilent LC colmns 2008.10.23 Dalian
分离模式的选择实例-三聚氰胺分析
三聚氰胺是强极性,弱碱性化合物(pKa=8),微溶于水。
模式一:离子对键合相的反相色谱 对应国标方法GB/T 22388-2008第一法(反相离子对方法) 流动相:离子对试剂(辛烷磺酸钠)溶液:乙腈 = 92:8 色谱柱:ZORBAX SB-C8 4.6x250mm,5um 模式二:硅胶基质的反相色谱(HILIC) 对应安捷伦开发的HILIC模式方法 流动相: 10mM乙酸铵:ACN=11:89 色谱柱:Zorbax Rx-Sil, Rx-Sil 2.1 2 1×150mm, 150mm 5um
4
Page 4
模式三:离子交换色谱 对应安捷伦开发的离子交换方法 流动相:50mM 甲酸铵(pH3.0):乙腈=15:85 色谱柱: ZORBAX 300SCX 4 4.6 6×150mm, 150mm 5um
How to fast your LC separation Agilent LC colmns 2008.10.23 Dalian
流动相的选择技巧
流动相的选择技巧 常用做反相流动相的溶剂是甲醇和乙腈,甲醇有其性价比的优势,但是甲醇活性高,可能与某些样品发生反应,而且甲醇在低波长下有紫外吸收,会降低分析方法的灵敏度;乙腈虽然价格很高,毒性比甲醇大,但是洗脱能力比甲醇强,很少与样品发生反应,用作流动相系统常用做反相流动相的溶剂是甲醇和乙腈,甲醇有其性价比的优势,但是甲醇活性高,可能与某些样品发生反应,而且甲醇在低波长下有紫外吸收,会降低分析方法的灵敏度;乙腈虽然价格很高,毒性比甲醇大,但是洗脱能力比甲醇强,很少与样品发生反应,用作流动相系统压力要比甲醇低很多,且截止波长比甲醇低20nm,增加了检测出在低波长下才有吸收的杂质的可能性,所以我们一般倾向于多用乙腈,少用甲醇。但是有时候样品峰形不好或者分离不好,更换溶剂试试是一个很好的选择,毕竟不同的溶剂提供不同的选择性。 对流动相的优化主要在水相上下功夫,水里可以加酸、加碱、加盐,从而改善峰形、提高分离度。流动相里加碱的情况比较少,主要还是加酸,常用的酸有磷酸、三氟乙酸、甲酸、乙酸、高氯酸、甲基磺酸等,其中最常用的是磷酸和三氟乙酸,磷酸在低波长下没有紫外吸收,而三氟乙酸在低波长下有,但是三氟乙酸易挥发而磷酸不行,所以单纯做液相,低波长下磷酸最合适,三氟乙酸有吸收,运行梯度时基线漂移很严重,而做液质就要考虑首选三氟乙酸了,近些年还比较流行加甲酸或乙酸。一般情况下这几种酸没有太大区别,我们更多的是考虑通过加酸改变流动相的pH值,从而改善样品的分离度和峰形。 相同进样量样品峰越高则意味着峰形越好,从图中可以看出多数样品在低pH值下峰形都比中性要好,这个主要是由色谱柱本身的性质所决定的。色谱柱主要都是硅胶基质,现有的填料处理工艺无法将硅胶上残余的硅羟基全部去除,硅羟基会造成样品峰拖尾,一般认为硅羟基的pKa在3.5到4.5之间,低pH值能帮助抑制硅羟基的活性,减小拖尾,从而改善峰形,提高分离度。水溶液中添加0.1%(体积)的磷酸或者三氟乙酸其pH值大概在2左右,用作流动相正好抑制硅羟基的活性,所以开发液相分析方法时流动相首选水加01.%的磷酸,然后再以此为基础做优化。 在单独用酸不行的时候就要考虑使用缓冲盐,缓冲盐的选择原则是:简单、稳定、缓冲能力强、配制简单,需要调pH值时要有相应的酸或碱。常用的缓冲盐是磷酸盐,主要是钾盐和钠盐,再有就是醋酸盐,常用的盐浓度在10~20mM 左右。以前因为色谱柱填料生产工艺的问题,往往需要在流动相里添加三乙胺来减少拖尾,但是三乙胺对色谱柱的寿命有很大影响,现在新的色谱柱都不再需要了。流动相里有时会需要调节pH值到碱性,具体pH要视色谱柱的耐受范围而定,常用 NaOH、KOH溶液或氨水做为调节缓冲盐溶液碱性pH的试剂,也可以往水里单独添加氨水做碱性流动相。 在缓冲盐做流动相时,出峰太早、峰形很差、相似结构的化合物峰因为拖尾或峰型太宽而不能达到基线分离时,可以考虑使用离子对试剂,常用的离子对试剂主要是各种烷基磺酸钠和四丁基铵盐,但是流动相里使用离子对试剂时,系统
常用高效液相色谱柱SOP
常用高效液相色谱柱S O P Prepared on 24 November 2020
常用高效液相色谱柱SOP 1 目的: 色谱柱的使用和保养:液相色谱仪由高压液体泵、检测器及液相色谱柱等三部分组成,其中液相色谱柱的正确安装和使用,是液相色谱工作的关键;也是液相色谱工作者获得正确可靠的实验数据的必经之路。 建立高效液相色谱柱日常维护与保养规程,保证能正常使用。 2 适用范围: 本规程适用高效液相色谱柱的维护与保养。 3 责任人: 液相色谱柱使用者。 4 液相色谱柱的安装: 液相色谱柱的结构: 4.1.1 液相色谱柱由柱管、压帽、卡套(密封环)、筛板(滤片)、接头、螺丝(封头)与柱填料等组成。 柱管:多用不锈钢制成,若果使用时柱压不高于70 kg/cm2时,也可采用厚壁玻璃或石英管,管内壁要求有很高的光洁度。用于柱填料的装填。空柱各组件均为不锈钢材质,能耐受一般的溶剂作用。但由于含氯化物的溶剂对其有一定的腐蚀性,故使用时要注意,柱及连接管内不能长时间存留此类溶剂,以避免腐蚀。 压帽:即色谱柱两端套合于柱管端外壁的塑性圆柱帽,中部有小孔,多为聚四氟乙烯制成,用于固定筛板。
密封环:位于接头螺旋环内壁的弹性环,多为聚四氟乙烯制成,用于色谱柱两端压帽与柱外壁的密封。 4.1.2柱填料: 液相色谱柱的分离作用是在填料与流动相之间进行的,柱子的分类是依据填料类型而定。 正相柱:多以硅胶为柱填料。根据外型可分为无定型和球型两种,其颗粒直径在3-10 μm的范围内。另一类正相填料是硅胶表面键合-CN,-NH2等官能团即所谓的键合相硅胶。 反相柱:主要是以硅胶为基质,在其表面键合十八烷基官能团(ODS)的非极性填料。也有无定型和球型之分。 常用的其他的反相填料还有键合C8、C4、C2、苯基等,其颗粒粒径在3-10 μm之间。 色谱柱的安装: 4.2.1拆开柱包装盒,确认色谱柱的类型、尺寸、出厂日期以及柱内贮存的溶剂。 4.2.2拧下柱两端接头的密封堵头放回包装盒供备用。 4.2.3 按柱管上标示的流动相流向,将色谱柱的入口端通过连接管与进样阀出口相连接(如条件允许,建议在柱前使用保护柱);柱的出口与检测器连接。连接管是外径为1.57 mm、内径为-0.3 mm的不锈钢管。连接管的两端均有空心螺钉及密封用压环。在接管时一定要设法降低柱外死体积。连接管通过空心螺钉、压环后尽量用力插到底,然后顺时针拧紧空心螺钉,直到拧不动为止。
高效液相色谱原理
高效液相色谱法(HPLC) 一、方法原理 1、液相色谱法概述 高效液相色谱分析法
其工作流程为:高压输液泵将贮液器中的流动相以稳定的流速(或压力)输送至分析体系,在色谱柱之前通过进样器将样品导人,流动相将样品依次带入预柱、色谱柱,在色谱柱中各组分被分离,并依次随流动相流至检测器,检测到的信号送至数据处理系统记录、处理和保存。
HPLC仪器的基本结构 2、高效液相色谱法的特点(HPLC) 与经典柱色谱原理相同,是由液体流动相将被分离混合物带入色谱柱中,根据各组分在固定相及流动相中吸附能力、分
配系数、离子交换作用或分子尺寸大小的差异来进行分离。 由于高压输液泵、高灵敏度检测器和高效固定相的使用,提高了柱效率,降低了检出限,缩短了分析时间。 特点是选择性高、分离效能高、分析速度快的特点。 高沸点有机物的分析、离子型化合物、高分子化合物、热稳定性差的化合物以及具有生物活性的物质,弥补了气相色谱法的不足。 高效液相色谱法与气相色谱法相比,各有所长,互相补充。 如果能用气相色谱法分析的样品,一般不用液相色谱法,因为气相色谱法分析速度更快、更方便、成本更低。 3、高效液相色谱法的固定相和流动相 (1)固定相 表面多孔型和全多孔型两大类。 (2)流动相(淋洗液) 流动相的选择对改善分离效果产生重要的辅助效应。 从实用,选用的流动相具有廉价、易购的特点外,还应满足下列要求: ①与固定相互不相溶,并能保持色谱柱的稳定性。 ②高纯度,以防所含微量杂质在柱中积累,引起柱 性能的改变。 ③与所用的检测器相匹配。 ④应对样品有足够的溶解能力,以提高测定的灵敏 度。 ⑤具有低的黏度(可减少溶质的传质阻力,提高柱 效)和适当低的沸点。
有关于气液相色谱柱常用知识小结2
https://www.wendangku.net/doc/056445759.html,/html/200901/1146555.html 常用色谱柱简介 气相色谱毛细柱 (键合,聚二甲基硅氧烷) HP-1,DB-1,P-1,CP-SIL5CB, Ultra-1,007-1,RTx-1,AT-1 类似固定相:SE-30,SP-2100,OV-1,OV-101,使用 温度:-60℃-320℃ 应用范围:烷烃,芳烃,多环芳烃,醇,酚,酮,酯,醛,胺,卤代烃,吡啶,糖衍生物,氨基酸衍 生物,维生素衍生物,镇痛药,农药,溶剂,胆固SPB-50型中等极性柱 醇,香料,咖啡,食品添加剂等。 (键合, 50%二苯基,50%二甲基聚硅氧烷) 对照品牌:HP-50,HP-17, DB-17,RTx-50, AT-50 SPB-5型弱极性柱 类似固定相:OV-17, SP-2250,使用温度:30℃-310℃ (键合,5%苯基,95%甲基聚硅氧烷) 应用范围:烷烃,低沸点芳烃,多环芳烃,醇,甘 对照品牌:HP-5,DB-5,BP-5,CP-SIL 8CB, 油三酸酯,喹啉,卤素化合物,香料,农药,酯,Ultra-2, ,RTx-5,AT-5 镇痛药,除草剂等。 类似固定相:SE-54,SE-52,OV-73 使用温度: -60℃-320℃ PTE-5,PTE-5QTM型弱极性柱 应用范围:烷基苯,多环芳烃,醇,酚,酮,脂肪(MS专用柱,键合,5%苯基,95%甲基聚硅氧烷) 酸酯,苯二甲酸酯,硝基芳烃,芳胺,烷基胺,联 对照品牌:HP-5 MS, DB-5 MS, DB-5.625,XTI-5,苯胺,卤代烃,多氯联苯,,糖类衍生物,维生素衍BPX625,半挥发污染物分析柱(US EPA方法525, 生物,有机酸,镇痛药,农药,抗组胺药,溶剂,625.5,625) 生物碱,防腐剂,香料等。 类似固定相:SE-54,SE-52 使用温度:-60℃-320℃ 应用范围:多氯联苯,胺,有机磷,有机氯农药,SUPELCOWAX 10型极性柱 含氯除草剂,酚,苯胺,香料等。
高效液相中流动相比例调整
高效液相中流动相比例调整 高效液相色谱法中流动相比例调整的要求是:“其中,调整流动相组分比例时,以组分比例较低者(小于或等于50%)相对于与自身的改变量不超过+-30%且相对于总量的改变量不超过+-10%为限,如30%相对改变量的数值超过总量的10%时,则改变量以总量的10%为限”请问这里的“相对于总量的改变量”是什么意思啊到底该如何计算器调整幅度范围。 “总量”指流动相的总量。比如甲醇-水(1:3),则甲醇变化的比例可在1±30%,即改变量不超过(~:3);总量的10%,则为(1+3)±10%,即;因此甲醇改变量不得超过,即甲醇最大允许调整比例为1±40%(~:3).不知道我解释的是否准确。 比如一个流动相甲醇-水(20:80)相对于自身的改变量不超过+-30% 20*30%=6 流动相的范围是14:86到26:74 相对于总量的10% 流动相的变化范围为10:90 到30:70 三楼正解,一楼错误 应为比如甲醇-水(1:3),则甲醇变化的比例可在1±30%,即改变量不超过(:至:);总量的10%,则为(1+3)±10%,即;因此甲醇改变量不得超过,即甲醇最大允许调整比例为1±40%(:至:). 30%的相对改变量小于10%总量绝对改变量,最终以30%为准即(:至:) 若甲醇-水(2:3),30%的相对改变量为(:至:),总量的10%改变量为(:至:) 根据原则“如30%相对改变量的数值超 过总量的10%时,则改变量以总量的10%为限” 最终以10%为准(即:至:) 一般以百分比例来表示会更直观,如甲醇-水(2:3),即甲醇-水(40:60)期调整范围为 (30:70至50:50),而不是30%相对改变量的(28:72至52:48) 三元组分时,可调节比例较低的两个组分,调整原则同上,一般只调整其中一个与大比例组分,另一个不调整。 如A-B-C(50:40:10)调整A、B组分时,30%相对改变量的数值超过总量的10%,所以调整范围为(40:50:10至60:30:10),调整A、C组分时,调整范围为(47:40:13至53:40:7) 还有不懂的,可以看看《2010版中国药品检验标准操作规范》85页
