伯乐尿生化质控说明书
标准品.质控品-体外诊断试剂生产及质量控制技术指导原则
附件5: 体外诊断试剂生产及质量控制技术指导原则——体外诊断试剂校准品(物)、质控品(物)研究技术指导原则 (征求意见稿) 体外诊断试剂校准品(物)(包括真实度控制品)、质控品(物)(简称校准品、质控品)是实现体外诊断试剂临床检测及监督检验结果准确一致的主要工具,也是保证量值有效传递的计量实物标准。校准品、质控品研究技术资料应包括产品技术要求、试验方法等重要信息,是指导注册申请人(简称申请人)单独申请注册校准品、质控品的重要技术性文件之一。 本研究技术指导原则基于国家食品药品监督管理局《体外诊断试剂注册管理办法(试行)》、《医疗器械标准管理方法》的相关规定。参考国际标准化组织(ISO)、美国食品药品监督管理局(FDA)、临床化学国际联合会(IFCC)等有关体外诊断试剂方面的指南,对编写的格式及各项内容的要求进行了详细的说明。其目的是为体外诊断试剂校准品、质控品单独注册申报进行原则性的指导,同时,也为注册管理部门审核体外诊断试剂校准品、质控品提供参考。 由于校准品、质控品种类多、范围广、临床使用重要性强且使用目的差别大,因此,申请人应根据产品特点及临床使用目的
编写技术资料,以便于关注者获取准确的信息。 申请人应该提供校准品、质控品产品标准和技术资料,技术资料的要求参见《体外诊断试剂注册管理办法(试行)》。产品标准格式和具体内容如下(不限于): 一、范围 应明确陈述本标准规范的对象和所涉及的方面,指明使用的界限。 二、规范性引用文件 应包括引导语和规范性引用文件的一览表。一览表中引用文件的排列顺序为:国家标准、行业标准、国际标准及规范性文件等。 例如: 下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。 GB/T 1.1-2000 标准化工作导则第1部分:标准的结构和编写规则 GB/T 191-2000 包装储运图示标志 YY 0466-2003 医疗器械用于医疗器械标签、标记和提供信息的符号
关于定值和非定值质控品(终审稿)
关于定值和非定值质控 品 文稿归稿存档编号:[KKUY-KKIO69-OTM243-OLUI129-G00I-FDQS58-
如何选择控制品——第一部分定值与非定值控制品 冯仁丰 我经常被众多同道询问有关每天质量控制的问题。令人高兴的是,越来越多的国内临床实验室在重视每天的质量控制,因为实验室检测结果对临床患者疾病的诊断和监测已经起着非常重要的作用,为了使临床和患者确信实验室的检测结果,其中一个必须实施的是开展每天的质量控制。在如何去选择合适的控制品上,很多实验室偏向于挑选定值控制品,认为控制品的定值对于实验室检测究竟准不准很有价值。而且认为非定值控制品相比定值控制品价钱也便宜,猜想这可能与它们内在的质量差别有关。因此,在质控品选择上,医院或实验室会倾向选择价格可能更贵的定值控制品。 一、控制品加工过程 从校准品、控制品的生产工艺上,如果是冷冻干燥的产品,无论从原材料来源、加工处理、直至成为稳定的冻干血清为止,校准品和控制品完全一样,定值与非定值控制品也完全一样。只是以后根据市场需求,部分冻干血清在体外诊断厂商处,按照校准品要求进入定值程序,最后成为校准品。部分冻干血清在控制品厂商那里,邀请一些实验室进行控制品的检测,将这些检测结果统计处理后确定最后定值,这些冻干血清成为了定值控制品;没有被定值处理的,即为非定值控制品。由于邀请实
验室参与检测定值,需要耗费一定投入,为此出售的定值控制品普遍比非定值控制品要贵。 二、控制品定值必须与使用的检测系统关联 需要说明的是,请注意每个定值控制品说明书上包含了一个很长的定值清单,它按照不同的检测系统进行排列,方便实验室从中寻找到适合自己检测系统的定值。这样的检测系统在国内被称为“封闭”系统。如果实验室确实完全使用了某个“封闭”检测系统,才可能从定值表中去寻找到对应的该检测系统的定值数据。 长期以来临床实验室受国内检验自动化发展试剂和仪器历程的影响,大多实验室至今还是对使用的仪器和试剂分别选择,且各试剂厂商建议的校准品不一,实验室最后形成仪器、试剂和校准品的“个性化组合”检测系统。这种“个性化组合”检测系统在任何控制品公司提供的控制品定值表中,是找不到对应定值的。 三、开展每天的质量控制有必要使用定值控制品吗 自质量控制从上世纪50年代开始引入临床实验室起,就强调内部质量控制反映的是不精密度。控制图的绘制方式,让我们观察每天控制值环绕均值的上下分布的波动情况,这就是以均值为中心的控制值不精密度表现。只要每天、每月检测控制值在以往过去波动的范围内,就被认可为“在控”,这是临床实验室的共识。
关于体外诊断试剂校准品溯源和质控品赋值的溯源性说明
天津市体外诊断试剂校准品和质控品技术审查要点 1范围 本文规定了对建立或确认测量正确度为目的的校准品和质控品赋值的计量学溯源性进行确认的方法,校准品和质控品由生产企业提供,作为体外诊断试剂的一部分或与其一起使用。适用于体外诊断试剂校准品和质控品的技术审查。 2规范性引用文件 下列文件中的条款通过本说明的引用而成为本说明的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本说明,然而,鼓励根据本说明达成协议的各方研究是否可以使用这些文件的最新版本。凡是注日期的引用文件,其最新版本适用于本说明。 GB/T 21415 - 2008/ISO 17511: 2003 体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源 GB/T 19702 - 2005/ISO 15193: 2002 体外诊断医疗器械生物源性样品中量的测量参考测量程序的说明 GB/T 19703 - 2005/ISO 15194: 2002 体外诊断医疗器械生物源性样品中量的测量参考物质的说明 3术语与定义 下列术语与定义适用于本说明 3.1计量学溯源性 metrological traceability 通过一条具有规定不确定度的不间断的比较链,使测量标准的值能够与规定的参考标准,通常与国家标准或国际标准联系起来的特性。 3.2国际标准品 具有最高的计量学特性,其值不必参考相同量的其他标准,被指定或普遍承认的测量标准。 3.3国家标准品 用国际标准品标定的,或我国自行研制的(尚无国际标准品者)用于微生物(或其产物)的定性鉴定或疾病诊断的生物试剂、生物材料或特异性抗血清。 3.4企业标准品 通过与相同量的国际(国家)标准品和/或进口(国产)试剂比对而定值的测量标准。 3.5浓储液 使用国家标准品和/或企业标准品赋值,作为企业标准品和或校准品配制过程中的母液。 3.6校准品 Calibritaor 具有在校准函数中用作独立变量值的参考物质。 3.7质控品 用于控制结果的准确性和重复性的物质。 3.8测量准确度 accuracy of measurement 测量结果与被测量真值之间的一致程度。
关于体外诊断试剂校准品溯源和质控品赋值的溯源性说明
精心整理 天津市体外诊断试剂校准品和质控品技术审查要点 1 范围 本文规定了对建立或确认测量正确度为目的的校准品和质控品赋值的计量学溯源性进行确认的方法,校准品和质控品由生产企业提供,作为体外诊断试剂的一部分或与其一起使用。适用于体外诊断试剂校准品和质控品的技术审查。 2 规范性引用文件 下列文件中的条款通过本说明的引用而成为本说明的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本说明,然而,鼓励根据本说明达成协议的 3 3.1 通常3.2 3.3 3.4 3.5 3.6 3.7 质控品 用于控制结果的准确性和重复性的物质。 3.8 测量准确度accuracyofmeasurement 测量结果与被测量真值之间的一致程度。 4 要求 应提供校准品的溯源性资料,计量学溯源链的说明应始于该产品的值,止于计量上最高参考标准。校准品如有互换性,应提供互换性研究资料。应至少提供一批校准品靶值的赋值程序及测量不确定度资料,校准品如有互换性,应提供互换性验证时对其赋值进行统计学处理、修订的研究资料。
质控品需提供质控品赋值的详细资料,包括来源、赋值、性能测定等。 根据计量学溯源至SI的可能性及测量程序和校准品的不同计量水平的可获得性,将计量学溯源链的上端分为以下几种: 4.1测量结果可以在计量上溯源至国家(国际)标准品的量。 有可用的国家(国际)标准品作为参考物质,校准品配制过程中使用国家(国际)标准品作为参照。 溯源至国家(国际)标准品,需详细提供国家(国际)标准品相关信息,如使用说明书、批号、质量要求、有效期和装量等。 确保校准品准确性、精密性、稳定性。 4.2 涉 化学等) 结果及结论。 4.3 4.4 4.5 效期稳定性:生产企业应规定产品的有效期,到效期后的校准品检测准确性和精密性,应符合4.3~4.4的要求。 热稳定性:检测校准品准确性和精密性,应符合4.3~4.4的要求。 5试验方法 5.1校准品溯源性 5.1.1主要原材料的选择 选择抗原(抗体)或纯品,按照4.2提供原料选择资料。 选用由生产企业推荐或经实验证明可使用的缓冲液作为稀释液,如可采用牛血清、人血清、5%
临检中心血液分析室内质控品使用说明书2014
临检中心血液分析室内质控品使用说明书 一、控制品名称: 室内调查品,水平1、水平2。 二、适用范围: 本品用于血液分析仪8项参数的质量控制,不包括分类、直方图和各类报警。8项参数为WBC,RBC, HGB, HCT, MCV, MCH, MCHC和PLT。 三、控制品性质: 本品用健康人新鲜全血所制,经检测HBsAg,HCV,HIV,梅毒血清学均为阴性。但各实验室在使用时请按传染性标本处理。本品必须贮存于2-8℃,当月有效,开瓶后使用1周。 四、使用方法: 使用前在室温环境下(18-30℃)放置10分钟,将本品置于两手间来回搓转并颠倒混匀,直至瓶底沉积血液完全摇散,状态均匀,时间至少2分钟。每瓶开始使用前必须充分混匀,并防止泡沫产生;按常规操作方法测定本控制品,使用完放入冰箱2-8℃保存。Beckman-Coulter,Cell-dyn仪器可在质控模式下操作。 五、控制品质量控制方法: 1、在准备开始进行质控时,需用同一批号控制品按使用方法连续测定3天,每天测定3~4次,每次测定间隔2~5小时,并将检测数据在质控软件“初始数据输入”模块下输入电脑,累积10个数据完成初始化,电脑将自动计算其均值(x)和标准差(s),并以此x和s判别当月输入的质控数据是否在控。或者按照《全国临床检验操作规程》第3版中P84对“稳定性较短的质控品标准差的建立”,采用以前几个月累积变异系数CV和初始的均值x来计算新的标准差S,但CV不应超出CLIA’88定义的项目允许总误差的1/3,并以此x和S判别当月输入的质控数据是否在控。 2、每日进行标本测定前,必须先至少同时使用2个水平控制品按常规方法进行操作,每天至少做1次,将测定数据按软件要求输入电脑,并保存原始数据。 3、失控规则:根据实验室试剂情况制定合适的质控规则,推荐采用13s和22s质控规则。 4、一旦发现失控,应查找原因并及时纠正,且有记录。在控后才能进行日常标本检测和出具检 测报告。 5、每月底将室内质控数据上报至上海市临床检验中心质控业务科。 上海市临床检验质量控制中心临床血液体液室 2013年12月26日
梅毒检测室内质控调查品使用说明解读
梅毒血清学检测室内质控调查品使用说明 1. 预期用途:梅毒血清学检测室内质控调查品用于梅毒血清学检测的室内质量控制。批号为 1401,分为特异性和非特异性两种质控调查品。非特异性质控品的浓度为 800mIU/ml;特异性质控品分为两种浓度:21mIU/ml用于化学发光法和 ELISA , 80mIU/ml用于 TPPA 、雅培等方法。三种浓度的质控调查品均为弱阳性,测定值必须大于 CutOff 值或为阳性。 2. 分装规格与保存要求:梅毒血清学检测质控调查品为 0.5ml/支,请放 -20°C 保存,有效期至 2014年 12月 31日。质控调查品复溶使用后,请置于 4°C 保存, 4周内使用,切勿反复冻融。 3. 检测要求:实验室应使用与临床标本检测相同的试剂和方法同步检测质控调查品, 并严格按照试剂使用说明书操作。 4. 质控统计要求:每月通过计算机网络向本中心上报结果。化学发光和 ELISA 方法采用 S/CO (S 为样调查品测定 A 值, CO 为 cutoff 值值进行统计。在本中心的质控软件中累积≥ 20 次的室内质控调查品测定数据 , 完成质控数据的初始化 , 使用 Levey-Jennings 质控图开展室内质量控制, CV 应<25%。检测标本量少,检测频次较低的单位,初始阶段采用即刻法统计(具体方法参见软件应用说明。TPPA 、 TRUST 、 RPR 等使用滴度方法报告结果的方法采用滴度值进行统计(具体方法参见软件应用说明。 5. 注意事项:该调查品以人血清为基质, 已经过病毒灭活。使用时请仍视同传染性样本对待。 上海临床检验质量控制中心 2014年 1月 2日
HbA1c质控品说明书(MAS)2014
糖化血红蛋白(HbA1c)调查品使用说明 一.使用目的 MAS糖化血红蛋白调查品是用于监测糖化血红蛋白项目的体外检测的质量控制。 二.概述 运用调查品对方法和技术的精密度作客观的评价是优秀实验室工作的一个主要部分。在临床范围的2个浓度水平的调查品供监控使用。 三.试剂成分和包装规格 本调查品由含正常和异常水平糖化血红蛋白的人全血制成,经生物灭活,含防腐剂,但不包含叠氮钠和硫柳汞。每支内含1ml溶液,直接使用,无需复溶。 四.贮存条件和稳定性 未开封的糖化血红蛋白调查品储存在-15~-25℃的环境中,可以稳定至效期,一旦打开使用,在原封闭的容器中,存放在2-8℃的环境下,稳定性可达21 天(建议打开后分装,储存在-15℃或以下的环境中)。 注意:该产品只可冻融一次。 如有迹象表明质控液已受微生物污染,请勿使用。 五.操作步骤 样品应平衡至室温后方可使用。取样前,轻轻地漩涡状混匀调查品。 注意:糖化血红蛋白调查品应与患者样本同样地处理,并按照操作规程进行分析。 六.质控值 该产品为包括正常与异常两个浓度糖化血红蛋白的未定值调查品。根据使用的仪器、试剂,建议每个实验室建立自己的均值和可接受范围。 七.警告和预防措施 该调查品成分来源于人体全血,每个捐赠者都已经过美国FDA批准的方法通过检测,如HbsAg、抗HIVⅠ/Ⅱ抗体、 HIVⅠ- RNA、HCV RNA、梅毒和HIV抗原,结果均为阴性或正常。但是,由于没有一种检测方法可以完全确保以人源物质做成的产品不发生传染,因此,该产品应被视为有潜在传染性且要依照相关的公共卫生预防措施对待和处理。 本产品仅适用于体外诊断使用。 上海市临床检验质量控制中心 2013年12月30日
血沉质控品中文说明书
血沉质控品说明书 [产品名称] 通用名称:血沉质控品 英文名称:PRECISION-RATE [包装规格] 水平1(正常) 2×9ml 水平2(异常) 2×9ml [预期用途] 用于红细胞沉降率(ESR)检测的精密度的质量控制. [主要组成成份] 由保存在缓冲液和防腐剂内的红细胞悬液组成,试剂成分的实质是一种生物试剂,因此,应该把质控品看做是一种潜在的传染源.但是,用于生产这种质控品的每一份人类全血标本都利用FDA允许的方法进行了检测,确保无感染性乙型肝炎病毒表面抗原(HbsAg)、丙型肝炎病毒(HCV)抗体、以及HIV-1/HIV-2抗体。该质控品也可能包含尚无已经批准监测方法所能够检测到的其他人源性材料。按照优良实验室操作规范的要求,所有人源性材料均应该视作具有潜在感染性材料。并按照患者标本相应的注意事项处理。 范围: LEVEL I:2-10mm/h LEVEL II:36-60mm/h [储存条件及有效期] 在未打开的情况下2-8℃保存,在有效期(1年)内是稳定的。 一但打开,室温条件下(18-30℃)可以稳定密封保存31天。 避免长时间暴露在光线下,试剂瓶应该密封避免蒸发。不要冷冻,不要长时间暴露在高温环境内。 [适用仪器] Monitor-100 Monitor-20 Microsed-System [检验方法] Precision-Rate 质控品应该按照患者标本对待,并按照配套仪器的说明书进行分析操作。 1. 质控品的分析,每次必须使用清洁的试管制备反应试剂。 2. 轻柔颠倒试剂瓶,直至包装内的细胞重新混匀。持续混匀30秒,避免产生泡沫。不要 使用漩涡振荡器震荡。 3. 按照制造商提供的说明书填满样品管。不需要采用传统的魏氏法(如蔡氏一次性 Westergren试管)对质控品重新稀释。 4. 每次使用后,擦干净瓶口及瓶盖内的残余质控材料。重新盖上盖,并按照存储及稳定性 部分内描述的存储条件存储。
内分泌激素室内质控品使用说明
内分泌激素室内质控品使用说明 1.2013年内分泌激素室内质控样品分别为中值和高值两个水平,可用项目 有:17-羟-孕酮、AFP、β2-微球蛋白、CA15-3、CA19-9、CA125、卡马西平、CEA、可的松、硫酸脱氢表雄酮、地高辛、铁蛋白、叶酸、游离T3、游离T4、FSH、生长激素、HCG、IgE、胰岛素、雌二醇、LH、PTH、苯妥英、孕酮、催乳素、游离PSA、总PSA、性激素结合球蛋白、睾酮、茶碱、甲状腺球蛋白、促甲状腺激素、总T3、总T4、丙戊酸、维生素B12等(具体详见《朗道靶值表》)。 2.可提供回报数据的项目包括::游离T3、总 T3、游离T4、总 T4、TSH、 皮质醇、胰岛素、HCG、甲状腺球蛋白、生长激素(GH)、甲状旁腺激素、促肾上腺皮质激素(ACTH)、醛固酮。 3.质控品状态:冻干品,5ml蒸馏水溶解,溶解时不要摇晃,避免产生气泡。 4.贮存条件:溶解后2-8℃可保存一周,-20℃可保存1个月。 (1) 质控品开瓶溶解后,按每周使用的量分装于仪器所用的样品杯中。 分装好的质控品放-20℃保存,有效期为一个月;将当周使用的质 控品放2-8℃保存,确保样品未受污染,有效期为一周。每次使 用后剩余的质控品不宜倒回原来的容器中,以防污染。 (2) 甲状旁腺激素和甲状腺球蛋白在溶解后4小时内应检测。 (3) 未开瓶的质控品,贮存于2-8℃,其稳定性可保持到保质期。 5.为了考核质控品的稳定性,请各实验室实事求是记录和上报实验数据。 备注:由于厂家的定值要在2月底发给中心,故内分泌激素的室内质控品定值将在3月中旬放于临检中心的网站上。请互相转告。谢谢! 上海临床检验质量控制中心 2013年1月4日
Beckman质控品说明书(2016)
SYNCHRON?CONTROL液体临床化学控制血清 BECKMAN COULTER(U.S.A) 贮存温度:-15℃~-20℃ 用于体外诊断 使用目的 SYNCHRON?CONTROL液体临床化学控制血清是适用于监测临床实验室临床化学检测系统性能的可靠性。用三个浓度水平的控制血清能帮助实验室监控校准和线性的变化以及分析误差和不精密度。 使用方法 应贮存在-15℃~-20℃。在低于-20℃条件下贮存可能引起内容物的破坏。在任何条件中含胆红素的溶液都应尽可能避光保存。 开始使用前,打开塑料螺盖,剪开密封头,在滴出液体前轻轻旋转混匀内含物。为防止溶液漏出,需直立保存且不要颠倒混匀。 为最大限度保持稳定性,尽可能将瓶子保存在规定的温度,并在使用后尽快放回原处。瓶塞和螺盖在贮存时应盖紧。 概述 SYNCHRON?CONTROL液体临床化学控制血清是由新鲜人冰冻血浆去除纤维蛋白后加入乙二醇制成的。用乙二醇做稳定剂有三个原因:1.高渗环境可抑制细菌生长,同时其抗氧化性可稳定含氧组分;2.乙二醇可使冰点降低,使质控血清在通常的冰冻温度下维持液体状态,如-15℃~-20℃;3.此稳定的液态质控血清可消除一般冻干产品因分装、冻干、复溶所造成的误差。 制备本品的原材料来源于纯品,淀粉酶、脂酶、ALT、AST、γ-GT来源于猪;LDH来源于鸟;CK来源于猿猴;ALP来源于牛。 注意: 因本品用人血清作基质,必须按对待含有传染性疾病样品的工作流程处理。每份志愿者的血清或血浆都已经用FDA推荐的方法检测过HIV抗体、HCV抗体和HBsAg,都为阴性。由于没有一种方法可以完全保证检测出所有HIV、HBV、HCV病毒或其他感染抗原的存在,因此必须按对待含有传染性疾病样品的工作流程处理本品。本品可能还含有尚无理想方法可检测出的其他人源性物质。 稳定性 未开瓶SYNCHRON?CONTROL液体临床化学控制血清可在-15℃~-20℃保存至瓶签上指定的日期,开瓶后在-15℃~-20℃可保存20天,低于-20℃保存可能引起内容物的破坏。 局限性 请注意,在任何溶液中光照和热量可使胆红素分解,胆红素的降解比其他分析物快。因此,建议实验室在胆红素的使用周期内对其进行性能评价。 本品与直接法(样品不作稀释)离子选择电极不相容,故不能用于这一系统。 因本品的粘度大于正常血清,应注意少量样品的吸取。建议在吸取样品时将吸头略伸入
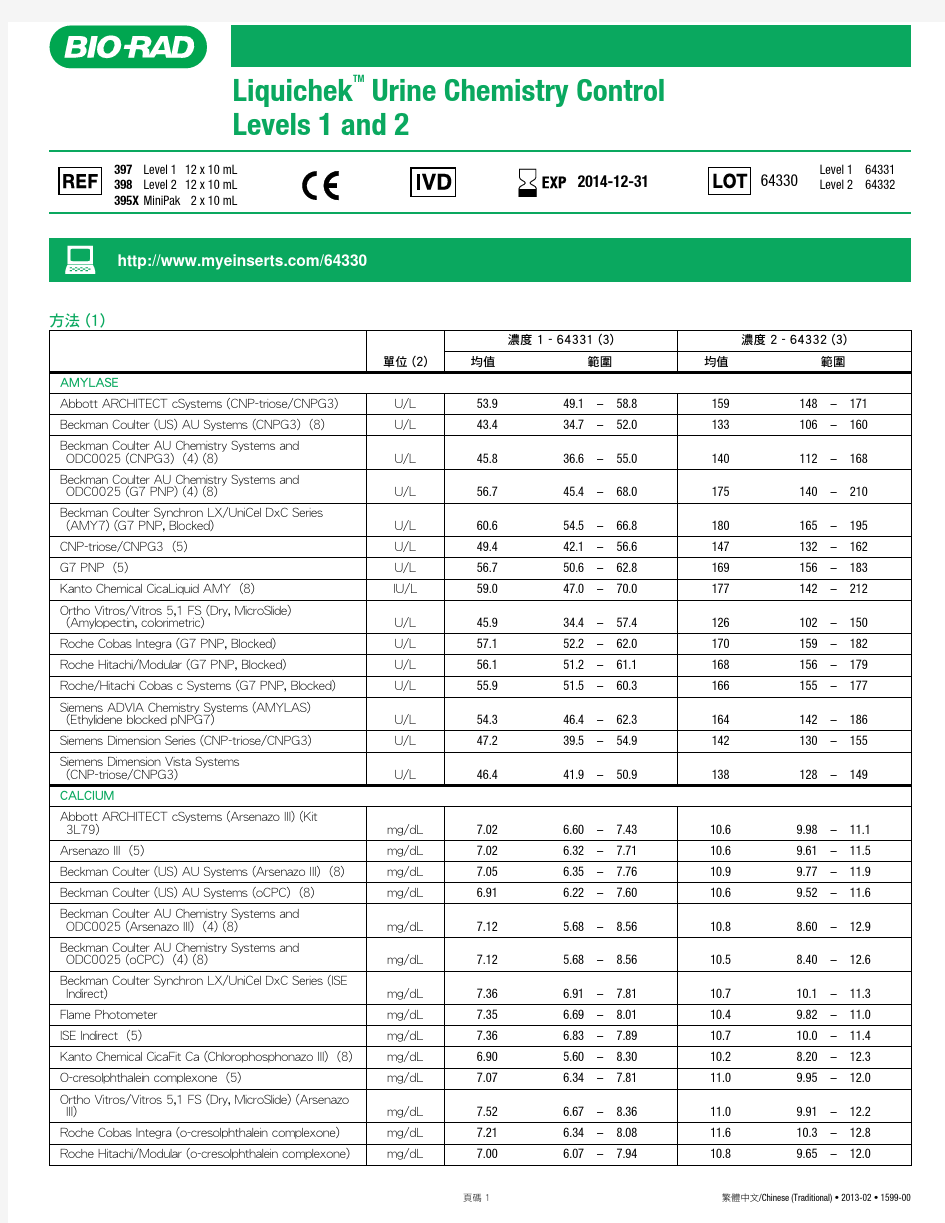
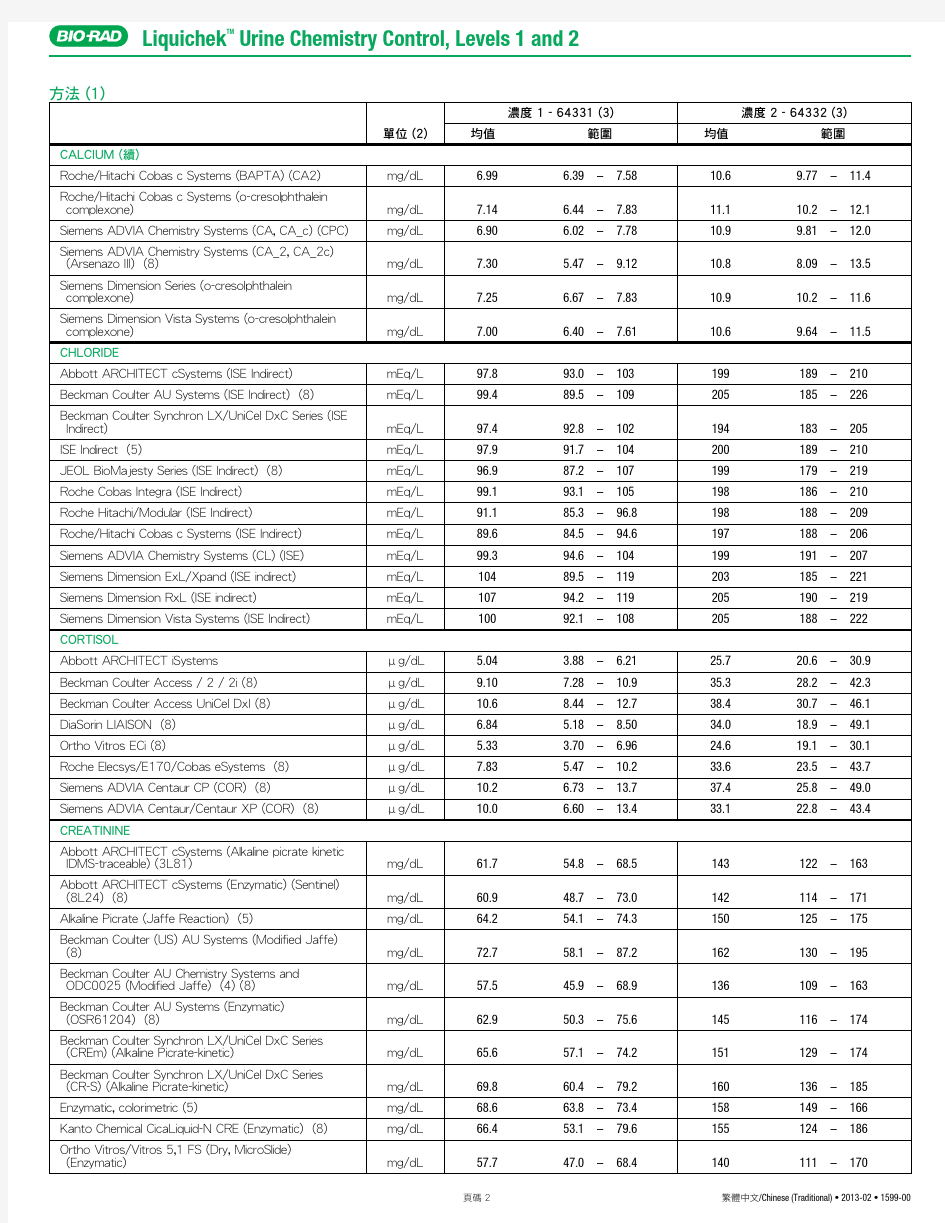
RANDOX尿液生化质控品说明书(2014)
RANDOX尿液化学调查品使用说明书 一.使用目的 RANDOX尿液化学调查品是一种用于监测实验室在进行尿液化学分析过程的质量控制物质。 二、概述 运用尿液化学调查品调查品对方法和技术的精密度作客观的评价,也是优秀实验室工作的一个主要部分。在临床范围的二个浓度水平的调查品供监控使用。 三、操作步骤: 1. RANDOX尿液化学调查品应该象病人样品一样处理并按照仪器和试剂操作要求进行测定。 2.室温下(15-25℃),每瓶调查品用10ml去离子水溶解,平衡30分钟。 3.期间将小瓶轻轻颠倒,不要振摇,确保内容物完全溶解,避免产生气泡。 4. 应立即使用复溶物或者将其储存到2~8℃冰箱里。 四、调查品的储存和稳定性: 未开封的调查品,贮存在2-8℃可稳定至失效期。已复溶的调查品,旋紧瓶盖,保存在15-25℃可稳定8小时;2-8℃可稳定5天;贮存于-20℃可稳定14天。(注意:不可反复冻融!)。 五、局限性 1.RANDOX尿液化学调查品应在有效期内使用。 2.如果调查品有微生物污染的迹象或过度浑浊应丢弃。 3.RANDOX尿液化学调查品不能作为标准品使用。 六、质控值: 根据使用的仪器、试剂,建议每个实验室建立自己的均值和可接受范围。 七、注意 本制品由人源性物质制备而成。处理时视同疾病传染性物质。均对乙型肝炎病毒表面抗原(HBsAg)、丙型肝炎病毒 (HCV) 抗体和人免疫缺陷病毒 (HIV) 抗体呈非反应性(阴性)。然而,没有一种实验能够绝对保证不存在传染性物质,因此,本制品的处理应遵照 CLSI 指南M29, 或公布的其它生物危害安全指南的建议。 上海市临床检验质量控制中心 2013年12月30日 1
血清蛋白质控品说明书2014
Helena血清蛋白(SPE)质控品使用说明 一.目的 血清蛋白(SPE)质控品是用于定量或定性控制琼脂糖凝胶血清蛋白电泳的分析过程。二.概述 一个优秀实验室的操作过程要求用已知待检测成分浓度的材料进行监控。血清蛋白质控品含有已知浓度的各血清蛋白组分,并且按照Helena实验室推荐的步骤用SPE Split Beta SPE 凝胶、SPIFE SPE凝胶和QuickGel Split Beta SPE凝胶进行检测,所获得的浓度数据在可接受范围。 三.原理 血清蛋白质控品的检测与未知的样品检测相同。请参照相应的操作步骤。 四.试剂 1.成份:血清蛋白质控品是源自人混合血清的冻干粉。 2.预防:仅供体外诊断使用。注意:该物品经检测HBsAg、HCV和HIV抗体阴性。但亦应将其当作是病人样品一样小心处理。 3.复溶:用2.0ml去离子水或蒸馏水复溶血清蛋白质控品,并轻轻摇动,放臵20分钟至其完全溶解后方可使用。在使用前应轻轻摇动。 4.储存和稳定性:血清蛋白质控品的冻干粉在2-8℃下可保存到试剂瓶上标示的效期。2-8℃下,配制好的液体质控品可保存5天。 5.变质标志:质控品的冻干粉必须呈现为干燥的、淡黄色固体。 五.步骤 血清蛋白质控品的检测与未知的样品检测相同。请参照相应血清蛋白电泳的操作步骤。六.局限性 质控品检测结果的获得取决于与检测方法及仪器相关的几个因素。使用Helena实验室提供的检测系统以外的系统可导致检测结果与试剂说明书给出的值不同。 七.预期值 血清蛋白质控品预期的平均值和可接受范围打印在本页说明书的背面,注意要确认质控品批号与说明书标示的批号相同。总蛋白的靶值是用双缩脲方法确定的。由于技术和方法学的各异,建议各实验室用本实验室的检测系统确定总蛋白的量。电泳可用SPE Split Beta SPE 凝胶、SPIFE SPE凝胶和QuickGel Split Beta SPE凝胶进行检测。其它检测系统可能产生不同的检测结果。因此,推荐使用其它系统的实验室建立自己的可接受范围。
伊华尿液干化学质控品说明书
上海伊华医学科技有限公司 Shanghai Yihua Medical Science & Technology Co., Ltd. 多项目尿液化学分析控制品使用说明书 【产品名称】多项目尿液化学分析控制品 【包装规格】12瓶/盒(6瓶冻干品,6瓶复溶液) 【预期用途】用于干化学尿液试条和干化学尿液分析仪的质量控制。 【检验原理】合成人工尿,定量加入尿液分析所需的各种化学组分。精确分装小瓶,冷冻干燥而成。 【主要组成成分】 冻干品1瓶×6 复溶液1瓶(10ml)×6。 【储存条件及有效期】本品2~10℃保存,有效期12个月。 【适用仪器】各类干化学尿液分析仪:Miditron Junior Ⅱ,Urisys 1800,combi Scan500,combi Scan100,Clinitek-500,Status,AE 4020,URYXXON300,URISCAN- PRO,Uritest-200,Uritest-500,GEB200,GEB600,Mejer-600,迪瑞H-500/800,sysmex US-2100R,艾康Mission U168,华通HT-2000。 【样本要求】与临床样品同样检测。 【检验方法】 1)打开瓶盖,加复溶液10ml,塞上瓶盖,颠倒三次,使干粉充分溶解。然后将瓶内控制液倒入l5×100mm 试管内,于25℃保温10分钟即可使用。取试纸按测定要求浸润于控制液中,取出置于尿液分析仪上测定,或者对照标准色板读取结果。 2)不同厂商提供的尿液分析纸条反应性能不同,因此,用户根据自己使用的试纸特性,经多次重复测 定后确定结果范围。 【参考值(参考范围)】另见定值表 【检验结果的解释】本质控品可以对尿pH、蛋白、葡萄糖、酮体、隐血、亚硝酸盐、胆红素、尿胆原、维生素C、白细胞、比重等11个项目进行可靠的质量控制。同时,通过上海市临床检验中心的实验室定值,给出了比较客观的定值可接受的控制范围,可以在一定程度上比较不同实验室之间的结果的一致性,供用户作为质量控制的参考。 【检验方法的局限性】本质控品只适用于干化学尿液试条和干化学尿液分析仪的质量控制。 【产品性能指标】 1.瓶间差/批内精密度: 1.1.定量项目(比重、酸碱度、葡萄糖和白蛋白)测量结果的变异系数,CV≤5%。 1.2.定性项目(胆红素、尿胆原、酮体、隐血、亚硝酸盐、白细胞、维生素C)的测量结果和标示值(阳性等级)的符合率不低于80%。 2.准确度:见定值表 【注意事项】 1. 尿液分析试纸的化学反应受温度影响明显。因此,在日常使用中须注意操作环境的室温。室温过低,反应效果下降,不仅是控制品,包括病人尿液的检测结果都不会准确。用户对此须引起重视。本质控品所附的测试结果是在室温25℃条件下的反应结果。 2. 当尿液试纸插入尿液时,试纸上各反应块经尿液浸润发生反应;同时反应块上的各化学反应物也扩散到尿液中去,污染了受检尿液。若对同份尿液作多次检测,次数过多(n>6),结果也会受影响。因此使用控制品时,过多地反复测试后,可能会使结果有变化。 3. 在日常工作中建议每天开机预温后,用仪器附上的标准色条,作检测后,取一条检测试纸用蒸馏水浸润后在仪器上检测,结果应该都是阴性(pH除外);再取一条检测试纸对本控制品进行检测,检测结果都在本说明所附范围内,说明仪器和尿液试纸都正常,记录结果,备查。然后,测试病人尿液。 【参考文献】 1. 全国临床检验操作规程(第三版)。中华人民共和国卫生部医政司。P.406-408,2006 2.临床化学常用项目自动分析法。韩志钧主编。辽宁科学技术出版社。2005 【生产企业】上海伊华医学科技有限公司
化学发光质控品使用说明书
质控品使用说明书 以下是各项目质控品在本公司实验室标定值之范围: 名称瓶盖参考范围单位适用范围 AFP 黑盖72.0-133.6 ng/ml 生产日期为20100704及以后的试剂盒CEA 黑盖76.4~141.80 ng/ml 生产日期为20100601及以后的试剂盒HCG 黑盖200.45-372.26 mIU/ml 生产日期为20091228及以后的试剂盒CA125 黑盖86.2~170.84 U/ml 生产日期为20090821及以后的试剂盒CA15-3 黑盖94.50-171.49U/ml U/ml 生产日期为20091215月份以后的试剂盒CA19-9 黑盖77.55-134.55 U/ml 生产日期为20091126及以后的试剂盒CA50 黑盖76.96-133.89 U/ml 生产日期为20100303以后的试剂盒PSA 黑盖11.35~18.46 ng/ml 生产日期为20100501以后的试剂盒LH 红盖20.02~33.37 mIU/ml 生产日期为20100401及以后的试剂盒FSH 红盖11.30~18.83 mIU/ml 生产日期为20100401及以后的试剂盒PRL 红盖502.66~944.94 uIU/ml 生产日期为20090313及以后的试剂盒P 黑盖8.81-14.68 ng/ml 生产日期为20100101以后的试剂盒T 黑盖 5.51-9.64 ng/ml 生产日期为20091204及以后的试剂盒E2 黑盖320.96~569.50 pg/ml 生产日期为20100401及以后的试剂盒T3 黑盖 3.28~7.46 ng/ml 生产日期为20090301及以后的试剂盒T4 黑盖9.83~14.23 ug/dl 生产日期为20090707及以后的试剂盒TSH 黑盖6~12.47 uIU/ml 生产日期为20090804及以后的试剂盒FT3 黑盖7.05~15.55 pmol/l 生产日期为20090401及以后的试剂盒FT4 黑盖20.50~39.95 pmol/l 生产日期为20090707及以后的试剂盒TG 黑盖235.5~385.6 IU/ml 生产日期为20091104及以后的试剂盒TPO 黑盖40.60~78.07 IU/ml 生产日期为20090820及以后的试剂盒INS 黑盖60.30-100.50 uIU/ml 生产日期为20100428及以后的试剂盒C-P 黑盖 3.14-5.23 ng/ml 生产日期为20100311以后的试剂盒HBsAg 黑盖70.94~121.76 ng/ml 生产日期为20101216及以后的试剂盒抗-HBs 黑盖81.10~139.37 mIU/ml HBeAg 黑盖 6.73~12.34 NCU/ml 抗-HBe 黑盖 2.82~3.61 NCU/ml 抗-HBc 黑盖 3.57~6.25 NCU/ml PⅢNP 黑盖Q2:52.4~73.7 ng/ml CⅣ黑盖Q2:525.2~785.2 ng/ml HA 黑盖Q2:371.4~572 ng/ml LN 黑盖Q2:454.1~678.1 ng/ml PⅢNP 黑盖Q1:13~27 ng/ml CⅣ黑盖Q1:150~240 ng/ml HA 黑盖Q1:100.5~161.8 ng/ml LN 黑盖Q1:160~250.5 ng/ml β2-MG 黑盖 3.90-7.07 ug/ml 生产日期20100126其以后的试剂盒Ferr 黑盖347.15~524.44 ng/ml 生产日期20101025其以后的试剂盒 质控品使用注意事项: 1.使用定值质控品,使用说明书上的原有标定值只能作参考。必须由实验室作 重复测定来确定实际的均值和标准差。
体外诊断试剂校准品、质控品研究技术指导原则
体外诊断试剂校准品、质控品研究技术指导原则 体外诊断试剂校准品(物)(包括真实度控制品)、质控品(物)(简称 校准品、质控品)是实现体外诊断试剂临床检测及监督检验结果准确一致 的主要工具,也是保证量值传递的实物计量标准。校准品、质控品研究技 术资料应包括产品技术要求、试验方法等重要信息,是指导注册申请人(简 称申请人)单独申请注册校准品、质控品的重要技术性文件之一。 本研究技术指导原则根据国家食品药品监督管理局《体外诊断试剂注 册管理办法(试行)》、《医疗器械标准管理方法》、《生物制品规程》(2000版)等相关规定,参考国际标准化组织(I S O)、美国食品药品监督管理局(F D A)、临床化学国际联合会(I F C C)等有关体外诊断试剂方面的指南, 对编写的格式及各项内容的要求进行了详细的说明。其目的是为体外诊断 试剂校准品、质控品单独注册申报进行原则性的指导,同时,也为注册检 验及审评部门审核体外诊断试剂校准品、质控品提供参考。本指导原则并 不适用于质控菌株。 由于校准品、质控品种类多、范围广、临床使用重要性强,因此,申 请人应根据产品特点及临床使用目的编写技术资料,以便于关注者获取准 确的信息。 申请人应提供申请注册校准品、质控品的产品标准和技术资料,技术 资料的要求参见《体外诊断试剂注册管理办法(试行)》。产品标准可参见 本技术指导原则。 1范围
应明确陈述本标准规范的对象和所涉及的方面,指明使用的范围。 2规范性引用文件 应包括引导语和规范性引用文件的一览表。 3分类和组成及其它 3.1组成成份 应说明校准品、质控品的主要组成成份及其生物学来源。 3.2标示值 应注明校准品赋值及测量不确定度、质控品的赋值及参考范围,非定值质控品可通过标示目标浓度(如:低、高、中)来表示。 3.3规格 应注明校准品、质控品的包装规格。 3.4用途 应详细注明校准品、质控品的预期用途。 3.5稳定性 应提供至少一批成品在实际储存条件下保存至有效期后的稳定性、开瓶稳定性研究资料。特殊情况应予以说明,必要时应提供加速破坏性试验资料。该资料可放入产品标准的规范性附录中。 3.6校准品的溯源性、互换性,定值质控品赋值的统计学处理 应提供校准品的溯源性资料,计量学溯源链的说明应始于该产品的值,止于计量上最高参考标准。校准品如有互换性,应提供互换性研究资料。 应至少提供一批校准品靶值的赋值程序及测量不确定度资料,校准品如有互换性,应提供互换性验证时对其赋值进行统计学处理、修订的研究
- HCV-PCR室内质控品1301说明书
- 关于体外诊断试剂校准品溯源和质控品赋值的溯源性说明-2.
- 同型半胱氨酸质控品说明书(2016)
- 伊华尿液干化学质控品说明书
- 标准品.质控品-体外诊断试剂生产及质量控制技术指导原则
- 体外诊断试剂校准品、质控品研究技术指导原则
- 性病艾滋病室内质控品使用说明
- 最新标准品.质控品-体外诊断试剂生产及质量控制技术指导原则资料
- 血凝质控操作说明
- PCT质控品产品介绍
- 关于体外诊断试剂校准品溯源和质控品赋值的溯源性说明
- 梅毒检测室内质控调查品使用说明解读
- Beckman质控品说明书(2016)
- 质控品使用注意事项
- 梅毒检测室内质控调查品使用说明
- (非常重要)质控品说明书使用指南
- HbA1c质控品说明书(MAS)2014
- 体外诊断试剂生产及质量控制技术指导原则-体外诊断试剂校准品(物)、质控品(物)研究技术指导原则
- 体外诊断试剂校准品、质控品研究技术指导原则
- 关于体外诊断试剂校准品溯源和质控品赋值的溯源性说明
