样品结果报告单

附件2
样品结果报告单
请各实验室务必认真及时填写本报告单、各项填写内容不能为空。第1页共2页
1.实验室名称(公章)甘肃国信润达分析测试中心
2.实验室代码样品编码347
3.填表人徐慧
4.检验人员杨博
5.授权签字人
6.检验时间2016.9.14
7.检验结果(mg/kg)
样品编码红2G 酸性橙Ⅱ碱性橙21 罗丹明B 碱性橙2 苏丹红Ι347 <0.858 <1.14
8.检验技术信息
8.1检验设备(包括前处理设备和检验设备)(行数不够可增加)
名称厂家型号备注(如检测器类型、
检定校准情况表)离心机盐城市安信实验仪器有限公司Model /
涡旋混合器北京金北德工贸有限公司MVS-1 /
超声清洗器宁波新芝生物科技有限公司SB25-12DTM /
高效液相色谱仪赛默飞世尔中国有限公司U-3000 紫外检测器
8.2标准物质(行数不够可增加)
编号名称纯度厂家
GBW(E)100254 苏丹红1 100Mg/ml 北京海岸鸿蒙标准物质技术有限责任公司C16813550 罗明丹B 99.0%/
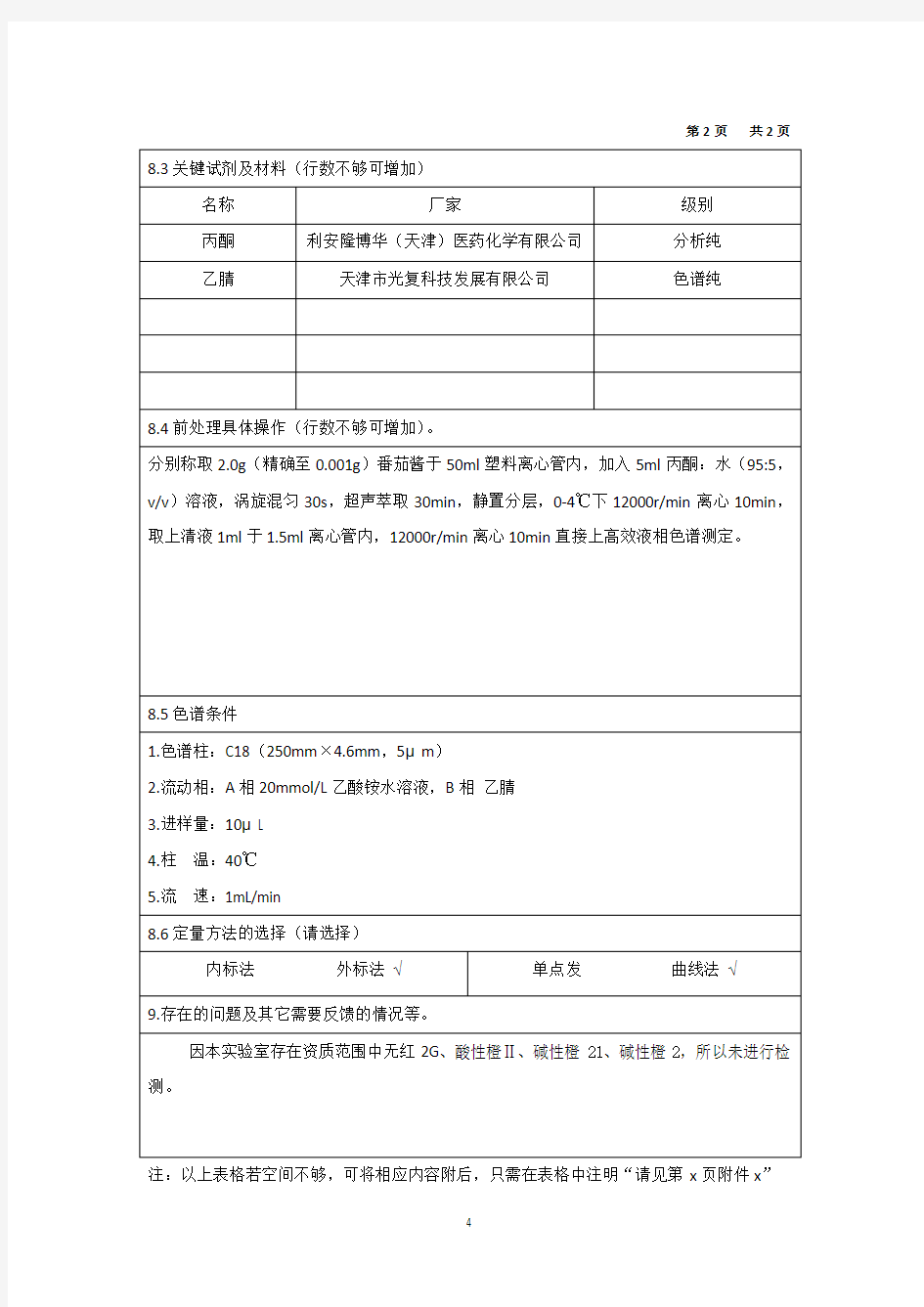
第2页共2页8.3关键试剂及材料(行数不够可增加)
名称厂家级别
丙酮利安隆博华(天津)医药化学有限公司分析纯
乙腈天津市光复科技发展有限公司色谱纯
8.4前处理具体操作(行数不够可增加)。
分别称取2.0g(精确至0.001g)番茄酱于50ml塑料离心管内,加入5ml丙酮:水(95:5,v/v)溶液,涡旋混匀30s,超声萃取30min,静置分层,0-4℃下12000r/min离心10min,取上清液1ml于1.5ml离心管内,12000r/min离心10min直接上高效液相色谱测定。
8.5色谱条件
1.色谱柱:C18(250mm×4.6mm,5μm)
2.流动相:A相20mmol/L乙酸铵水溶液,B相乙腈
3.进样量:10μL
4.柱温:40℃
5.流速:1mL/min
8.6定量方法的选择(请选择)
内标法外标法√单点发曲线法√
9.存在的问题及其它需要反馈的情况等。
因本实验室存在资质范围中无红2G、酸性橙Ⅱ、碱性橙21、碱性橙2,所以未进行检测。
注:以上表格若空间不够,可将相应内容附后,只需在表格中注明“请见第x页附件x”
检验科质量管理及监督记录文本
检验科质量管理与监督记录 濮阳市第二人民医院 二〇一六年度
实验室质量与安全管理小组职责 一、质量管理 1、科主任负责质量与安全管理工作,建立科室质量管理小组及制度,体现全面质量管理与持续改进,应有适宜的实验室信息系统(LIS)进行检验数据管理,存在问题有分析、处理程序及改进措施,有记录文件。 2、每月召开1次科室质量与安全工作会议,内容要体现全面、全过程质量管理、有记录。 3、制定全员培训计划,全员参与质量与安全管理的全过程,员工知晓指控要求、程序与方法。 4、制定专业人员继续教育计划,做到知识不断更新,对特殊检测项目和新技术、新业务实施准入管理、有制度、有相关培训内容、讨论记录和操作规程,有代表科室特色及水平的技术项目,有本科工作统计数据资料,有与院外先进水平比较的检查项目。 二、工作规范 1、开展临床检验项目必须是经批准的准入项目,开展特殊检查的实验室应有验收、准入程序,工作人员有上岗资格证明文件、应建立实验项目临床应用指南或手册,定期更新,对本院尚未开展或条件不具备的部分检验项目应有规范的外送运行机制,并签订有保障合同或协议及委托合同或协议,有检查服务项目清单,能够提供24h急诊服务,能够满足临床工作需要。 2、科室布局与流程合理、符合医院感染控制要求,有医院感染控制制度,有废弃物处理程序,并落实到位,做到“一人、一针、一管、一片”,实验室废弃物、尖锐器具的处理应符合医院感染控制规范要求,具有生物危害标志,使用正确。 3、有室内质控制度及室内质控失控处理程序,参与省市临床检验中心组织的室间质评,有记录,有EQA回报不及格结果的处理程序,有工作记录,检测
检验报告单书写制度
检验科检验报告单书写制度 1、检验报告单是疾病诊断及治疗的重要参考依据,也是病人知情权的一种体现,因此,对检验单内容、格式、报告及发放有必要作详细的规定,指导检验人员正确书写检验报告,为患者提供完整、正确、规范、及时的检验报告。 2、检验结果审核人员和检验人员对检验报告的正确性、及时性及规范性负责,实行双签字制度。科主任对检验报告发放流程及监督负责。 3、临床医生(具有职业医师的资格)申请检验项目(化验单申请)必须规范填写(包括病人姓名、性别、年龄、住院号、床号、临床诊断、科别、标本种类、送检日期、送检医生),对申请内容含糊不清或缺项的,本科人员应退回修改,并在标本拒收记录本上登记。 4、检验报告内容应包括检验项目中文名称、报告单位、标本类型、参考范围、异常值提示、唯一编码、标本采集和接收日期时间、报告日期时间、备注、检验者和报告者的双签名。报告单书
写必须规范,严禁涂改,严禁使用热敏打印或打印不清楚的报告。 5、检验报告经审核后,门诊病人自取,病区的检验报告单由病房值班护士来取送到病区。在报告单发放过程中,要注意保护好病人的隐私,不得随意泄漏病人检验结果,病区办公室只限于医务人员进入电脑(或病历)查看病人检验报告。 6、即时检验(POCT)检验报告:由检验科负责质量监督,报告单书写要求有专用POCT报告格式,检验科定期检查POCT检验报告书写质量,对书写不规范、采用热敏纸打印,单位用错,缺项等报告单,及时纠正。 7、发送报告单时严格执行查对制度,避免报告单的丢失、遗落。报告单如有丢失,实验室负责查找、补发报告。 8、检验报告单应严格执行生物安全相关规定,污染的报告单必须经消毒后再发放。 9、检验报告单发放时间的规定:急诊优先原则。 10、临床医生和护士收到报告单应妥善保管,粘贴在病历上应整齐,严禁在检验报单上任意的涂改、划线、做记号或列公式等不规范的行为。
检验科各种通用记录表格
目录: 一:服务质量记录 1、患者满意度调查表编号:1-1(科) 2、临床医护人员满意度调查表编号:1-2(科) 3、临床沟通反馈记录编号:1-3(科) 4、与医护人员定期会议记录表编号:1-4(科) 5、服务对象投诉记录编号:1-5(科) 6、咨询记录表编号:1-6(科) 二:人员培训 7、会议、培训签到表编号:2-7(科) 8、新进人员考核记录编号:2-8(科) 9、生物安全培训记录表编号:2-9(科) 10、员工基本信息表编号:2-10(科) 11、员工继续教育记录编号:2-11(科) 12、员工外出参会或进修记录编号:2-12(科) 13、员工岗位能力评估报告编号:2-13(科) 14、科研成果及学术论文发表记录编号:2-14(科) 三:质量控制 15、检验项目定标记录表编号:3-15(通用) 16、实验室间或实验室内部比对试验结果及分析报告编号:3-16(通用) 17、室间质评标本收到和分发记录编号:3-17(通用) 18、室间质评原始记录及上报记录编号:3-18(通用) 19、室间质评总结报告编号:3-19(通用) 20、室内质控记录编号3-20(通用) 21、室内质控失控(警告)处理记录编号:3-21(通用) 22、20 年月室内质控月总结编号:3-22(通用) 四:生物安全 23、标准菌株保存和使用记录编号:4-23(细菌) 24、菌、毒株的使用记录编号:4-24(细菌) 25、室消毒焚烧记录编号:4-25(通用) 26、试管破损或血样溢出时处理记录表编号4-26(通用) 27、复查标本记录编号:4-27(通用) 28、检测结果危急值报告登记表编号:4-28(通用) 29、不合格标本记录表编号:4-29(通用)
新产品验证试验报告样本
可靠性实验报告 Reliability Test Report 报告名称:XXXXXX验证试验报告 报告编号:XXXXXXXX 发出日期:Jan.13.2013 封 面 产品验证试验报告 TO: XXX CC: XXX 拟制: XXX 审核: XXX
报告编号:QA1301001 完成日期:Jan.15.2009 页码:1of 14样品数量: 10PCS 委托日期: Dec.25.2009 目录 1.0实验目的 (2) 2.0实验设备 (2) 3.0样品名称、编号及来源 (2) 4.0试验方法/环境与步骤要求 (2) 4.1实验室环境测试: (2) 4.2试验流程: (3) 4.3预处理: (3) 4.4初始测试项目及数据: (3) 4.5关键器件温升试验: (7) 4.6低温贮存与工作试验: (7) 4.7高温贮存与工作试验: (9) 4.8恒定湿热试验: (9) 4.9模拟故障测试试验: (10) 4.10最后测试: (11) 5.0实验结果判定 (14) 6.0附件 (14)
报告编号:QA1301001 完成日期:Jan.15.2009 页码:2of 14样品数量: 10PCS 委托日期: Dec.25.2009 1.0实验目的 新产品可靠性验证试验。 2.0实验设备 序号 设备名称 设备型号 设备编号 1 高压仪 TOS8870A FE-0011 2 三用表 34410A FE-0399 3 AC SOURCE Chroma 6520 FE-0400 4 电子负载 Chroma 6214 FZ-0010 5 功率测试仪 AN2102W FC11098 6 可程式恒温恒湿仪 TH-225D 060420A 7 数字示波器 DOS6032A FE-0398A 8 温度测试仪 DR130 FZ-0009 9 调压仪 TDGC2 \ 10 振动试验台 DZD-450A \ 11 跌落测试台 \ \ 3.0样品名称、编号及来源 3.1样品型号/名称:FP09M038 3.2FEREX P/N #: 3.3样品编号: No.1 ~ No.10 3.4试验样品来源:R&D 4.0试验方法/环境与步骤要求 4.1实验室环境测试:
微生物检验报告结果及事项
微生物检验报告结果及事项--青岛科标生物实验室 一、涉及定性项目的检验结果报告 沙门氏菌、志贺氏菌、金黄色葡萄球菌、单核细胞增生李斯特氏菌、大肠杆菌O157:H7、空肠弯曲杆菌、副溶血性弧菌(定性)等,如果检样是称重取样,则最后检测结果一定报告为检出/25g或未检出/25g。如果检样是体积取样,则最后检测结果一定报告为检出/25mL或未检出/25mL。检测标准要求g必须要小写,mL中m必须小写,L则必须大写。记录中所有有用的信息必须填上,无法填充的用“/”划掉。 二、菌落总数检验结果报告 1.菌落总数小于100CFU时,按“四舍五入”原则修约以整数报告,如80.5CFU 可修约报告为81CFU;80.4CFU则修约报告为80CFU。 2.菌落总数大于等于100CFU时,左边数第3位数字采用四舍五入原则修约后,取前2位数字,后面位数用0代替,也可用10的指数形式表示:如10-2两平板平均菌落数为238CFU/g,可修约为240CFU/g,最后报告为24000CFU/g 或2.4×104CFU/g。 3.霉菌、酵母菌、乳酸菌、蜡样芽孢杆菌、产气荚膜梭菌报告形式和菌落总数一样。 4.称重取样以CFU/g为单位报告,体积取样以CFU/mL为单位报告。 三、大肠菌群检验结果报告。 LST初发酵,产酸产气,接种BGLB复发酵后仍产酸产气,则证明样品受到了大肠菌群污染,可检索MPN表,得出相应结果。检测时如果采用(10-1,10-2,10-3)三个稀释度,最后BGLB产气管为(2,0,0),查MPN表可得出大肠菌群检
测值为9.2MPN/g;检测时如果采用(100,10-1,10-2)三个稀释度,最后BGLB 产气管仍为(2,0,0),查MPN表可得大肠菌群检测值为0.92MPN/g;如果采用(10-2,10-3,10-4)三个稀释度,最后BGLB产气管仍然为(2,0,0),查MPN表可得大肠菌群检测值为92MPN/g。称重取样以MPN/g为单位报告,体积取样以MPN/mL为单位报告。大肠杆菌、粪大肠群群、副溶血性弧菌(定量)、总大肠菌群当检出阳性结果时,都会涉及查MPN表,其规律和大肠菌群一样。 四、饮用天然矿泉水中铜绿假单胞菌检验结果报告 根据CN平板上生长的蓝色或绿色菌落的计数和生化确证试验的结果,计算出每250mL水样中的铜绿假单胞菌数量,结果以CFU/250mL报告。 五、饮用天然矿泉水中产气荚膜梭检验结果报告 根据SPS平板上黑色菌落的计数和生化确证试验的结果,计算出每50mL水样中产气荚膜梭菌的数量,结果以CFU/50mL报告。 六、涉及到用29921进行结果判定的项目,每个项目要出5份报告。送检样品用企业标准进行结果判定的,出报告时要参考企标进行出具。 七、阪崎肠杆菌检验结果报告 根据阪崎肠杆菌显色培养基绿色菌落的生长情况和生化确证试验的结果,报告每100g(mL)样品中检出或未检出阪崎肠杆菌。 八、化妆品中粪大肠菌群检验结果报告 根据发酵乳糖产酸产气,EMB平板上有典型菌落,并经证实为革兰氏阴性短杆菌,靛基质试验阳性,则可报告每10g被检样品中检出粪大肠菌群。 九、化妆品中铜绿假单胞菌检验结果报告
产品包装验证报告.doc
文件编号:产品包装材料验证报告 拟制日期年月日 审核日期年月日 批准日期年月日 版号生效日期年月日 有限公司
产品包装材料验证报告 一、总则 1 包装材料的要求 依据:YY/T0681.1、YY/T0313 、YZB/国《体》产品注册标准。 用作制造XXXX的包装材料原料是原始材料,应有原料的来源,明确其历史和可追溯性,并受到控制,以确保成品始终能满足要求。 2 包装材料的设计必须在满足原定用途的条件下,既能够确保内包装材料的符合性,又把对使用者或患者的安全造成危害的可能性降低到最小程度。 2.1 包装材料与XXXX的相容性(即包装与医疗器材相互无不良影响):主要考虑的有:包装材料的安全性毒性的要求,拟包装的医疗器械的大小和形状,对物理和其它防护的要求,医疗器械对特殊危险例如辐射、湿气、机械性撞击,静电放射的敏感性。 2.2 包装材料与标识方式的相容性:标识方法必须对包装材料与采用的灭菌过程的相容性无不良影响,印刷或书写所采用的油墨不会转移到XXXX产品上,也不会和包装材料起反应而影响包装材料的效用,也不会变色而使标识变的模糊不清,对固定在包装材料表面的标识,其附着方式必须能耐受灭菌过程的使用及制造厂规定的贮存和运输条件。 3 包装材料能够提供对物理、化学和微生物的防护。 3.1包装材料在使用场所与使用者撕开包装取出使用时的要求相容性(例如无菌的开封)。
3.2 在使用条件下,在灭菌前、中、后,包装材料不可释放已知是有毒的,其数量足以对健康危害的物质。 3.3无菌状态的保持:(即从其产品灭菌后,成为无菌之时起,直至规定的失效日期或使用时止),包装完整性及包装材料的微生物阻隔特性。 3.4 材料的毒性检测。
体检报告单样本
体检报告单样本集团档案编码:[YTTR-YTPT28-YTNTL98-UYTYNN08]
云阳县第一人民医院体检报告 尊敬的张兴富先生/女士: 您好,云阳县第一人民医院体检中心热情欢迎您前来进行全面的身体检查。对您的光临我们表示感谢,现将您的体检结果报告如下,并请我们的专家针对您的检查结果提出相关的建议供您参考。 您本次体检在选择的项目中,以下指标请您注意: 1.心电图: 窦性心律,房早,正常心电图;2.彩色b超: 胆囊炎胆囊囊壁胆固醇结晶;双肾小结石;前列腺增生;3.放射科: 主动脉型心影,建议结合临床;4.检验科:尿蛋白质+1; 针对以上印象,提出如下建议供参考: 1.房早:定期复查。 2.胆囊炎:宜选择细软易消化食物、少食多餐,避免肥肉、奶油、动物内脏和油炸食 品,忌食辛辣、酒类等刺激性食物;定期胆囊超声。 3.胆囊囊壁胆固醇结晶:低脂饮食,定期复查。 4.主动脉型心影:定期复查,心内科随 诊。 5.双肾小结石:多饮水,适量运动,定期复查,必要时泌尿科就诊。 6.尿蛋白质+1 :尿液中经常有蛋白质存在,可能有肾功能损害。建议复查尿常规。各项检查结果如下:一般项目 项目名称 检查结果 收缩压舒张压 12080 检查结果 项目名称 肺 两肺呼吸音清晰,未闻及干湿性啰音 呼吸音心率心律心音杂音 检查日期:2012-07-23未见异常72正常正常无杂音 检查医生:王维康 检查结果 项目名称 淋巴结甲状腺 未见异常未见异常 检查结果 项目名称 晶体眼睑球结膜角膜虹膜 正常未见异常未见异常未见异常未见异常 检查结果 项目名称 鼻耳咽喉未见异常 未见异常未见异常检查结果 项目名称 龋齿缺齿牙周齿槽
工艺验证报告模板
验证文件 XXXXXX有限公司2013年XX月
6.验证报告起草、审核与批准6.1验证报告起草 6.2 再验证报告审核 6.3 再验证报告批准
目录 1. 验证概述 2. 验证目的 3. 验证范围 4. 再验证依据标准 5. 机构与职责 5.1 验证机构 5.2 验证职责 6. 验证方式 7. 验证准备 7.1 设备设施准备 7.2 仪器试剂准备 7.3 原辅物料准备 7.4 文件与培训 8. 验证时间与计划 9. 验证实施 9.1 产品的工艺流程图 9.2产品的工艺验证: 9.2.1称量备料 9.2.1.1目的 9.2.1.2文件 9.2.1.3检查项目及结果9.2.2 配制 9.2.2.1 目的 9.2.2.2 文件 9.2.2.3 评估项目 9.2.2.4 评估方法 9.2.2.5 取样方法 9.2.2.6配制试验数据 9.2.3 灌装封尾 9.2.3.1 目的 9.2.3.2文件 9.2.3.3评估项目 9.2.3.4评估方法 9.2.3.5灌装封尾检查数据9.2.4 成品抽样检验 9.2.4.1 目的 9.2.4.2 文件
9.2.4.3 评估项目 9.2.4.4 评估方法 9.2.4.5产品检验报告复印件 10. 偏差与处理. 11. 结果与分析 11.1 验证数据汇总 11.2 存在问题与措施 11.3 风险与预防 12. 验证结论 12.1 验证结论 12.2 验证评价与建议 13. 验证周期 14. 附件 15.参考或引用文件 1.概述: 复方醋酸地塞米松乳膏为我司生产多年的乳膏剂品种,自2009GMP再认证以来,乳膏剂生产线生产所用关键设备、生产工艺及工艺参数没有改变,为了验证在正常的生产条件和GMP文件管理体系下能生产出符合预定的规格及质量标准的产品,根据验证管理文件的要求,我们对复方醋酸地塞米松乳膏的生产工艺进行再验证。 2.目的: 在现行的GMP文件管理体系下,生产三批复方醋酸地塞米松乳膏进行工艺再验证: (1)确认关键工序质量监控点是否符合质量要求; (2)确认该产品质量是否符合预定成品的标准。 3.验证范围: 本次验证对复方醋酸地塞米松乳膏,依据工艺规程的各项参数设定指标,并认真按方案组织了实施,仅验证该品种工艺参数设定的科学性符合性。 4.再验证的依据与标准: 《药品生产质量管理规范》(2010版)、《复方醋酸地塞米松乳膏生产工艺规程》、《复方醋酸地塞米松乳膏中间产品内控质量标准》、《复方醋酸地塞米松乳膏成品内控质量标准》。
注塑机验证报告
注塑机验证报告 编审批记录: 编制审核批准 会签记录: 会签单位负责人会签单位负责人
目次 序号内容页码1 概述2/13 2目的2/13 3 范围2/13 4 职责2/13 5 验证小组2/13 6 注塑机安装确认(IQ)2/13 7 运行确认(OQ)4/13 8 性能确认(PQ)9/13 9 再验证12/13 10 报告12/13
1. 概述 公司产品为**管医疗器械,属于II类无菌器械,与负压吸引装置配套使用,该产品用于人工流产手术,产品组成有导管和手柄,其中手柄材料为PP材料,型号为5、6、7、8号,其中5号适用于单管,其余适于单管和双管产品,导管手柄采用注塑方法制造,要求手柄外观整齐、无毛刺、无注塑缺陷,为达到此目的,特展开以下确认工作。 2.目的 通过验证,证实EH160B注塑机能够实现**管正常生产,并为正常生产和工艺文件编写提供参数依据。 3.范围 本方案适用于公司生产车间***型注塑机安装、运行和性能验证。 4.职责 技术部负责起草验证方案,负责配合设备的安装调试过程,主要参与性能验证。 生产部负责对验证活动的开展实施和过程记录。 质管部负责验证方案的审核,负责对验证过程的监控和检验。 管理者代表负责方案和报告的最后批准。 5.验证小组 验证小组成员名单组长 小组成员 部门姓名部门姓名部门姓名生产部质管部 生产部质管部 生产部 6.注塑机安装确认(IQ) 6.1注塑机基本信息 设备名称注塑机型号设备编号生产厂家设备生产日期入厂日期
6.2注塑机系统描述 设备结构:主要由液压系统、锁模系统和射台系统等部分组成。 技术参数:见操作说明书 6.3注塑机资料档案和备件检查 序号 确认内容 检查人 检查结果 1 EH160B 注塑机使用说明书 已归档,齐备 2 EH160B 注塑机产品合格证 同上 3 备件清单 已归档,备件和清单对应 4 工具箱 工具齐备 6.4 注塑机安装要求确认 6.3安装确认小结 亿利达注塑机能力符合公司产品生产要求,操作前对各部件的安装过程进行了检查和确认,各运动和控制部件进行了模拟操作(服务人员指导),未见异常,具备进行注塑工作实际操作条件,安装确认合格。 评价人: 日期: 复核人: 日期: 项 目 描 述 检查结果 检查者 完成 未完成及原因 1 检查设备的紧固和松动部件安装无误 √ 无 郝壮壮 2 检查设备安装到位 √ 3 检查模具规格型号与要验证的是否一致 √ 4 确认所有的正常生产操作所必须的其它配件都准备完好 √ 5 确认主电路开关有标识并运行正常 √ 6 确认计数器有效性并运行正常 √ 7 确认热电偶有效性并运行正常 √ 复核人: 日期:
检验报告管理程序
X X X 妇幼保健院 2020 年最新ISO15189:2012妇幼保健院检验科管理体系文件
程序文件更改履历表
检验报告管理程序 1. 目的: 保证检验结果及时准确的发出。 2. 适用范围: 实验室检验结果报告的审核,发放,管理,查询和意见的反馈。3.工作程序: 3.1.检测结果的报告应准确、清晰、明确、客观和及时,杜绝虚假报告。 3.2.测定时其数据要经分析,避免出现假阳性,假阴性结果或者其它不符合的结果。根据质控品判断有效性,只有当质控品结果符合项目 SOP 有关条件时,才可发出报告,否则应重新测定。 3.3.定性测定的检测项目其结果以“阴性”或“阳性”报告;定量测定的,结果报告为单位按实际情况而定,因不同检测项目的单位可能不同,如结果高于测定方法线性范围上限,则应根据需要对样本稀释后再测,结果乘上稀释倍数。 3.4.检验报告单由实验操作人员完成实验后,将结果录入,打印出报告单。检测结果报告结果进入数据库,在服务器保存,并满足临
床随时查询。查询结果时直接进入数据库。 3.5.每份报告均应使用科内统一的打印报告专用纸打印;报告内容至少应包括:实验室的标识、病人姓名、性别、年龄、及测定项目、结果、参考范围(按照国际单位)以及标本号、标本类型、标本接收日期和检测日期、实验操作者和审核者的签名、报告日期等。否则视为无效或虚假报告单。 3.6.如果所收到的原始样品不适于检验,或可能影响检验结果时,应在报告中予以说明。 3.7.对于实验结果有异常的,需在检验报告单提示栏标示出。 3.8.对于检验结果对病人的病情有警示的,应即时电话通知该病人主管医生。并在申请单上注明电话通知时间,以备查询。如出现以下情况,需电话通知: 3.8.1.2.0*109/L 电化学发光免疫检验项目性能验证报告 一、检测系统 我院检验科生化室共申请认可的电化学发光检验项目27项,各项目的检测系统配对情况如表1。故各分析性能的验证均按其配对情况进行。 表1 生化检验项目检测系统配对情况 二、范围: 2.1 精密度(包括批内及日间精密度)。 2.2 准确度 2.3线性范围验证: 2.4 稀释度(可报告范围) 2.5 生物参考区间的验证 三方法 1、精密度评估 1.1 批内精密度; 仪器:瑞士ROCHE公司MODULAR E170全自动电化学发光免疫分析仪材料:ROCHE正常肿瘤质控(批号),ROCHE病理肿瘤质控(批号);ROCHE 正常通用质控(批号),ROCHE病理通用质控(批号);ROCHE正常杂项质控(批号),ROCHE病理杂项质控(批号)。 评估步骤:在确定ROCHE MODULAR E170性能正常的情况下,重复测定20次上述各质控品,计算出各项目的均值、标准差和变异系数。变异系数即代表精密度。 统计方法:用EXCEL来分析计算均数、标准差和变异系数。 评价方法:根据CLIA'88要求,批内精密度应≤1/4TEa,总精密度应≤1/3TEa,若CLIA'88中未做出规定,则依据中国卫生部临床检验中心室间质评要求执行或验证试剂说明书声明的精密度数据。 结论: 1. 2 批间精密度; 仪器:瑞士ROCHE公司MODULAR E170全自动电化学发光免疫分析仪材料:ROCHE正常肿瘤质控(批号),ROCHE病理肿瘤质控(批号);ROCHE 正常通用质控(批号),ROCHE病理通用质控(批号);ROCHE正常杂项质控(批号),ROCHE病理杂项质控(批号)。 评估步骤:在确定ROCHE MODULAR E170性能正常的情况下,在5个工作日,测定2批,每次测定2次上述质控,计算出均值,标准差和变异系数。变异系数即代表精密度。 统计方法:用EXCEL来分析计算均数、标准差和变异系数。 评价方法:根据CLIA'88要求,批内精密度应≤1/4TEa,总精密度应≤1/3TEa,若CLIA'88中未做出规定,则依据中国卫生部临床检验中心室间质评要求执行或验证试剂说明书声明的精密度数据。 结论 2、正确度评估 仪器:瑞士ROCHE公司MODULAR E170全自动电化学发光免疫分析仪试剂:卫生部临床检验中心2012年全国肿瘤标志物测定室间质评质控物(批号),2013年卫生部内分泌测定室间质评质控物(批号)作为正确度评估的标本。 评估步骤:根据卫生部临床检验中心2013年室间质评回报结果,挑选以上质控物中相对高值及相对低值质控品进行检测,每个质控品测定3次,计算出均值,标准差和变异系数。 评价方法:将上述测定结果与卫生部临检中心回馈的质评报告中相应的“靶 检验报告样本(型式检验报告) ————————————————————————————————作者:————————————————————————————————日期: 1 xxxxxxxxxxxxxxxxxxxxxxxxx 检验报告 NO:D09-SG0015 产品名称储水式电热水器生产日期2009年11月 型号规格xxxxxxxxxxxxx 编号或批号 商标------ 等级------- 样品单号3053929 受检单位xxxxxxxxxxxxxxxxxx 检验类别市专项执法检查委托单位xxxxxxxxxxxxxxxxxxxx 样品数量3台 生产单位xxxxxxxxxxxxxxxxxxx 抽样基数13台 抽样地点xxxxxxxxxxxxxxxx 到样日期2009年12月2日来样方式xxxxxxxxxxxxxxxxxxxxxx 验讫日期2009年12月22日样品特征和状态完好 检验依据GB4706.12-2006《家用和类似用途电器的安全储水式热水器的特殊要求》GB4706.1-2005《家用和类似用途电器的安全第一部分:通用要求》 GB/T20289-2006《储水式电热水器》 《2009年第四季度广东省专项监督检验电热水器产品检验细则》 检验结论 本次专项执法检查检验项目共20项,其中标志和说明项合格,A类不合格0项,B 类不合格0项。 A类不合格项目:------- B类不合格项目:------ 检验报告专用章 2009年12月25日 备注xxxxxxxxxx 批准:审核:编制: 序号检验项目标准要求 检测结果单项 判定 1# 2# 1 分类按防触电保护分类I类I类---- 按防水保护程度分类IPX4 IPX4 ---- 2 标志器 具 上 应 有 标 志 额定电压或额定电压范围(V)220 220 合格电源种类与符号符合符合合格额定频率或额定频率范围(Hz)50 50 合格额定功率(W&KW)2000W 2000W 合格制造厂名或代理商名、商标或识别标志符合符合合格器具型号DSZF-40 合格II类结构的符号---- ---- ---- 按其防水等级的IP代码,IPX0不标出IPX4 IPX4 合格额定压力(Pa) 0.6MPa 0.6MPa 合格额定容量(L)40L 40L 合格具有一个额定值范围,应采用由一个连字符分开的范围的上限值和下限值 来标示 ---- ---- ---- 不同额定电压设定应清晰可辨---- ---- ---- 应标出每个额定电压所对应的额定输入功率---- ---- ---- 使用正确的符号符合符合合格电源性质的符号,应紧挨所标示的额定电压符合符合合格II类器具符号所放置的位置,应不可能与任何其他标示发生混淆---- ---- ---- 连接到三根或三根以上的供电导线的器具和多电源器具,配备正确的接线 图,并固定在器具上 ---- ---- ---- 除Z 型连 接 专为中性线使用的接线疯子用字母N表示符合符合合格接地端子必须用接地符号表示符合符合合格上述符号不应标在螺钉、可拆卸的垫圈或其它在连接导线时可能被 拆卸的部件上 符合符合合格 可能引起危险的开关,其标志和放置的位置应清楚的表明它所控制的是器 具的那个部分 符合符合合格 开关和调节装置的不同位置应用数字、字母或其它标志加以表示,较大数 字应对较大输入功率 符合符合合格 数字“0”只能表示“断开”档位,除非不致与“断开”档位相混淆---- ---- ---- 在安装或正常使用期间,打算调节的控制器应标出调节方向的标示符合符合合格使用说明书应随器具一起提供,以保证器具能安全使用符合符合合格符合附录AA要求的热水器,在使用说中应注明“一旦发生器具以外的接 地系统异常情况时,应立即停止使用热水器,并拔下其电源插头或断开与 供电电路的一切连接,并与制造厂的维修人员联系处理” ---- ---- ---- 检验报告单审核制度 篇一:检验科报告审核制度 检验科报告审核制度 1.目的 对检验报告的格式、内容、编制、审核、签发及修改等全过程实施质量控制,确保向患者提供准确、可靠、有效的检验报告。 2.范围 适用于检验科出具的各科检验报告。 3.检验报告内容 检验报告至少应包括下列信息。 3.1医院名称与报告标题。 3.2被检者姓名、性别、年龄、门诊/病室、床号、病历号。 3.3送检样品号(唯一识别号),送检日期、时间,送检医师,样品性质,对不符合要求样品的状态描述。 3.4检验项目名称(英文缩写名、中文名),检验结果、结果单位、参考值。 3.5报告日期、时间,报告人,审核人。. 3.6仅对被检样品所检项目负责的声明。 4.检验报告的格式, 4.1检验科主任设计各类检验报告格式。 4.2根据各专业技术特点编制检验报告。 各类检验报告需满足第3条要求。 5.检验报告的审核、签发和存档 5.1检测人员必须根据室内质量控制数据确认所检项目结果受控。 5.2检测人员必须认真核对检验样品与检验报告一一对应的唯一性。 5-3检测人员必须认真核查异常结果,判断其技术误差的可接受性。有疑问时进行复检。复检包括:核查样品性状是否符合要求,样品与样品号是否对应,重作检测。复检后仍有疑问需报告审核人处理。 5.4检测人员核查后在报告人栏签名。 5.5审核人必须核查整批检验结果的质控数据,判断是否在控及误差的可接受性。 5.6审核人员必须认真核查异常结果。分析可疑结果原因,确定复检方案,督促复检。。’、。 5.7复检后仍有疑问,报告科主任。科主任组织复检。必要时科主任联系临床科室查寻异常原因,确认复检结果,发出报告。 5.8审核合格,审核人签名,发出报告。 5.9检验科报告的电子版由检测人员输入微机,签名贮存。其它人员不能改动。文字版由管理人员保管。 检验科自查报告 Prepared on 22 November 2020 篇一:检验科医疗安全自查 检验科“医疗安全隐患”自查报告书 在医院的领导重视下,针对当前某些医疗单位存在的不良医疗行为,全院进行了全面的自查自纠的工作检查。检验科对科内的管理、质量、安全、服务等方面进行了全面的自查自纠检查。经过三天的自查自纠,对照相关的医疗规章制度,发现了一些存在的隐患,制定了相关的措施。简要总结如下: 1、标本质量情况大部分标本合格,不合格标本有拒收记录及重抽处理。存在问题:与护理部及各区护理沟通不够充分,要更加全面和及时地反映抽血中存在的质量问题。措施:季度将相关的标本质量以表格的形式向护理部反映,以促进检验前质量的改进。 2、室内质量控制全部开展项目都能坚持每天进行室内质量控制,有记录,对失控点有分析,有处理。质量控制良好。 3、室间质量控制能按年度参加佛山市、广东省、卫生部的各类项目的室间质量。有记录及反馈分析,有质量负责人的严格控制。同类分析仪器有测定数值的定期比对,数据显示,不同分析仪器间测定结果在合理的可接受范围内。 4、危急值报告制度各实验室都能认真执行,有记录及处理。存在问题,发现1例假性危急值处理不当。措施:加强工作人员业务能力的学习及培训,不断提高其自身专业能力。对危急值的处理及报告进行规范及贯彻。要求人人过关。 5、对危险品、安全用电、火灾隐患进行清查。危险品进行上锁管理,有使用登记。未发现用电、电器使用安全隐患。未发现潜在的火灾隐患。消防器材合格并按要求存放。 6、服务能力能按时发报告,检验报告及时率达95%。服务满意度达90%。评分为时84分。服务水平和质量仍要不断提高。加强思想及职业道德教育,树立行业新风,创建文明服务窗口。 本次自查自纠检查,对提高我科检验质量有很大的促进作用,对保障医疗安全,消除医疗隐患有着积极的意义。 检验中心篇二:检验科自查表 检验科自查表 填报日期:年月日 篇三:医学检验科安全自查报告 一、行政安全方面: 1、全科室人员加强防火安全意识,熟悉应急事件处理流程,积极参加院组织的防火演练。 2、科室人员在行政安全方面积极做好防火、防盗工作。下班及时关好门窗,关闭电源,做好安全防护。 3、各室区域做好易燃易爆防范工作。 4、各办公区域无私人存放贵重物品及现金。 验证文件 2013年XX月 6.验证报告起草、审核与批准 6.1验证报告起草 6.2 再验证报告审核 6.3 再验证报告批准 目录 1. 验证概述 2. 验证目的 3. 验证范围 4. 再验证依据标准 5. 机构与职责 5.1 验证机构 5.2 验证职责 6. 验证方式 7. 验证准备 7.1 设备设施准备 7.2 仪器试剂准备 7.3 原辅物料准备 7.4 文件与培训 8. 验证时间与计划 9. 验证实施 9.1 产品的工艺流程图 9.2产品的工艺验证: 9.2.1称量备料 9.2.1.1目的 9.2.1.2文件 9.2.1.3检查项目及结果9.2.2 配制 9.2.2.1 目的 9.2.2.2 文件 9.2.2.3 评估项目 9.2.2.4 评估方法 9.2.2.5 取样方法 9.2.2.6配制试验数据 9.2.3 灌装封尾 9.2.3.1 目的 9.2.3.2文件 9.2.3.3评估项目 9.2.3.4评估方法 9.2.3.5灌装封尾检查数据9.2.4 成品抽样检验 9.2.4.1 目的 9.2.4.2 文件 9.2.4.3 评估项目 9.2.4.4 评估方法 9.2.4.5产品检验报告复印件 10. 偏差与处理. 11. 结果与分析 11.1 验证数据汇总 11.2 存在问题与措施 11.3 风险与预防 12. 验证结论 12.1 验证结论 12.2 验证评价与建议 13. 验证周期 14. 附件 15.参考或引用文件 1.概述: 复方醋酸地塞米松乳膏为我司生产多年的乳膏剂品种,自2009GMP再认证以来,乳膏剂生产线生产所用关键设备、生产工艺及工艺参数没有改变,为了验证在正常的生产条件和GMP文件管理体系下能生产出符合预定的规格及质量标准的产品,根据验证管理文件的要求,我们对复方醋酸地塞米松乳膏的生产工艺进行再验证。 2.目的: 在现行的GMP文件管理体系下,生产三批复方醋酸地塞米松乳膏进行工艺再验证: (1)确认关键工序质量监控点是否符合质量要求; (2)确认该产品质量是否符合预定成品的标准。 3.验证范围: 本次验证对复方醋酸地塞米松乳膏,依据工艺规程的各项参数设定指标,并认真按方案组织了实施,仅验证该品种工艺参数设定的科学性符合性。 4.再验证的依据与标准: 《药品生产质量管理规范》(2010版)、《复方醋酸地塞米松乳膏生产工艺规程》、《复方醋酸地塞米松乳膏中间产品内控质量标准》、《复方醋酸地塞米松乳膏成品内控质量标准》。 5 .机构与职责: 1.机构:在公司验证委员会的指导下,成立验证小组负责工艺验证的具体工作。验证小组的成员包括车间和生产部人员,QA和QC人员,工程设备人员、注册部人员。 2.职责:参与人员的职责 XX院医疗质量检查情况记录单 检查日期:_________________________ 检查科室:临床(门诊、病房) 检查内容: 临床:门诊病历、处方、门诊登记、病案质量、医生交接班记录、 抢救记录、核心制度、各种记录本、医疗安全(投诉、医疗争议、医疗事故)。其他__________________ 。 检查中存在问题: 1. 2. 3. 4. 5. 被查科室签名:______________ 检查人签名:_______________ XX卫生院 XX卫生院医疗质量检查情况记录单 检查日期:__________________ 检查科室:护理_____________ 检查内容: 病案质量、护士长日志、各种护理文书、交接班本、差错事故登记本、入院宣教记录、业务学习记录、医疗安全(投诉、医疗争议、医疗事故)、核心制度、其他_________________ 。 检查中存在问题: 1. 2. 3. 4. 5. 被查科室签名:______________ 检查人签名:________________ XX中心卫生院 XX卫生院医疗质量检查情况记录单 检查日期:_________________________________________ 检查科室:特检科(放射科、B超室、心电图室) 检查内容: 科主任台帐、检查登记本、报告审签制度、仪器维护记录、诊断报告 符合率、急诊备班实行24小时负责制、核心制度、医疗安全(投诉、医疗争议、医疗事故)、其他_____________ 。 检查中存在问题: 3. 4. 5. 被查科室签名:______________ 检查人签名:________________ XX中心卫生院 XX卫生院医疗质量检查情况记录单 检查日期:____________________ 检查科室:检验科_________ 检查内容: 科主任台帐、随访登记、室内质控、报告准确性、急诊报告及时性、标本管理、核心制度、医疗安全(投诉、医疗争议、医疗事故)、其他 检查中存在问题: 1. 2. 3. 4. 5. 被查科室签名:______________ 检查人签名:_______________ XX中心卫生院 检验科报告审核制度 1.目的 对检验报告的格式、内容、编制、审核、签发及修改等全过程实施质量控制,确保向患者提供准确、可靠、有效的检验报告。 2.范围 适用于检验科出具的各科检验报告。 3.检验报告内容 检验报告至少应包括下列信息。 3.1医院名称与报告标题。 3.2被检者姓名、性别、年龄、门诊/病室、床号、病历号。3.3送检样品号(唯一识别号),送检日期、时间,送检医师,样品性质,对不符合要求样品的状态描述。 3.4检验项目名称(英文缩写名、中文名),检验结果、结果单位、参考值。 3.5报告日期、时间,报告人,审核人。. 3.6仅对被检样品所检项目负责的声明。 4.检验报告的格式, 4.1检验科主任设计各类检验报告格式。 4.2根据各专业技术特点编制检验报告。 各类检验报告需满足第3条要求。 5.检验报告的审核、签发和存档 5.1检测人员必须根据室内质量控制数据确认所检项目结果受控。 5.2检测人员必须认真核对检验样品与检验报告一一对应的唯一性。 5-3检测人员必须认真核查异常结果,判断其技术误差的可接受性。有疑问时进行复检。复检包括:核查样品性状是否符合要求,样品与样品号是否对应,重作检测。复检后仍有疑问需报告审核人处理。 5.4检测人员核查后在报告人栏签名。 5.5审核人必须核查整批检验结果的质控数据,判断是否在控及误差的可接受性。 5.6审核人员必须认真核查异常结果。分析可疑结果原因,确定复检方案,督促复检。。’、。 5.7复检后仍有疑问,报告科主任。科主任组织复检。必要时科主任联系临床科室查寻异常原因,确认复检结果,发出报告。 5.8审核合格,审核人签名,发出报告。 5.9检验科报告的电子版由检测人员输入微机,签名贮存。其它人员不能改动。文字版由管理人员保管。 6.检验报告的更改 已签发的检验报告需要作补充或修改时,根据不同情况采用不同方式。 6.1对不影响原有检测结果的补充,由报告人、审核人签发新报告,收回原报告归档备查。 怎样看体检检验报告单 当你拿到检验报告单,在单子上都写有一个“参考值”。那么这个“参考值”到底意味着什么?检验结果一旦超过了“参考值”就等于健康出现问题了吗?“参考值”顾名思义就是一个用于参考、指导判断的数值,它实际上是正常人群中绝大多数人的平均数值,参考值只是一个统计学上的概念。举例说,像心跳,一个人的心跳每分钟60~100次是参考值范围,如果你体检时心跳是50次,就是不正常了,这就不对了,因为绝大多数人的心跳是每分钟60~100次,但少数人可以不在这个范围;还有血常规中的白细胞总数,参考值是4.0~10.0,意思就是说正常人群中绝大多数人每单位(×109/l)的白细胞总数是在4.0~10.0之间。少数人可以不在这个范围。不过,他们的检验结果数值虽然不在参考值的范围内,但却不代表他们的健康有异常。 化验结果是判断疾病的一方面 化验结果低于或高于“参考值”不一定是病理状态或患了某种疾病。化验结果也受很多因素的影响,不能单凭参考值就判断有没有疾病。比如你剧烈活动、发热、受寒或精神紧张会在尿中出现蛋白,并且大于蛋白尿的参考范围上限150毫克/24小时,但这种尿蛋白的出现是人体的正常现象,被称为生理性蛋白尿。如葡萄糖,就是血糖,参考范围是:3.89~6.11,稍高或者低一点没有关系,身体自身很快就会调节回来,如果葡萄糖偏低,食物吃下去,血糖很快就上来了;如果血糖偏高点,你少吃一点,血糖就降下来了。但如果葡萄糖低于2.00,出现了心跳很快,出大汗,甚至神志不清,这就是低血糖,如果低血糖反复发作,就要查一下胰腺有没有肿瘤。如果葡萄糖超过了7.00,那就是患有糖尿病了。 ,一个病人有了化验结果,再结合症状、体征、其他辅助检查等综合分析,最终才会得出患有什么疾病的正确判断。因此,人们在拿到化验单时即使看到自己的检查结果不在“参考值”范围内也不必太紧张,而应请教医生,对自己的情况作出客观的评估。 化验单要看关键项目 拿到化验单,很多人会被名目繁多的项目搞糊涂,到底该看哪一项才好?指出,化验单上有许多项目确实非常专业,其作用是帮助医生判断病人的病情,或者查找病因。至于普通人,很难也没必要把化验单完全看懂,拿到化验单后只要学会看最关键的项目就能掌握最重要的信息了。例如血常规化验单,人们关键要看的数值有四项:白细胞总数、红细胞总数、血红蛋白和血小板。这四个项目其中一项出现异常都应该引起重视。如以发热为例,医生会让病人做个血常规检查,目的就是为了分辨病人的发热是由细菌感染引起还是由病毒感染所引起的。如果患者的白细胞高于参考值上限,表示可能是细菌性感染;但如果是低于参考值下限,则可能是病毒性感染。 而对于尿常规的化验单,关键要看尿糖、尿蛋白、尿白细胞、镜检红细胞四项,这四项其中一项异常都有患病的可能,应该尽快请教医生或复查或进一步检查。 提醒,血常规(白细胞总数、红细胞总数、血红蛋白和血小板),尿常规(尿糖、尿蛋白、尿白细胞、镜检红细胞),这几项主要指标非常重要,而其他一些次要指标正常的情况下出现高或低,不在参考值范围内,不能说明有疾病;而当主要指标出现不正常时,这些次要指标全部发挥作用,可作为判断你有可能得什么疾病的重要依据。 除血常规、尿常规检查外,其他如血生化、乙肝两对半和血糖等体检指标每项都非常重要,任何一项异常都预示着健康出现了问题,不能掉以轻心,应主动去医院随访;体检医院的医师有责任和义务对此作出详细的解释。 主要指标不正常很可能有疾病 如果在体检中发现一些主要指标不正常,表明有疾病。 如血常规检查,*白细胞:高,很可能是细菌感染;如果白细胞超过5万、6万,并且形态有异常,就有可能是患了白血病;低于2000或以下,说明抵抗力低,经常容易伤风感冒,罗氏性能验证报告模板
检验报告样本型式检验报告
检验报告单审核制度
检验科自查报告
工艺验证报告模板
医院医疗质量检查情况记录单
检验科报告审核制度11567
体检化验报告单
