高三化学·方程式默写及答案
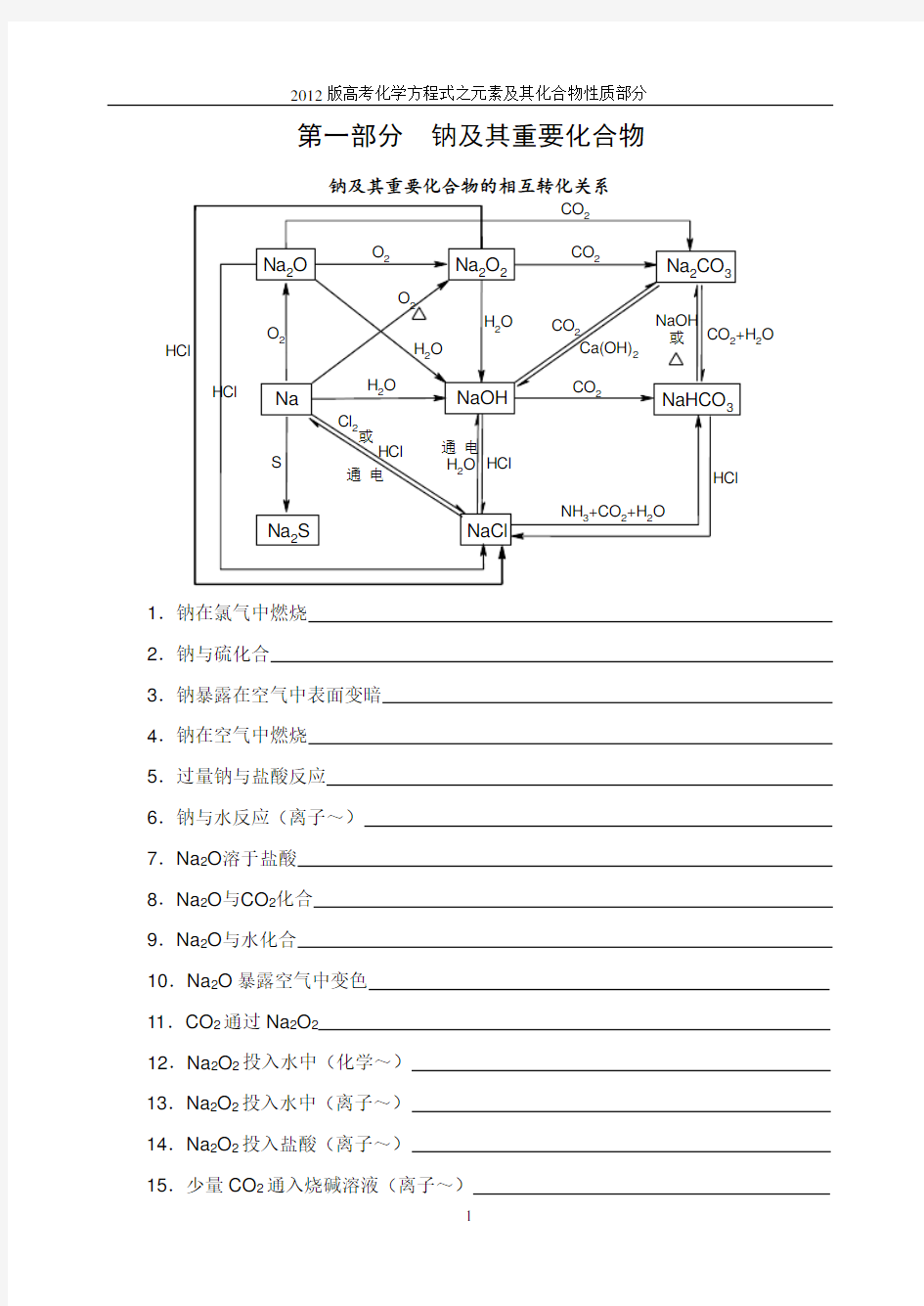

第一部分 钠及其重要化合物
钠及其重要化合物的相互转化关系
2O Cl H
1.钠在氯气中燃烧
2.钠与硫化合
3.钠暴露在空气中表面变暗
4.钠在空气中燃烧
5.过量钠与盐酸反应
6.钠与水反应(离子~)
7.Na 2O 溶于盐酸
8.Na 2O 与CO 2化合
9.Na 2O 与水化合
10.Na 2O 暴露空气中变色
11.CO 2通过Na 2O 2
12.Na 2O 2投入水中(化学~)
13.Na 2O 2投入水中(离子~)
14.Na 2O 2投入盐酸(离子~)
15.少量CO 2通入烧碱溶液(离子~)
16.少量烧碱溶液吸收CO2(离子~)
17.足量CO2通入饱和Na2CO3溶液中(离子~)
18.小苏打受热分解
19.小苏打溶液与烧碱溶液混合(离子~)
20.小苏打溶液与盐酸溶液混合(离子~)
21.往盐酸溶液中逐滴加入纯碱溶液(离子~)
22.往纯碱溶液中逐滴加入盐酸(离子~)
23.电解饱和食盐水(化学~)
24.电解饱和食盐水(离子~)
25.电解熔融氯化钠
26.饱和食盐水中先通NH3再通CO2
27.石灰纯碱法制备烧碱
28.NaHSO4与NaHCO3溶液反应(离子~)
29.Na投入CuSO4溶液(离子~)
30.Na2O2投入足量硫酸酸化的KMnO4溶液
31.Na218O2与水反应
32.SO2通过Na2O2
33.Ba(OH)2溶液与少量NaHCO3溶液混合(离子~)
34.标况下6.72LCO2通入400mL1 mol·L-1烧碱溶液(离子~)35.等物质的量的FeSO4溶液与Na2O2充分反应(离子~)36.将Na2O2投入Na2S溶液(离子~)
37.NaHSO4溶液与少量Ba(OH)2溶液混合
第二部分钙、镁及其重要化合物
镁及其重要化合物相互关系
2 233
)
2 N
2
O
H
Na
2
CO
3
通
钙及其重要化合物相互关系
Ca
N
2
4
通
1.镁在空气中燃烧
2.Mg3N2与水反应
3.Mg3N2溶于硝酸
4.镁粉使溴水褪色
5.镁与水反应
6.MgO与水反应
7.MgO溶于盐酸(离子~)
8.MgO与CO2混合加热
9.Mg(OH)2溶于盐酸(离子~)
10.Mg(OH)2受热分解
11.从海水中提取镁制备金属镁所有反应的方程式(如果是离子反应写离子方程式)
12.加热MgCO3浊液
13.过量CO2通入MgCO3浊液
14.高温煅烧Ca(HCO3)2固体
15.Mg(HCO3)2溶液与过量烧碱溶液混合(离子~)
16.CO2通入澄清石灰水直至过量
17.过量CO2通入石灰水(离子~)
18.石灰石溶于醋酸(离子~)
19.饱和CaCl2溶液中滴加足量浓烧碱溶液(离子~)
20.煅烧石灰石
21.工业上用石灰石、纯碱、石英制玻璃的主要反应
22.Cl2通入石灰浊液制备漂白粉
23.工业上用石灰石吸收有毒SO2得到石膏
第三部分 铝及其重要化合物
铝及其重要化合物相互关系
KAl(SO 4)2O H 2O H 212.
1.Al 溶于盐酸(离子~)
2.Al 溶于烧碱溶液(离子~)
3.Al 高温下与Fe 3O 4反应
4.工业电解熔融Al 2O 3制备Al
5.Al 2O 3溶于盐酸(离子~)
6.Al 2O 3溶于烧碱溶液(离子~)
7.AlCl 3溶液与过量氨水混合(离子~)
8.往AlCl 3溶液滴加烧碱溶液直至过量(离子~)
9.AlCl 3溶液与过量烧碱溶液混合(离子~)
10.往NaAlO 2溶液通入过量CO 2(离子~)
11.往NaAlO 2溶液滴加盐酸溶液直至过量(离子~)
12.NaAlO 2溶液与过量盐酸溶液混合(离子~)
13.Al(OH)3受热分解
14.明矾溶于水形成净水剂(离子~)
15.AlCl3溶液与NaAlO2溶液混合(离子~)
16.泡沫灭火器工作原理[Al2(SO4)3与小苏打溶液混合](离子~)17.NH4Cl溶液与NaAlO2溶液混合(离子~)
18.Al4C3与适量水混合
19.Al(OH)3的电离
20.往明矾溶液中滴加Ba(OH)2溶液至Al3+完全沉淀(离子~)21.往明矾溶液中滴加Ba(OH)2溶液至SO42-完全沉淀(离子~)22.Ba(AlO2)2溶液与少量硫酸反应(离子方程式)
23.在硫酸铝铵溶液中加入少量Ba(OH)2溶液反应
24.在硫酸铝铵溶液中加入过量Ba(OH)2溶液反应
第四部分铁及其重要化合物铁及其重要化合物相互关系
O
34
-
2+
3
Na
2
FeO
4
O
2
胶体
杀菌
消 毒
1.Fe溶于盐酸(离子~)
2.Fe棒浸入CuSO4溶液(离子~)
3.Fe粉、S粉混合加热
4.Fe在氯气中燃烧
5.Fe在氧气中燃烧
6.Fe溶于过量稀HNO3
7.过量Fe与稀HNO3作用
8.Fe粉高温下与水蒸气反应
9.FeCl2溶液中滴入氯水(离子~)
10.FeSO4溶液中滴入溴水(离子~)
11.酸性FeSO4溶液中滴入双氧水(离子~)
12.酸性FeSO4溶液暴露在空气中(离子~)
13.酸性FeSO4溶液使酸性KMnO4溶液褪色(离子~)
14.H2S气体通入FeCl3溶液(离子~)
15.FeCl3溶液与KI溶液混合(离子~)
16.SO2气体通入FeCl3溶液(离子~)
17.Fe溶于FeCl3溶液(离子~)
18.Cu溶于FeCl3溶液(离子~)
19.1~2mL饱和FeCl3溶液滴入20mL沸水(离子~)
20.无水FeCl3暴露空气中产生棕色烟雾
21.Cl2通入NaOH、Fe(OH)3混合物中制得高铁酸钠
22.FeCl3溶液与NaHCO3溶液混合(离子~)
23.FeCl3溶液与NaAlO2溶液混合(离子~)
24.往FeCl3溶液中滴入KSCN溶液(离子~)
25.Fe(OH)2浊液露置空气中变色
26.工业炼铁原理(铁矿石以Fe2O3为例)
27.等物质的量的FeSO4溶液与Na2O2充分反应(离子~)
28.Fe(OH)3溶于氢碘酸(离子~)
29.少量氯气通入FeBr2溶液中(离子~)
30.过量氯气通入FeI2溶液中(离子~)
31.氯气通入FeBr2溶液将其中2/3的Br-氧化(离子~)
32.请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个配平的化学方程式。
O
2
第五部分 铜及其重要化合物
铜及其重要化合物相互关系
2O 3)4
2+
1.Cu 溶于稀硝酸
2.Cu 溶于浓硝酸
3.用灼热的铜除去氧气
4.Cu 在硫蒸气中燃烧
5.Cu 在氯气中燃烧
6.Cu 溶于浓硫酸
7.H 2还原CuO
8.CuO 氧化乙醇
9.CuO 溶于硝酸(离子~)
10.Cu(OH)2溶于醋酸(离子~)
11.新制Cu(OH)2氧化乙醛
12.碱式碳酸铜受热分解
13.H 2S 通入CuSO 4溶液(离子~)
14.CuSO 4溶液与Ba(OH)2溶液混合(离子~)
15.电解CuSO 4溶液(离子~)
16.CuSO 4溶液中加入过量氨水(离子~)
17.加热条件下用氨还原CuO
18.Na 投入CuSO 4溶液(离子~)
19.Cu 2O 溶于酸性H 2O 2溶液(离子~)
20.Cu 溶于酸性双氧水
21.Cu 2S 溶于稀硝酸 22.对苯二甲醛与新制Cu(OH)2浊液反应
第六部分 碳、硅及其重要化合物
碳及其重要化合物
CaO
2
+NaOH 3)22CO 3Na 2CO NaHCO 3
2
22
2
O 2
CuO O H 2①
浓硫酸
③②①③ 硅及其重要化合物
2CaSiO 3Na 2SiO 3H 4SiO 4H 23
SiF 4SiCl 4H 2
2CO 3CaO Ca(OH)2CaCO 322H +2O ②①③①②
1.C 燃烧可能反应的方程式
2.C还原CuO可能的反应方程式
3.工业上用水与煤反应制备氢气
4.碳被浓硫酸氧化
5.碳在热的浓硝酸中燃烧
6.镁在CO2中燃烧
7.C与CO2化合
8.工业上用C还原SiO2制粗硅
9.工业上煅烧石灰石制生石灰
10.少量Ca(OH)2溶液与NaHCO3溶液混合(离子~)
11.Si粉在O2中灼烧
12.Si溶于氢氟酸
13.Si溶于强碱溶液(离子~)
14.SiO2溶于强碱溶液(离子~)
15.SiO2与CaO高温下化合
16.SiO2溶于氢氟酸
17.工业上用石英、石灰石、纯碱制玻璃
18.在水玻璃中通入过量CO2生成白色胶状沉淀
19.原硅酸失水最终变成SiO2
第七部分 氮及其重要化合物
氮及其重要化合物相互关系
NH 4
+
N 2O 4
3
3O
H 2NH Cl
NH 4HCO OH
-
Mg 3N 2
H 22
O 2
2-
2+
2-
2H 2
1.N 2与O 2反应 2.工业上合成氨 3.Mg 在N 2中燃烧 4.Mg 3N 2与少量水反应 5.Mg 3N 2与过量水反应
6.氨与水反应(离子~) 7.浓氨水与浓盐酸靠近产生白烟 8.工业上制硝酸的3个反应 9.实验室制取氨 10.碳铵受热分解 11.将生石灰加入浓氨水
12.NH 4Cl 溶液与烧碱溶液混合(离子~) 13.NH 4Cl 溶液与烧碱溶液混合加热(离子~) 14.NH 4Cl 浓溶液与烧碱浓溶液混合(离子~) 15.NO 2变成N 2O 4 16.硝酸见光或受热分解
17.灼热的C在浓硝酸中燃烧
18.铜与浓硝酸反应
19.铜与稀硝酸反应
20.过量铁与稀硝酸反应(假设还原产物为NO)(离子~)
21.银溶于稀硝酸(离子~)
22.Fe2+溶于稀硝酸(离子~)
23.SO2通入稀硝酸(离子~)
24.稀硝酸使KI淀粉试纸变蓝(离子~)
25.H2S气体通入稀硝酸(离子~)
26.NO、O2混合气体(体积比4∶3)溶于水
27.NO2、O2混合气体(体积比4∶1)溶于水
28.氨与氯气混合产生白烟
29.加热条件下用氨还原CuO
30.在催化剂条件下用氨清除有毒的NO
31.氨在纯氧中燃烧
32.请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个配平的化学方程式。
O
2 33.NO2与SO2混合
34.NH4HCO3溶液与足量热Ba(OH)2溶液反应(离子~)
35.在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合(离子~)
36.少量NH4HS固体与浓烧碱溶液混合(离子~)
37.SO2通入BaCl2和HNO3的混合溶液
第八部分硫及其重要化合物
硫及其重要化合物相互关系
3
2
Na
2
SO Na2
BaSO
4
2
SO
2
SO
3
232222223
KMnO
4
/H
Fe Ca(ClO)2
SO
3
H
2
SO
4
SO
4
2-
2
等
1.S的燃烧
2.S与H2化合
3.用硫粉处理洒落地面的液态汞
4.铁粉与硫粉混合加热
5.铜丝在硫蒸气中燃烧
6.H2S的不完全燃烧
7.H2S的完全燃烧
8.H2S通入CuSO4溶液(离子~,此反应可用于H2S的检验与吸收)
9.实验室用FeS溶于稀硫酸或稀盐酸制备H2S气体(离子~)
10.工业上制硫酸的3个反应
11.实验室用Na2SO3粉末与浓硫酸制备SO2
12.SO2溶于过量烧碱(离子~)
13.SO2溶于水
14.SO2与CaO化合
15.Na2SO3溶液(或亚硫酸)暴露空气中变质(离子~)
16.少量Mg在SO2中燃烧
17.过量Mg在SO2中燃烧
18.SO2使氯水褪色(离子~)
19.SO2与H2O2反应
20.SO2使酸性KMnO4溶液褪色(离子~)
21.SO2与H2S混合
22.工业上用氨水吸收SO2防止污染空气
23.工业上用石灰石吸收SO2防止污染空气(生成石膏)
24.灼热的C与浓硫酸反应
25.铜与浓硫酸反应
26.Na2S2O3溶液与稀硫酸混合
27.SO2通过Na2O2
28.将Na2O2投入Na2S溶液(离子~)
29.Cu2O溶于酸性H2O2溶液(离子~)
30.Cu溶于酸性双氧水
31.NO2与SO2混合
32.O3与SO2混合
33.O3使湿润的淀粉KI试纸变蓝(离子~)
34.S溶于热的烧碱溶液
35.SO2通入BaCl2和HNO3的混合溶液
第九部分氯及其重要化合物氯及其重要化合物相互关系
FeCl
CuCl
NaClO
2
Fe
光照
化
1.H2在Cl2中燃烧
2.Na在Cl2中燃烧
3.Cu在Cl2中燃烧
4.Fe在Cl2中燃烧
5.Cl2与水的反应(化学~)
6.Cl2与水的反应(离子~)
7.Cl2通入烧碱溶液(离子~)
8.工业上用Cl2与石灰浊液制漂白粉
9.Cl2水滴入氢硫酸(离子~)
10.Cl2水滴入亚硫酸(离子~)
11.Cl2水滴入亚硫酸钠溶液(离子~)
12.Cl2水滴入NaBr溶液(离子~)
13.Cl2水使KI淀粉试纸变蓝(离子~)
14.Cl2水滴入FeSO4溶液(离子~)
15.MnO2氧化浓盐酸
16.过量CO2通入漂白粉溶液(离子~)
17.HClO见光分解
18.AgX(X为Cl、Br或I)见光分解
19.AgCl浊液中滴入NaBr溶液
20.AgBr浊液中滴入NaI溶液(离子~)
21.AgNO3溶液中滴入氨水直至沉淀恰好溶解(离子~)
22.氨与氯气混合产生白烟
23.Fe(OH)3溶于氢碘酸(离子~)
24.少量氯气通入FeBr2溶液中(离子~)
25.过量氯气通入FeI2溶液中(离子~)
26.甲苯与氯气混合光照
27.氯气通入FeBr2溶液将其中2/3的Br-氧化(离子~)
28.Cl2与热、浓KOH反应(产物之一可用于实验室制O2)29.KMnO4常温下可将盐酸氧化成氯气(离子~)
第一部分钠及其重要化合物答案
Al(OH)
O3Al
第五部分铜及其重要化合物答案
高中金属化学方程式-默写
一、金属钠及其化合物的方程式 1、铁与水蒸气反应: 2、常温下铝被氧气氧化: 3、钠在氯气中燃烧: 4、钠和水反应:离子方程式: 5、钠和盐酸反应:离子方程式: 6、钠投入到硫酸铜溶液: 离子方程式: 7、氧化钠和水反应: 8、过氧化钠和水反应: 9、氧化钠和CO2反应: 10、过氧化钠和CO2反应: 11、氧化钠和盐酸反应: 12、Na2O2和盐酸反应: 13、沉淀法鉴别碳酸钠和碳酸氢钠原理: 离子方程式: 14、加热法鉴别固体Na2CO3、NaHCO3原理: 15、碳酸钠溶液和足量盐酸反应: 离子方程式: 16、碳酸氢钠和盐酸反应: 离子方程式: 17、碳酸钠溶液和氢氧化钙溶液反应: 离子方程式: 18、碳酸氢钠溶液和足量氢氧化钙溶液反应: 离子方程式: 19、碳酸氢钠溶液和少量氢氧化钙溶液反应: 离子方程式: 二、金属铝及其化合物的方程式 1、铝和盐酸反应: 离子方程式: 2、铝和NaOH溶液反应: 离子方程式: 3、氧化铝和盐酸反应: 4、氧化铝和氢氧化钠反应: 5、氢氧化铝和盐酸反应: 6、氢氧化铝和氢氧化钠反应: 7、氢氧化铝的制备:
离子方程式: 8、明矾净水原理: 9、向氯化铝溶液中滴加氢氧化钠溶液至过量: △10、向氢氧化钠溶液中滴加氯化铝溶液至过量: 11、向偏铝酸钠溶液中滴加盐酸至过量: △12、向盐酸中滴加偏铝酸钠溶液至过量: 三、金属铁及其化合物的相互转化 1、铁和水蒸气高温下反应: 铁在纯氧燃烧: 铁在氯气中燃烧: 铁和硫粉共热: 2、铁和盐酸反应:离子方程式: 铁和氯化铜反应:离子方程式: 3、氧化亚铁和盐酸反应: 离子方程式: 4、氧化铁和盐酸反应: 离子方程式: 5、氯化亚铁和氢氧化钠反应: 离子方程式: 6、氢氧化亚铁和盐酸反应: 离子方程式: 7、氯化铁和氢氧化钠反应: 离子方程式: 8、氢氧化铁和盐酸反应: 离子方程式: 9、氯化亚铁和氯气反应: 离子方程式: 10、铁和氯化铁反应:离子方程式: 铜和氯化铁反应: 离子方程式: 11、氢氧化铁受热分解: 12、白色沉淀,然后迅速变为灰绿色,最后变为红褐色(氢氧化亚铁与氧气反应转化为氢氧化铁):
最新化学式大全 默写答案
写出化学式
写出物质的学名、俗名 写出物质的颜色和状态 1、白色固体:MgO、P2O5、CaO、NaOH、Ca(OH) 2、KClO 3、KCl、Na2CO3、NaCl、无水CuSO4; 2、绿色固体:碱式碳酸铜Cu2(OH)2CO3 3、蓝色固体:氢氧化铜硫酸铜晶体 4、紫黑色固体:高锰酸钾 5、淡黄色固体:硫 6、无色固体:冰干冰金刚石 7、银白色固体:银铁镁铝汞等金属 9、红褐色固体:氢氧化铁 10、铁、镁为银白色(汞为银白色液态)
11、黑色固体:石墨、炭粉、铁粉、CuO、MnO2、Fe3O43、红色固体:Cu、Fe2O3、 HgO、红磷 溶液的颜色:凡含Cu2+的溶液呈蓝色;凡含Fe2+的溶液呈浅绿色;凡含Fe3+的溶液呈棕黄色,其余溶液一般不无色。(高锰酸钾溶液为紫红色) 11、无色液体:水,双氧水 12、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液 13、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液 14、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液 15、紫红色溶液:高锰酸钾溶液 16、紫色溶液:石蕊溶液 沉淀(即不溶于水的盐和碱):①盐:白色↓:CaCO3、BaCO3(溶于酸)AgCl、 (也不溶于稀HNO3) 等②碱:蓝色↓:Cu(OH)2红褐色↓:Fe(OH)3白色↓:BaSO4 其余碱。 6、(1)具有刺激性气体的气体:NH3、SO2、HCl(皆为无色) (2)无色无味的气体:O2、H2、N2、CO2、CH4、CO(剧毒) ▲注意:具有刺激性气味的液体:盐酸、硝酸、醋酸。酒精为有特殊气体的液体。 7、有毒的,气体:CO 液体:CH3OH 固体:NaNO2 CuSO4(可作杀菌剂,与熟石 灰混合配成天蓝色的粘稠状物质——波尔多液) (三)、气体的颜色 17、红棕色气体:二氧化氮 18、黄绿色气体:氯气 19、无色气体:氧气氮气氢气二氧化碳一氧化碳二氧化硫氯化氢气体等大 多数气体。 写出化学方程式 一、化合反应 1、镁在空气中燃烧:2Mg+ O2点燃2MgO 2、铁在氧气中燃烧:3Fe +2O2点燃Fe3O4 3、铝在空气中燃烧:4Al+ 3O2点燃2Al2O3 4、氢气在空气中燃烧:2H2 +O2点燃2H2O 5、红磷在空气中燃烧:4P +5O2点燃2P2O5 6、硫粉在空气中燃烧:S+ O2点燃2 7、碳在氧气中充分燃烧:C +O点燃CO2 8、碳在氧气中不充分燃烧:2点燃2CO 9、二氧化碳通过灼热碳层:2高温2CO 10、一氧化碳在氧气中燃烧:2CO +O点燃2CO2 11:CO2 +H2O === H2CO3
八年级常见化学式和化学方程式
初中常见化学式和化学方程式 第一部分八年级内容一、常见单质 二、化合物 1、氧化物 2、其他化合物
3、常见有机化合物 三、常见反应的化学方程式 1. 镁在空气中燃烧:2Mg + O2 点燃2MgO 2. 铁在氧气中燃烧:3Fe + 2O点燃Fe3O4 3. 氢气中空气中燃烧:2H2 + O2 点燃2H2 O 4. 红磷在空气中燃烧:4P + 5O点燃2P2 O5 5. 硫粉在空气中燃烧:S + O点燃SO2 6. 碳在氧气中充分燃烧:C + O2 点燃CO2 7. 碳在氧气中不充分燃烧:2C + O点燃2CO 8. 一氧化碳在氧气中燃烧:2CO + O2 点燃2CO2 9. 甲烷在空气中燃烧:CH4 + 2O点燃CO2 +2H2 O 10. 酒精在空气中燃烧:C2 H5OH + 3O点燃2CO2 +3H2 O
11. 水在直流电的作用下分解:2H2 O 通电2H2 ↑+ O2 ↑ 12. 过氧化氢的分解:2H2O2MnO22H2O+O 2↑ 13. 加热氯酸钾(有少量的二氧化锰):2KClO3△2KCl + 3O2 ↑ 14. 加热高锰酸钾:2KMnO△K2 MnO4 + MnO2 + O2 ↑ 15. 碳酸不稳定而分解:H2 CO3H2 O + CO2↑;H2 CO3△H2 O + CO2↑ 16. 高温煅烧石灰石(工业制CO2):CaCO3高温CaO + CO2 ↑ 17. 氢气还原氧化铜:H2 + CuO△Cu + H2 O 18. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2 ↑ 19. 焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑ 20. 焦炭还原四氧化三铁:2C+ Fe3O高温3Fe + 2CO2↑ 21. 一氧化碳还原氧化铜:CO+ CuO △Cu + CO2 22. 一氧化碳还原氧化铁:3CO+ Fe2 O3高温2Fe + 3CO2 23. 一氧化碳还原四氧化三铁:4CO+ Fe3O高温3Fe + 4CO2 24. 锌和稀盐酸(实验室制氢气):Zn + 2HCl === ZnCl2 + H2 ↑ 25. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu 26.检验CO2 :Ca(OH) 2 + CO2 ==== CaCO 3↓+ H2 O 27.大理石(或石灰石)与稀盐酸反应(实验室制CO2): CaCO 3+ 2HCl === CaCl2 + H2 O + CO2↑ 28.氢氧化钠与硫酸铜:2NaOH + CuSO4==== Cu(OH) 2↓+ Na2 SO4
常见的化学式和化学方程式
常见物质的化学式 单质 化合物 氧化物 酸 碱
有机物 其他:氨气NH3 常见物质的俗名
常见的化学方程式 说明:用楷体标示的内容不是重点。 化合反应 ●红磷在空气中燃烧,产生白烟:4P+5O22P2O5 白磷自燃:4P+5O2=2P2O5 ●木炭充分燃烧:C+O2CO2 ●木炭不充分燃烧:2C+O22CO ●硫在空气(氧气)中燃烧:S+O2SO2 ●铁丝在氧气中燃烧:3Fe+2O2Fe3O4 ●铝在氧气中燃烧:4Al+3O22Al2O3 铝不易生锈的原因:4Al+3O2=2Al2O3 ●镁在空气中燃烧:2Mg+O22MgO ●铜在空气中加热:2Cu+O22CuO ●氢气在氧气中燃烧:2H2+O22H2O ●将CO2变成CO:C+CO22CO ●二氧化碳溶于水形成碳酸:CO2+H2O=H2CO3 ●用生石灰制取熟石灰:CaO+H2O=Ca(OH)2 ●一氧化碳燃烧:2CO+O22CO2 ●向澄清的石灰水中通入过量的二氧化碳,变浑浊的石灰水又变澄清: CaCO3+CO2+H2O=Ca(HCO3)2 ●氢气在氯气中燃烧:H2+Cl22HCl 钠在氯气中燃烧:2Na+Cl22NaCl 镁在氮气中燃烧:3Mg+N2Mg3N2(注意氮元素的化合价) 上面三个化学方程式给我们的启示是:燃烧不一定有氧气参与。 分解反应 ●汞在空气中加热:2Hg+O22HgO ●氧化汞加强热:2HgO2Hg+O2↑ ●分解过氧化氢制取氧气(实验室制取氧气的反应原理之一):2H2O22H2O+O2↑ 加热高锰酸钾制取氧气(实验室制取氧气的反应原理之一):2KMnO4K2MnO4+MnO2+O2↑ 加热氯酸钾制取氧气(实验室制取氧气的反应原理之一):2KClO32KCl+3O2↑ 分解过氧化氢制取氧气符合绿色化学的观念,是三种方案中最安全、最节约资源的一种。 ●电解水生成氢气和氧气:2H2O2H2↑+O2↑ ●工业制取生石灰和CO2的反应原理:CaCO3CaO+CO2↑ ●干粉灭火器的反应原理(碳酸氢钠受热分解):2NaHCO3Na2CO3+H2O+CO2↑ ●碱式碳酸铜受热分解:Cu2(OH)2CO32CuO+H2O+CO2↑ ●过氧化氢溶液不稳定,发生分解:2H2O2=2H2O+O2↑ ●碳酸不稳定,分解成水和二氧化碳:H2CO3=H2O+CO2↑ ●碳铵(碳酸氢铵)“消失”并发出刺激性气味:NH4HCO3=NH3↑+CO2↑+H2O
高中重要化学方程式(或离子方程式)默写
高中重要化学方程式(或离子方程式)默写1.钠在空气中被氧化 2.钠在氧气中燃烧 3.钠与硫研磨爆炸 4.钠与硫酸铜溶液反应 5.钠与乙醇反应 6.工业制钠 7.过氧化钠与水反应 8.过氧化钠与二氧化碳反应 9.过氧化钠与二氧化硫反应 10.过氧化钠与氯化亚铁溶液反应 11.向氢硫酸中加入过氧化钠固体 12.碳酸氢钠受热分解 13.碳酸氢钠与强碱反应 14.碳酸氢钠与强酸反应 15.碳酸氢钠与少量石灰水反应 16.石灰水与少量碳酸氢钠溶液反应 17.向碳酸钠溶液中通入二氧化碳气体 18.向碳酸钠溶液中加入少量盐酸 19.向盐酸中加入少量碳酸钠溶液 20.向碳酸氢钙溶液中加入少量氢氧化钠溶液 21.向碳酸氢钙溶液中加入足量氢氧化钠溶液
22.电解饱和食盐水 23.锂在空气中燃烧 24.向硫代硫酸钠溶液中加入稀盐酸 25.镁在氮气中燃烧 26.镁在二氧化碳中燃烧 27.镁与沸水反应 28.氮化镁与水反应 29.工业制镁 30.向碳酸氢镁溶液中加入少量氢氧化钠溶液 31.向碳酸氢镁溶液中加入足量氢氧化钠溶液 32.铝在氧气中燃烧 33.铝与氢氧化钠溶液反应 34.铝热反应 35.铝与硫蒸气反应 36.硫化铝与水反应 37.氧化铝与酸反应 38.氧化铝与强碱溶液反应 39.实验室制取氢氧化铝 40.向氯化铝溶液中加入少量氢氧化钠溶液 41.向氯化铝溶液中加入足量氢氧化钠溶液 42.向偏铝酸钠溶液中加入少量稀盐酸
43.向偏铝酸钠溶液中加入足量稀盐酸 44.向偏铝酸钠溶液中加入氯化铝溶液 45.向氢氧化铝沉淀中加入稀盐酸 46.向氢氧化铝沉淀中加入氢氧化钠溶液 47.向偏铝酸钠溶液中通入少量二氧化碳气体 48.向偏铝酸钠溶液中通入足量二氧化碳气体 49.氢氧化铝的电离 50.向明矾溶液中加入少量氢氧化钡溶↓ +2Al(OH)3↓ 51.向明矾溶液中加入足量氢氧化钡溶液 52.氢氧化铝受热分解 53.工业制铝 54.铁在氧气中燃烧 55.铁与硫单质反应 56.铁与碘单质反应 57.铁与液溴反应 58.铁与水蒸气反应 59.铁与氯气反应 60.铁与非氧化性酸反应 61.铁与热的浓硫酸反应 62.铁与过量的稀硝酸反应 63.大量的铁粉与少量的稀硝酸反应
常见化学式和化学方程式含答案
常见化学式和化学方程 式含答案 集团档案编码:[YTTR-YTPT28-YTNTL98-UYTYNN08]
常见化学式和化学方程式 化学式 1.单质: 非金属:氢气、氧气、臭氧、氮气、氯气、碳、硫、磷、碘 H 2、O 2 、O 3 、N 2 、Cl 2 、C、S、P、I 2 稀有气体:氦气、氖气、氩气:He、Ne、Ar 金属:钠、钾、镁、铝、钙、锌、铁、铜、金、银、汞、锰 Na、K、Mg、Al、Ca、Zn、Fe、Cu、AuAg、Hg、Mn 2.氧化物: 非金属氧化物:一氧化碳、二氧化碳、二氧化硫、三氧化硫、一氧化氮、 CO、CO 2、SO 2 、SO 3 、NO 二氧化氮、五氧化二氮、五氧化二磷、水、过氧化氢、二氧化硅 NO 2、N 2 O 5 、P 2 O 5 、H 2 O、H 2 O 2 、SiO 2 金属氧化物:氧化钠、氧化镁、氧化钙、氧化铜、氧化汞、二氧化锰、 Na 2O、MgO、CaO、CuO、HgO、MnO 2 氧化铝、氧化铁、氧化亚铁、四氧化三铁、氧化亚铜 Al 2O 3 、Fe 2 O 3 、FeO、Fe 3 O 4 、Cu 2 O 3.酸:盐酸、硝酸、硫酸、碳酸、醋酸 HCl、HNO 3、H 2 SO 4 、H 2 CO 3 、CH 3 COOH 4.氢氧化物:氢氧化钠、氢氧化钙、氢氧化镁、氢氧化铜、氢氧化铝、氢氧化铁 NaOH、Ca(OH) 2、Mg(OH) 2 、Cu(OH) 2 、Al(OH) 3 、Fe(OH) 3 5.氯化物:氯化钠、氯化镁、氯化钙、氯化铜、氯化锌、氯化铝、氯化铁、氯化亚铁 NaCl、MgCl 2、CaCl 2 、CuCl 2 、ZnCl 2 、AlCl 3 、FeCl 3 、FeCl 2 6.硝酸盐:硝酸钾、硝酸镁、硝酸钙、硝酸铜、硝酸银、硝酸铝、硝酸铁、硝酸汞 KNO 3、Mg(NO 3 ) 2 、Ca(NO 3 ) 2 、Cu(NO 3 ) 2 、AgNO 3 、Al(NO 3 ) 3 、Fe(NO 3 ) 3 、Hg(NO 3 ) 2 7.硫酸盐:硫酸钠、硫酸镁、硫酸钙、硫酸铜、硫酸锌、硫酸铝、硫酸铁、硫酸亚铁 Na 2SO 4 、MgSO 4 、CaSO 4 、CuSO 4 、ZnSO 4 、Al 2 (SO 4 ) 3 、Fe 2 (SO 4 ) 3 、FeSO 4 8.碳酸盐:碳酸钠、碳酸镁、碳酸钙、碳酸铜、碳酸锌、碳酸钡、碱式碳酸铜 Na 2CO 3 、MgCO 3 、CaCO 3 、CuCO 3 、ZnCO 3 、BaCO 3 、Cu 2 (OH) 2 CO 3 9.其它盐:氯酸钾、高锰酸钾、锰酸钾 KClO 3、KMnO 4 、K 2 MnO 4 10.有机物:甲烷、酒精、葡萄糖、蔗糖、淀粉 CH 4、C 2 H 5 OH、C 6 H 12 O 6 、C 12 H 22 O 11 、(C 6 H 10 O 5 ) n 11.氢化物:氨气、氯化氢、硫化氢 NH 3、HCl、H 2 S 化学方程式 一、氧气的性质(燃烧): 1.镁在空气中燃烧:2Mg+O 2 2MgO 2.铁在氧气中燃烧:3Fe+2O 2Fe 3 O 4
化学方程式默写
元素化合物部分有关化学(或离子)方程式 默写下列化学方程式: 1.Na在空气中缓慢氧化,Na在空气中最终变为白色粉末。 2.Na在空气中燃烧 3.潜水员呼吸面具中的反应: 4.Na2O2与水反应: 5.Al与Fe2O3反应:。 铝热反应 6.Al与Fe3O4反应:。 7.铁在Cl2中燃烧:,反应现象; 铁和I2共热:; 细铁丝在硫蒸气中燃烧:(黑色固体) 8.Fe在氧气中燃烧: 9.Fe与水蒸气在高温条件下反应 10.Fe2O3与CO反应:, (工业炼铁) Fe3O4与CO反应: 11.Fe(OH)2在空气中变质:, 反应现象: 12.光亮的铜丝在硫蒸气中燃烧:(黑色) 13.Cu在Cl2中燃烧:,反应现象:,14.湿法炼铜:Fe+CuSO4== ; 火法炼铜:Cu2S+2O2 15.过量的C和SiO2反应 16.SiO2和HF的反应: 17.NO和O2通入水中: 18.NO2和O2通入水中: 19.雷雨发庄稼三反应:;;。
20.氨的催化氧化: 21.工业合成氨的反应: 22.实验室制NH 3:(固+固→) (固+液→) 23.浓HNO 3见光(或受热)分解: 24.C 和浓HNO 3反应: 25.O 2和O 3的相互转化: (O 3是有特殊臭味的淡蓝色气体)。 26.制O 2:(1)固体加热法:2KClO 3 ;2KMnO 4 (2)固液反应: 2Na 2O 2+2H 2O ,2H 2O 2 27.Cu 和浓H 2SO 4共热: 。 28.木炭和浓H 2SO 4共热: 29.工业制H 2SO 4三反应: FeS 2+ O 2 , 2SO 2+O 2 , 。 30.H 2S 气体与SO 2反应: (SO 2通入H 2S 溶液中产生淡黄色沉淀) 31.H 2在Cl 2中燃烧: ,现象:苍白色的火焰,瓶口有白雾 。 32.工业制漂白粉反应: , 漂白粉的主要成分: ,有效成分: 。 33.漂白粉在空气中失效反应: ,2HClO===2HCl+ O 2↑ 。 34.实验室制Cl 2反应: 35.F 2通入水中: 默写下列离子方程式: 1.Cl 2与H 2O 反应: 2.Cl 2与NaOH 反应: 3.实验室制备Cl 2: 4.Cl 2与KI 反应: 5.AgI 悬浊液与K 2S 反应: 光照 催化剂 △
高中化学方程式默写(High school chemistry equation dictation)
高中化学方程式默写(High school chemistry equation dictation)Write the following reaction (the chemical formula is ion reaction to write ion equation) 1. sodium combustion in oxygen: 2. sodium and oxygen at room temperature reaction 3. sodium and water reaction 4. sodium and water reaction 6. reaction between sodium peroxide and water The reaction between sodium peroxide and 7. carbon dioxide 8. sodium carbonate and hydrochloric acid 9. sodium bicarbonate reacts with hydrochloric acid The reaction of 10. sodium bicarbonate and sodium hydroxide The thermal decomposition of 11. sodium bicarbonate 12. carbon dioxide into sodium carbonate solution 13. calcium carbonate with hydrochloric acid 14. sodium bicarbonate and excess calcium hydroxide A small amount of 15. sodium bicarbonate and calcium hydroxide
常见化学式及化学方程式大全
初中常见化学式及化学方程式 常见的化学式
初中化学方程式全(已配平). 一、化合反应 1、镁在空气中燃烧:2Mg+ O2点燃2MgO 2、铁在氧气中燃烧:3Fe +2O2点燃Fe3O4 3、铝在空气中燃烧:4Al+ 3O2点燃2Al2O3 4、氢气在空气中燃烧:2H2 +O2点燃2H2O 5、红磷在空气中燃烧:4P +5O2点燃2P2O5 6、硫粉在空气中燃烧:S+ O2点燃SO2 7、碳在氧气中充分燃烧:C +O2 点燃CO2 8、碳在氧气中不充分燃烧:2C +O2点燃2CO 9、二氧化碳通过灼热碳层:C +CO2高温2CO 10、一氧化碳在氧气中燃烧:2CO +O2 点燃2CO2 11、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 +H2O === H2CO3 12、生石灰溶于水:CaO+ H2O === Ca(OH)2 13、无水硫酸铜作干燥剂:CuSO4 +5H2O ==== CuSO4·5H2O 14、钠在氯气中燃烧:2Na+ Cl2点燃2NaCl 二、分解反应 15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O +O2↑ 16、加热高锰酸钾:2KMnO4 加热K2MnO4 + MnO2+O2↑
17、水在直流电的作用下分解:2H2O 通电2H2↑+O2↑ 18、碳酸化学物理学报不稳定而分解:H2CO3 === H2O +CO2↑ 19、高温煅烧石灰石(二氧化碳工业制法):CaCO3高温 CaO+ CO2↑ 三、置换反应 20、铁和硫酸铜溶液反应:Fe+ CuSO4 == FeSO4 +Cu 21、锌和稀硫酸反应(实验室制氢气):Zn+ H2SO4 == ZnSO4+ H2↑ 22、镁和稀盐酸反应:Mg +2HCl === MgCl2 +H2↑ 23、氢气还原氧化铜:H2 +CuO 加热Cu +H2O 24、木炭还原氧化铜:C+ 2CuO 高温2Cu +CO2↑ 25、甲烷在空气中燃烧:CH4 +2O2 点燃CO2+2H2O 26、水蒸气通过灼热碳层:H2O +C 高温H2 +CO 27、焦炭还原氧化铁:3C +2Fe2O3高温4Fe +3CO2↑ 其他 28、氢氧化钠溶液与硫酸铜溶液反应:2NaOH+ CuSO4 == Cu(OH)2↓+ Na2SO4 29、甲烷在空气中燃烧:CH4 +2O2点燃CO2 +2H2O 30、酒精在空气中燃烧:C2H5OH+ 3O2点燃2CO2 +3H2O 31、一氧化碳还原氧化铜:CO +CuO 加热Cu+ CO2 32、一氧化碳还原氧化铁:3CO+ Fe2O3高温2Fe+ 3CO2 33、二氧化碳通过澄清石灰水(检验二氧化碳):Ca(OH)2+ CO2 ==== CaCO3 ↓+ H2O
化学式与化学方程式7
曾鸿迪VIP一对一化学培优第7讲 书写化学方程式及配平方法 知识小清单 一、化学方程式的书写原则: 1、:即不能凭空臆造不存在的反应,也不能乱书写不存在的物质的化学式; 2、:即等号两边的各种原子的数目要相等。 二、化学方程式的书写步骤: 1、写:根据实验事实写出反应物和生成物的化学式,中间用短线连接; 2、注:注明反应条件; 3、配:配平化学方程式,在化学式前面添上适当的化学计量数,使各种元素的原子个数反应前后相等,从而体现质量守恒定律; 4、等:将短线(或箭头线)改为等号; 5、标:标明生成物的状态,有气体用“↑”,沉淀物用“↓”。注意:气体生成是指反应物中本身无气态物质,反应后产生了气体物质才使用,而沉淀是针对溶液中进行的反应,原来无固态物质,现在产生了固态物质才使用。 三、化学方程式配平方法 ①、最小公倍数法: (找出两边同种原子的个数最多的原子,然后求最小公倍数,得原子个数。) 1、 Al + O 2—— Al 2 O 3 2、Al + Fe 3 O 4 —— Fe + Al 2 O 3 3、 Fe + O 2—— Fe 3 O 4 4、Al + MnO 2 —— Mn + Al 2 O 3 5、 N 2 + H 2 —— NH 3 6、Al + H 2 SO 4 —— Al 2 (SO 4 ) 3 + H 2 ②、观察法: (观察顺序:从复杂入手,推导其它)(具体观察顺序——O、C、Fe) 1、 CO + Fe 2O 3 —— Fe + CO 2 2、 C + Fe 2 O 3 —— Fe + CO 2 3、 CO + Fe 3O 4 —— Fe + CO 2 4、 C + Fe 3 O 4 —— Fe + CO 2 5、 CO + FexOy —— Fe + CO 2 6、 C + FexOy—— Fe + CO 2 7、 H 2 + Fe 2 O 3 —— Fe + H 2 O 8、H 2 + Fe 3 O 4 —— Fe + H 2 O 9、 H 2 + Fe X O Y —— Fe + H2O 10、H 2 + WO 3 —— W + H 2 O 11、 CO + O 2 —— CO 2 12、Fe + H 2 O—— H 2 + Fe 3 O 4 13、 Al(OH) 3 + HCl ——AlCl 3 + H2O ③、奇数配偶法: (找出左右两边出现次数较多的元素,该元素的原子个数在两边为一基数一偶数) 1、 FeS 2 + O 2 —— Fe 2 O 3 + SO 2 2、 C 2 H 2 + O 2 ——CO 2 + H 2 O 3、 C + Fe 2 O 3 —— Fe + CO 2 4、 MnO 2 + HCl—— MnCl 2 + Cl 2 + H 2 O 5、 Cl 2 + Ca(OH) 2 —— CaCl 2 + Ca(ClO) 2 + H 2 O ④、归一法: (找出化学式中原子数目最多的化学式,使其化学计量数为“1”,观察配平,若是分数再进行通分 去掉分母,保证最后得到最简整数比) 1、 C 2 H 2 + O 2 ——CO 2 + H 2 O 2、C 6 H 6 + O 2 —— CO 2 + H 2 O 3、 C 22 H 46 + O 2 ——CO 2 + H 2 O 4、 NH 3 + Cl2 —— NH 4 Cl + N 2 5、 As 2 O 3 + Zn + HCl——AsH 3 + ZnCl 2 + H 2 O 6、C X H Y + O 2 ——CO 2 + H 2 O 易混淆清单 化学反应方程式中的“↑”和“↓”使用范围:气体生成是指反应物中本身无气态物质,反应后 产生了气体物质才使用,而沉淀是针对溶液中进行的反应,原来无固态物质,现在产生了固态物质 才使用。
方程式默写
化学方程式复习 1. 钾在氧气中燃烧: 2. NaAlO2溶液中加入足量NaHSO4溶液(离子): 3. Fe(OH)3溶于氢碘酸(离子): 4. 惰性电极电解AgNO3溶液,写总反应(离子): 5. CH3CHBrCHBrCH3与NaOH的醇溶液共热,所得产物中所有碳原子共直线 6. 氮化镁溶于水(化学): 7. 1mol明矾和Ba(OH)2溶液反应至生成沉淀的物质的量最大(离子): 8. FeSO4溶液和KMnO4(H+)溶液(离子): 9. 铅蓄电池充电时阴极反应: 阳极反应: 10. 葡萄糖和新制银氨溶液的反应: 11. 少量NaHCO3溶于石灰水(离子): 12. 铁与水蒸气的反应: 13. 等物质的量的氯气和溴化亚铁溶液(离子): 14. 惰性电极电解MnSO4酸性溶液得MnO2,阳极反应: 15. 制酚醛树脂,并注明反应类型: 16. Na2CrO4溶液中滴加稀H2SO4,并注明现象(离子):
17. 草酸和KMnO4(H+)溶液(离子): 18. 实验室制SO2气体(两种方法): 19. 盛放碱液的试剂瓶不能用玻璃塞(离子): 20. 对苯二甲酸与乙二醇形成环酯,并指明反应类型: 21. Na2O2与SO2反应: 22. Al与磁性氧化铁的反应: 23. 用铁氰化钾检验Fe2+,并注明实验现象(离子): 24. 碱性锌锰电池正极反应: 负极反应: 25. 乳酸缩聚: 26. 镁和热水的反应(化学): 27. 磁性氧化铁溶于稀硝酸(离子): 28. Na2SO3溶液和KMnO4(H+)溶液(离子): 29. Cu作电极电解Na2SO4溶液,写总反应(离子): 30. 向CH2BrCOOH中加足量NaOH溶液并共热,并注明反应类型: 31. 4 mol/L的NaAlO2溶液和7 mol/L的盐酸溶液等体积混合(离子): 32. Fe(OH)3胶体制备(离子): 33. 工业制粗硅: 34. 甲醇燃料电池(碱性)正极反应:负极反应:
常见化学式和化学方程式含答案修订版
常见化学式和化学方程式含答案修订版 IBMT standardization office【IBMT5AB-IBMT08-IBMT2C-
常见化学式和化学方程式 化学式 1.单质: 非金属:氢气、氧气、臭氧、氮气、氯气、碳、硫、磷、碘 H 2、 O 2 、 O 3 、 N 2 、 Cl 2 、 C、 S、 P、 I 2 稀有气体:氦气、氖气、氩气: He、Ne、Ar 金属:钠、钾、镁、铝、钙、锌、铁、铜、金、银、汞、锰 Na、K、 Mg、 Al、Ca、 Zn、 Fe、 Cu、 Au Ag、 Hg、Mn 2.氧化物: 非金属氧化物:一氧化碳、二氧化碳、二氧化硫、三氧化硫、一氧化 氮、 CO 、 CO 2 、 SO 2 、 SO 3 、 NO 二氧化氮、五氧化二氮、五氧化二磷、水、过氧化氢、二氧化硅
NO 2、 N 2 O 5 、 P 2 O 5 、H 2 O 、 H 2 O 2 、 SiO 2 金属氧化物:氧化钠、氧化镁、氧化钙、氧化铜、氧化汞、二氧化锰、 Na 2O 、 MgO 、 CaO 、 CuO 、 HgO 、 MnO 2 氧化铝、氧化铁、氧化亚铁、四氧化三铁、氧化亚铜 Al 2O 3 、 Fe 2 O 3 、 FeO、 Fe 3 O 4 、 Cu 2 O 3.酸:盐酸、硝酸、硫酸、碳酸、醋酸 HCl、 HNO 3、H 2 SO 4 、H 2 CO 3 、CH 3 COOH 4.氢氧化物:氢氧化钠、氢氧化钙、氢氧化镁、氢氧化铜、氢氧化铝、氢氧化铁 NaOH、 Ca(OH) 2、 Mg(OH) 2 、 Cu(OH) 2 、 Al(OH) 3 、 Fe(OH) 3 5.氯化物:氯化钠、氯化镁、氯化钙、氯化铜、氯化锌、氯化铝、氯化铁、氯化亚铁
九年级上册化学必须记住的化学式和化学方程式
九年级上册化学必须记住的化学式和化学方程 式 Company number:【WTUT-WT88Y-W8BBGB-BWYTT-19998】
九年级上册化学必须记住的化学式 一、单质的化学式:(25个) 1、气态非金属单质:氧气O 2、氮气N2、氢气H2、氯气Cl2 2、固态非金属单质:碳C 、磷P、硫S、硅Si 3、稀有气体单质:氦He、氖Ne、氩Ar 4、金属单质:铁Fe、铜Cu、锌Zn、铝Al、银Ag、镁Mg、 钡Ba、铂Pt、金Au、汞Hg、钾K、钙Ca、锰Mn、钠Na 二、化合物的化学式:(37个) 1、氧化物:水H2O、二氧化碳CO2、过氧化氢H2O2、二氧化锰MnO2、一氧化碳CO、二氧化硫SO2、二氧化氮NO2、氧化铜CuO、氧化铁Fe2O3、四氧化三铁Fe3O4、氧化镁MgO、氧化钙CaO、一氧化碳CO、五氧化二磷P2O5、氧化铝Al2O3、二氧化硅SiO2、氧化汞HgO、氧化亚铜Cu2O、氨气NH3 2、酸:硫酸H2SO4、碳酸H2CO3、盐酸HCl、硝酸HNO3 3、碱:氢氧化钠NaOH、氢氧化钙Ca(OH)2、氢氧化钾KOH 4、盐:氯化钠NaCl、氯化钾KCl、硫酸铜CuSO4、碳酸钠Na2CO3、 氯酸钾KClO3、高锰酸钾KMnO4、锰酸钾K2MnO4、碳酸钙CaCO3、 硫酸亚铁FeSO4、硫酸铁Fe2(SO4)3 5、有机物:甲烷CH4、乙醇(俗名酒精)C2H5OH 九年级上册化学必须记住的化学方程式(34个) 1、镁燃烧:2Mg+O22MgO 2、铁燃烧:3Fe+2O2Fe3O4 3、铝燃烧:4Al+3O22Al2O3 4、氢气燃烧:2H2+O22H2O(淡蓝色火焰)
常见物质化学式及化学方程式归纳
物质化学式的书写和读法 依据组成纯净物的元素种类是否单一将纯净物分为单质和化合物。纯净物具有固定的组成和性质,可以用化学式表示,各种物质的化学式都是通过实验方法测定出来的,一种纯净物只能由一个化学式来表示,不能主观臆造。 一.单质化学式的书写和读法(由同种元素组成的纯净物) 1.稀有气体单质、固态非金属单质、金属单质(由原子直接构成)等物质的化学式直接用元素符号表示。(1)氦气---He (2)氖气---Ne (3)氩气---Ar (4)碳---C (5)磷---P (6)硫---S (7)硅---Si (8)钠--- Na (9)镁---Mg (10)铝--- Al (11)钙---Ca (12)钾---K (13)铜---Cu (14)铁--- Fe (15)锌---Zn (16)汞---Hg (17)银---Ag (18)钡---Ba ★【读法】直接读出元素的名称。 2.双原子(或多原子)构成分子的单质化学式的书写,在元素符号右下角标注每个分子中原子的个数。(1)氧气--- O2(2)氢气--- H2 (3)氮气---N2(4)氯气--- Cl2 (5)臭氧---O3(6)碳60---C60(7)溴---Br2(8)碘---I2 ★【读法】元素名称后加“气或直接读出元素名称”。 二.化合物化学式的书写和读法(由不同种元素组成的纯净物) (一)由两种元素组成的化合物的化学式的书写和读法 1.氧化物化学式的书写和读法(由两种元素组成,其中一种元素是氧元素的化合物) (1)氧化镁---MgO (2)氧化铜CuO (3)氧化钙---CaO (4)氧化钠---Na2O (5)氧化锌---ZnO (6)氧化汞---HgO (7)氧化铁---Fe2O3(8)氧化铝---Al2O3 (9)二氧化锰---MnO2(10)四氧化三铁---Fe3O4(11)二氧化碳---CO2(12)二氧化硫---SO2(13)二氧化氮---NO2 (14)三氧化硫---SO3 (15)五氧化二磷---P2O5(16)一氧化碳---CO (17)一氧化氮---NO ▼(18)水--- H2O ▼(19)过氧化氢--- H2O2 ★【书写规则和读法】氧化物的化学式中,氧元素符号写在右边,另一种元素的符号写在左边,即“先读的后写,后读的先写”一般称为“氧化某”,例如“氧化铜”,后读“铜”,则先写铜的元素符号“Cu”,先读“氧”,则后写氧元素的符号“O”,故氧化铜的化学式为“CuO”。反之,MgO的名称就是“氧化镁”,CaO 的名称就是“氧化钙”。 某些稍微复杂点的氧化物或者有多种化合价元素的氧化物,一般称为“几氧化(几)某”,即化学式中有几个氧原子就称为“几氧化”,另一种元素有几个原子就称为“几某”,例如Fe3O4称为“四氧化三铁”、P2O5称为“五氧化二磷”,若另一种元素原子数是1,则称为“几氧化某”,例如CO2称为“二氧化碳”、SO2称为“二氧化硫”、SO3称为“三氧化硫”。 2.其他由两种元素组成物质化学式的书写和读法 (1)氯化氢---HCl (2)氯化钠(俗称食盐)---NaCl (3)氯化钾---KCl (4)氯化镁---MgCl2 (5)氯化钙---CaCl2 (6)氯化铝---AlCl3(7)氯化铁---FeCl3 (8)氯化银---AgCl (9)氯化铜---CuCl2 (10)硫化锌---ZnS (11)氟化钙--- CaF2▼(12)氯化亚铁---FeCl2 ★【书写规则和读法】一般正价元素写在前,负价元素写在后。根据元素的名称,从右往左读作“某化某”。(二)由三种及三种以上元素组成物质化学式的书写和读法 1.含有碳酸根原子团(CO3)物质化学式的书写和读法 (1)碳酸--- H2CO3(2)碳酸钠---Na2CO3(3)碳酸氢钠--- NaHCO3(4)碳酸钙---CaCO3 ★【书写规则和读法】一般正价元素或原子团写在前,负价元素或原子团写在后。根据元素的名称,从中间元素读起读作“碳酸某”或“碳酸氢某”。 2.含有硫酸根原子团(SO4)物质化学式的书写和读法 (1)硫酸---H2SO4 (2)硫酸铜--- CuSO4(3)硫酸钡BaSO4 (4)硫酸钠---Na2SO4 (5)硫酸镁---MgSO4 (6)硫酸锌---ZnSO4 (7)硫酸铝---Al2(SO4)3 (8)硫酸铁---Fe2(SO4)3 ▼(9)亚硫酸钠---Na2SO3 ▼(10)硫酸亚铁---FeSO4 ★【书写规则和读法】一般正价元素或原子团写在前,负价元素或原子团写在后。根据元素的名称,从中间元素读起读作“硫酸某”。 3.含有硝酸根原子团(NO3)物质化学式的书写和读法 (1)硝酸---HNO3(2)硝酸银---AgNO3 (3)硝酸钾---KNO3 (4)硝酸铜---Cu(NO3)2 (5)硝酸钠--- NaNO3 (6)硝酸铁---Fe(NO3)3 ▼7、硝酸亚铁---Fe(NO3)2 ★【书写规则和读法】一般正价元素或原子团写在前,负价元素或原子团写在后。根据元素的名称,从中间元素读起读作“硝酸某”。 4.含有氢氧根原子团(OH)物质化学式的书写和读法 (1)氢氧化钠---NaOH (2)氢氧化钾---KOH (3)氢氧化钙---Ca(OH)2(4)氢氧化镁--- Mg(OH)2(5)氢氧化铜---Cu(OH)2(6)氢氧化钡---Ba(OH)2(7)氢氧化铝--- Al(OH)3(8)氢氧化铁---Fe(OH)3 ★【书写规则和读法】一般正价元素或原子团写在前,负价元素或原子团写在后。氢氧化物化学式书写时,金属元素符号先写,氢氧根(OH)后写,读作“氢氧化某”,例如氢氧化钠,化学式为NaOH,又如Mg(OH)2的名称为氢氧化镁。 5.含有铵根原子团(NH4)物质化学式的书写和读法 (1)氯化铵---NH4Cl (2)硫酸铵--- (NH4)2SO4 (3)硝酸铵--- NH4NO3 (4)碳酸铵--- (NH4)2CO3 (5)碳酸氢铵--- NH4 HCO3 ★【书写规则和读法】一般正价元素或原子团写在前,负价元素或原子团写在后。化学式书写时,铵根原子团写在前,其他元素或原子团写在后;读作“某化铵或某酸铵”,例如氯化铵,化学式为NH4Cl,又如(NH4)2CO3 的名称为碳酸铵。 (三)其他常用物质化学式 (1)高锰酸钾---KMnO4 (2)锰酸钾---K2MnO4 (3)氯酸钾---KClO3 (4)甲烷---CH4 (5)乙醇(俗称酒精)---C2H5OH (6)氨气---NH3 ▼(7)氨水(NH3·H2O)(8)尿素---CO(NH2)2 1
高中化学方程式大全(默写训练版)
高考总复习之高中化学方程式总结 化学 第一册 第一章 卤素 第一节 氯气 1、NaCl 2Cl Na 22??→?+点燃 2、22CuCl Cl Cu ?? →?+点燃 3、32FeCl 2Cl 3Fe 2??→?+点燃 4、HCl 2Cl H 22?? ??→?+点燃(光照) 5、32PCl 2Cl 3P 2??→?+点燃 6、523PCl Cl PCl →+ 7、HClO HCl O H Cl 22+→+ 8、O H 2CaCl ClO Ca Cl 2OH Ca 222222++→+)()( 9、HClO 2CaCO O H CO ClO Ca 3222+↓→++)( 10、O H NaCl NaClO Cl NaOH 222++→+ 11、↑++?→? +? 2222Cl O H 2MnCl MnO HCl 4 12、O H 8Cl 5KCl 2MnCl 2HCl 16KMnO 22224+↑++→+(浓) 13、2O HCl 2HClO 2+?? →?见光 第二节 氯化氢 14、↑+→+HCl NaHSO SO H NaCl 442(浓) 15、↑+?→? +? HCl SO Na NaCl NaHSO 424 16、↑+?→?+? HCl 2SO Na SO H NaCl 2424 2(浓)(14、15结合) 17、33HNO AgCl AgNO HCl +↓→+
化学 第一册 第一章 卤素 第一节 氯气 1、??→?+点燃 2Cl Na 2、??→?+点燃 2Cl Cu 3、??→?+点燃2Cl Fe 4、????→?+点燃(光照)22Cl H 5、?? →?+点燃 2Cl P 6、→+23Cl PCl 7、→+O H Cl 22 8、→+22Cl OH Ca )( 9、→++O H CO ClO Ca 222)( 10、→+2Cl NaOH 11、?→? +? 2MnO HCl 12、→+(浓) HCl KMnO 4 13、??→ ?见光 HClO 第二节 氯化氢 14、→+(浓)42SO H NaCl 15、?→? +? NaCl NaHSO 4 16、?→?+?(浓)4 2SO H NaCl (14、15结合) 17、→+3AgNO HCl
化学式和化学方程式计算(全部类型题目) (1)
化学方程式 化学方程式是用化学式表示化学反应的式子。化学方程式不仅表达了物质在质的方面的关系,即什么是反应物质和什么是生成物质,而且还表达物质在量的方面上的变化关系,即反应物质和生成物质的质量关系,同时包括反应物质和生成物质的微粒个数关系。这是我们计算化学方程式的理论依据。 我们将化学方程式计算分为以下几个类型: 一、有关反应物和生成物质量的的计算 1,通过电解水值得的氢气可用于电子工业制备高纯硅。若要制得0.4kg氢气,理论上消耗水的质量是多少? 2、 二、根据质量守恒定律利用差量法计算相关物质的质量以及质量分数(或纯度) 1、氯酸钾与二氧化锰的混合物26.5克,放入试管中加热,完全反应后剩余物质为16.9克,求: (1)生成氧气多少克? (2)有多少克氯酸钾发生反应? (3)剩余固体中的物质是什么?质量各是多少克? 2、实验室常用一定质量分数的过氧化氢溶液制取氧气。某同学实验前称得一定质量分数的过氧化氢溶液42.5克, 加入1克MnO2,完全反应后称得剩余物的质量为41.9克。 计算:(1)反应中放出氧气的质量。 (2)实验中加入的过氧化氢溶液的质量分数。 3、某同学把3 g碳放在给定的氧气中充分燃烧,实验数据如下: 第一次第二次第三次 给定O2的质量 6 g 8 g 13 g 生成CO2的质量8.25 g 11 g 11 g 回答:(1)从以上数据说明,这三次实验中第______ 次恰好完全反应。 (2)第______ 次实验中,碳有剩余,剩余________g。 (3)第______ 次实验中,氧气有剩余,剩余________g。 4、氢气和氧气共5克,点燃后充分反应生成1.8克水,则原来氢气和氧气各为多少克?
(完整word版)化学式与化学方程式计算知识点
有关化学式计算的知识点 一、定义:用元素符号表示物质组成的式子如:MgO、H2O、CO2 表示该物质 表示该物质的组成 二、意义: 表示该物质的一个分子 表示该物质一个分子的构成 水 水是由氢、氧两种元素组成 例:H2O 2H2O :2个水分子 一个水分子 一个水分子是由一个氧原子和二个氢原子构成 三、化合价与化学式 1、常见元素的化合价 金正非负单质零,(金属元素通常显正价,非金属元素通常显负价,单质中元素的化合为零)正负总价和为零。(在化合物中,各元素的正负化合价的代数和为零) 一价氢氯(-1)钾钠银, 二价氧(-2)钙镁钡锌。 +1 -1 -1 -2 -2 NH4OH NO3CO3SO4 (1)求元素的化合价 例题 计算KClO3中氯元素的化合价 解:设氯酸钾中氯元素的化合价为X +1 X -2 K Cl O3 +1+X+(-2)×3=0 X=+5 答:氯酸钾中氯元素的化合价为+5 (2)根据化合价写化学式 例题 已知铝的化合价是+3,氧的化合是-2,写出铝的氧化物的化学式。 1、写:(正价在前,负价在后或金前非后) AlO 2、求:最小公倍数 |+3|×|-2|=6 3、算:原子个数 Al:6÷3=2O:6÷2=3 4、标: Al2O3 5、查:
四、物质组成的定量表示 1、相对分子质量:化学式中各原子的相对原子质量的总和 例:H2O的相对分子质量=1×2+16=18 2、计算物质组成元素的质量比 例:计算H2O中氢元素和氧元素的质量比 H2O中氢元素和氧元素的质量比为:1×2︰16=1︰8 3、计算物质中某元素的质量分数 质量分数 组成物质的各种成分的质量在总质量中所占的比例,称为质量分数,习惯上质量分数用百分数来表示。 这里的“成分”可以是元素(如人体中钙元素的质量分数约为2%);也可以是混合物中的各种组成物质(如生理盐水中氯化钠的质量分数约为0.9%)。 该元素的相对原子质量×其原子个数 物质中该元素的质量分数为:×100% 该物质的相对分子质量 例:求H2O中氢元素和氧元素的质量分数 氢元素的相对原子质量×氢原子个数 H2O中氢元素的质量分数为:×100% 水的相对分子质量 1×2 = ×100%≈11% 1×2+16×1 H2O中氧元素的质量分数为:100%-11%≈89% 3、根据化学式的计算 计算一定量物质中某元素的质量: 物质的质量×物质中某元素的质量分数=该元素的质量 例:电解10g水产生氢气的质量是多少克? 1×2 解:10g ××100% =10g×11% =11g 1×2+16×1 答:。。。。。 根据硝酸铵的化学式计算: (1)NH4NO3的相对分子质量; (2)氮、氢、氧三种元素的质量比 (3)氮元素的质量分数。 (4)50千克硝酸铵中氮元素的质量 相对原子质量:H-1 C-12 N-14 O-16
- 1-必修一化学方程式默写 填空
- 高中化学方程式默写(High school chemistry equation dictation)
- 高一化学方程式默写-09-12
- 高中化学方程式大全(完整版)(20210127095558)
- 高中化学方程式默写全覆盖--钠钙镁及其化合物部分
- 高中有机化学方程式总结(默写版)
- 高中化学方程式大全(默写训练版)
- 所有重要的高中化学方程式-汇总
- 有机复习方程式默写
- 高中化学方程式默写清单
- 高中重要化学方程式(或离子方程式)默写
- 高中无机化学方程式汇总(默写)
- 高中无机化学方程式默写 汇总
- 高中化学方程式纯默写
- 高中化学方程式默写清单.doc
- 高中化学方程式默写大赛(全部)资料
- 高一化学方程式默写
- 化学式化学方程式默写
- 高一化学方程式默写-硫及其化合物
- 高中化学方程式默写
