【推荐精选】2018届高考化学三轮冲刺 核心突破 电池连接问题的分析考前特训

电池连接问题的分析
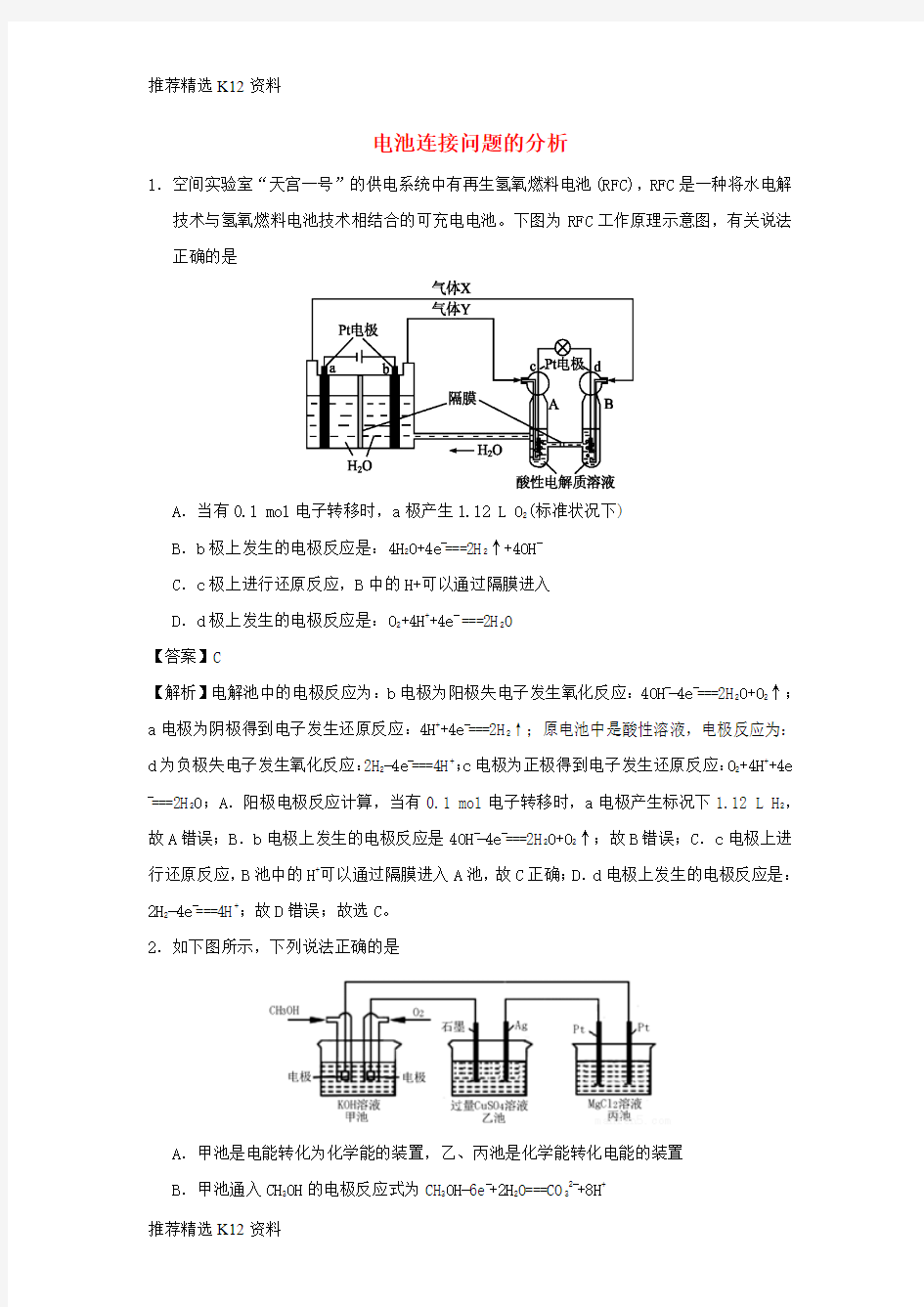
1.空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是
A.当有0.1 mol电子转移时,a极产生1.12 L O2(标准状况下)
B.b极上发生的电极反应是:4H2O+4e?===2H2↑+4OH?
C.c极上进行还原反应,B中的H+可以通过隔膜进入
D.d极上发生的电极反应是:O2+4H++4e?===2H2O
【答案】C
【解析】电解池中的电极反应为:b电极为阳极失电子发生氧化反应:4OH??4e?===2H2O+O2↑;a电极为阴极得到电子发生还原反应:4H++4e?===2H2↑;原电池中是酸性溶液,电极反应为:d为负极失电子发生氧化反应:2H2?4e?===4H+;c电极为正极得到电子发生还原反应:O2+4H++4e
?===2H
2O;A.阳极电极反应计算,当有0.1 mol电子转移时,a电极产生标况下1.12 L H2,故A错误;B.b电极上发生的电极反应是4OH??4e?===2H2O+O2↑;故B错误;C.c电极上进行还原反应,B池中的H+可以通过隔膜进入A池,故C正确;D.d电极上发生的电极反应是:2H2?4e?===4H+;故D错误;故选C。
2.如下图所示,下列说法正确的是
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应式为CH3OH?6e?+2H2O===CO32?+8H+
C .反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO 4溶液恢复到原浓度
D .甲池中消耗280 mL(标准状况下)O 2,此时丙池中理论上最多产生14. 5 g 固体
【答案】D
【解析】A.甲池是原电池,是化学能转化为电能的装置;乙、丙池是电能转化为化学能的装置,A 错误;B. 甲池通入CH 3OH 的电极是原电池的负极,发生氧化反应,其电极反应式为:CH 3OH ?6e ?+8OH ?===CO 32?+6H 2O ,B 错误;C.乙池中,石墨与原电池的正极相连,为电解池的阳极,发生失去电子的氧化反应,其电极反应式为:2H 2O ?4e ?===4H ++O 2↑;Ag 电极与原电池的负极相连,为电解池的阴极,发生得到电子的还原反应,其电极反应式为:Cu 2++2e ?===Cu ;整个反应中消耗了不仅消耗了Cu 2+,而且消耗了溶质水,因此反应一段时间后,只向乙池中加入一定量Cu(OH)2固体不能使CuSO 4溶液恢复到原浓度,C 错误;D. 甲池中消耗280 mL(标
准状况下)O 2,O 2量为2(e )4(O )40.0125mol=0.05mol n n -==?,丙池中阴极的电极反应式为:2H 2O+2e ?===H 2↑+2OH ?,产生固体的化学方程式为:2OH ?+Mg 2+===Mg(OH)2↓,故产生Mg(OH)2的物质的
量为,产生固体的质量为2[Mg(OH)]0.25mol 58g/mol=14.5g m =?,D 正确。故答案D 。
3、某同学组装了如图所示的电化学装置,电极Ⅰ为Al ,其他均为Cu ,则
A .电流方向:电极Ⅳ→→电极Ⅰ
B .电极Ⅰ发生还原反应
C .电极Ⅱ逐渐溶解
D .电极Ⅲ的电极反应:Cu 2++2e ?
===Cu
【答案】A
【解析】首先应根据图示判断左边两池通过盐桥构成原电池,产生电流对右边硫酸铜溶液进行电解(相当于精炼铜)。电极Ⅰ为负极,电极Ⅱ为正极,所以电流方向:电极Ⅳ→→电极Ⅰ(电流方向与电子流动方向相反),A 正确。电极Ⅰ上铝失电子发生氧化反应,B 错。电极
Ⅱ上有铜析出,C 错。电极Ⅲ的电极反应:Cu ?2e ?===Cu 2+
,D 错。
4、如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X 为阳离子交换膜。下列有关说法正确的是
A .反应一段时间后,乙装置中生成的氢氧化钠在铁极区
B .乙装置中铁电极为阴极,电极反应式为Fe ?2e ?===Fe 2+
C .通入氧气的一极为正极,发生的电极反应为O 2?4e ?+2H 2O===4OH ?
D .反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
【答案】A
【解析】甲装置为甲醚燃料电池,充入氧气的一极发生还原反应,为电极的正极,充入燃料的一极为电极的负极;乙装置为电解饱和氯化钠溶液的装置,根据串联电池中电子的转移,可知Fe 电极为阴极,C 极为阳极;丙装置为电解精炼铜的装置,精铜为阴极,粗铜为阳极。
5、下图装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池。装置(Ⅰ)的离子交换膜只允许Na +通过,已知电池充、放电的化学方程式为2Na 2S 2+NaBr 3???→←???放电
充电Na 2S 4+3NaBr ,当闭合开关K 时,X 电极附近溶液变红。
下列说法正确的是
A .闭合开关K 时,Na +
从右到左通过离子交换膜
B .闭合开关K 时,负极反应式为3NaBr ?2e ?===NaBr 3+2Na +
C .闭合开关K 时,X 电极反应式为2Cl ??2e ?===Cl 2↑
D .闭合开关K 时,当有0.1 mol Na +通过离子交换膜时,X 电极上放出标准状况下气体
1.12 L
【答案】D
【解析】选“当闭合开关K 时,X 电极附近溶液变红”说明X 是阴极,Y 为阳极,则电池的左侧是负极,右侧为正极,Na +
从左到右通过离子交换膜,A 错误;放电时,X 电极反应式为2Na 2S 2?2e ?===Na 2S 4+2Na +,B 错误;X 极是阴极,发生的电极反应式为2H ++2e ?===H 2↑,C 错误;“当有0.1 mol Na +通过离子交换膜时”说明转移了0.1 mol 电子,则X 电极生成0.05 mol H 2,在标准状况下体积为1.12 L ,D 正确。 6、我国科研人员以Zn 和尖晶石百锰酸锂(ZnMn2O4)为电极材料,研制出一种水系锌离
子电池。该电池的总反应方程式:x Zn +Zn 1?x Mn 2O 4???→←???放电
充电ZnMn 2O 4(0 A .ZnMn 2O 4是负极材料 B .充电时,Zn 2+ 向ZnMn 2O 4电极迁移 C .充电时,阳极反应:ZnMn 2O 4?x Zn 2+?2x e ?===Zn 1?x Mn 2O 4 D .充放电过程中,只有Zn 元素的化合价发生变化 【答案】C 【解析】A. 原电子放电是Zn 失电子发生氧化反应,为负极材料,故A 错误;B. 充电时其原理为电解原理,充电时原来的负极连接电源的负极变为Zn 极,Zn2+向阴极即Zn 电极迁移,故B 错误;C. 充电时,阳极ZnMn2O4发生氧化生成Zn1?x Mn2O4,其电极反应为ZnMn2O4?xZn2+?2xe ?===Zn1?xMn2O4,故C 正确;D. 充放电过程中,只有Zn 元素的化合价降低,Mn 元素的化合价升高,故D 错误;答案为C 。 7、.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K 2FeO 4+8H 2O ???→←???放电 充电 3Zn(OH)2+2Fe(OH)3+4KOH ,下列叙述不正确的是 A .放电时负极反应为:Zn ?2e ?+2OH ? ===Zn(OH)2 B .充电时阳极反应为:Fe(OH)3?3e ?+5OH ?===FeO 42?+4H 2O C .充电时,蓄电池的负极应与外接电源正极相连 D .放电时负极附近溶液的碱性减弱 【答案】C 【解析】A .根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn ?2e ?+2OH ?===Zn(OH)2,故A 正确;B .充电时阳极发生Fe(OH)3失电子的氧化反应,即反应为:Fe(OH)3?3e ?+5OH ?===FeO 42?+4H 2O ,故B 正确;C .充电时蓄电池的负极应与外接电源 负极相连,故C错误;D.高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn?2e?+2OH?===Zn(OH)2,所以负极附近溶液的碱性减弱,故D正确;故选C。 8、某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观 察到电流计的指针发生了偏转。 请回答下列问题: (1)甲池为________(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为____________。 (2)乙池中A(石墨)电极的名称为________(填“正极”“负极”“阴极”或“阳极”),总反应式为_________________________________________。 (3)当乙池中B极质量增加5.40 g时,甲池中理论上消耗O2的体积为________mL(标准状况),丙池中________极析出________g铜。 (4) 若丙池中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH 将________(填“增大”“减小”或“不变”);丙中溶液的pH将________(填“增大”“减小”或“不变”),若将丙中溶液复原,需加入________。 【答案】(1)原电池CH3OH?6e?+8OH?===2 3 CO-+6H2O (2)阳极4AgNO3+2H2O 电解 4Ag+O2↑+4HNO3 (3)280 D 1.6 (4)减小增大HCl 【解析】(1)甲池为原电池,通入CH3OH的电极为负极,电极反应式为CH3OH?6e?+8OH? ===2 3 CO-+6H2O。 (2)乙池中为用惰性电极电解AgNO3溶液,其中A作阳极,B作阴极,总反应式为 4AgNO3+2H2O 电解 4Ag+O2↑+4HNO3。 (4)若丙池中电极不变,将其溶液换成NaCl溶液,根据丙中总反应式为 2NaCl+2H2O 电解 2NaOH+H2↑+Cl2↑,溶液pH增大,而甲中总反应式为 2CH3OH+3O2+4KOH===2K2CO3+6H2O,溶液pH减小。 9.某化学兴趣小组在实验室利用质子酸甲醇燃料电池作电源,电解硫酸铜溶液。 请回答下列问题: (1)通入氧气的电极为______(填“正极”或“负极”),通入甲醇一极的电极反应式为 _________。 (2)b电极上的现象为________________。 (3)假设硫酸铜溶液的体积为600 mL(电解前后溶液的体积变化忽略不计),若消耗336 mL(标准状况)O2,则电解后硫酸铜溶液的pH为________。 (4)若a、b均换成铜电极,则电解一段时间后硫酸铜溶液的浓度_____(填“增大”“减小”或“不变”)。 【答案】(1)正极 CH3OH?6e?+H2O===CO2↑+6H+ (2)石墨电极表面有紫红色固体析出 1 (3)不变 【解析】(1)氧气得到电子,通入氧气的电极为正极,通入甲醇一极是负极,甲醇失去电子,由于存在质子交换膜,所以电极反应式为CH3OH?6e?+H2O===CO2↑+6H+。 (2)b电极与电源的负极相连,作阴极,溶液中的铜离子放电析出铜,电极上的现象为石墨电极表面有紫红色固体析出。 (3)假设硫酸铜溶液的体积为600 mL(电解前后溶液的体积变化忽略不计),336 mL(标准状况)O2的物质的量是0.015 mol,转移0.06 mol电子,则有0.06 mol氢氧根放电,产生0.06 mol氢离子,浓度是0.1 mol/L,则电解后硫酸铜溶液的pH为1。 (4)若a、b均换成铜电极,相当于电镀,则电解一段时间后硫酸铜溶液的浓度不变。 10、认真观察下列装罝,回答下列问题: (1)装置B中Cu上发生的电极反应方程式为__________________________;电池工作时, 对盐桥中的K+、Cl?的移动方向的表述正确的是________ 。 A.盐桥中的K+向左侧烧杯移动、Cl?向右侧烧杯移动 B.盐桥中的K+向右侧烧杯移动、Cl?向左侧烧杯移动 C.盐桥中的K+、Cl?都向左侧烧杯移动 D.盐桥中的K+、 Cl?几乎都不移动 (2)装置A中总反应的离子方程式为________________________。 (3)若装置E的目的是在Cu材料上镀银,则X为___________,极板N的材料为 ___________;若装置E的目的是电解精炼铜,则极板___________(填“M”或“N”)的材料为粗铜板(含少量锌、金和银),该电极发生的电极反应式为___________。 (4)当装置A中Cu电极质量改变6.4 g时,装置D中产生的气体体积为_______L(标准状况下)。 【答案】(1)Cu2++2e?===Cu A (1)Cu+2H+===Cu2++H2↑ (3)AgNO3 Ag N Zn?2e?===Zn2+ Cu?2e?===Cu2+3.92 【解析(1)B和C装置形成原电池,锌作负极,铜作正极,正极上铜离子得电子生成铜,电极反应式为:Cu2++2e?===Cu,盐桥中的K+、Cl?的移动方向为K+移向左侧正极,Cl?移向右侧负极; (2)A连接电源,则A是电解池,左边Pt作阴极,右边Cu作阳极,阳极上Cu放电,阴极上 氢离子放电,装置A中总反应的离子方程式为Cu+2H+电解 Cu2++H2↑; (3)镀时,镀层作阳极,镀件作阴极,电解质溶液中阳离子和镀层金属相同,若装置D的目 的是在某镀件上镀银,则X为硝酸银溶液,N作阳极,应该是银,若装置E电解精炼铜,则阳极N的材料为粗铜板发生氧化反应,反应式为Zn?2e?===Zn2+,Cu?2e?===Cu2+; (4)当装置A中Cu电极质量改变6.4 g时,n(Cu)=0.1 mol,则转移0.2 mol电子,装置D中n(NaCl)=0.1 mol,阳极首先发生2Cl?2e?===Cl2↑、其次发生4OH?4e?===2H2O+O2↑,则阳极首先生成0.05 molCl2,其次生成0.025 mol O2,阴极只发生2H++2e?===H2↑,生成0.1 molH2,则总共生成0.175 mol气体,体积为0.175 mol×22.4 L/mol=3.92 L。
