中国经皮冠状动脉介入治疗指南(2016)

中国经皮冠状动脉介入治疗指南(2016)
中华心血管病杂志,第44卷第5期第382页-第400页
自"中国经皮冠状动脉介入治疗指南2012(简本)" [1]更新以来,在经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)及其相关领域又积累了众多临床证据。为此,中华医学会心血管病学分会介入心脏病学组、中国医师协会心血管内科医师分会血栓防治专业委员会、中华心血管病杂志编辑委员会组织专家组,在2009和2012年中国PCI 指南[1,2]的基础上,根据最新临床研究成果、特别是结合中国人群的大型随机临床试验结果,参考最新美国心脏病学学院/美国心脏协会(ACC/AHA)以及欧洲心脏病学学会(ESC)等组织发布的相关指南[3,4,5,6,7,8,9]、并结合我国国情及临床实践,对PCI治疗领域的热点和焦点问题进行了全面讨论并达成一致共识,在此基础上编写了本指南。
为便于读者了解PCI对某一适应证的价值或意义,本指南对推荐类别的表述沿用国际通用的方式。
Ⅰ类:指已证实和(或)一致公认有益、有用和有效的操作或治疗,推荐使用。
Ⅱ类:指有用和(或)有效的证据尚有矛盾或存在不同观点的操作或治疗。
Ⅱa类:有关证据/观点倾向于有用和(或)有效,应用这些操作或治疗是合理的。
Ⅱb类:有关证据/观点尚不能被充分证明有用和(或)有效,可考虑应用。
Ⅲ类:指已证实和(或)一致公认无用和(或)无效,并对一些病例可能有害的操作或治疗,不推荐使用。
对证据来源的水平表达如下。
证据水平A:资料来源于多项随机临床试验或荟萃分析。
证据水平B:资料来源于单项随机临床试验或多项非随机对照研究。
证据水平C:仅为专家共识意见和(或)小规模研究、回顾性研究和注册研究。
概述
一、建立质量控制体系
对于每一个开展PCI的中心,应建立质量控制体系(Ⅰ,C),包括:(1)回顾分析整个中心的介入治疗结局和质量;(2)回顾分析每个术者的介入治疗结局和质量;(3)引入风险调控措施;(4)对复杂病例进行同行评议;(5)随机抽取病例作回顾分析。
资质要求:每年完成的心血管疾病介入诊疗病例不少于200例,其中治疗性病例不少于100例,主要操作者具备介入治疗资质且每年独立完成PCI>50例,血管造影并发症发生率低于0.5%,心血管病介入诊疗技术相关病死率低于0.5%。
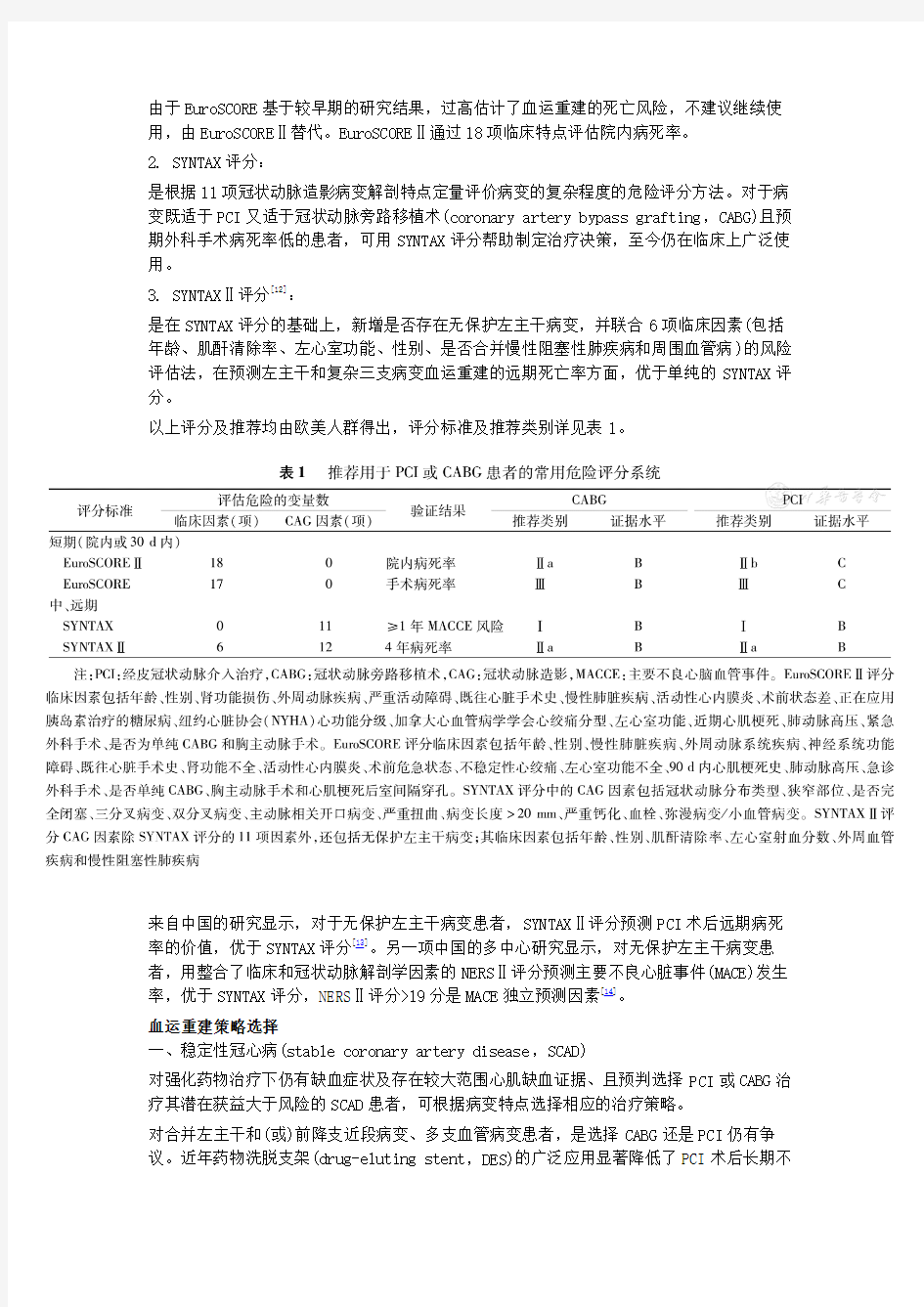
二、危险评分系统
风险-获益评估是对患者进行血运重建治疗决策的基础。运用危险评分可以预测心肌血运重建手术病死率或术后主要不良心脑血管事件(major adverse cardiac and cerebrovascular event,MACCE)发生率,指导医师对患者进行风险分层,从而为选择适宜的血运重建措施提供参考。常用的危险评分系统特点如下。
1.欧洲心脏危险评估系统Ⅱ(EuroSCORE Ⅱ)[7,10,11]:
由于EuroSCORE基于较早期的研究结果,过高估计了血运重建的死亡风险,不建议继续使用,由EuroSCOREⅡ替代。EuroSCOREⅡ通过18项临床特点评估院内病死率。
2. SYNTAX评分:
是根据11项冠状动脉造影病变解剖特点定量评价病变的复杂程度的危险评分方法。对于病变既适于PCI又适于冠状动脉旁路移植术(coronary artery bypass grafting,CABG)且预期外科手术病死率低的患者,可用SYNTAX评分帮助制定治疗决策,至今仍在临床上广泛使用。
3. SYNTAXⅡ评分[12]:
是在SYNTAX评分的基础上,新增是否存在无保护左主干病变,并联合6项临床因素(包括年龄、肌酐清除率、左心室功能、性别、是否合并慢性阻塞性肺疾病和周围血管病)的风险评估法,在预测左主干和复杂三支病变血运重建的远期死亡率方面,优于单纯的SYNTAX评分。
以上评分及推荐均由欧美人群得出,评分标准及推荐类别详见表1。
来自中国的研究显示,对于无保护左主干病变患者,SYNTAXⅡ评分预测PCI术后远期病死率的价值,优于SYNTAX评分[13]。另一项中国的多中心研究显示,对无保护左主干病变患者,用整合了临床和冠状动脉解剖学因素的NERSⅡ评分预测主要不良心脏事件(MACE)发生率,优于SYNTAX评分,NERSⅡ评分>19分是MACE独立预测因素[14]。
血运重建策略选择
一、稳定性冠心病(stable coronary artery disease,SCAD)
对强化药物治疗下仍有缺血症状及存在较大范围心肌缺血证据、且预判选择PCI或CABG治疗其潜在获益大于风险的SCAD患者,可根据病变特点选择相应的治疗策略。
对合并左主干和(或)前降支近段病变、多支血管病变患者,是选择CABG还是PCI仍有争议。近年药物洗脱支架(drug-eluting stent,DES)的广泛应用显著降低了PCI术后长期不
良事件发生率,PCI在SCAD中的适应证逐渐拓宽。建议对上述患者,根据SYNTAX评分[11](Ⅰ,B)和SYNTAX Ⅱ评分[12](Ⅱa,B)评估中、远期风险,选择合适的血运重建策略。
建议以冠状动脉病变直径狭窄程度作为是否干预的决策依据。病变直径狭窄≥90%时,可直接干预;当病变直径狭窄<90%时,建议仅对有相应缺血证据,或血流储备分数(fractional flow reserve, FFR)≤0.8的病变进行干预(表2,表3)。
SCAD血运重建方式选择应依据指南,不能开展CABG的医院,应将适宜患者转诊至有心脏外科手术能力的医院手术治疗。
二、非ST段抬高型急性冠状动脉综合征(non-ST-segment elevation acute coronary syndrome, NSTE-ACS)
在无心电图ST段抬高的前提下,推荐用高敏肌钙蛋白(high-sensitivity cardiac troponin,hs-cTn)检测作为早期诊断工具之一,并在60min内获取检测结果[3](Ⅰ,A),根据即刻和1 h hs-cTn水平快速诊断或排除NSTEMI。
建议根据患者的病史、症状、体征、心电图和肌钙蛋白作为风险分层的工具(Ⅰ,A)[34,35]。采用全球急性冠状动脉事件注册(global registry of acute coronary events,GRACE)预后评分进行缺血危险分层,分为紧急(2 h以内)、早期(24 h以内)和延迟(72 h以内)3种
血运重建策略(包括PCI和CABG)。具体推荐见表4。
对首诊于非PCI中心的患者,极高危者,建议立即转运至PCI中心行紧急PCI;高危者,建议发病24 h内转运至PCI中心行早期PCI;中危者,建议转运至PCI中心,发病72 h 内行延迟PCI;低危者,可考虑转运行PCI或药物保守治疗。
三、急性ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI) 减少时间延误是STEMI实施再灌注治疗的关键问题,应尽量缩短首次医疗接触(first medical contact,FMC)至PCI的时间和FMC至医院转出时间,从而降低院内死亡风险。对首诊可开展急诊PCI的医院,要求FMC至PCI时间<90 min(Ⅰ,A)。对首诊不能开展急诊PCI的医院,当预计FMC至PCI的时间延迟<120 min时,应尽可能将患者转运至有直接PCI条件的医院[3](Ⅰ,B)。根据我国国情,可请有资质的医生到有PCI设备的医院行直接PCI,但要求FMC至PCI时间<120 min[41](Ⅱb,B)。
如预计FMC至PCI的时间延迟>120 min,对有适应证的患者,应于30 min内尽早启动溶栓治疗[6,42](Ⅰ,A)。早期荟萃分析[43]、近期FAST-MI注册研究[44]、FAST-PCI研究[45]、STREAM 研究[46]以及2项基于中国人群的研究[47,48]均显示,溶栓后早期实施PCI的患者30 d病死率与直接PCI的患者无差异,溶栓后早期常规PCI的患者1年MACCE发生率有优于直接PCI 的趋势。因此,对STEMI患者尽早溶栓并进行早期PCI治疗是可行的,尤其适用于无直接PCI治疗条件的患者。溶栓后早期实施冠状动脉造影的时间宜在3~24 h[43](Ⅱa,A),其最佳时间窗尚需进一步研究。
对合并多支病变的STEMI患者,美国2013年[6]及中国2015年STEMI指南均建议仅对梗死相关动脉(infarct relative artery,IRA)进行干预,除非合并心原性休克或梗死IRA行PCI后仍有持续性缺血征象,不应对非IRA行急诊PCI。然而,2013至2015年4项随机对照研究(PRAMI[49]、CvLPRIT[50]、DANAMI-3 PRIMULTI[51]和PRAGUE-13[52]试验)及2015年最新荟萃分析[53]均显示,对部分STEMI合并多支血管病变的患者行急诊PCI或择期PCI时,干预非IRA可能有益且安全。美国2015年STEMI指南更新中,建议对STEMI合并多支病变、血液动力学稳定患者,可考虑干预非IRA(可与直接PCI同时或择期完成)。HORIZONS-
AMI[54]、REAL[55]等观察性研究以及网络荟萃分析[56]提示,择期完成多支PCI的临床获益可能优于直接PCI同期干预非IRA。对于合并心原性休克和严重心力衰竭的STEMI患者,应
由经验丰富的医师完成PCI。具体推荐见表5。
PCI术中操作
一、介入治疗入径
股动脉径路是PCI的经典径路。但随着技术的发展,目前在我国大多选择经桡动脉径路(血管相关并发症少,患者痛苦少),应作为首选推荐[63](Ⅰ,A)。特殊情况下可酌情选择其他适宜的血管径路,如尺动脉[64]、肱动脉等。
二、术中辅助诊断及治疗技术
1.血管内超声(intravascular ultrasound, IVUS):
IVUS通常用于造影结果不明确、或者不可靠的情况下,如开口病变、血管重叠及分叉病变等。采用IVUS指导有助于查明支架失败原因(Ⅱa,C)。IVUS对PCI有非常重要的指导价值,尤其是对高危病变(包括左主干、钙化及分叉病变等),可明确支架大小、膨胀是否充分以及定位是否准确等。对选择性的患者(无保护左主干、三支、分叉、慢性闭塞及支架内再狭窄病变等),推荐IVUS指导的优化支架置入[65,66,67](Ⅱa,B)。对慢性闭塞病变,IVUS 指导有助于明确闭塞始点及帮助判断指引导丝是否走行在真腔,提高PCI成功率[68]。2.FFR:
FFR能特异地反映心外膜下冠状动脉狭窄的功能学严重程度,对开口、分支、多支和弥漫性病变均有一定的指导意义。
对没有缺血证据的SCAD患者,推荐对冠状动脉造影目测直径狭窄50%~90%的病变行FFR 评估[69,70](Ⅰ,A)。DEFER研究提示,对冠状动脉造影提示直径狭窄>50%临界病变的SCAD
患者,当病变FFR≥0.75时延迟PCI,其5年随访期内心血管事件显著低于FFR<0.75而实施PCI的患者[69]。
FAME研究[70]发现,对存在多支病变的SCAD、不稳定性心绞痛和NSTEMI患者,FFR指导的介入治疗组患者1年内复合终点事件显著低于单纯造影指导的介入治疗组。对单支或多支血管病变的SCAD患者,FAME2研究[22]提示,在有FFR<0.80的病变存在的患者中,PCI组患者1年内MACE发生率明显低于单纯药物治疗组。因此,对多支血管病变患者,推荐FFR指导的PCI(Ⅱa,B)。近期的大样本注册研究证实,FFR指导的血运重建在真实世界中的获益与随机对照研究中一致;且对FFR在0.75~0.80之间的病变,介入治疗联合最佳药物治疗
较单纯药物治疗预后更好[71]。
关于冠状动脉真性分叉病变,DKCRUSH-Ⅵ研究[72]结果提示,应用"必要时分支支架技术"处理分支病变,FFR指导与造影指导相比较,分支干预的概率减少,而1年MACE无差异。提示FFR可用于指导真性分叉病变的分支介入治疗。
3.光学相干断层成像(optical coherence tomography,OCT):
OCT较IVUS具有更好的空间分辨率,但穿透力较差,因此对发现靠近冠状动脉腔内病变及支架边缘损伤的细微解剖学变化更有价值,但对判定斑块负荷及组织内部特征依然不够准确。迄今尚无大规模前瞻性随机对照试验探讨OCT指导的PCI治疗。
OCT对明确血栓、造影未识别的斑块破裂及支架膨胀不良的价值优于IVUS,有助于查明支架失败原因(Ⅱa,C)。对选择性患者,OCT可优化支架置入(Ⅱb,C)。
三、支架选择
第一代DES(西罗莫司DES和紫杉醇DES)采用永久材料作涂层,可增加晚期和极晚期血栓形成和内皮化不良风险。2006年后逐渐上市的新一代DES采用了与第一代不同的支架框架材料(包括钴铬合金、铂铬合金等)、新的抗增生药物[包括百奥莫司(biolimus)、依维莫司(evemlimus)和佐他莫司(zotamlimus)]以及生物可降解材料作涂层,其生物相容性更好,支架梁更薄,因而DES处管壁较早内皮化,降低了新生内膜过度增生、再狭窄率及晚期和极晚期支架内血栓形成的发生率。中国的I-LOVE-IT 2研究[73]显示,新一代生物可降解涂层DES 1年内靶病变失败率不劣于永久涂层DES,且前者服用6个月双联抗血小板治疗(dual antiplatelet therapy,DAPT)的效果和安全性不劣于12个月[74]。
对以下情况推荐置入新一代DES:NSTE-ACS患者[75,76](Ⅰ,A),STEMI直接PCI患者
[77,78](Ⅰ,A),冠心病合并糖尿病患者[79,80](Ⅰ,A),冠心病合并慢性肾脏疾病(chronic kidney disease,CKD)患者[81,82](Ⅰ,B)。
对以下冠状动脉病变推荐置入新一代DES:开口处病变[83,84](Ⅱa,B)、静脉桥血管病变[85,86](Ⅰ,A)及支架内再狭窄病变[87,88](Ⅰ,A)。对左主干合并分叉病变和慢性闭塞病变,优先考虑应用新一代DES,以降低再狭窄率。
对3个月内计划接受择期非心脏外科手术的患者行PCI时,可考虑置入裸金属支架(bare-metal stent, BMS)或经皮冠状动脉腔内血管成形术(percutaneous transluminal coronary angioplasty,PTCA)[89](Ⅱa,B);对高出血风险、不能耐受12个月DAPT,或因12个月内可能接受侵入性或外科手术必须中断DAPT的患者,建议置入BMS[90]或行
PTCA(Ⅰ,B)。
近年完全生物可吸收支架成为新一代支架的发展方向。目前多种完全生物可吸收支架已开始在中国进行临床试验。ABSORB China研究[91]显示使用完全生物吸收支架后1年支架节段内晚期管腔丢失不劣于金属DES。
四、药物洗脱球囊
药物洗脱球囊通过扩张时球囊表面的药物与血管壁短暂接触,将抗再狭窄的药物释放于病变局部,从而达到治疗的目的。推荐用药物洗脱球囊治疗BMS或DES支架内再狭窄病变[92,93](Ⅰ,A)。虽然目前药物洗脱球囊还有很多问题需进一步研究明确,如远期疗效,是否联合应用切割球囊以及哪种药物效果更好,但对BMS和DES相关的再狭窄病变、多层支架病变、大的分支病变及不能耐受DAPT的患者,药物洗脱球囊可考虑作为优先选择的治疗方案。也有研究显示药物洗脱球囊治疗小血管病变有一定的疗效,但不优于新一代DES。五、血栓抽吸装置
对STEMI患者,基于INFUSE-AMI[94]、TASTE[95]和TOTAL[96]试验结果,不推荐直接PCI前进行常规冠状动脉内手动血栓抽吸(Ⅲ,A)。
在直接PCI时,对经过选择的患者(如血栓负荷较重、支架内血栓),可用手动或机械血栓抽吸,或将其作为应急使用(Ⅱb,C)。
血栓抽吸时应注意技术方法的规范化,以发挥其对血栓性病变的治疗作用。
六、冠状动脉斑块旋磨术
对无法充分扩张的纤维性或严重钙化病变,置入支架前采用旋磨术是合理的[97](Ⅱa,C),可提高钙化病变PCI成功率,但不降低再狭窄率[98]。不推荐对所有病变(包括首次行PCI的病变或支架内再狭窄)常规使用旋磨术[99](Ⅲ,A)。
完全生物可降解支架置入前需要在血管病变处行充分预扩张,当球囊导管预扩张效果不理想时,可考虑应用旋磨术[7]。
七、主动脉内球囊反搏(intra-aortic balloon pump,IABP)及左心室辅助装置
对STEMI合并心原性休克患者,不推荐常规应用IABP[100,101](Ⅲ,A),但对药物治疗后血液动力学仍不能迅速稳定者,可用IABP支持[101](Ⅱa,B)。急性冠状动脉综合征(acute coronary syndromes,ACS)合并机械性并发症患者,发生血液动力学不稳定或心原性休克时可置入IABP(Ⅱa,C)。在严重无复流患者中,IABP有助于稳定血液动力学[102]。
少量国内外经验表明,体外膜肺氧合系统等左心室辅助装置,可降低危重复杂患者PCI病死率,有条件时可选用。
PCI主要并发症防治措施
一、急性冠状动脉闭塞
急性冠状动脉闭塞大多数发生在术中或离开导管室之前,也可发生在术后24 h。可能由主支血管夹层、壁内血肿、支架内血栓、斑块和或嵴移位及支架结构压迫等因素所致。主支或大分支闭塞可引起严重后果,立即出现血压降低、心率减慢,甚至很快导致心室颤动、心室停搏而死亡。上述情况均应及时处理或置入支架,尽快恢复冠状动脉血流。
二、无复流
推荐冠状动脉内注射替罗非班[103,104]、钙通道阻滞剂[105]、硝酸酯类、硝普钠、腺苷等药物,或应用血栓抽吸[106]及置入IABP,可能有助于预防或减轻无复流,稳定血液动力学。关于给药部位,与冠状动脉口部给药比较,经灌注导管在冠状动脉靶病变以远给予替罗非班可改善无复流患者心肌灌注[107]。
三、冠状动脉穿孔
冠状动脉穿孔是少见但非常危险的并发症。发生穿孔时,可先用直径匹配的球囊在穿孔处低压力扩张封堵,对供血面积大的冠状动脉,封堵时间不宜过长,可间断进行,对小穿孔往往能奏效;如果穿孔较大或低压力扩张球囊封堵失败,可置入覆膜支架封堵穿孔处,并停用血小板膜糖蛋白Ⅱb/Ⅲa受体拮抗剂(glycoprotein Ⅱb/Ⅲa receptor inhibitor, GPI),做好心包穿刺准备。监测活化凝血时间(activated clotting time,ACT),必要时应用鱼精蛋白中和肝素。若介入手段不能封堵破口,应行急诊外科手术。若出现心脏压塞则在维持血液动力学稳定的同时立即行心包穿刺或心包切开引流术。指引导丝造成的冠状动脉穿孔易发生延迟心包填塞,需密切观测,若穿孔较大,必要时应用自体脂肪颗粒或弹簧圈封堵。无论哪种穿孔类型,都应在术后随访超声心动图,以防延迟的心包填塞发生。
四、支架血栓形成
支架血栓形成虽发生率较低(30 d内发生率0.6%,3年内发生率2.9%)[108],但病死率高达45%[109]。与支架血栓形成的相关危险因素主要包括:(1)高危患者:如糖尿病、肾功能不全、心功能不全、高残余血小板反应性、过早停用DAPT等;(2)高危病变:如B2或C型复杂冠状动脉病变、完全闭塞、血栓及弥漫小血管病变等;(3)操作因素:置入多个支架、长支架、支架贴壁不良、支架重叠、Crush技术,支架直径选择偏小或术终管腔内径较小、支架结构变形、分叉支架、术后持续慢血流、血管正性重构、病变覆盖不完全或夹层撕裂等操作因素;(4)支架自身因素:对支架药物涂层或多聚物过敏、支架引起血管局部炎症反应、支架断裂、血管内皮化延迟等。
支架内血栓的预防措施包括:(1)术前及围术期充分DAPT和抗凝治疗,对高危患者或病变,可加用GPI,但应充分权衡出血与获益风险。(2)选择合适的介入治疗方案。应权衡利弊,合理选用球囊扩张术、BMS或DES置入术;支架贴壁要尽可能良好,建议高压力释放支架(必要时选用后扩张球囊),尽量减少支架两端血管的损伤;对选择性患者,可选用IVUS指导。(3)强调术后充分使用DAPT。
一旦发生支架血栓,应立即行冠状动脉造影,建议行IVUS或OCT检查,明确支架失败原因,对血栓负荷大者,可采用血栓抽吸,可应用GPI持续静脉输注48 h。球囊扩张或重新置入支架仍是主要治疗方法,必要时可给予冠状动脉内溶栓治疗,应检测血小板功能、了解有无高残余血小板反应性,以便调整抗血小板治疗,对反复、难治性支架血栓形成者,必要时需外科手术治疗。
五、支架脱载
支架脱载较为少见,多见于病变未经充分预扩张(或直接支架术)、近端血管扭曲(或已置入支架)、支架跨越狭窄或钙化病变阻力过大且推送支架过于用力时,或支架置入失败、回撤支架至指引导管内时,因支架与指引导管同轴性不佳、支架与球囊装载不牢,导致支架脱载。术前充分预判病变特点及预处理病变(如钙化病变采取旋磨术预处理等),是防止支架脱落的有效手段。发生支架脱落后,若指引导丝仍在支架腔内,可经导丝送入直径≤1.5 mm小球囊至支架内偏远端,轻微扩张后,将支架缓慢撤入指引导管。若因支架近端变形无法撤入指引导管,可先更换更大外径指引导管重新尝试;也可经另一血管路径,送入抓捕器,将支架捕获后取出。如上述方法无效,可沿指引导丝送入与血管直径1∶1球囊将支架原位释放,或置入另一支架将其在原位贴壁。必要时行外科手术,取出脱载支架。
六、出血
围术期出血是引发死亡及其他严重不良事件的主要危险因素[110]。大出血(包括脑出血)可能直接导致死亡,出血后停用抗栓药物也可能导致血栓事件乃至死亡。
出血的预防措施包括:所有患者PCI术前均应评估出血风险(Ⅰ,C),建议用CRUSADE评分评估出血风险;建议采用桡动脉路径(Ⅰ,A);对出血风险高的患者(如肾功能不全、高龄、有出血史及低体重等),围术期优先选择出血风险较小的抗栓药物,如比伐芦定、磺达肝癸钠等;PCI术中根据体重调整抗凝药物剂量;监测ACT,以避免过度抗凝。
出血后是否停用或调整抗血小板和抗凝药物,需权衡出血和再发缺血事件风险进行个体化评价。出血后通常首先采用非药物一般止血措施,如机械压迫止血;记录末次抗凝药或溶栓药的用药时间及剂量、是否存在肝肾功能损害等;估算药物半衰期;评估出血来源;检测全血细胞计数、凝血指标、纤维蛋白原浓度和肌酐浓度;条件允许时行药物的抗栓活性检测;对血液动力学不稳定者静脉补液和输注红细胞;必要时使用内镜、介入或外科方法局部止血;若出血风险大于缺血风险,尽快停用抗栓药物。若上述方法效果不满意,可进一步采用药物治疗的方法:应用鱼精蛋白中和肝素,以硫酸鱼精蛋白1 mg/80~100 U肝素
剂量注射,总剂量一般不超过50 mg;鱼精蛋白可中和60%的低分子量肝素(low-molecular-weight heparin,LMWH),LMWH用药不足8 h者,可以硫酸鱼精蛋白1 mg/100 U抗Xa活性剂量注射,无效时可追加0.5 mg/100 U抗Xa活性。在停用阿司匹林或替格瑞洛3 d、氯吡格雷5 d后,应再次权衡出血和再发缺血事件的风险,适时恢复适度的抗栓治疗[111,112]。
七、血管并发症
血管并发症主要与穿刺点相关,其危险因素有女性、年龄≥70岁、体表面积<1.6 m2、急诊介入治疗、外周血管疾病和围术期应用GPI[113,114]。
股动脉穿刺主要并发症及其防治方法如下:(1)穿刺点及腹膜后血肿。少量局部出血或小血肿且无症状时,可不予处理。血肿较大、出血过多且血压下降时,应充分加压止血,并适当补液或输血。若PCI后短时间内发生低血压(伴或不伴腹痛、局部血肿形成),应怀疑腹膜后出血,必要时行超声或CT检查,并及时补充血容量。(2)假性动脉瘤。多普勒超声可明确诊断,局部加压包扎,减少下肢活动,多可闭合。对不能压迫治愈的较大假性动脉瘤,可在超声指导下向瘤体内注射小剂量凝血酶治疗。少数需外科手术治疗。(3)动静脉瘘。少部分可自行闭合,也可作局部压迫,但大的动静脉瘘常需外科修补术。(4)动脉夹层和(或)闭塞。可由指引导丝或导管损伤血管内膜或斑块脱落引起。预防的方法包括低阻力和(或)透视下推送导丝、导管。
桡动脉穿刺主要并发症及其防治方法如下。(1)桡动脉术后闭塞:发生率<5%。术前常规行Allen试验检查桡、尺动脉的交通情况,术中充分抗凝,术后及时减压,能有效预防桡动脉闭塞和PCI后手部缺血。(2)桡动脉痉挛:较常见,穿刺时麻醉不充分、器械粗硬、操作不规范或指引导丝进入分支,均增加痉挛发生概率。桡动脉痉挛时,严禁强行拔出导管,应首先经动脉鞘内注射硝酸甘油200~400 μg、维拉帕米200~400 μg或地尔硫5 mg(必要时反复给药),直至痉挛解除后再进行操作。(3)前臂血肿:可由亲水涂层导丝穿孔桡动脉小分支或不恰当应用桡动脉压迫器引起,预防方法为透视下推送导丝;如遇阻力,应做桡动脉造影。术后穿刺局部压迫时应注意确压迫血管穿刺点。(4)筋膜间隙综合征:少见但后果严重。当前臂血肿快速进展引起骨筋膜室内压力增高至一定程度时,常会导致桡、尺动脉及正中神经受压,进而引发手部缺血、坏死。因此一旦发生本征,应尽快外科手术治疗。(5)假性动脉瘤:发生率低于0.01%[115],若局部压迫不能奏效,可行外科手术治疗。
八、对比剂导致的急性肾损伤(contrast induced acute kidney injury,CIAKI)
可应用AGEF评分系统评估CIAKI的风险。影响AGEF评分的因素包括:年龄、eGFR和LVEF。其计算公式为:AGEF评分=年龄/LVEF(%)+1(如eGRF<60 ml·min-1·1.73 m-2)。有研究显示,AGEF评分≤0.92、0.92~1.16和>1.16的CIAKI发生率分别为1.1%、2.3%和5.8%。AGEF评分增高是CIAKI发生的独立预测因素[116]。
水化疗法是应用最早、被广泛接受、可有效减少CIAKI发生的预防措施。对CKD合并慢性心力衰竭患者,可在中心静脉压监测下实施水化治疗,以减少CIAKI的发生[117]。近年来,包括荟萃分析[118]、PRATO-ACS研究[119]、尤其是纳入2 998例中国患者的TRACK-D研究(瑞舒伐他汀10 mg/d)[120]等提示,他汀治疗对预防CIAKI有一定效果。预防CIAKI的措施详见表6。
PCI围术期抗栓治疗
一、抗血小板治疗
目前国内常用的抗血小板药物包括口服阿司匹林、氯吡格雷和替格瑞洛及静脉注射替罗非班。替格瑞洛是一种直接作用、可逆结合的新型P2Y12受体拮抗剂,相比氯吡格雷,具有更快速、强效抑制血小板的特点[131,132],其良好的疗效及安全性已在中国人群中得到证实[133,134]。PLATO研究遗传亚组分析表明,无论是否携带CYP2C19功能缺失等位基因,替格瑞洛治疗ACS的疗效均优于氯吡格雷[135]。中国ACS研究[136]显示,CYP2C19功能缺失与氯吡格雷治疗中的血小板高反应性相关,能增加接受DES患者的血栓性不良事件(心血管死亡、心肌梗死、支架血栓和缺血性卒中)风险。对治疗期高残余血小板反应性患者,替格瑞洛疗效优于高剂量氯吡格雷[137]。替格瑞洛不良反应有出血、诱发心动过缓等,尤其呼吸困难发生率高,PLATO研究提示,呼吸困难的发生率为14.5%,高于氯吡格雷(8.7%)[138]。服用替格瑞洛的患者因不良反应停药,其原因为呼吸困难者占55.6%[139]。抗血小板药物治疗推荐详
见表7。
二、抗凝治疗
PCI术中均应抗凝治疗。目前国内常用的抗凝药物包括普通肝素、依诺肝素、比伐芦定和
磺达肝癸钠。
目前STEMI患者抗凝治疗争议焦点是比伐芦定与肝素孰优孰劣。HORIZONS-AMI[166,167]和EUROMAX[168]研究显示,STEMI患者行直接PCI期间使用比伐芦定与肝素(常规或临时合用GPI)相比,前者可显著减少死亡和主要出血事件,但均伴有急性支架内血栓风险增高。单中心HEAT-PPCI研究[169]显示,与单用肝素(仅紧急情况下合用GPI)相比,比伐芦定不减少主要出血风险,反而显著增加缺血事件(主要是支架内血栓风险显著增高)。新近发表的MATRIX研究显示,与单用肝素对比,比伐芦定降低全因死亡和心性死亡,同时降低出血风险[170]。我国的BRIGHT研究[171]采用延时注射比伐芦定的方式(PCI术后持续静脉滴注术中剂量的比伐芦定3~4 h),发现急性心肌梗死患者直接PCI期间,使用比伐芦定相比肝素或肝素联合GPI可减少总不良事件和出血风险,且不增加支架内血栓风险。纳入22项研究、共22 434例患者的最新荟萃分析[172]表明,比伐芦定与肝素或LMWH联合GPI相比,出血风险最低。抗凝治疗推荐详见表8。
三、特殊人群的抗栓治疗
对某些特殊ACS患者,如糖尿病[184]、CKD、复杂冠状动脉病变、拟接受非心脏外科手术、CYP2C19慢代谢型及高残余血小板反应性者或正在口服抗凝药物的SCAD或ACS患者,其血栓或出血风险相对增高,应用抗血栓药物时更应充分权衡其疗效与安全性。
对糖尿病患者,抗血小板治疗首选替格瑞洛(负荷剂量180 mg,维持剂量90 mg、2次
/d),与阿司匹林联合应用至少12个月[184]。替格瑞洛受肾功能影响较小,因此,CKD患者首选替格瑞洛,且无需调整剂量;在接受透析治疗的患者中使用替格瑞洛经验较少,可选
择氯吡格雷。根据PLATO研究结果,对ACS合并复杂冠状动脉病变患者,首选替格瑞洛。对接受非心脏外科手术患者,抗血小板方案的调整应充分权衡外科手术的紧急程度和患者出血及血栓的风险,需多学科医生会诊,选择优化的抗血小板治疗方案;对心脏事件低危患者,术前5~7 d停用DAPT,术后保证止血充分可重新用药。对于已知CYP2C19慢代谢型的患者,或血小板功能检测提示有残余高反应者,如无出血高危因素,首选替格瑞洛[137]。
对CHA2DS2-VAS评分≥2分、HAS-BLED≤2分的SCAD合并心房颤动患者,建议置入BMS或新一代DES后,口服抗凝药物加阿司匹林100mg/d、氯吡格雷75 mg/d至少1个月,然后口服抗凝药物加阿司匹林100 mg/d或氯吡格雷75 mg/d持续至1年(Ⅱa,C)。对ACS合并心房颤动患者,如HAS-BLED评分≤2分,建议不考虑支架类型,均口服抗凝药物加阿司匹林100 mg/d、氯吡格雷75 mg/d 6个月,然后口服抗凝药物加阿司匹林100 mg/d或氯吡格雷75 mg/d持续至1年(Ⅱa,C)。对HAS-BLED评分≥3分需口服抗凝药物的冠心病患者(包括SCAD和ACS),建议不考虑支架类型,口服抗凝药物加阿司匹林100 mg/d、氯吡格雷75 mg/d至少1个月,然后改为口服抗凝药物加阿司匹林100 mg/d或氯吡格雷75 mg/d(持续时间根据临床具体情况而定)(Ⅱa,C)。
其他围术期药物治疗及术后管理
PCI后控制危险因素、积极进行康复及合理的药物治疗等二级预防措施,对于改善患者预后至关重要,应予重视。
一、康复治疗
康复治疗包括运动、合理膳食、戒烟、心理调整和药物治疗5个方面。ACS患者PCI治疗后应实施以合理运动为主的心脏康复治疗[185](Ⅱa,A)。同时,应注意合理的膳食,控制总热量和减少饱和脂肪酸、反式脂肪酸以及胆固醇摄入。超重和肥胖者在6~12个月内减重5%~10%,使体重指数≤25 kg/m2;腰围控制在男性≤90 cm、女性≤85 cm。彻底戒烟,并避免被动吸烟;严格控制酒精摄入(男性≤20 g/d,非孕期女性≤10 g/d)。另外,有研究显示,冠心病患者PCI后焦虑、抑郁与术后10年全因死亡增加相关,其中抑郁是独立的预测因素[186]。因此,需调整患者PCI术后的心理状态。首先,需对患者进行多次、耐心的程序化教育,这是帮助患者克服不良情绪的关键之一。内容包括什么是冠心病、冠心病的发病原因及诱发因素、不适症状的识别、发病后的自救、如何保护冠状动脉等,并教会患者监测血压和脉搏。使患者充分了解自己的疾病及程度,缓解紧张情绪,提高治疗依从性和自信心,学会自我管理。其次,需识别患者的精神心理问题,并给予对症处理。其措施包括:(1)评估患者的精神心理状态。(2)了解患者对疾病的担忧、患者的生活环境、经济状况和社会支持,给予有针对性的治疗措施。(3)对患者进行健康教育和咨询。促进患者伴侣和家庭成员、朋友等参与患者的教育和咨询。(4)轻度焦虑抑郁治疗以运动康复为主,对焦虑和抑郁症状明显者给予对症药物治疗,病情复杂或严重时应请精神科会诊或转诊治疗[187]。
二、调脂治疗
1.术前他汀预处理:
对ACS患者,无论是否接受PCl治疗,无论基线胆固醇水平高低,均应及早服用他汀,必要时联合服用依折麦布,使低密度脂蛋白胆固醇(LDL-C)<1.8 mmol/L。目前缺少硬终点高质量随机对照试验证据支持在这些患者PCI术前早期使用负荷高剂量他汀,亚洲与我国的研究结果显示PCI术前使用负荷剂量他汀不优于常规剂量[188,189],不建议对ACS患者PCI术前使用负荷剂量他汀。
2.长期调脂治疗:
对冠心病患者,不论何种类型,均推荐长期服用他汀类药物,使LDL-C<1.8
mmol/L[190](Ⅰ,A),且达标后不应停药或盲目减小剂量。若应用最大可耐受剂量他汀类药物治疗后LDL-C仍不能达标,可联合应用非他汀类调脂药物[191](Ⅰ,B)。
三、冠心病合并高血压
进行有效的血压管理(包括药物和非药物治疗措施),控制血压<140/90 mmHg(1 mmHg=
0.133 kPa)[7](Ⅱa,A)。ACS患者降压药物建议首选血管紧张素转换酶抑制剂(ACEI)[不能耐受者可用血管紧张素Ⅱ受体拮抗剂(ARB)代替]和β受体阻滞剂。β受体阻滞剂可改善心肌梗死患者生存率,应结合患者的临床情况采用最大耐受剂量长期治疗。
有近期心肌梗死病史的高血压患者,建议服用β受体阻滞剂和ACEI/ARB。对有心绞痛的高血压患者,应给予降压治疗,首选β受体阻滞剂和钙拮抗剂[192](Ⅰ,A)。
四、冠心病合并糖尿病
积极控制饮食和改善生活方式并给予降糖药物治疗。应尽量选择不易导致低血糖的药物,如二甲双胍、DPP-4抑制剂、SGLT2抑制剂等。推荐将糖化血红蛋白控制在7%以下[7](Ⅰ,
A)。
五、冠心病合并心力衰竭
建议冠心病合并心力衰竭或心肌梗死后LVEF<40%的患者尽早服用ACEI[193](Ⅰ,A);如不能耐受ACEI,选用ARB[194](Ⅰ,A)。所有心力衰竭或左心室功能不全患者如无禁忌,尽早服用β受体阻滞剂[195],至最大可耐受剂量(Ⅰ,A),并长期服用,以降低PCI后患者心肌梗死及心原性死亡发生率。症状持续(NYHA心功能Ⅱ~Ⅳ级)且LVEF<35%的患者,可在服用ACEI/ARB及β受体阻滞剂的基础上,给予醛固酮受体拮抗剂[196](I,A)。
窦性心律、心率>70次/min且LVEF<35%的心力衰竭患者,给予伊伐布雷定治疗可降低住院风险;如患者症状持续(NYHAⅡ~Ⅳ级),可在服用建议剂量的β受体阻滞剂(或已达最大耐受量)、ACEI/ARB及醛固酮受体拮抗剂的基础上,给予伊伐布雷定[197](Ⅱa,B)。
六、ACS后
心功能正常ACS患者,PCI后服用β受体阻滞剂持续至少3年[198](Ⅰ,B),至最大可耐受剂量,以降低PCI后心肌梗死及心原性死亡发生率。
七、PCI术后随访
对某些特定患者(从事危险行业,如飞行员、驾驶员或潜水员,以及竞技运动员;需参与高耗氧量娱乐活动;猝死复苏;未完全血运重建;PCI过程复杂;合并糖尿病;多支病变术后非靶血管仍有中等程度狭窄),建议早期复查冠状动脉造影或CT血管成像(Ⅱa,C)。PCI 术后>2年的患者应常规行负荷试验(Ⅱb,C),负荷试验提示中高危(低负荷出现缺血、试验早期出现缺血发作、多区域的室壁运动异常或可逆的灌注缺损)的患者应复查冠状动脉造影(Ⅰ,C)。高危患者(如无保护左主干狭窄)PCI后无论有无症状,术后3~12个月复查冠状动脉造影(Ⅱb,C)。
(执笔:韩雅玲)
专家组成员(按姓氏拼音排序):曹蘅(皖南医学院弋矶山医院),曾武涛(中山大学附属第一医院),常荣(青海省人民医院),陈纪言(广东省人民医院),陈良龙(福建医科大学附属协和医院),陈茂(四川大学华西医院),陈绍良(南京市第一医院),陈玉国(山东大学齐鲁医
院),陈韵岱(解放军总医院),丛洪良(天津胸科医院),崔连群(山东省立医院),丁世芳(解放军广州军区武汉总医院),杜志民(中山大学附属第一医院),方唯一(上海胸科医院),冯颖青(广东省人民医院),傅国胜(浙江大学医学院附属邵逸夫医院),傅向华(河北医科大学附属第二医院),高传玉(河南省人民医院),高润霖(中国医学科学院阜外医院),高炜(北京大学第三医院),葛均波(复旦大学附属中山医院),郭丽君(北京大学第三医院),郭延松(福建省立医院),韩雅玲(沈阳军区总医院),何奔(上海交通大学医学院附属仁济医院),侯静波(哈尔滨医科大学附属第二医院),侯玉清(南方医科大学附属南方医院),胡大一(北京大学人民医院),华琦(首都医科大学附属北京宣武医院),黄岚(第三军医大学附属新桥医院),惠永明(北京丰台医院),霍勇(北京大学第一医院),贾大林(中国医科大学附属第一医院),贾绍斌(宁夏医科大学附属医院),江洪(武汉大学人民医院),江力勤(嘉兴学院附属第二医院),姜铁民(武警医学院附属医院),荆全民(沈阳军区总医院),荆志成(中国医学科学院阜外医院),黎辉(大庆油田总医院),李保(山西心血管病研究所),李春坚(江苏省人民医院),李浪(广西医科大学附属第一医院),李潞(沈阳医学院附属沈洲医院),李田昌(解放军海军总医院),李晓东(中国医科大学附属盛京医院),李晓燕(济南军区总医院),李妍(第四军医大学附属第一医院),李毅(沈阳军区总医院),梁春(第二军医大学附属长征医院),刘斌(吉林大学第二医院),刘朝中(解放军空军总医院),刘惠亮(武警总医院),刘健(北京大学人民医院),刘强(深圳市孙逸仙心血管医院),吕树铮(首都医科大学附属北京安贞医院),马根山(东南大学附属中大医院),马礼坤(安徽省立医院),马丽萍(第二军医大学附属长海医院),马依彤(新疆医科大学附属第一医院),聂绍平(首都医科大学附属北京安贞医院),牛丽丽(北京军区总医院),钱菊英(复旦大学附属中山医院),乔树宾(中国医学科学院阜外医院),邱春光(郑州大学附属第一医院),史旭波(首都医科大学附属同仁医院),苏国海(济南市中心医院),苏晞(武汉亚洲心脏病医院),孙艺红(北京大学人民医院),孙英贤(中国医科大学附属第一医院),陶剑虹(四川省人民医院),陶凌(第四军医大学附属第一医院),田军(武警后勤学院附属医院),田野(哈尔滨医科大学附属第一医院),王斌(沈阳军区总医院),王刚(鞍山市中心医院),王海昌(第四军医大学附属第一医院),王建安(浙江大学医学院附属第二医院),王建昌(解放军空军总医院),王乐丰(首都医科大学附属北京朝阳医院),王守力(解放军第三○六医院),王伟民(北京大学人民医院),王效增(沈阳军区总医院),温尚煜(大庆油田总医院),吴翔(南通大学附属医院),吴永健(中国医学科学院阜外医院),徐标(南京市鼓楼医院),徐波(中国医学科学院阜外医院),徐亚伟(上海同济大学附属第十人民医院),许锋(北京医院),颜红兵(中国医学科学院阜外医院),杨丽霞(成都军区昆明总医院),杨跃进(中国医学科学院阜外医院),叶平(解放军总医院),于波(哈尔滨医科大学附属第二医院),余再新(中南大学湘雅医院),袁晋青(中国医学科学院阜外医院),袁祖贻(西安交通大学附属第一医院),张俊杰(南京市第一医院),张立(四川大学华西医院),张明(辽宁省金秋医院),张奇(上海交通大学医学院附属瑞金医院),张瑞岩(上海交通大学医学院附属瑞金医院),张文琪(吉林大学中日联谊医院),张育民(长沙市第三医院),张钲(兰州大学附属第一医院),赵红丽(沈阳医学院附属沈洲医院),赵水平(中南大学湘雅二医院),赵仙先(第二军医大学附属长海医院),郑扬(吉林大学第一医院),钟诗龙(广东省人民医院),周玉杰(首都医科大学附属北京安贞医院),朱建华(浙江医科大学附属第一医院)
参考文献
[1] 中华医学会心血管病学分会介入心脏病学组,中华心血管病杂志编辑委员会. 中国经皮冠状动脉介入治疗指南2012(简本)[J]. 中华心血管病杂志,2012,40(4):271-
277.DOI:10.3760/cma.j.issn.0253-3758.2012.04.003.
[2] 中华医学会心血管病学分会,中华心血管病杂志编辑委员会. 经皮冠状动脉介入治疗指南(2009)[J].中华心血管病杂志,2009,37(1):4-25.DOI:10.3760/cma.j.issn.0253-3758.2009.01.003.
[3] Roffi M, Patrono C, Collet JP, et al. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without
persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-segment Elevation of the European Society of Cardiology (ESC)[J].Eur Heart J, 2016,
37(3):267-315.DOI:10.1093/eurheartj/ehv320.
[4] Levine GN, Bates ER, Blankenship JC, et al. 2015 ACC/AHA/SCAI focused update on primary percutaneous coronary intervention for patients with ST-elevation myocardial infarction: an update of the 2011 ACCF/AHA/SCAI guideline for percutaneous coronary intervention and the 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Society for Cardiovascular Angiography and Interventions[J]. Circulation, 2016, 133:1135-
1147.DOI:10.1161/CIR.0000000000000336.
[5] Montalescot G, Sechtem U, Achenbach S, et al. 2013 ESC guidelines on the management of stable coronary artery disease: the Task Force on the Management of Stable Coronary Artery Disease of the European Society of Cardiology[J]. Eur Heart J, 2013,34(38):2949-3003.DOI:10.1093/eurheartj/eht296.
[6] O′Gara PT, Kushner FG, Ascheim DD, et al. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines[J]. Circulation, 2013,127(4):e362-
e425.DOI:10.1161/CIR.0b013e3182742cf6.
[7] Windecker S, Kolh P, Alfonso F, et al. 2014 ESC/EACTS Guidelines on myocardial revascularization: the Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS) developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI)[J]. Eur Heart J, 2014,35(37):2541-2619.DOI:10.1093/eurheartj/ehu278.
[8] Fihn SD, Blankenship JC, Alexander KP, et al. 2014
ACC/AHA/AATS/PCNA/SCAI/STS focused update of the guideline for the diagnosis and management of patients with stable ischemic heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines, and the American Association for Thoracic Surgery, Preventive Cardiovascular Nurses Association, Society for Cardiovascular Angiography and Interventions, and Society of Thoracic Surgeons[J].J Thorac Cardiovasc Surg, 2015, 149(3):e5-e23.DOI:10.1016/j.jtcvs.2014.11.002.
[9] Amsterdam EA, Wenger NK, Brindis RG, et al. 2014 AHA/ACC guideline for the management of patients with non-ST-elevation acute coronary syndromes: a report
of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines[J]. Circulation, 2014,130(25):e344-
e426.DOI:10.1161/CIR.0000000000000134.
[10] Nashef SA, Roques F, Sharples LD, et al. EuroSCORE Ⅱ[J]. Eur J Cardiothorac Surg,2012,41(4):734-745.DOI:10.1093/ejcts/ezs043.
[11] Sianos G, Morel MA, Kappetein AP, et al. The SYNTAX Score: an angiographic tool grading the complexity of coronary artery disease[J]. EuroIntervention, 2005,1(2):219-227.
[12] Farooq V, van Klaveren D, Steyerberg EW, et al. Anatomical and clinical characteristics to guide decision making between coronary artery bypass surgery and percutaneous coronary intervention for individual patients: development and validation of SYNTAX score Ⅱ[J]. Lancet, 2013,381(9867):639-
650.DOI:10.1016/S0140-6736(13)60108-7.
[13] Xu B, Généreux P, Yang Y, et al. Validation and comparison of the long-term prognostic capability of the SYNTAX score-Ⅱ among 1528 consecutive patients who underwent left main percutaneous coronary intervention[J]. JACC Cardiovasc Interv, 2014,7(10):1128-1137.DOI:10.1016/j.jcin.2014.05.018.
[14] Chen SL, Han YL, Zhang YJ, et al. The anatomic- and clinical-based NERS (new risk stratification) score Ⅱ to predict clinical outcomes after stenting unprotected left main coronary artery disease: results from a multicenter, prospective, registry study[J]. JACC Cardiovasc Interv, 2013,6(12):1233-1241.DOI:10.1016/j.jcin.2013.08.006.
[15] Bittl JA, He Y, Jacobs AK, et al. Bayesian methods affirm the use of percutaneous coronary intervention to improve survival in patients with unprotected left main coronary artery disease[J]. Circulation, 2013,
127(22):2177-2185.DOI:10.1161/CIRCULATIONAHA.112.000646.
[16] Hueb W, Lopes N, Gersh BJ, et al. Ten-year follow-up survival of the medicine, angioplasty, or surgery study (MASS Ⅱ): a randomized controlled clinical trial of 3 therapeutic strategies for multivessel coronary artery disease[J]. Circulation, 2010,122(10):949-
957.DOI:10.1161/CIRCULATIONAHA.109.911669.
[17] Smith PK, Califf RM, Tuttle RH, et al. Selection of surgical or percutaneous coronary intervention provides differential longevity benefit[J]. Ann Thorac Surg, 2006,82(4):1420-1428;discussion 1428-
1429.DOI:10.1016/j.athoracsur.2006.04.044.
[18] Frye RL, August P, Brooks MM, et al. A randomized trial of therapies for type 2 diabetes and coronary artery disease[J]. N Engl J Med, 2009,
360(24):2503-2515.DOI:10.1056/NEJMoa0805796.
[19] Chaitman BR, Hardison RM, Adler D, et al. The bypass angioplasty revascularization investigation 2 diabetes randomized trial of different treatment strategies in type 2 diabetes mellitus with stable ischemic heart
disease: impact of treatment strategy on cardiac mortality and myocardial infarction[J]. Circulation, 2009,120(25):2529-
2540.DOI:10.1161/CIRCULATIONAHA.109.913111.
[20] Hannan EL, Samadashvili Z, Cozzens K, et al. Comparative outcomes for patients who do and do not undergo percutaneous coronary intervention for stable coronary artery disease in New York[J]. Circulation, 2012,125(15):1870-1879.DOI:10.1161/CIRCULATIONAHA.111.071811.
[21] Hannan EL, Wu C, Walford G, et al. Drug-eluting stents vs. coronary-artery bypass grafting in multivessel coronary disease[J]. N Engl J Med, 2008,
358(4):331-341.DOI:10.1056/NEJMoa071804.
[22] De Bruyne B, Pijls NH, Kalesan B, et al. Fractional flow reserve-guided PCI versus medical therapy in stable coronary disease[J]. N Engl J Med, 2012,367(11):991-1001.DOI:10.1056/NEJMoa1205361.
[23] Boden WE, O′Rourke RA, Teo KK, et al. Optimal medical th erapy with or without PCI for stable coronary disease[J]. N Engl J Med, 2007,356(15):1503-1516.DOI:10.1056/NEJMoa070829.
[24] Shaw LJ, Berman DS, Maron DJ, et al. Optimal medical therapy with or without percutaneous coronary intervention to reduce ischemic burden: results from the clinical outcomes utilizing revascularization and aggressive drug evaluation (COURAGE) trial nuclear substudy[J]. Circulation, 2008,
117(10):1283-1291.DOI:10.1161/CIRCULATIONAHA.107.743963.
[25] Bangalore S, Pursnani S, Kumar S, et al. Percutaneous coronary
intervention versus optimal medical therapy for prevention of spontaneous myocardial infarction in subjects with stable ischemic heart disease[J]. Circulation, 2013,127(7):769-781.DOI:10.1161/CIRCULATIONAHA.112.131961.
[26] Pursnani S, Korley F, Gopaul R, et al. Percutaneous coronary intervention versus optimal medical therapy in stable coronary artery disease: a systematic review and meta-analysis of randomized clinical trials[J]. Circ Cardiovasc Interv, 2012,5(4):476-490.DOI:10.1161/CIRCINTERVENTIONS.112.970954.
[27] Sch?mig A, Mehilli J, de Waha A, et al. A meta-analysis of 17 randomized trials of a percutaneous coronary intervention-based strategy in patients with stable coronary artery disease[J]. J Am Coll Cardiol, 2008,52(11):894-
904.DOI:10.1016/j.jacc.2008.05.051.
[28] Thomas S, Gokhale R, Boden WE, et al. A meta-analysis of randomized controlled trials comparing percutaneous coronary intervention with medical therapy in stable angina pectoris[J]. Can J Cardiol, 2013,29(4):472-
482.DOI:10.1016/j.cjca.2012.07.010.
[29] Aziz O, Rao C, Panesar SS, et al. Meta-analysis of minimally invasive internal thoracic artery bypass versus percutaneous revascularisation for isolated lesions of the left anterior descending artery[J]. BMJ, 2007,
334(7594):617.DOI:10.1136/bmj.39106.476215.BE.
[30] Blazek S, Holzhey D, Jungert C, et al. Comparison of bare-metal stenting with minimally invasive bypass surgery for stenosis of the left anterior descending coronary artery: 10-year follow-up of a randomized trial[J]. JACC Cardiovasc Interv, 2013,6(1):20-26.DOI:10.1016/j.jcin.2012.09.008.
[31] Mohr FW, Morice MC, Kappetein AP, et al. Coronary artery bypass graft surgery versus percutaneous coronary intervention in patients with three-vessel disease and left main coronary disease: 5-year follow-up of the randomised, clinical SYNTAX trial[J]. Lancet, 2013,381(9867):629-638.DOI:10.1016/S0140-6736(13)60141-5.
[32] Head SJ, Davierwala PM, Serruys PW, et al. Coronary artery bypass graftingvs. percutaneous coronary intervention for patients with three-vessel disease: final five-year follow-up of the SYNTAX trial[J]. Eur Heart J, 2014,35(40):2821-2830.DOI:10.1093/eurheartj/ehu213.
[33] Farkouh ME, Domanski M, Sleeper LA, et al. Strategies for multivessel revascularization in patients with diabetes[J]. N Engl J Med, 2012,
367(25):2375-2384.DOI:10.1056/NEJMoa1211585.
[34] Scirica BM, Morrow DA, Budaj A, et al. Ischemia detected on continuous electrocardiography after acute coronary syndrome: observations from the MERLIN-TIMI 36 (metabolic efficiency with ranolazine for less ischemia in non-ST-elevation acute coronary syndrome-thrombolysis in myocardial infarction 36) trial[J]. J Am Coll Cardiol, 2009,53(16):1411-
1421.DOI:10.1016/j.jacc.2008.12.053.
[35] Akkerhuis KM, Klootwijk PA, Lindeboom W, et al. Recurrent ischaemia during continuous multilead ST-segment monitoring identifies patients with acute coronary syndromes at high risk of adverse cardiac events; meta-analysis of three studies involving 995 patients[J]. Eur Heart J, 2001,22(21):1997-
2006.DOI:10.1053/euhj.2001.2750.
[36] Katritsis DG, Siontis GC, Kastrati A, et al. Optimal timing of coronary angiography and potential intervention in non-ST-elevation acute coronary syndromes[J]. Eur Heart J, 2011,32(1):32-40.DOI:10.1093/eurheartj/ehq276. [37] Mehta SR, Granger CB, Boden WE, et al. Early versus delayed invasive intervention in acute coronary syndromes[J]. N Engl J Med, 2009,360(21):2165-2175.DOI:10.1056/NEJMoa0807986.
[38] Bavry AA, Kumbhani DJ, Rassi AN, et al. Benefit of early invasive therapy in acute coronary syndromes: a meta-analysis of contemporary randomized
clinical trials[J]. J Am Coll Cardiol, 2006,48(7):1319-
1325.DOI:10.1016/j.jacc.2006.06.050.
[39] Fox KA, Clayton TC, Damman P, et al. Long-term outcome of a routine versus selective invasive strategy in patients with non-ST-segment elevation acute coronary syndrome a meta-analysis of individual patient data[J]. J Am Coll Cardiol, 2010,55(22):2435-2445.DOI:10.1016/j.jacc.2010.03.007.
中国经皮冠状动脉介入治疗指南(2016).
中国经皮冠状动脉介入治疗指南(2016) 中华心血管病杂志,第44卷第5期第382页-第400页 自"中国经皮冠状动脉介入治疗指南2012(简本)" [1]更新以来,在经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)及其相关领域又积累了众多临床证据。为此,中华医学会心血管病学分会介入心脏病学组、中国医师协会心血管内科医师分会血栓防治专业委员会、中华心血管病杂志编辑委员会组织专家组,在2009和2012年中国PCI 指南[1,2]的基础上,根据最新临床研究成果、特别是结合中国人群的大型随机临床试验结果,参考最新美国心脏病学学院/美国心脏协会(ACC/AHA)以及欧洲心脏病学学会(ESC)等组织发布的相关指南[3,4,5,6,7,8,9]、并结合我国国情及临床实践,对PCI治疗领域的热点和焦点问题进行了全面讨论并达成一致共识,在此基础上编写了本指南。 为便于读者了解PCI对某一适应证的价值或意义,本指南对推荐类别的表述沿用国际通用的方式。 Ⅰ类:指已证实和(或)一致公认有益、有用和有效的操作或治疗,推荐使用。 Ⅱ类:指有用和(或)有效的证据尚有矛盾或存在不同观点的操作或治疗。 Ⅱa类:有关证据/观点倾向于有用和(或)有效,应用这些操作或治疗是合理的。 Ⅱb类:有关证据/观点尚不能被充分证明有用和(或)有效,可考虑应用。 Ⅲ类:指已证实和(或)一致公认无用和(或)无效,并对一些病例可能有害的操作或治疗,不推荐使用。 对证据来源的水平表达如下。 证据水平A:资料来源于多项随机临床试验或荟萃分析。 证据水平B:资料来源于单项随机临床试验或多项非随机对照研究。 证据水平C:仅为专家共识意见和(或)小规模研究、回顾性研究和注册研究。 概述 一、建立质量控制体系 对于每一个开展PCI的中心,应建立质量控制体系(Ⅰ,C),包括:(1)回顾分析整个中心的介入治疗结局和质量;(2)回顾分析每个术者的介入治疗结局和质量;(3)引入风险调控措施;(4)对复杂病例进行同行评议;(5)随机抽取病例作回顾分析。 资质要求:每年完成的心血管疾病介入诊疗病例不少于200例,其中治疗性病例不少于100例,主要操作者具备介入治疗资质且每年独立完成PCI>50例,血管造影并发症发生率低于0.5%,心血管病介入诊疗技术相关病死率低于0.5%。 二、危险评分系统 风险-获益评估是对患者进行血运重建治疗决策的基础。运用危险评分可以预测心肌血运重建手术病死率或术后主要不良心脑血管事件(major adverse cardiac and cerebrovascular event,MACCE)发生率,指导医师对患者进行风险分层,从而为选择适宜的血运重建措施提供参考。常用的危险评分系统特点如下。 1.欧洲心脏危险评估系统Ⅱ(EuroSCORE Ⅱ)[7,10,11]:
冠状动脉造影及经皮冠状动脉介入治疗
冠状动脉造影及经皮冠状动脉介入治疗 一冠脉造影﹙CAG﹚简介 1 1929年,Werner Forssmann完成首例心导管术 2 1959年美国儿科医师Sones为一个有主动脉病变的患者做心脏造影的时候,利用特制的头端呈弧形的造影导管,误经肱动脉逆行送入主动脉根部,并将导管远端分别置于左、右冠状动脉口,将约30ml的造影剂直接注入左、右冠状动脉内而使其清晰显影,令人惊讶的是,患者并没有像预期的那样发生室颤,因为在这之前医疗界普遍认为向冠状动脉里注射造影剂是非常危险的(会引起室颤),从而开创了选择性冠状动脉造影术。 3 1964年,Sones完成了第一例经肱动脉切开的冠状动脉造影术。 4 1967年,Judkins采用穿刺股动脉的方法进行选择性冠状动脉造影,使这一技术进一步完善并得以广泛推广应用。 二什么是冠脉造影 选择性冠状动脉造影就是利用血管造影机,通过特制定型的心导管经皮穿刺入下肢股动脉或上肢挠动脉,沿降主动脉或上肢动脉逆行至升主动脉根部,然后探寻左或右冠状动脉口插入,注入造影剂,使冠状动脉显影。这样就可清楚地将整个左或右冠状动脉的主干及其分支的血管腔显示出来,可以了解血管有无狭窄病灶存在,对病变部位、范围、严重程度、血管壁的情况等作出明确诊断,决定治疗方案(介入、手术或内科治疗),还可用来判断疗效。这是一种较为安全可靠的有创诊断技术,现已广泛应用于临床,被认为是诊断冠心病的“金标准”。IVUS、OCT、FFR等逐步在临床应用,发现部分在冠状动脉造影中显示正常的血管段存在内膜增厚或斑块,但由于IVUS等检查费用较为昂贵,操作较为复杂,现在并不是常规检查手段。 三曹妃甸区医院如何开展起的CAG
经皮冠状动脉介入治疗
经皮冠状动脉介入治疗
经皮冠状动脉介入治疗 经皮冠状动脉介入治疗(percutaneoustransluminalcoronaryinterven tion, PCI) 是指采用经皮穿刺技术送入球囊导管或其他相关器械,解除冠状动脉狭窄或梗阻,重建冠状动脉血流的技术。主要包括经皮冠状动脉腔内成形术(PTCA)、支架置入 术、定向性斑块旋切术(DCA)、斑块旋切吸引术(TEC)、斑块旋磨术及激光血管成 形等。本章重点介绍PCI的基本技术--PTCA 和支架置入术。 【适应证】 确定PCI的适应证主要是权衡其收益和风险。收益大于风险即可为相对适 应证,反之则为相对禁忌证。权衡收益和风险须考虑下列因素:①患者全身情况能 否耐受操作;②心肌缺血严重程度;③病变形态、特征,手术操作成功的可能性;
④处理并发症的能力;⑤远期效果;⑥费用。 1.稳定性劳力型心绞痛 (1)药物治疗后仍有症状、并有缺血证据,狭窄≥50%、单支或多支病变患者。 (2)症状虽不严重或无明显症状,但负荷试验显示广泛心肌缺血,病变治疗成 功把握性大,手术风险低。 (3)PCI后再狭窄病变。 (4)左主干病变不宜冠状动脉旁路移植术(CABG)者。 (5)CABG术后:CABG术后移植血管局限性狭窄,近远端吻合口病变或自身 血管新发生的病变导致心绞痛或有客观缺血证据者。 (6)有外科手术禁忌或要经历大的非心脏手术的冠心病患者。 2.无ST段抬高急性冠状动脉综合征(不稳定性心绞痛及非Q波心肌梗死) 对高危以及经充分药物治疗后不能稳定的患者提倡早期介入治疗。 3.急性ST段抬高心肌梗死(AMI)
稳定性冠心病诊断与治疗指南(三)
稳定性冠心病诊断与治疗指南(三) 危险因素管理 一、血脂管理 饮食治疗和改善生活方式是血脂异常治疗的基础措施。无论是否选择药物调脂治疗,都必须坚持控制饮食和改善生活方式。强烈推荐SCAD患者坚持日常身体锻炼和控制体重(Ⅰ,B)[109-110]。建议低脂饮食。药物治疗推荐以他汀类药物为主。 二、血压管理 建议所有SCAD患者进行生活方式调整:控制体重,增加身体锻炼,节制饮酒,限盐,增加新鲜果蔬和低脂饮食,避免过度劳累(Ⅰ,B)[111-114]。如果SCAD 患者血压≥140 / 90 mmHg(1 mmHg=0.133kPa),在生活方式调整的同时,考虑使用降压药物(Ⅰ,A)[115-116]。降压药物应根据患者具体情况选择,但建议包括ACEI或ARB和/或β受体阻滞剂,治疗目标应<140/90 mmHg(Ⅰ,B)[117-118]。糖尿病患者血压控制目标建议为130/80mmHg[119]。
三、糖尿病患者血糖管理 对于糖尿病病程较短,预期寿命较长的SCAD患者,HbA1c目标值≤7%是合理的(Ⅱa,B)[120-121]。 对年龄较大、糖尿病病程较长、存在低血糖高危因素患者,HbA1c 目标应控制在<7.5%或<8.0%,对慢性疾病终末期患者,如纽约心脏协会(NYHA)心功能Ⅲ~Ⅳ级、终末期肾脏病、恶性肿瘤伴有转移、中重度认知功能障碍等,HbA1c控制目标可适当放宽至<8.5%(Ⅱa,C)[122-123]。为达到HbA1c的目标值,推荐给予药物治疗(Ⅱb,A)[124-125]。SCAD患者不应选用罗格列酮治疗(Ⅲ,C)。 四、体育锻炼 建议所有SCAD患者在日常锻炼强度(如工作间歇的步行,家务劳动)的基础上,每周至少5 d进行30~60 min中等强度的有氧锻炼,如健步走,以增强心肺功能(Ⅰ,B)[126-127]。对所有患者,建议根据体育锻炼史和/或运动试验情况进行风险评估来指导治疗和改善预后(Ⅰ,B)[128-129]。推荐首诊时发现具有缺血风险的患者参与医学监督项目(如心脏康复)和由医生指导下基于家庭的锻炼项目(Ⅰ,A)[126,130]。
经皮冠状动脉腔内成形术及冠状动脉支架
经皮冠状动脉腔内成形术及冠状动脉支架 经皮冠状动脉腔内成形术(PTCA)是采用经皮穿刺的方法,将球囊导管经动脉逆行至病变的冠状动脉,将液压球囊加压扩张狭窄的冠状动脉,从而使血管的内腔扩大,心肌血供增加,缓解冠状动脉缺血预防心肌梗死的发生。随着该项技术的成熟及冠状动脉内支架的应用,不仅可以治疗心绞痛的病人对于急性心肌梗死直接的PTCA可以大大的降低病死率。且已经成为治疗冠心病的重要手段。 一PTCA的作用机制 虽然PTCA已经广泛应用与临床,但是其作用机制尚未完全定论。目前认为,球囊扩张导致粥样硬化斑块撕裂,使血管中层及外膜被球囊扩张,伸展,使狭窄的动脉官腔扩大,PTCA术后,内皮细胞再生及中层平滑肌细胞增生,使撕裂的斑块及内膜修复,官腔变为光滑。 二PTCA的导管系统 PTCA导管系统由引导导管,导引钢丝和球囊导管三部分组成。PTCA术者必须全面了解导管的进展和熟悉各种器械的构造,性能和操作技巧,善于根据不同的血管解剖和病变特征来选择最佳器械是一个成功者的诀窍。 (一)引导导管形状类似诊断性造影导管,两者的区别在于引导导管官腔大,具有较高的硬度良好的旋转控制能力和记忆功能,以保持预制的形状。股动脉引导导管长100
厘米,外径8F最常用,高流量的7F大腔引导导管也在临床应用。近年来普遍软头,尖端有标记的引导导管,大大的增加了使用的安全性,减少导管尖端损伤冠状动脉口的危险。 理想的引导导管需能提供足够的后座支撑力。从而有組于导丝和球囊通过高度狭窄或复杂的病变区;提供清晰的显影效果,有利于结果的判定。引导导管的选择需根据主动脉根部的宽度,冠状动脉开口的位置,近端中走行和冠状动脉病变处的解剖特点等因素决定。选择适当的引导导管是PTCA成功的选决条件之一。而使引导导管与冠状动脉口及血管近端保持同轴位置,在球囊导管通过严重狭窄或远端病变时,提供良好的后坐力而不阻断血流使压力衰减。左冠状动脉的PTCA可以选择JUDKINS型引导导管,回旋支的PTCA,选择amplatz,L型导管常较Judkins导管跟能保持同轴关系而提供足够的后坐力。由于冠状动脉从升主动脉发出后赱行方向有很大的生理变异,往往造成引导导管的后坐支持力不良,而导致手术失败。当右冠状动脉的近端走向与升主动脉垂直时,选用Judkins型;如右冠状动脉从升主动脉发出后先向上然后以锐角拐向下走形,则可以用Amplatz型;若右冠状动脉从主动脉发出后向下走行,应选用Amplatz型或多用途引导导管。 (二)球囊导管 1 球囊导管可以分三类
选择性冠状动脉造影术操作规范
选择性冠状动脉造影术操作规范 【原理】 冠状动脉造影导管选择性插入冠状动脉开口,注射造影剂显示冠状动脉解剖走行及病变。 【适应证】 1.临床怀疑冠心病者,为明确诊断。 2.临床诊断冠心病者,根据造影结果选择治疗方式(如介入治疗、冠状动脉旁 路移植术或药物治疗)。 3.急性心肌梗死,须急诊介入治疗或外科手术治疗者。 4.血管重建术后疗效随访。 5.心脏外科手术前,了解冠状动脉情况。 6.特殊职业者。 【禁忌证】 1.除了精神正常、有行为和责任能力的患者拒绝该项检查及拒绝签署知情同意书外,无绝对禁忌证。 2.相对禁忌证主要有以下几种。
(1)未控制的充血性心力衰竭或急性左心衰竭; (2)未控制的严重心律失常; (3)未控制的严重电解质紊乱或洋地黄中毒; (4)未控制的高血压; (5)急性脑卒中; (6)并发感染性疾病或其他未控制的全身性疾病; (7)急性心肌炎; (8)主动脉瓣心内膜炎; (9)活动性出血或严重出血倾向; (10)正在口服抗凝药(如华法林)者; (11)急性心肌梗死无上述适应证者; (12)严重碘造影剂过敏; (13)严重肾功能衰竭和(或)无尿,除非已准备透析治疗清除造影剂和体内过多的液体,否则不宜进行造影。 【术前准备】 1.术前检查:三大常规、凝血功能、电解质、肝肾功能、胸片、心脏彩超、心电图、血型、传染病检查等。
2.术者术前查房,了解病情。 3.患者及其家属知情同意并签字。 4.术前小结。 5.如有PCI准备,需术前阿斯匹林100mg、氯吡格雷75mg,每天一次,使用三天以上,不足三天,氯吡格雷须负荷300mg一次。 6.送手术通知单到南楼5楼导管室。 7.建立静脉通道。 【手术方法】 1.血管入路:可采用股动脉、桡动脉或肱动脉等入路。 2.Seldinger法经皮穿刺动脉并置入动脉鞘管,酌情给予肝素2000~3000U,高凝状态或操作时间延长(超过lh),可追加肝素。经常抽吸动脉鞘侧管,观察有无血栓阻塞。 3.在X线透视下和导引钢丝引导下将导管送至升主动脉中部,不要过深,以免在不知情的状态下进入冠状动脉。导管裂位后取出导丝,排除空气,连接三联三通,观察压力曲线,确认压力曲线显示良好。
《中国经皮冠状动脉介入治疗指南》正式发布
《中国经皮冠状动脉介入治疗指南》正式发布 《中国经皮冠状动脉介入治疗指南》在沈阳东北心血管病论坛期间正式重磅发布! 该指南由韩雅玲院士牵头,113位国内心血管领域顶尖专家组成的专家组共同完成,刊登于《中华心血管病杂志》2016年第五期,是在2009和2012年中国PCI指南的基础上,根据最新临床研究成果、特别是结合中国人群的大型随机临床研究结果(共收录了31篇中国专家的文章),参考ACC/AHA以及ESC等国际权威组织发布的最新相关指南,并结合我国国情及临床实践,对PCI治疗领域的热点和焦点问题进行了全面讨论并达成一致观点的基础上编写而成。相较于2012版PCI指南,该版指南有几点重要更新: 一、首次提出建立质量控制体系 从2009年开始,PCI的质量控制体系在全国范围内运行。此后,国家质量控制中心逐步建立了省级和军队级质量控制中心的合作关系。为进一步改善质量控制技术和团队协作,新版指南首次对开展PCI的中心提出了明确的资质要求,并要求每一个开展PCI的中心建立质量控制体系(Ⅰ,C),以期对冠心病患者提供更好的医疗服务。质量控制体系具体包括:(1)回顾分析整个中心的介入治疗结局和质量;(2)回顾分析每个术者
的介入治疗结局和质量;(3)引入风险调控措施;(4)对复杂病例进行同行评议;(5)随机抽取病例作回顾分析。 二、提出最新的EuroSCORE Ⅱ和SYNTAXⅡ危险评分系统 基于最新的临床研究结果以及结合中国人群的临床研究,指南首次提出了欧洲心脏危险评估系统Ⅱ(EuroSCOREⅡ)和SYNTAXⅡ评分,新的评分系统更加符合临床需求,为患者后续血运重建策略的选择提供了更为统一、科学的标准。 EuroSCOREⅡ通过年龄、性别、肾功能损伤、外周动脉疾病、严重活动障碍、既往心脏手术史、慢性肺脏疾病、活动性心内膜炎、术前状态差、正在应用胰岛素治疗的糖尿病、纽约心脏协会(NYHA)心功能分级、CCS 心绞痛分型、左心室功能、近期心肌梗死、肺动脉高压、紧急外科手术、是否为单纯CABG、胸主动脉手术等18项临床特点,评估院内病死率。而上一版推荐的EuroSCORE评分因过高地估计了血运重建的死亡风率,已不再推荐使用。 SYNTAXⅡ评分在SYNTAX评分11项因素基础上,新增是否存在无保护左主干病变而变成了12个影像因素,并联合应用了6项临床因素(包括年龄、肌酐清除率、左心室功能、性别、是否合并慢性阻塞性肺疾病、周围血管病)。在预测左主干和复杂三支病变血运重建的远期(4年或以
经皮冠状动脉介入治疗操作规范
经皮冠状动脉介入治疗操作规范
经皮冠状动脉介入治疗操作规范 【适应证】 确定PCI的适应证主要是权衡其收益和风险。收益大于风险即可为相对适应证,反之则为相对禁忌证。权衡收益和风险须考虑下列因素:①患者全身情况能否耐受操作;②心肌缺血严重程度;③病变形态、特征,手术操作成功的可能性;④处理并发症的能力;⑤远期效果;⑥费用。 1.稳定性劳力型心绞痛 (1)药物治疗后仍有症状、并有缺血证据,狭窄≥50%、单支或多支病变患者。 (2)症状虽不严重或无明显症状,但负荷试验显示广泛心肌缺血,病变治疗成功把握性大,手术风险低。 (3)PCI后再狭窄病变。 (4)左主干病变不宜冠状动脉旁路移植术(CABG)者。 (5)CABG术后:CABG术后移植血管局限性狭窄,近远端吻合口病变或自身血管新发生的病变导致心绞痛或有客观缺血证据者。 (6)有外科手术禁忌或要经历大的非心脏手术的冠心病患者。
(3)急性期后的PCI ①有自发或诱发心肌缺血或再梗死征象者。 ②心源性休克或持续血流动力学不稳定者。 ③左室射血分数<40%、左心衰竭、严重室性心律失常患者。 ④急性期曾有过心力衰竭者。 ⑤对溶栓治疗后的患者,均可考虑冠状动脉造影对闭塞的梗死相关动脉或严重狭窄病变行PCI(若无缺血证据,建议在数天或数周后进行)。 ⑥非Q波心肌梗死患者。 【相对禁忌证】 1.病变狭窄程度<50%,且无明确客观缺血证据。 2.左主干狭窄伴多支病变。 3.过于弥漫的狭窄病变。 4.在无血流动力学受损的AMI急性期不应对非梗死相关动脉行PCI;AMI发病已超过12h,无心肌缺血症状,且心电图及血流动力学稳定者不应行PCI。 【操作方法】
经皮冠状动脉介入治疗操作规范
1.目的 1.1定制我科经皮冠状动脉介入治疗的操作规范,以作为医护人员的实际临床操作依据,使该操作更科学合理,便于医务人员充分了解遵守,助于提高治疗质量。 2.范围 2.1我科医护人员均适用。 3.定义 3.1经皮冠状动脉介入治疗(percutaneous transluminal coronary intervention ,PCI)是指采用经皮穿刺技术送入球囊导管或其他相关器械,解除冠状动脉狭窄或梗阻,重建冠状动脉血流的技术。 4.职责 无 5.标准 5.1简介:经皮冠状动脉介入治疗主要包括经皮冠状动脉腔内成形术(PTCA)、支架置人术、定向性斑块 旋切术(DCA)、斑块旋切吸引术(TEC)、斑块旋磨术及激光血管成形等。本章重点介绍PCI 的基本技术--PTCA 和支架置入术。 5.2适应证:确定PCI 的适应证主要是权衡其收益和风险。收益大于风险即可为相对适应证,反之则为相 对禁忌证。权衡收益和风险须考虑下列因素:①患者全身情况能否耐受操作;②心肌缺血严重程度;③病变形态、特征,手术操作成功的可能性;④处理并发症的能力;⑤远期效果;⑥费用。 5.2.1稳定性劳力型心绞痛: 5.2.1.1药物治疗后仍有症状、并有缺血证据,狭窄≥50%、单支或多支病变患者。 5.2.1.2症状虽不严重或无明显症状,但负荷试验显示广泛心肌缺血,病变治疗成功把握性大, 手术风险低。 5.2.1.3 PCI 后再狭窄病变。 5.2.1.4左主干病变不宜冠状动脉旁路移植术(CABG)者。 5.2.1.5 CABG 术后:CABG 术后移植血管局限性狭窄,近远端吻合口病变或自身血管新发生的病 变导致心绞痛或有客观缺血证据者。 5.2.1.6有外科手术禁忌或要经历大的非心脏手术的冠心病患者。 5.2.2无ST 段抬高急性冠状动脉综合征(不稳定性心绞痛及非Q 波心肌梗死)对高危以及经充分药物 治疗后不能稳定的患者提倡早期介入治疗。 5.2.3急性ST 段抬高心肌梗死(AMI) 5.2.3.1直接PCI: 5.2.3.1.1 ST 段抬高或新出现左束支传导阻滞的AMI ,发病在12h 内,能在就诊后90min 内由有经验的术者开始球囊扩张者。 5.2.3.1.2 ST 段抬高或新出现左束支传导阻滞的AMI ,发病36h 内发生心源性休克,可 在休克发生18h 内由有经验的术者行PCI 者。 5.2.3.1.3 AMI 发病12h 内有严重心力衰竭和(或)肺水肿(Killip3级)患者。 5.2.3.1.4 AMI 发病12~24h 伴有严重心力衰竭、血流动力学或心电不稳定或有持续心肌 缺血症状者。 5.2.3.1.5适合再灌注治疗,但有溶栓禁忌证的AMI 患者。 5.2.3.2溶栓后补救性PCI : 5.2.3.2.1溶栓后仍有明显胸痛,或合并严重心力衰竭、肺水肿或心电不稳定者. 5.2.3.2.2溶栓后仍有或新发生心源性休克或血流动力学不稳定者。 5.2.3.3急性期后的PCI
2011美国经皮冠状动脉介入治疗指南解读
2011美国经皮冠状动脉介入治疗指南解读吕树铮,汪国忠(首都医科大学附属北京安贞医院 心内科,北京 100029) 自1982年撰写的第1版经皮冠状动脉介入治疗(percutaneous transluminal coronary intervention,PCI)指南问世以来,随着冠心病介入治疗新型器械、药物及研究结果的涌现,美国心脏协会/美国心脏病学会基金会(AHA/ACCF)适时组织专家进行指南的更新[1]。为反映最新的临床研究结果,更好地指导临床实践,2011版指南无论是阐述方式还是涉及内容均具有鲜明的特点:①阐述方式更加简洁、明晰:如在表述相关研究结果时,仅对临床研究结果进行汇总性阐述,而不再对各个研究结果进行解读。在进行诊疗策略推荐时,遵循适应证选择、术前准备、术后处理等临床治疗流程,有利于临床医师解读和在实践中遵循;②所涉及的内容更加丰富:本指南涵盖了新型药物、成像技术、支架及手术入路等最新进展,同时还首次对特殊解剖特征的病变[冠状动脉慢性完全闭塞(CTO)、分叉病变、钙化病变等]治疗策略的选择进行了阐述。③在进行推荐级别描述时,首次将Ⅲ类推荐分为无效(无获益)和有害两种,这将有助于临床医师制定治疗决策。此外,基于新的临床实践特点及新型临床试验结果,本版指南对左主干病变、新型抗血小板药物及抗凝药物的应用、血管入路选择等诸多方面进行了重要更新,现试将相关要点阐述如下。 1 冠心病血管重建方式的选择 2011版指南首次将冠心病血管重建的获益分为提高生存率及改善症状。基于既往研究,本指南指出对于左主干病变、三支病变、含前降支近段的双支病变、疑为缺血诱导的室速所致猝死患者复苏成功后,冠状动脉旁路移植术(CABG)能改善患者的生存率(Ⅰ类推荐)。而对于有大面积心肌缺血的双支病变、前降支近段的单支病变及合并心功能不全(35%~50%)的冠心病,CABG可能改善患者生存率(Ⅱa类推荐)。 本版指南最大的亮点之一是关于无保护左主干患者的PCI治疗,基于冠脉支架置入术与冠脉搭桥术治疗严重冠心病的对比研究(SYNTAX)认为对于SYNTAX积分小于22而CABG风险高[美国胸外科医师协会(Society of Thoracic Surgeons,STS)危险积分预期死亡率>5%]、左主干作为罪犯血管的ST段抬高型心肌梗死(STEMI),选择PCI可改善患者的生存率(Ⅱa类推荐)。对于SYNTAX积分小于33而CABG风险较高(STS预期死亡率>2%)的患者,选择PCI治疗可能改善患者的预后(Ⅱb类推荐)。对于三支病变、含前降支近段的双支病变,选择PCI治疗有可能改善生存率(Ⅱb类推荐)。而对于非前降支近段的单支病变及无缺血证据的患者,CABG及PCI均是有害的(Ⅲ类推荐)。 就改善心肌缺血症状而言,如予以指南指导性药物治疗(GDMT)而症状无法控制或无法耐受药物治疗的患者,CABG及PCI治疗均是合理选择,但CABG可能优于PCI治疗。惟一例外的是CABG后再发心绞痛患者,应优先选择PCI治疗而非再次CABG治疗。 应当指出的是,指南中关于CABG相对于药物治疗能改善患者生存率的推荐意见是基于20世纪70~80年代的研究结果,由于现代药物 通讯作者:吕树铮 Email:shuzheng@https://www.wendangku.net/doc/5e2969135.html,
经桡动脉行冠状动脉造影术的护理
经桡动脉行冠状动脉造影术的护理 冠状动脉造影术是指经皮穿刺外周动脉将冠状动脉造影管送至主动脉根或左、右冠状动脉口,推注造影剂,使冠状动脉显影,从而明确冠状动脉是否病变,如有狭窄,则显示冠状动脉病变的部位、狭窄的程度、治疗的可行性与治疗的方法,是心血管科诊断常用的方法之一,也是冠心病确诊的手段之一,目前使用冠脉造影的方法有两种,一个是经股动脉冠状动脉造影,另一个是经桡动脉冠状动脉造影术。 经桡动脉穿刺与经股动脉穿刺介入治疗冠心病,疗效相似,但经桡动脉途径穿刺的患者穿刺部位出血少,术后体位自由,住院时间短、费用少,穿刺点便于加压包扎,伤口不易感染,更容易被老年人特别是在床上排尿困难而需导尿的患者所接受,也特别适用于股动脉狭窄者,所以经桡动脉行冠状动脉造影术是经股动脉造影很好的替代途径。 1 术前护理 1.1 术前指导①训练床上大小便;②病情允许时淋浴,更换病号服;③术前2h可进食,胃肠道
症状严重者禁食4~6h;④保证良好的睡眠;⑤进入介入室前排空膀胱。 1.2 心理护理做好心理护理是确保手术顺 利进行的关键,重点在于评估患者的身心状况,通过询问、交谈及观察,对患者住院后的情绪状态进行评估,由责任护士及分管医生于术前向患者及家属讲述手术的部位、大概方法,指导病人密切医生进行手术,术中可能有局部的疼痛,导管经过上肢处有轻微不适,及时告知医生以便及时给药,减轻痛苦与不适,消除由于精神紧张而出现桡动脉痉挛,并介绍经桡动脉行冠脉造影的优点,同时鼓励病人增加战胜疾病的信心,以最佳的心理状态介绍治疗。 1.3 术前准备 1.3.1皮肤准备:右侧桡动脉穿刺区,腹股沟区术前常规备皮,这样做是为防止因桡动脉穿刺失败而改行股动脉穿刺。 1.3.2碘试验。,
冠状动脉造影术
冠状动脉造影术 冠状动脉造影是诊断冠状动脉粥样硬化性心脏病(冠心病)的一种常用而且有效的方法,是一种较为安全可靠的有创诊断技术,现已广泛应用于临床,被认为是诊断冠心病的“金标准”。 冠状动脉的正常解剖 冠状动脉走行在心脏表面,环绕心脏分布,立体形态类似树状,有许多大小不同的分支,但个体差异大,行走方向各异。 冠状动脉造影的适应证 以诊断为主要目的: ⒈不明原因的胸痛,无创性检查不能确诊,临床怀疑冠心病。 ⒉不明原因的心律失常,如顽固的室性心律失常或新发传导阻滞;有时需冠状
动脉造影除外冠心病。 ⒊不明原因的左心功能不全,主要见于扩张型心肌病或缺血性心肌病,两者鉴别往往需要行冠状动脉造影。 ⒋经皮冠状动脉介入治疗(PCI)或冠状动脉旁路移植术后复发心绞痛。 ⒌先天性心脏病和瓣膜病等重大手术前,年龄>50岁,其易合并有冠状动脉畸形或动脉粥样硬化,可以在手术的同时进行干预。 ⒍无症状但疑有冠心病,在高危职业如:飞行员、汽车司机、警察、运动员及消防队员等. 以治疗为主要目的: 临床冠心病诊断明确,行冠状动脉造影可进一步明确冠状动脉病变的范围、程度,选择治疗方案。 ⒈稳定型心绞痛或陈旧心肌梗死,内科治疗效果不佳,影响学习、工作及生活。 ⒉不稳定型心绞痛,首先采取内科积极强化治疗,一旦病情稳定,积极行冠状动脉造影;内科药物治疗无效,一般需紧急造影。对于高危的不稳定型心绞痛患者,以自发性为主,伴有明显心电图的ST段改变及梗死后心绞痛,也可直接行冠状动脉造影。 3.无症状性冠心病,其中对运动试验阳性、伴有明显的危险因素的患者,应行冠状动脉造影。 4.CT等影像学检查发现或高度怀疑冠状动脉中度以上狭窄或存在不稳定斑块。 5.原发性心脏骤停复苏成功、左主干病变或前降支近段病变的可能性较大的均属高危人群,应早期进行血管病变干预治疗,需要评价冠状动脉。
经皮冠状动脉介入治疗
经皮冠状动脉介入治疗 一、护理评估 1、评估患者是否具备手术适应症,完善术前常规检查,了解患者术区循环情况。 2、评估患者对治疗方案的了解程度,有无紧张、恐惧情绪。 3、评估急救用物是否备好,如心电监护仪、除颤器、抗心律失常及升压药物等。 二、护理措施 (一)术前护理 1、指导患者完成必要的实验室检查。 2、心理护理:向患者及家属介绍心导管检查的方法和意义、手术的必要性和安全性,以解除思想顾虑和精神紧张。 3、皮肤准备:会阴部及两侧腹股沟备皮。 4、行桡动脉穿刺者需做 Allen 试验,判断能否行桡动脉穿刺及插管。 5、碘过敏试验。备好急救器械和药品。 6、术前检查双侧足背动脉搏动情况并标记。 7、遵医嘱使用抗血小板聚集药物。 (二)术后护理 1、持续心电监护 24 小时,观察有无心律失常、心肌缺血等急性期并发症。 2、十二导心电图检查,并与术前比较。 3、鼓励患者多饮水加速造影剂的排泄。 4、术侧肢体的护理
(1)经股动脉穿刺部位的护理:术后 4 小时拔出鞘管。弹力绷带加压包扎,用 1 千克左右的沙袋压迫 6 小时,术侧肢体制动至少 12 小时。卧床期间做好生活护理。检查足背动脉搏动是否减弱或消失,观察肢体皮肤颜色与温度、感觉与运动功能有无变化等。防止动静脉血栓的形成。 (2)经桡动脉穿刺部位的护理:经桡动脉 PCI 术后即可拔除鞘管,使用弹力绷带或专用止血工具装置局部加压止血。包扎 2 小时后可放松弹力带,术后 6 小时可拆除绷带或止血装置。加压包扎期间需观察术肢局部皮肤的颜色,温度及肿胀情况。 5、术后并发症的观察:观察有无尿潴留、低血压、穿刺部位出血、血肿、血管栓塞及感染等并发症,协助医生给予导尿、扩容、压迫止血、溶栓等处理。 三、健康指导要点 1、注意劳逸结合,避免受凉,情绪激动等。 2、应定期进行心电图、血糖、血脂、肝肾功能的检查。 3、指导低盐、低脂、低胆固醇饮食,肥胖者控制体重,戒烟限酒,保持大便通畅。 4、继续服用抑制血小板聚集药物及其他药物,定期门诊随诊。 四、注意事项 1、术后严密观察并发症,及时处理。 2、注意用药反应。
冠心病诊疗指南
2013年欧洲心脏病学会(ESC, European Society of Cardiology)发布了最新的稳定性冠状动脉疾病(stable coronary artery disease,SCAD)的管理指南(下称“指南”),为该领域的诊疗规范作出较详细的推荐,本文将对该新指南进行简要解读。 一、病理生理及概念 首先指南指出SCAD的病理生理机制为:①斑块相关的心外膜动脉阻塞;②正常或有斑块动脉局限或弥漫的痉挛;③微血管功能障碍;④既往急性心肌缺血和(或)冬眠心肌导致的左心室功能不全。结合病理生理的机制,概念上该指南的SCAD不仅局限于既往所指的稳定性心绞痛,同时也包括急性冠脉综合征(ACS)稳定后无症状或症状稳定的情况及痉挛导致的静息发作的心绞痛。 因此,SCAD的人群范围亦随之而扩大:①现有稳定性心绞痛或其他和冠状动脉病变相关的症状,如呼吸困难;②已知以往有冠心病症状,现经治疗后症状消失且需要定期随访; ③虽首次报告冠心病症状,但通过病史采集明确既往已有类似症状发生;④虽首次报告冠心病症状,但能被归为急性冠脉综合症低危人群,例如现无胸痛、心衰,静息心电图及心肌坏死标志物(首先肌钙蛋白)无异常。无冠状动脉粥样硬化狭窄的病人,例如微血管功能不全或者冠脉痉挛的病人也纳入在内。 二、诊断和危险分层评估 传统胸痛包括典型心绞痛、非典型心绞痛和非心绞痛性胸痛,通过胸痛表现结合患者年龄、性别、症状特征来评估患者罹患SCAD的验前概率(pre-test probability,PTP)大小,并根据流行病学调查结果及临床特征将PTP划分为三档,低度怀疑—PTP≤15%,中度怀疑—PTP在15%至85%之间,高度怀疑—PTP≥85%。 新指南指出,检查手段的选择取决于患者罹患该病的可能性大小,强调PTP可决定是否进一步检查及采取何种检查手段,同时根据该可能性及即将进行的检查手段敏感性和特异性,决定是否进行该项检查。然后根据检查结果产生出病人的冠心病可能性。 (一)、诊断 1、检查手段的评价和推荐 所有具有可疑症状的患者,在排除持续不稳定性心绞痛后,常规行静息心电图(Ⅰ类推荐,C级证据)、血液生化(首选肌钙蛋白)、静息超声心动图(Ⅰ类推荐,B级证据)、选择性胸部X线检查,同时评估患者的一般情况、并发症及生活质量。新指南提到运动心电图检查的敏感性为45%~50%,特异性为85%~90%;而运动负荷影像学检查特异性略低,约为80%,敏感性较高,约为70%~90%。作为SCAD 的初始诊断手段,运动心电图(ECG)推荐用于未接受抗缺血治疗可耐受运动的中等可能性(PTP 15%~65%)患者(I类推荐,B级证据)患者考虑为缺血性心肌病引起胸痛,如左心室功能尚可(LVEF>50%),则评估患者罹患SCAD的验前概率,低度怀疑者可能为其他疾病或者功能性冠脉疾病,中度怀疑者选择非侵入性检查手段,高度怀疑者直接进行危险分层和药物治疗,有条件者可施行侵入性冠脉造影。 2、冠状动脉CT(CT angiography,CTA) 新指南强调适当的设备(至少64排CT)、患者选择以及患者准备对医师选择CTA有重要提示作用。其敏感性高而特异性相对较低,建议用于SCAD中低可能性(PTP 15%~50%)患者的排除诊断(IIa类推荐,C级证据)。同时,对于中低可能性患者,如负荷试验的结果不能提供肯定性的结论或患者有负荷试验的禁忌证,为了避免侵入性检查,如估计可获得清晰的影像,也可选择冠状动脉CTA(IIa类推荐,C级证据)。该指南不建议冠状动脉CTA 用于经皮冠状动脉介入治疗(PCI)术后复查或者无任何冠状动脉疾病征象无症状个体的筛查(III类推荐,C级证据)。
《经皮冠脉造影检查》 知情同意书
《经皮冠脉造影检查》知情同意书 尊敬的患者: 您好! 根据您目前的病情,您有该检查的适应症,医师特向您详细介绍和说明如下内容:特殊检查项目名称、目的、费用、可能出现的并发症、风险及替代医疗方案,帮助您了解相关知识,做出选择。 一般项目患者姓名________ 性别_________ 年龄___________ 科室________ 病房_________ 病案号_________ 医师告知【检查前诊断及主要病情介绍】___________________________________________________ 【检查方案及效果评估介绍】 根据您的病情,目前主要有如下几种检查方案: □无创检查:写明项目:______________________________________________________ □有创检查:写明项目:______________________________________________________ □其他:____________________________________________________________________ 【检查名称】经皮冠状动脉造影检查 【检查入路】□桡动脉□股动脉□其他____________ 【使用的特殊、贵重药品说明】请详见特种检查、治疗、贵重药品审批表(自费项目协议书) 【是否同意使用血管缝合器】__________(同意/不同意),患者/家属签字:___________ 【检查目的】为明确诊断冠状动脉病变情况,确定下一步治疗方案 【患者自身存在高危因素】_______________________________________________________ 【检查可能出现的并发症、医疗风险及应对措施】 患者手术中和手术后可能出现下列并发症、危险性和意外情况,特告知如下: 1.麻醉剂及相关并发症:麻醉剂过敏,严重可导致过敏性休克、危及生命。 2.血管相关并发症:穿刺部位出血、血肿、感染、假性动脉瘤或动静脉瘘形成;血管内血栓形成或脱落,并导致重要脏器栓塞(如肺栓塞、肾栓塞、脑栓塞等)。经桡动脉或肱动脉入路手术时可能出现动脉痉挛、血管穿孔或闭塞,可能因血管严重扭曲、狭窄或闭塞等原因无法完成手术操作,必要时需改为穿刺股动脉等血管;出血、血肿可能导致腕管综合征。术后可能发生桡动脉瘤形成或桡动脉闭塞。 3.造影剂相关并发症:造影剂过敏,甚至过敏性休克,造影剂肾病、肾功能不全需血液透析,严重者可危及生命。 4.神经相关并发症:穿刺时损伤肘正中神经、股神经,可能导致同侧肢体麻木、萎缩、运动障碍。5.冠状动脉并发症:各种原因引起的冠脉痉挛、夹层、撕裂、血栓形成、血管闭塞,导致严重心肌缺血、心肌梗塞,或出现冠脉穿孔导致心包填塞,可能需心包穿刺引流,必要时外科手术处理,危急生命。 6.术中/术后心、脑、血管意外事件发生:术中可能出现急性肺水肿,心衰;心肌梗死;脑血管事件;下肢静脉血栓形成并血栓脱落导致急性肺栓塞;室速、室颤或严重的传导阻滞、心跳骤停等恶性心律
经皮冠状动脉腔内成形术
经皮冠状动脉腔内成形术(PTCA)及冠状动脉内支架植入术护理常规 一、评估与观察要点 1.了解脏器功能,评估生命体征,心电图以及胸痛的性质、持续时间、部位、诱因等。 2.评估患者术前检查及准备是否完善,是否了解手术过程及心理状况。 3.评估患者肾功能情况。 4.评估急救物品等是否完备。 二、护理措施 1.术前向患者及其家属介绍手术的方法和意义、手术的必要性和安全性,以解除思想顾虑和精神紧张,取得配合。指导患者进行呼吸、咳嗽、屏气训练、以便于术中顺利配合手术,经股动脉穿刺者,训练患者术前进行床上排尿。 2.术前口服抗血小板聚集药物:急诊行PCI手术患者或术前6小时内给药者,遵医嘱服用负荷剂量的阿司匹林和氯吡格雷。对于已经服用华法林的患者,术前应停用3 天,并使INR<1.5。 3.拟行桡动脉穿刺者 (1)术前行 Allen试验:即同时按压桡、尺动脉,嘱患者连续伸屈五指至掌面苍白时松开尺侧,如 10 秒内掌面颜色恢复正常,提示尺动脉功能好,可行桡动脉介人治疗。 (2)非术侧上肢留置静脉套管针,标记双侧足背动脉以备穿刺
股动脉时监测。 4.术后妥善安置患者至病床,查看静脉输液、伤口、末梢循环状况等,查看交接记录单,了解患者术中情况。 5.做 12 导联心电图,持续心电监护心率、心律、血压。严密观察有无心律失常、心肌缺血、心肌梗死等急性期并发症。复查血清钾,维持血钾4.0mmol/L以上。注意穿刺部位及局部情况。 6.观察有无尿潴留、腹胀、腰酸、出血、低血压、急性冠状动脉闭塞、造影剂不良反应等并发症,询问患者主诉,如有胸痛发作,及时报告医生处理。 7.术后带入留置鞘管拔管护理∶拔管前备好除颤仪、抢救药品如多巴胺、阿托品等,密切观察心率、心律、呼吸、血压变化,测量血压,触摸足背动脉搏动,拔鞘之前常规监测活化部分凝血活酶时间(APT),停用肝素 4-6小时后拔除鞘管。经股动脉穿刺拔除鞘管后压迫穿刺点 15~20分钟,无出血、渗血后,进行下肢制动,用弹力绷带加压包扎,1kg沙袋压迫 6~8 小时,穿刺侧肢体应限制屈曲活动,24 小时后解除弹力绷带;经桡动脉穿刺拔除鞘管后,用弹力绷带加压包扎 4~6小时后解除弹力绷带。 8. 鼓励患者多饮水,4~6 小时内尿量达 1000~2000ml 以利造影剂排出。 9.植入支架的患者遵医嘱口服抗血小板聚集的药物,如氯毗格雷和阿司匹林;依据病情需要给予抗凝治疗,如低分子肝素皮下注射、替罗非班静脉泵入。定期监测血小板、出凝血时间的变化。严密观察
-经皮冠状动脉介入治疗
经皮冠状动脉介入治疗 经皮冠状动脉介入治疗(percutaneoustransluminalcoronaryintervention,PCI) 是指采用经皮穿刺技术送入球囊导管或其他相关器械,解除冠状动脉狭窄或梗阻,重建冠状动脉血流的技术。主要包括经皮冠状动脉腔内成形术(PTCA)、支架置入术、定向性斑块旋切术(DCA)、斑块旋切吸引术(TEC)、斑块旋磨术及激光血管成 形等。本章重点介绍PCI的基本技术--PTCA和支架置入术。 【适应证】 确定PCI的适应证主要是权衡其收益和风险。收益大于风险即可为相对适 应证,反之则为相对禁忌证。权衡收益和风险须考虑下列因素:①患者全身情况能否耐受操作;②心肌缺血严重程度;③病变形态、特征,手术操作成功的可能性; ④处理并发症的能力;⑤远期效果;⑥费用。 1.稳定性劳力型心绞痛 (1)药物治疗后仍有症状、并有缺血证据,狭窄≥50%、单支或多支病变患者。 (2)症状虽不严重或无明显症状,但负荷试验显示广泛心肌缺血,病变治疗成功把握性大,手术风险低。 (3)PCI后再狭窄病变。 (4)左主干病变不宜冠状动脉旁路移植术(CABG)者。 (5)CABG术后:CABG术后移植血管局限性狭窄,近远端吻合口病变或自身 血管新发生的病变导致心绞痛或有客观缺血证据者。 (6)有外科手术禁忌或要经历大的非心脏手术的冠心病患者。 2.无ST段抬高急性冠状动脉综合征(不稳定性心绞痛及非Q波心肌梗死)对高危以及经充分药物治疗后不能稳定的患者提倡早期介入治疗。 3.急性ST段抬高心肌梗死(AMI) (1)直接PCI ①ST段抬高或新出现左束支传导阻滞的AMI,发病在12h内,能在就诊后 90min内由有经验的术者开始球囊扩张者。 ②ST段抬高或新出现左束支传导阻滞的AMI,发病36h内发生心源性休 克,可在休克发生18h内由有经验的术者行PCI者。 ③AMI发病12h内有严重心力衰竭和(或)肺水肿(Killip3级)患者。 ④AMI发病12---24h伴有严重心力衰竭、血流动力学或心电不稳定或有持 续心肌缺血症状者。 ⑤适合再灌注治疗,但有溶栓禁忌证的AMI患者。 (2)溶栓后补救性PCI ①溶栓后仍有明显胸痛,或合并严重心力衰竭、肺水肿或心电不稳定者。 ②溶栓后仍有或新发生心源性休克或血流动力学不稳定者。 (3)急性期后的PCI ①有自发或诱发心肌缺血或再梗死征象者。 ②心源性休克或持续血流动力学不稳定者。 ③左室射血分数<40%、左心衰竭、严重室性心律失常患者。 ④急性期曾有过心力衰竭者。 ⑤对溶栓治疗后的患者,均可考虑冠状动脉造影对闭塞的梗死相关动脉或严
冠脉介入中对比剂应用中国专家共识(全文)
冠脉介入中对比剂应用中国专家共识(全文) 1.引言 随着血管造影和经皮冠状动脉介入治疗(Percutaneous Coronary Intervention,PCI)技术的发展,含碘对比剂的使用越来越广泛,其安全使用和合理选择也日益受到关注。鉴于此,共识工作小组通过对现有循证医学证据的系统性回顾,并结合专家的临床实践经验,共同制定了此共识,以规范并指导对比剂的临床使用。 2.对比剂的分类 目前临床应用的含碘对比剂的基本机构是含三个碘的苯环(3-乙酰-2,4,6-三苯甲酸),根据苯环的个数分为单体和双聚体;按照是否在溶液中电离出离子可以分为离子型和非离子型;按照渗透压分为高渗、相对低渗和等渗对比剂。含碘对比剂的发展经历了从离子型到非离子型、从高渗到相对低渗直至等渗的过程。第一代高渗对比剂为离子型单体,其渗透压高达血浆渗透压的5–7倍;第二代相对低渗对比剂包括非离子型单体和离子型二聚体,其渗透压与高渗对比剂相比已明显降低,但仍然是血浆渗透压的2倍左右;第三代等渗对比剂为非离子型二聚体,其渗透压与血浆渗透压相等【1】。高渗对比剂由于不良反应相对较多,已很少使用。目前常用的含碘对比剂以低渗或等渗对比剂为主。 表1 常用含碘对比剂的分类和理化性质
3.对比剂肾病(Contrast induced nephropathy, CIN) 3.1 CIN的定义 部分患者在使用含碘对比剂后24~48小时内,血清肌酐值会升高,一般3天内达到峰值,排除其他的原因后将这种对比剂引起的肾脏损害称为对比剂肾病(Contrast induced nephropathy, CIN)。目前,CIN尚无统一的诊断标准,2003及2008年欧洲泌尿生殖放射协会(European Society of Urogenital Radiology, ESUR)给出的定义是使用对比剂后3天内,血清肌酐值绝对值升高≥0.5 mg/dl(44.2 umol/l)或较基础值升高≥25%,并排除其他原因导致的肾损害【2】。 2007年,急性肾损害工作网(Acute Kidney Injury Network, AKIN)提出了对比剂诱导的急性肾损伤(Contrast Induced Acute Kidney Injury,CI-AKI)的概念,将CI-AKI的诊断标准定义为48小时内血清肌酐水平升高>0.3 mg/dl或7天内升高>50%【3】。最近有观点主张将CIN由CI-AKI代替来定义对比剂对肾脏的损伤更合适[4],但目前对比剂肾病的概念仍广泛应用。 3.2 CIN的流行病学 CIN是仅次于肾灌注不足和肾毒性药物引起的医院获得性肾衰竭的第
- 2016中国经皮冠状动脉介入治疗指南解读
- 2016中国经皮冠状动脉介入治疗指南(最新课件)
- 中国经皮冠状动脉介入治疗指南解读(全文)
- 中国经皮冠状动脉介入诊疗PCI指南9
- 中国经皮冠状动脉介入治疗指南(2016)解读
- 经皮冠状动脉介入治疗操作规范
- 中国经皮冠状动脉介入治疗指南(2016).
- 2016-中国PCI冠脉介入指南专业解读
- 中国经皮冠状动脉介入治疗指南(全文版)
- 中国经皮冠状动脉介入治疗指南(2016)
- 2016中国经皮冠状动脉介入治疗指南.ppt
- 中国经皮冠状动脉介入治疗指南 ppt课件
- 2016中国经皮冠状动脉介入治疗指南
- 2016中国经皮冠状动脉介入治疗指南(2016)
- 2016中国经皮冠状动脉介入治疗指南
- 《中国经皮冠状动脉介入治疗指南》正式发布
- 2016中国经皮冠状动脉介入治疗指南
- 中国经皮冠状动脉介绍与介入治疗指南
- 2016中国经皮冠状动脉介入治疗指南
- 中国经皮冠状动脉介入治疗指南
