医疗卫生机构消毒产品登记表
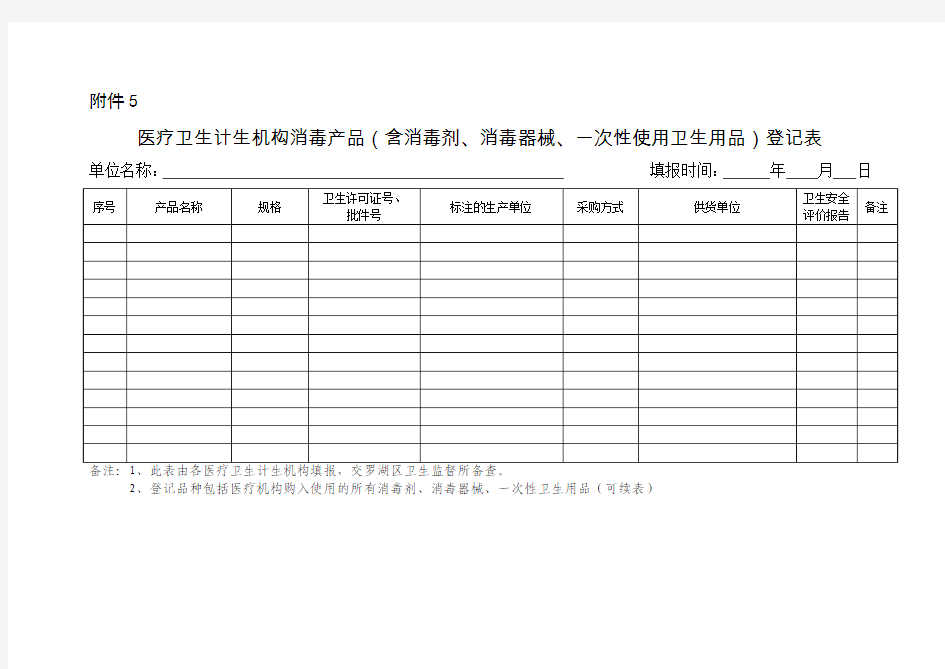
附件5
医疗卫生计生机构消毒产品(含消毒剂、消毒器械、一次性使用卫生用品)登记表
单位名称:填报时间:年月日
2、登记品种包括医疗机构购入使用的所有消毒剂、消毒器械、一次性卫生用品(可续表)
消毒产品生产企业卫生要求规范标准
消毒产品生产企业卫生规 第一章总则 第一条为规消毒产品生产企业卫生管理,保证消毒产品卫生质量和使用安全,根据《中华人民国传染病防治法》及《消毒管理办法》等法律法规的有关要求,制定本规。 第二条凡中华人民国境从事消毒产品生产(含分装)的单位和个人应遵守本规。 第二章厂区环境与布局 第三条厂区选址卫生要求: (一)与可能污染产品生产的有害场所的距离应不少于30米。 (二)消毒产品生产企业不得建于居民楼。 (三)厂区周围无积水、无杂草、无生活垃圾、无蚊蝇等有害医学昆虫孳生地。 第四条厂区环境整洁。厂区非绿化的地面、路面采用混凝土、沥青及其他硬质材料铺设,便于降尘和清除积水。 第五条厂区的行政、生活、生产和辅助区的总体布局应合理,生产区和生活区应分开。 第六条厂区应具备生产车间、辅助用房、质检用房、物料和成品仓储用房等,且衔接合理。 第七条厂区的生产和仓储用房应有与生产规模相适应的面积和空间。生产车间使用面积应不小于100平方米,其中分装企业生产车间使用面积应不小于60平方米;生产车间净高不低于2.5米。 第八条厂区设置的厕所应采用水冲式,厕所地面、墙壁、便槽等应采用易清洗、不易积垢材料。 第九条动力、供暖、空调机房、给排水系统和废水、废气、废渣的处理系统等设施应不影响产品质量。
第三章生产区卫生要求 第十条生产区设置的各功能间(区)应按生产工艺流程进行合理布局,工艺流程应按工序先后顺序合理衔接。人流物流分开,避免交叉。 第十一条生产区各功能间(区)应配置有效的防尘、防虫、防鼠、通风等设施。 第十二条消毒剂、化学(生物)指示物、抗(抑)菌制剂、隐形眼镜护理用品、卫生湿巾、湿巾的生产企业生产车间包括:配料间(区)、制作加工间(区)、分(灌)装间(区)、包装间(区)等。 分装企业生产车间至少包括:分(灌)装间(区)、包装间(区)等。 第十三条生产区应设更衣室,室应配备衣柜、鞋架、流动水洗手等设施,并保持清洁卫生。 消毒剂和卫生用品生产企业更衣室还应配备空气消毒设施和手消毒设施。洁净室(区)应设置二次更衣室。使用的消毒产品应符合国家有关规定。 第十四条皮肤粘膜消毒剂(用于洗手的皮肤消毒剂除外)、皮肤粘膜抗(抑)菌制剂(用于洗手的抗(抑)菌制剂除外)、隐形眼镜护理用品等产品的生产区应根据各自的洁净度级别按生产工艺和产品质量要求合理布局。同一生产区或相邻生产区间的生产操作,不得相互污染,不同洁净度级别的生产车间避免交叉污染。 洁净区的设计、建筑、维护和管理等应符合现行有关标准、规的规定。 第十五条物料的前处理、提取、浓缩等生产操作工序与成品生产应在不同生产车间(区)或采取隔离等其他防止污染的有效措施。 第十六条生产区通道应保证运输和卫生安全防护需要,不得存放与生产无关物品。生产过程中的废弃物、不合格品应分别置于有明显标志的专用容器中,并及时处理。 第十七条生产车间地面、墙面、顶面和工作台面所用材质应便于清洁。对于有特殊卫生要求的产品,其生产车间还应符合下列要求: (一)隐形眼镜护理用品生产(包装除外)、分装应在10万级空气洁净度以上净化车间进行。 (二)皮肤粘膜消毒剂(用于洗手的皮肤消毒剂除外)、皮肤粘膜抗(抑)菌制剂(用于洗手的抗(抑)菌制剂除外)等产品配料、混料、分装工序应在30万级空气洁净度以上净化车间进行。
医疗机构环境表面清洁与消毒规范
医疗机构环境表面清洁与消毒管理规范(2016) 1 范围 本标准规定了医疗机构建筑物内部表面与医疗器械设备表面的清洁与消毒的管理要求、清洁与消毒原则、日常清洁与消毒、强化清洁与消毒、清洁工具复用处理要求等。 本标准适用于各级各类医疗机构。承担环境清洁服务的机构可参照执行。 2 规范性引用文件 下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。 GB 15982 医院消毒卫生标准 WS/T 311 医院隔离技术规范 WS/T 313 医务人员手卫生规范 WS/T 367 医疗机构消毒技术规范 3 术语和定义 下列术语和定义适用于本文件。 3.1 环境表面environmental surface 医疗机构建筑物内部表面和医疗器械设备表面,前者如墙面、地面、玻璃窗、门、卫生间台面等,后者如监护仪、呼吸机、透析机、新生儿暖箱的表面等。 3.2 环境表面清洁environmental surface cleaning 消除环境表面污物的过程。 3.3 清洁工具cleaning products 用于清洁和消毒的工具,如擦拭布巾、地巾和地巾杆、盛水容器、手套(乳胶或塑胶)、洁具车等。 3.4 清洁单元cleaning unit 邻近某一患者的相关高频接触表面为一个清洁单元,如该患者使用的病床、床边桌、监护仪、呼吸机、微泵等视为一个清洁单元。 3.5 高频接触表面high-touch surface 患者和医务人员手频繁接触的环境表面,如床栏、床边桌、呼叫按钮、监护仪、微泵、床帘、门把手、计算机等。 3.6 污点清洁与消毒spot cleaning and disinfection 对被患者的少量体液、血液、排泄物、分泌物等感染性物质小范围污染的环境表面进行的清洁与消WS/T 512-2016毒处理。 3.7 消毒湿巾disinfection wet wipes 以非织造布、织物、无尘纸或其他原料为载体,纯化水为生产用水,适量添加消毒剂等原材料,制成的具有清洁与消毒作用的产品,适用于人体、一般物体表面、医疗器械表面及其他物体表面。 3.8 A0值A0 value 评价湿热消毒效果的指标,指当以Z值表示的微生物杀灭效果为10K时,温度相当于80℃的时间(秒)。A0值600是复用清洁工具消毒的最低要求。 3.9 隔断防护barrier containment 医疗机构内部改建、修缮、装修等工程实施过程中,采用塑料、装饰板等建筑材料作为围挡,以完全封闭施工区域,防止施工区域内的尘埃、微生物等污染非施工区域内环境表面的措施。 3.10 人员卫生处理personnel decontamination
消毒产品卫生安全评价规定附件检验项目及要求
附件2 检验项目及要求 注:“+”为必须做项目,“-”为不做项目,“±”为选做项目。 ①戊二醛类消毒剂进行加pH调节剂前、后的pH值测定,如产品为固体应做最高使用浓度溶液。 ②餐饮具、瓜果蔬菜、生活饮用水仅做铅、砷。 ③根据标签、说明书标注的杀灭微生物类别和使用范围进行相应的指示微生物试验。 ④乙醇消毒液、戊二醛类消毒剂、次氯酸钠类消毒剂、漂白粉和漂粉精类消毒剂使用范围中,用于一般物体表面和织物消毒的应做金黄色葡萄球菌定量杀菌试验;用于洁具表面消毒的应做白色念珠菌定量杀菌试验;用于生活饮用水、游泳池水、污水和瓜果蔬菜的应做大肠杆菌定量杀菌试验;用于餐饮具消毒的应做脊髓灰质炎病毒灭活试验;用于体液污染物品和排泄物等消毒的应做细菌芽孢定量杀菌试验;用于手、皮肤、黏膜消毒的应做白色念珠菌定量杀菌试验; 用于医疗器械、用品灭菌和高水平消毒的应做细菌芽孢定性杀菌试验,中水平消毒应做龟分枝杆菌定量杀菌试验;用于空气消毒的应做白色葡萄球菌定量杀菌实验;其他用途的按照标签、说明书杀灭微生物类别和使用范围确定一项抗力最强微生物的杀灭试验。 ⑤次氯酸钠类消毒剂以及清洁后消毒的消毒剂杀菌试验用有机干扰物质浓度为0.3%。 ⑥用于医疗器械、用品的消毒剂(含无纺布为载体消毒剂)及灭菌剂的模拟现场试验,所用指示微生物应按适用范围选择抗力最强指示微生物进行试验。 ⑦除乙醇消毒液、戊二醛类消毒剂、次氯酸钠类消毒剂、漂白粉和漂粉精类消毒剂外均应做急性经口毒性或急性吸入毒性试验及一项致突变试验;标签、说明书中标明用于手、皮肤消毒的应做多次皮肤刺激性试验,标明用于粘膜或破损皮肤的消毒剂应做眼刺激性试验,标明用于阴道粘膜的消毒剂应做阴道粘膜刺激性试验。
《消毒产品标签说明书管理规范》
附件: 消毒产品标签说明书管理规范 第一条为加强消毒产品标签和说明书的监督管理,根据《中华人民共和国传染病防治法》和《消毒管理办法》的有关规定,特制定本规范。 第二条本规范适用于在中国境内生产、经营或使用的进口和国产消毒产品标签和说明书。 第三条消毒产品标签、说明书标注的有关内容应当真实,不得有虚假夸大、明示或暗示对疾病的治疗作用和效果的内容,并符合下列要求:(一)应采用中文标识,如有外文标识的,其展示内容必须符合国家有关法规和标准的规定。 (二)产品名称应当符合《卫生部健康相关产品命名规定》,应包括商标名(或品牌名)、通用名、属性名;有多种消毒或抗(抑)菌用途或含多种有效杀菌成分的消毒产品,命名时可以只标注商标名(或品牌名)和属性名。 (三)消毒剂、消毒器械的名称、剂型、型号、批准文号、有效成分含量、使用范围、使用方法、有效期/使用寿命等应与省级以上卫生行政部门卫生许可或备案时的一致;卫生用品主要有效成分含量应当符合产品执行标准规定的范围。 (四)产品标注的执行标准应当符合国家标准、行业标准、地方标准和有关规范规定。国产产品标注的企业标准应依法备案。 (五)杀灭微生物类别应按照卫生部《消毒技术规范》的有关规定进行表述;经卫生部审批的消毒产品杀灭微生物类别应与卫生部卫生许可时批准的一
门认定的消毒产品检验机构出具的检验报告一致。 (六)消毒产品对储存、运输条件安全性等有特殊要求的,应在产品标识中明确注明。 (七)在标注生产企业信息时,应同时标注产品责任单位和产品实际生产加工企业的信息(两者相同时,不必重复标注)。 (八)所标注生产企业卫生许可证号应为实际生产企业卫生许可证号。 第四条未列入消毒产品分类目录的产品不得标注任何与消毒产品管理有关的卫生许可证明编号。 第五条消毒产品的最小销售包装应当印有或贴有标签,应清晰、牢固、不得涂改。 消毒剂、消毒器械、抗(抑)菌剂、隐形眼镜护理用品应附有说明书,其中产品标签内容已包括说明书内容的,可不另附说明书。 第六条消毒剂包装(最小销售包装除外)标签应当标注以下内容: (一)产品名称; (二)产品卫生许可批件号; (三)生产企业(名称、地址); (四)生产企业卫生许可证号(进口产品除外); (五)原产国或地区名称(国产产品除外); (六)生产日期和有效期/生产批号和限期使用日期。 第七条消毒剂最小销售包装标签应标注以下内容: (一)产品名称; (二)产品卫生许可批件号;
消毒产品卫生安全评价规定(2014年).
消毒产品卫生安全评价规定(2014 年).
国家卫生计生委 关于印发消毒产品卫生安全评价规定的通知 国卫监督发〔2014〕36号 各省、自治区、直辖市卫生计生委(卫生厅局),新疆生产建设兵团卫生局,中国疾病预防控制中心、卫生监督中心: 为加强取消行政许可消毒产品的监督管理,依据《传染病防治法》和《消毒管理办法》有关规定,我委组织修订了《消毒产品卫生安全评价规定》(以下简称《规定》),可从我委网站综合监督”栏目下载。现印发给你们,请遵照执行。 已获得卫生许可批件的消毒剂和消毒器械,批件在有效期内可继续使用,有效期满按照本《规定》要求将其相关资料转换为卫生安全评价报告并备案;国家卫生计生委《通告》(国卫通〔2013〕4号)中列出已通过技术审查的消毒产品,于2014年9月30日前按照本《规定》要求将其相关资料转换为卫生安全评价报告并备案。 国家卫生计生委 2014年6月27日 消毒产品卫生安全评价规定 第一条为进一步深化卫生行政审批制度改革,规范消毒产品的生产经营行为,保障用于传染病防治的消毒产品的有效性、安全性,依据《中华人民共和国传染病防治法》、《消毒管理办法》和有关规定,制定本规定。 第二条按照消毒产品用途、使用对象的风险程度实行分类管理。
第一类是具有较高风险,需要严格管理以保证安全、有效的消毒产品,包括用于医疗器械的高水平消毒剂和消毒器械、灭菌剂和灭菌器械,皮肤黏膜消毒剂,生物指示物、灭菌效果化学指示物。第二类是具有中度风险,需要加强管理以保证安全、有效的消毒产品,包括除第一类产品外的消毒剂、消毒器械、化学指示物,以及带有灭菌标识的灭菌物品包装物、抗(抑)菌制剂。第三类是风险程度较低,实行常规管理可以保证安全、有效的除抗(抑)菌制剂外的卫生用品。 同一个消毒产品涉及不同类别时,应当以较高风险类别进行管理。 第三条本规定适用于在中华人民共和国境内生产、经营的不需要 行政审批的第一类、第二类消毒产品。 第四条产品责任单位应当在第一类、第二类消毒产品首次上市前自行或者委托第三方进行卫生安全评价,并对评价结果负责。卫生安全评价合格的消毒产品方可上市销售。 产品责任单位是指依法承担因产品缺陷而致他人人身伤害或财产损失赔偿责任的单位或个人。国产产品责任单位为生产企业,委托生产加工时,特指委托方;进口产品的责任单位为在华责任单位。 第五条卫生安全评价内容包括产品标签(铭牌)、说明书、检验报告(含结论)、企业标准或质量标准、国产产品生产企业卫生许可资质、进口产品生产国(地区)允许生产销售的批文情况。其中,消毒剂、生物指示物、化学指示物、带有灭菌标识的灭菌物品包装物、抗 (抑)菌制剂还包括产品配方,消毒器械还应当包括产品主要元器件、结构图。 第六条消毒产品的配方应当与实际生产的一致,配方的书写格式和要求见附件1。 第七条消毒产品原材料的级别、纯度和消毒器械主要元器件等原
医疗机构清洁消毒方案
医疗机构环境表面清洁与消毒方案(拟定) 1.地面与物体表面无明显污染时,采用湿式清洁。当受到患者血液、体液等明显污染时,先用吸湿材料去除可见的污染物,再清洁和消毒。 2..感染高风险的部门其地面和物体表面的清洁与消毒 感染高风险的部门如手术部(室)、产房、导管室、洁净病房、骨髓移植病房、器官移植病房、重症监护病房、新生儿室、血液透析病房、烧伤病房、感染疾病科、口腔科、检验科、急诊等病房与部门的地面与物体表面,应保持清洁、干燥,每天进行消毒,遇明显污染随时去污、清洁与消毒。地面消毒采用400mg/~700mg/L有效氯的含氯消毒液擦拭,作用30分钟。物体表面消毒方法同地面。 3.清洁病房或诊疗区域时,应有序进行,由上而下,由里到外,由轻度污染到重度污染;有多名患者共同居住的病房,应遵循清洁单元化操作。 4.清洁工具应分区使用,实行颜色标记。擦拭物体表面的布巾,不同患者之间和洁污区域之间应更换;擦拭地面的地巾(拖布)不同病房及区域之间应更换,用后集中清洗、消毒,干燥保存。抹布擦拭时,按照“S”型走势,勿重复擦拭已经清洁过的区域。当擦拭两个不同的物体表面或抹布变脏时,必须更换抹布,忌反转用另一面擦拭或重新浸泡使用。 5.污点的清洁与消毒 (1)对于含小量血液或体液(通常<10ml)等物质的溅污,可先用吸湿材料,如布类、纸类、棉球等将其清除,如污渍已干涸,可使用含有效氯500mg/L消毒液、消毒湿巾或75%乙醇棉球擦去,然后使用500mg/L含氯消毒液的抹布或消毒湿巾,擦拭污染表面,作用30分钟。 (2)对于被血液、体液(通常>10ml)等污染的物体表面,建议采用含有效氯2000~5000mg/L 消毒液的抹布或消毒干巾覆盖污染物上,用覆盖物吸附清除污染物,后采用含有效氯2000mg/L消毒液浸泡的抹布或消毒湿巾以污染表面为中心,由外向内擦拭物体表面,作用30分钟。 6.有特殊感染患者周围的环境表面,应根据病原体选择有效的消毒剂。 7.清洁结束后,清洁工具应及时清洁与消毒,擦拭布巾清洗干净,在250mg/L有效氯消毒剂中浸泡30分钟,冲净消毒液,干燥备用;地巾清洗干净,在500mg/L有效氯消毒剂中浸泡30分钟,冲净消毒液,干燥备用。 8.实施清洁与消毒时应做好个人防护,不同区域环境清洁人员个人防护应符合规定。工作结束时应做好手卫生与人员卫生处理。 9.在实施清洁与消毒时,应设有醒目的警示标志。
消毒药械及一次性医疗产品索证管理登记表
武汉仲景东西湖中医医院 消毒药械及一次性医疗产品索证管理登记表 一、产品购进登记表: 二、生产企业出示证件: 1、《医疗器械生产企业许可证》或《医疗器械经营企业许可证》复印件 期限 □ 2、《医疗器械产品注册证》的复印件及产品合格证 期限 □ 3、法定代表人的委托授权书复印件,委托授权书应明确授权范围 期限 □ 4、销售人员的身份证复印件及单位介绍信。 □ 5、《生产企业营业执照》 期限 □ 三、经销企业出示证件: 1、一次性医疗器械证件管理: a 、《医疗器械生产企业许可证》或《医疗器械经营企业许可证》的复印件。期限 □ b 、《医疗器械产品注册证》的复印件 (年检)日 有效期 □ c 、产品合格证。(规格、重量、用途、生产范围、经营范围、年检) □ d 、企业法定代表人的委托授权书原件,委托授权书应明确授权范围。 期限 □ e 、销售人员的身份证复印件及单位介绍信。 □ f 、《经营企业营业执照》 期限 □ 2、采购消毒产品时,还应索取下列有效证件: a 、生产企业卫生许可证复印件 □ b 、卫生许可批件复印件 □ 有效证件的复印件均应加盖原件公司有效的印章,外地生产企业或经营企业必须取得我省药监局发放的《医疗器械经营企业许可证》。 验收结果: 证件不全 □ 证件部分齐全 □ 证件不齐全 □ 证件有无过期 □ 证件合格 □ 证件不合格 □ 药剂科负责人签名: 院感办验证签名: 日期: 卖货单位 生产厂家 产品名称 规格 产品批号 产品注册 证号 卫生许可 证号 失效期 出厂日期 单价 数量 购进产品的日期 购进产品的失效期 供需双方 经办人 签名 消毒或灭菌日期
消毒产品卫生安全评价规定
消毒产品卫生安全评价规定 第一条为进一步深化卫生行政许可改革、规范消毒产品生产企业的生产经营行为,加强企业自律,保障医疗卫生机构、公共场所等单位和个人用于传染病防治的消毒产品的有效性、安全性,依据《中华人民共和国传染病防治法》、《消毒管理办法》和有关规定,制定本规定。 第二条本规范适用于下列不需要取得产品卫生许可的消毒产品首次上市前的卫生安全评价: (一)紫外线杀菌灯。 (二)食具消毒柜(限于符合GB17988 《食具消毒柜安全和卫生要求》的产品)。 (三)压力蒸汽灭菌器。 (四)75%单方乙醇消毒液。 (五)符合《次氯酸钠类消毒剂卫生质量技术规范》和《戊二醛类消毒剂卫生质量技术规范》的产品。 (六)抗(抑)菌制剂。 (七)卫生部规定的其他不需要进行产品卫生许可的消毒剂和消毒器械。 第三条产品责任单位应对符合本规定适用范围的消毒产品进行卫生安全评价,并对评价结果负责。卫生安全评价合格的消毒产品方可上市销售。产品上市前、后,产品责任单位无需向卫生行政部门备案。 产品卫生安全评价的责任单位是指依法承担因产品缺陷而致他人人身伤害或财产损失的赔偿责任的法人单位。委托生产加工时,特指委托方。 第四条产品卫生安全评价内容包括产品标签、说明书、检验报告、执行标准,其中,消毒剂和抗(抑)菌制剂还包括产品配方、原料,消毒器械还应包括产品结构图。 第五条消毒剂和抗(抑)菌制剂的产品配方、原料的卫生安全评价结果应符合下列要求: (一)75%单方乙醇消毒液中的乙醇应符合《药典》或GB 10343《食用酒精》的规定,水应符合《药典》中纯化水的要求。 (二)次氯酸钠类消毒剂和戊二醛类消毒剂配方、原料的级别、含量等质量要求应符合《次氯酸钠类消毒剂卫生质量技术规范》和《戊二醛类消毒剂卫生质量技术规范》的要求,其中次氯酸钠类消毒剂含量波动范围应在±15%内。 (三)抗(抑)菌制剂配方、原料应符合GB 15979 《一次性使用卫生用品卫生标准》等国家或行业有关质量要求,禁、限用物质应符合《消毒产品生产企业卫生规范》、《卫生部关于发布皮肤粘膜消毒剂中部分成分限量值规定的通知》(卫法监发〔2003〕214号)及卫生部发布的其他相关规定,不得添加抗生素、抗真菌药物和激素。 第六条消毒产品的标签、说明书的卫生安全评价结果应符合下列要求: (一)《消毒产品标签说明书管理规范》的要求。 (二)食具消毒柜的标签/铭牌、说明书还应符合GB 17988《食具消毒柜安全和卫生要求》的要求,次氯酸钠类消毒剂和戊二醛类消毒剂的标签、说明书还应符合《次氯酸钠类消毒剂卫生质量技术规范》和《戊二醛类消毒剂卫生质量技术规范》的要求。 第七条产品责任单位应在产品首次上市前进行检验,检验项目应符合本规定中附件1的要求。 有下列情形之一的,应对产品重新进行检验(所有检验项目必须使用相同批次产品完成)。 (一)实际生产地址迁移、另设分厂或车间、转委托生产加工的,消毒剂应进行有效成分含量测定,原液稳定性试验,pH值测定(戊二醛类消毒剂应测定加入pH调节剂前、后的pH值);消毒器械应进行主要杀菌因子强度和电气安全性能的测定。 (二)消毒剂变更产品有效期的,应进行有效成分含量和稳定性指标的检验。 (三)次氯酸钠类消毒剂和戊二醛类消毒剂增加使用范围的(限于《次氯酸钠类消毒剂卫生质量技术规范》和《戊二醛类消毒剂卫生质量技术规范》中规定的使用范围),应进行理化指标和相应微生物的杀灭检验。
消毒产品卫生安全评价技术要求
消毒产品卫生安全评价技术要求 1 范围 本标准规定了消毒产品卫生安全评价的基本要求及内容。 本标准适用于中华人民共和国境内生产、经营和使用的除新消毒产品以外的第一类、第二类消毒产品[消毒剂、消毒器械、指示物、抗(抑)菌制剂]的卫生安全评价。 本标准不适用于定制消毒器械的卫生安全评价。 2 规范性引用文件 下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅所注日期的版本适用于本文件。凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。 生活饮用水消毒剂和消毒设备卫生安全评价(试行)(2005年版)中华人民共和国卫生部 3 术语和定义 下列术语和定义适用于本文件。 3.1 消毒产品卫生安全评价disinfection product hygienic safety evaluation 对消毒产品有效性和卫生安全性进行的综合评价,评价内容包括产品标签(铭牌)、说明书、检验报告、企业标准或质量标准、生产企业卫生许可证(境外允许生产销售的证明文件及报关单)、消毒剂、指示物和抗(抑)菌制剂的产品配方、消毒器械的主要元器件和结构图等。 3.2 产品责任单位responsible entity 依法承担因产品缺陷而致他人人身伤害或财产损失的赔偿责任的个人、法人及其他组织。委托生产加工时,特指委托方,进口产品的责任单位为在华责任单位。 3.3 第一类消毒产品classⅠdisinfection product 用于医疗器械的高水平消毒剂和消毒器械、灭菌剂和灭菌器械,皮肤/黏膜消毒剂,生物指示物、灭菌效果化学指示物。 3.4 第二类消毒产品class Ⅱ disinfection product 除第一类产品外的消毒剂、消毒器械、化学指示物,以及带有灭菌标识的灭菌物品包装物、抗(抑)菌制剂。 3.5 定制消毒器械customized disinfection instrument
医疗机构消毒技术规范》_(2012年版
《医疗机构消毒技术规范》 (2012年版)中华人民共和国卫生部 2012-04-05发布 2012-08-01正式实施 3.术语和定义 3.1 清洁cleaning 去除物体表面有机物、无机物和可见污染物的过程。 3.2 清洗 washing 去除诊疗器械、器具和物品上污物的全过程,流程包括冲洗、洗涤、漂洗和终末漂洗。 3.3 清洁剂 detergent 洗涤过程中帮助去除被处理物品上有机物、无机物和微生物的制剂。 3.4 消毒 disinfection 清除或杀灭传播媒介上病原微生物,使其达到无害化的处理。 3.5 消毒剂 disinfectant 能杀灭传播媒介上的微生物并达到消毒要求的制剂。 3.6高效消毒剂 high-efficacy disinfectant 能杀灭一切细菌繁殖体(所括分枝杆菌)、病毒、真菌及其孢子等,对细菌芽孢也有一定杀灭作用的消毒制剂。 3.7中效消毒剂 intermediate-efficacy disinfeetant
能杀灭分枝杆菌、真菌、病毒及细菌繁殖体等微生物的消毒制剂。3.8低效消毒剂 intermediate-efficacy disinfectant 能杀灭细菌繁殖体和亲脂病毒的消毒制剂。 3.9灭菌 sterilization 杀灭或清除医疗器械、器具和物品上一切微生物的处理。 3.10灭菌剂 sterilant 能杀灭一切微生物(包括细菌芽孢),并达到灭菌要求的制剂。 3.11无菌保证水平 sterility assurance level.SAL 灭菌处理后单位产品上存在活微生物的概率。SAL通示为10-n 。医学灭菌一般设定SAL为10-6 。即经灭菌处理后在一百万件物品中最多只允许一件物品存在活微生物。 3.12斯伯尔丁分类法 E.H.Spaulding classification 1968年E.H.Spaulding根据医疗器械污染后使用所致感染的危险性大小及在患者使用之前的消毒或灭菌要求,将医疗器械分三类,即高度危险性物品(critical items)、中度危险性物品(semi-critical items)和低度危险性物品(non- critical items)。 3.13高度危险性物品 critical items 进入人体无菌组织、器官、脉管系统,或有无菌体液从中流过的物品或接触破损皮肤、破损黏膜的物品,一旦被微生物污染,具有极高感染风险,如手术器械、穿刺针、腹腔镜、活检钳、心脏导管、植入物
不需卫生许可批件的消毒产品的
不需卫生许可批件的消毒产品的《卫生安全评价报告》内容要求 根据卫生部2009年11月11日颁布,2010年1月1日实施的《消毒产品卫生安全评价规定》:产品经营、使用单位在经营、使用上述产品前应索取生产企业卫生许可证和《卫生安全评价报告》(配方和结构图除外)的复印件,并由产品责任单位加盖公章。下列产品需提供:75%单方乙醇消毒液、次氯酸钠类消毒剂、戊二醛类消毒剂、抗(抑)菌制剂、紫外线杀菌灯、压力蒸汽灭菌器、食具消毒柜等。 产品经营、使用单位应对《卫生安全评价报告》中的产品名称、规格、剂型、责任单位、生产单位、标签说明书等信息与实际销售使用的产品进行核对,《卫生安全评价报告》的有关内容与产品相符的方可经营使用。 2010年1月1日前已上市的相关消毒产品未按《消毒产品卫生安全评价规定》要求进行卫生安全评价的,应尽快按要求补做卫生安全评价 卫生安全评价报告(格式) 注:本表应使用A4规格纸张打印,附件应按顺序排列,逐页加盖产品责任单位公章,并装订成册。配方的书写格式和要求附后。 产品责任单位盖章评价日期:年月日
注:①单一化学原料应填写原料的化学名称、CAS号和商品名称。单一的植物原料应填写拉丁文名称。 ②复合原料只填写复合原料的商品名,但应另行列明复合原料的组分构成,包括各组分的原料化学名称(或植物拉丁文名称)、CAS号以及构成百分比。 ③以植物提取物为原料的只填写原料商品名,但应另行列明提取物所使用的植物拉丁文名称及其用量、提取工艺和提取液的质量规格。 2、产品检验报告书 (1)75%单方乙醇消毒液、次氯酸钠类消毒剂、戊二醛类消毒剂、抗(抑)菌制剂、紫外线杀菌灯、压力蒸汽灭菌器、食具消毒柜等需提供。 (2)产品检验应在省级以上卫生行政部门认定的消毒产品检验机构进行。其中紫外线杀菌灯、压力蒸汽灭菌器、食具消毒柜等产品首次上市前的电器安全性能的测定应在市级以上具有法定计量认证资质的检验机构进行。 (3)产品责任单位应在产品首次上市前进行检验,检验项目应符合本规定中附件1的要求。 有下列情形之一的,应对产品重新进行检验(所有检验项目必须使用相同批次产品完成)。 第一、实际生产地址迁移、另设分厂或车间、转委托生产加工的,消毒剂应进行有效成分含量测定,原液稳定性试验,pH值测定(戊二醛类消毒剂应测定加入pH调节剂前、后的pH值);消毒器械应进行主要杀菌因子强度和电气安全性能的测定。 第二、消毒剂变更产品有效期的,应进行有效成分含量和稳定性指标的检验。 第三次氯酸钠类消毒剂和戊二醛类消毒剂增加使用范围的(限于《次氯酸钠类消毒剂卫生质量技术规范》和《戊二醛类消毒剂卫生质量技术规范》中规定的使用范围),应进行理化指标和相应微生物的杀灭检验。 3、企业标准/执行标准 4.标签说明书 5.消毒器械结构图(除消毒剂、抗抑剂外) 附件1检验项目及要求 表1 消毒剂检验项目及要求
消毒产品索证验证须知
消毒产品索证验证须知 一.消毒产品概念 消毒产品包括消毒剂、消毒器械(含生物指示物、化学指示物和灭菌物品包装物)、卫生用品。 (一)消毒剂: 1.用于医疗卫生用品消毒、灭菌的消毒剂 2.用于皮肤、粘膜消毒的消毒剂 3.用于餐饮具消毒的消毒剂 4.用于瓜果、蔬菜消毒的消毒剂 5.用于水消毒的消毒剂 6.用于环境消毒的消毒剂 7.用于物体表面消毒的消毒剂 8.用于空气消毒的消毒剂 9.用于排泄物分泌物等污物消毒的消毒剂 (二)消毒器械 1.用于医疗器械、用品灭菌的灭菌器械 2.用于医疗器械、用品消毒的消毒器械 3.用于餐饮具消毒的消毒器械 4.用于空气消毒的消毒器械 5.用于水消毒的消毒器械 6.用于物体表面消毒的消毒器械
(三)生物指示物 1.用于测定压力蒸汽灭菌效果的指示物 2.用于测定环氧乙烷灭菌效果的指示物 3.用于测定紫外线消毒效果的指示物 4.用于测定甲醛灭菌效果的指示物 5.用于测定电离辐射灭菌效果的指示物 (四)化学指示物 1.用于测定压力蒸汽灭菌的指示物(包括指示卡、指示胶带、指示标签和BD试纸) 2.用于测定环氧乙烷灭菌的指示物(包括指示卡和指示标签) 3.用于测定紫外线消毒的指示物(包括辐照强度指示卡和消毒效果指示卡) 4.用于测定干热灭菌效果的指示物 5.用于测定电离辐射灭菌效果的指示物 6.用于测定化学消毒剂浓度的指示物 (五)灭菌包装物 1.用于压力蒸汽灭菌且带有灭菌标识的包装物 2.用于环氧乙烷灭菌且带有灭菌标识的包装物 3用于甲醛灭菌且带有灭菌标识的包装物
(六)卫生部规定的纳入消毒剂、消毒器械管理的其他物品 二.消毒产品分类 1.第一类是具有较高风险,需要严格管理以保证安全、有效的消毒产品,包括用于医疗器械的高水平消毒剂和消毒器械、灭菌剂和灭菌器械皮肤黏膜消毒剂生物指示物、灭菌效果化学指示物。卫生安全评价报告效期:四年。 2.第二类是具有中度风险,需要加强管理以保证安全、有效的消毒产品,包括除第一类产品外的消毒剂、消毒器械、化学指示物带有灭菌标识的灭菌物品包装物抗(抑)菌制剂。卫生安全评价报告效期:长期。 3.第三类是风险程度较低,实行常规管理可以保证安全、有效的除抗(抑)菌制剂外的卫生用品。 三.消毒产品索证要求 1.第一类、第二类消毒产品 索取《消毒产品生产企业卫生许可证》和完整版的《消毒产品卫生安全评价报告》。 2.“三新”产品(新材料、新工艺技术和新杀菌原理) 索取《消毒产品生产企业卫生许可证》和《产品卫生许可批件》(注:我院无此类产品) 3.相关要求 《消毒产品卫生安全评价报告》内容包括:封面、基本
消毒产品卫生安全评价技术要求
ICS11.080 C 59 WS 中华人民共和国卫生行业标准 WS 628—2018 消毒产品卫生安全评价技术要求 Technical requirements for the hygiene and safety evaluation of disinfectant products 2018-09-21发布2019-03-01实施中华人民共和国国家卫生健康委员会发布
目次 前言................................................................................ I I 1 范围 (1) 2 规范性引用文件 (1) 3 术语和定义 (1) 4 基本要求 (2) 5 评价内容 (2) 附录A (规范性附录)消毒产品卫生安全评价报告格式 (5) 附录B(规范性附录)消毒剂检验项目 (8) 附录C(规范性附录)乙醇、戊二醛、次氯酸钠类、漂白粉和漂粉精消毒剂检测项目 (13) 附录D(规范性附录)消毒器械检验项目 (15) 附录E(规范性附录)化学指示物、生物指示物检验项目 (17) 附录F(规范性附录)带有灭菌标识的灭菌物品包装物检验项目 (19) 附录G(规范性附录)抗(抑)菌制剂检验项目 (20) 附录H(资料性附录)消毒产品检验报告体例 (21) 附录I(规范性附录)配方的书写格式 (27)
前言 本标准5.2.6为推荐性条款,其余为强制性条款。 本标准按照GB/T 1.1—2009给出的规则起草。 本标准主要起草单位:江苏省卫生监督所、中国疾病预防控制中心环境与健康相关产品安全所、山东省卫生和计划生育监督所、江西省卫生计生监督所、江苏省疾病预防控制中心。 本标准主要起草人:顾健、张一凡、张流波、袁青春、周玉、承叶奇、徐燕、赵斌秀、陈越英、姜天华、宋恒志、郭春林、林春桥、史绍毅、李齐天。
医疗机构消毒技术规范》-(2015年版57986
(2015年版)《医疗机构消毒技术规范》中华人民共和国卫生部 2015-04-05发布正式实施 2015-08-01 术语和定义3.cleaning 3.1 清洁去除物体表面有机物、无机物和可见污染物的过程。 washing 清洗3.2 去除诊疗器械、器具和物品上污物的全过程,流程包括冲洗、洗涤、漂洗和终末漂洗。 3.3 清洁剂 detergent 洗涤过程中帮助去除被处理物品上有机物、无机物和微生物的制剂。. 3.4 消毒 disinfection 清除或杀灭传播媒介上病原微生物,使其达到无害化的处理。 3.5 消毒剂 disinfectant 能杀灭传播媒介上的微生物并达到消毒要求的制剂。 3.6高效消毒剂 high-efficacy disinfectant 能杀灭一切细菌繁殖体(所括分枝杆菌)、病毒、真菌及其孢子等,对细 菌芽孢也有一定杀灭作用的消毒制剂。 3.7中效消毒剂 intermediate-efficacy disinfeetant 能杀灭分枝杆菌、真菌、病毒及细菌繁殖体等微生物的消毒制剂。 3.8低效消毒剂 intermediate-efficacy disinfectant
能杀灭细菌繁殖体和亲脂病毒的消毒制剂。 3.9灭菌 sterilization 杀灭或清除医疗器械、器具和物品上一切微生物的处理。 3.10灭菌剂 sterilant 能杀灭一切微生物(包括细菌芽孢),并达到灭菌要求的制剂。 3.11无菌保证水平 sterility assurance level.SAL 灭菌处理后单位产品上存在活微生物的概率。SAL通示为10-n 。医学灭菌一般设定SAL为10-6 。即经灭菌处理后在一百万件物品中最多只允许一件物品存在活微生物。 3.12斯伯尔丁分类法 E.H.Spaulding classification 1968年E.H.Spaulding根据医疗器械污染后使用所致感染的危险性大小及在患者使用之前)、中度危险itemscritical 的消毒或灭菌要求,将医疗器械分三类,即高度危险性物品(. 性物品(semi-critical items)和低度危险性物品(non- critical items)。 3.13高度危险性物品 critical items 进入人体无菌组织、器官、脉管系统,或有无菌体液从中流过的物品或接触破损皮肤、破损黏膜的物品,一旦被微生物污染,具有极高感染风险,如手术器械、穿刺针、腹腔镜、活检钳、心脏导管、植入物等。 3.14中度危险性物品 semi-critical items 与完整黏膜相接触,而不进入人体无菌组织、器官和血流,也不接触破损皮肤、破损黏膜的物品,如胃肠道内镜、气管镜、喉镜、肛表、口表、呼吸机管道、麻醉机管道、压舌板、肛门直肠压力测量导管等。
XX学校生活饮用水涉水产品及消毒产品索证制度
XX学校生活饮用水涉水产品及消毒产品索证制度 一、采购饮用水消毒药品,必须索取商家的卫生许可证、营业执照、消毒药品的检查合格证复印件. 二、索取新改扩建时所用涉及饮用水卫生安全产品的卫生许可批件复印件。 三、采购所有的饮用水消毒药品时,须认真仔细查看所购产品的生产日期、生产地址、注册商标、保质期限、标签等,禁止采购“三无”和伪劣产品。 四、所有的消毒药品索证材料需保存好,以备待查。 XX学校供管水人员体检培训制度 一、供、管水人员须参加基础卫生培训、持有健康证后方可上岗,健康证时效为一年。 二、供、管水人员办理健康证须统一组织在指定地点进行体检。 三、体检不合格的供、管水人员(如发现有传染病患者或健康带菌者)应立即时调离工作岗位,体检不合格的人员,不予从事该工作。 四、供、管水人员在健康证即将失效前10天,由学院食品卫生管理员统一组织供、管水人员体检办证。 五每年对供、管水人员进行两次以上系统的饮用水卫生知识培训,并至少保障每年有一次由卫生监督部门指导的培训。 饮用水清洗消毒制度 一、对饮用水设施进行必要的保养,以确保供水设施的完好正常使用。定时对饮水设施进行卫生清理和消毒。 二、师生的饮水机由供水方定期进行清洗、消毒,夏季每月一次,冬季每两月一次,并做好定期清洗消毒记录。 三、饮用水供水蓄水池每月定期进行清洗、消毒,并做好定期消毒记录。所用的净水剂和消毒剂必须符合卫生要求和有关规定。 四、经常观察饮水设施内外部的卫生和水质情况,及时清除污垢,保证师生饮用水的干净和卫生。 五、责任人须做好责任区内环境卫生,保持整洁的卫生环境。 XX学校供管水人员岗位责任制度 一、每天保障师生的生活用水。 二、定期对供水蓄水池进行清洗、消毒,并负责做好定期清洗消毒记录。 三、按标准对细菌指标超标的自备水进行严格的消毒,并负责做好消毒记录。若因玩忽职守未对水质进行严格的消毒而造成检测不合格,将承担对水质复查检测的费用。 四、按要求对细菌指标超标设备的操作,保证设备对水质的消毒效果。 五、按要求对净化处理设备的操作,保证设备对水质的净化效果。 六、注意个人卫生,做到勤换衣、勤剪指甲,勤洗澡、勤洗头。 XX学校水污染报告制度 为保证安全、优质、持续供水,完善落实水质事故的报告、处理事项,最大限度地减轻事故损失,特制订本制度: 一、若遇突发水污染事故时,立即关闭进水口,同时将情况汇报给学校领导,再由学校领导将此事件报告给上级主管部门和卫生监督部门,启动应急预案恢复供水。 二、发生传染病等疫情时,学校应将情况及时报告给上级主管部门和卫生监督部门,采取应急措施,保证水质达标。
消毒产品生产企业卫生规范标准
消毒产品生产企业卫生规范 第一章总则 第一条为规范消毒产品生产企业卫生管理,保证消毒产品卫生质量和使用安全,根据《中华人民共和国传染病防治法》及《消毒管理办法》等法律法规的有关要求,制定本规范。 第二条凡中华人民共和国境内从事消毒产品生产(含分装)的单位和个人应遵守本规范。 第二章厂区环境与布局 第三条厂区选址卫生要求: (一)与可能污染产品生产的有害场所的距离应不少于30米。 (二)消毒产品生产企业不得建于居民楼。 (三)厂区周围无积水、无杂草、无生活垃圾、无蚊蝇等有害医学昆虫孳生地。 第四条厂区环境整洁。厂区非绿化的地面、路面采用混凝土、沥青及其他硬质材料铺设,便于降尘和清除积水。 第五条厂区的行政、生活、生产和辅助区的总体布局应合理,生产区和生活区应分开。 第六条厂区应具备生产车间、辅助用房、质检用房、物料和成品仓储用房等,且衔接合理。 第七条厂区的生产和仓储用房应有与生产规模相适应的面积和空间。生产车间使用面积应不小于100平方米,其中分装企业生产车间使用面积应不小于60平方米;生产车间净高不低于2.5米。 第八条厂区内设置的厕所应采用水冲式,厕所地面、墙壁、便槽等应采用易清洗、不易积垢材料。 第九条动力、供暖、空调机房、给排水系统和废水、废气、废渣的处理系统等设施应不影响产品质量。
第三章生产区卫生要求 第十条生产区内设置的各功能间(区)应按生产工艺流程进行合理布局,工艺流程应按工序先后顺序合理衔接。人流物流分开,避免交叉。 第十一条生产区各功能间(区)应配置有效的防尘、防虫、防鼠、通风等设施。 第十二条消毒剂、化学(生物)指示物、抗(抑)菌制剂、隐形眼镜护理用品、卫生湿巾、湿巾的生产企业生产车间包括:配料间(区)、制作加工间(区)、分(灌)装间(区)、包装间(区)等。 分装企业生产车间至少包括:分(灌)装间(区)、包装间(区)等。 第十三条生产区内应设更衣室,室内应配备衣柜、鞋架、流动水洗手等设施,并保持清洁卫生。 消毒剂和卫生用品生产企业更衣室内还应配备空气消毒设施和手消毒设施。洁净室(区)应设置二次更衣室。使用的消毒产品应符合国家有关规定。 第十四条皮肤粘膜消毒剂(用于洗手的皮肤消毒剂除外)、皮肤粘膜抗(抑)菌制剂(用于洗手的抗(抑)菌制剂除外)、隐形眼镜护理用品等产品的生产区应根据各自的洁净度级别按生产工艺和产品质量要求合理布局。同一生产区内或相邻生产区间的生产操作,不得相互污染,不同洁净度级别的生产车间避免交叉污染。 洁净区的设计、建筑、维护和管理等应符合现行有关标准、规范的规定。 第十五条物料的前处理、提取、浓缩等生产操作工序与成品生产应在不同生产车间(区)或采取隔离等其他防止污染的有效措施。 第十六条生产区通道应保证运输和卫生安全防护需要,不得存放与生产无关物品。生产过程中的废弃物、不合格品应分别置于有明显标志的专用容器中,并及时处理。 第十七条生产车间地面、墙面、顶面和工作台面所用材质应便于清洁。对于有特殊卫生要求的产品,其生产车间还应符合下列要求: (一)隐形眼镜护理用品生产(包装除外)、分装应在10万级空气洁净度以上净化车间进行。 (二)皮肤粘膜消毒剂(用于洗手的皮肤消毒剂除外)、皮肤粘膜抗(抑)菌制剂(用于洗手的抗(抑)菌制剂除外)等产品配料、混料、分装工序应在30万级空气洁净度以上净化车间进行。
附录7.医疗机构消毒技术规范
附录7.医疗机构消毒技术规范 WS/T 367-2012 医疗机构消毒技术规范 2012-04-05 发布 2012-08-01 实施 前言 本标准按照GB/T 1.1-2009 给出的规则起草。 根据《中华人民共和国传染病防治法》制定本标准。 本标准由卫生部医院感染控制标准专业委员会提出。 本标准起草单位:北京大学第一医院、中国疾病预防控制中心、军事医学科学院疾病预防控制所、湖北省卫生厅卫生监督局、浙江省疾病预防控制中心、卫生部医院管理研究所、浙江大学医学院附属第二医院、上海瑞金医院、首都医科大学附属北京朝阳医院、厦门大学附属第一医院。 本标准起草人:李六亿、张流波、姚楚水、陈顺兰、班海群、胡国庆、张宇、丁炎明、陆群、钱黎明、刘坤、邢淑霞、任伍爱、黄靖雄、贾会学、要慧、黄辉萍。 医疗机构消毒技术规范 1 范围 本标准规定了医疗机构消毒的管理要求:消毒与灭菌的基本原则;清洗与清洁,消毒 与灭菌方法;清洁、消毒与灭菌的效果监测等。 本标准适用于各级各类医疗机构。 2 规范性引用文件 下列文件对于本文件的应用是必不可少的。凡是注日期的引用文件,仅注日期的版本 适用于本文件。凡是不注明日期的引用文件,其最新版本(包括所有的修改单)适用于本 文件。 GB/T 16886.7 医疗器械生物学评价第7 部分:环氧乙烷灭菌残留量 GB 19258 紫外线杀菌灯 GB/T 19633 最终灭菌医疗器械的包装 GB 50333 医院洁净手术部建筑技术规范
WS 310.1 医院消毒供应中心第1 部份:管理规范 WS 310.2 医院消毒供应中心第2 部份:清洗消毒及灭菌技术操作规范 WS 310.3 医院消毒供应中心第3 部份:清洗消毒及灭菌效果监测标准 WS/T 311 医院隔离技术规范 WS/T 313 医务人员手卫生规范 YY/T 0506.1 病人、医护人员和器械用手术单、手术衣和洁净服第1 部分:制造厂、处理厂和产品的通用要求 YY/T 0698.2 最终灭菌医疗器械包装材料第2 部分:灭菌包裹材料要求和试验方法 YY/T 0698.4 最终灭菌医疗器械包装材料第4 部分:纸袋要求和试验方法 YY/T 0698.5 最终灭菌医疗器械包装材料第5 部分:透气材料与塑料膜组成的可密封组合袋和卷材要求和试验方法 YY/T 0698.8 最终灭菌医疗器械包装材料第8 部分:蒸汽灭菌器用重复性使用灭菌 容器要求和试验方法 3 术语和定义 下列术语和定义适用于本文件 3.1 清洁 cleaning 去除物体表面有机物、无机物和可见污染物的过程。 3.2 清洗 washing 去除诊疗器械、器具和物品上污物的全过程,流程包括冲洗、洗涤、漂洗和终末漂洗。 3.3 清洁剂 detergent 洗涤过程中帮助去除被处理物品上有机物、无机物和微生物的制剂。 3.4 消毒 disinfection 清除或杀灭传播媒介上病原微生物,使其达到无害化的处理。 3.5 消毒剂 disinfectant 能杀灭传播媒介上的微生物并达到消毒要求的制剂。 3.6 高效消毒剂 high-efficacy disinfectant 能杀灭一切细菌繁殖体(包括分枝杆菌)、病毒、真菌及其孢子等,对细菌
- 定点医疗机构登记表
- 医疗保险异地居住参保人员就医登记表新
- 医疗机构基本情况登记表
- FESCO 修改定点医院所需的表格
- 医疗机构医务人员登记表
- 临沂市基本医疗保险 定点医疗机构申请书
- 定点医疗机构登记表
- 医院各类登记表
- 定点医疗机构申请书
- 异地定点医疗机构变更登记表
- 异地安置人员定点医疗机构登记表
- 医院各类登记表
- 医疗机构医务人员登记表
- 北京市社会保险个人信息登记表_基本医疗保险定点医疗机构
- 深圳市社会医疗保险参保人异地就医定点医疗机构登记表
- 门诊定点医疗机构信息登记表演示教学
- 定点医疗机构登记表
- 门诊定点医疗机构信息登记表
- 深圳市社会医疗保险参保人异地就医定点医疗机构登记表(样表)
- 社保定点医院变更登记表
