试验二典型系统瞬态响应和稳定性

实验二 典型系统瞬态响应和稳定性
一、 实验要求
了解和掌握典型二阶和三阶系统的传递函数和模拟电路图。观察和分析典型二阶系统在欠阻尼,临界阻尼,过阻尼的响应曲线及典型三阶系统在发散,等幅振荡,衰减振荡的响应曲线。 二、实验要求
a) 典型二阶系统
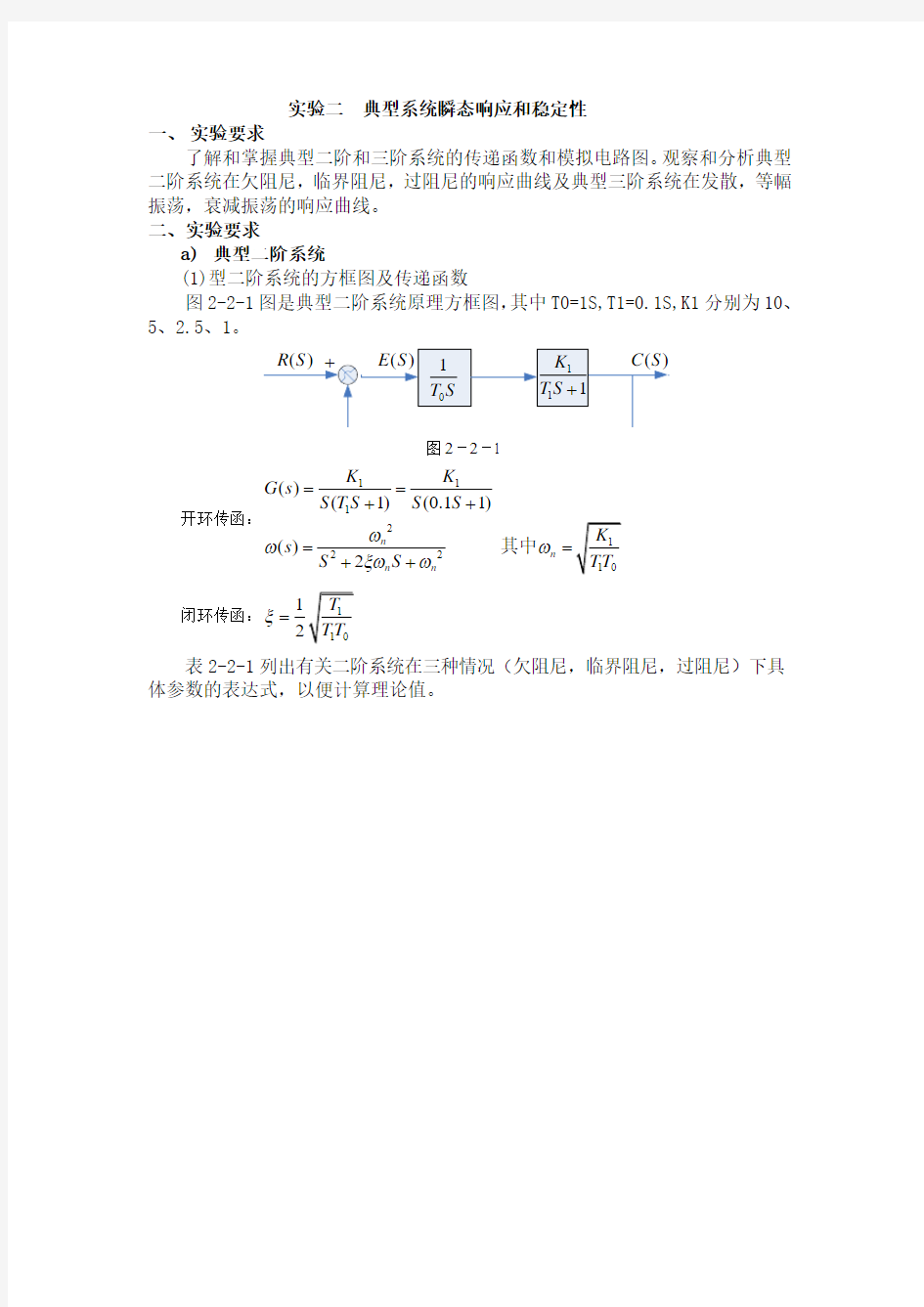
(1)型二阶系统的方框图及传递函数
图2-2-1图是典型二阶系统原理方框图,其中T0=1S,T1=0.1S,K1分别为10、5、2.5、1。
图2-2-1
开环传函:
11
12
22
()(1)(0.11)
()2n
n n
n K K G s S T S S S s S S ωωωξωω=
=
++=
=
++其中
闭环传函:ξ=
表2-2-1列出有关二阶系统在三种情况(欠阻尼,临界阻尼,过阻尼)下具体参数的表达式,以便计算理论值。
表2-2-1
(2)模拟电路图:见图2-2-2
)
图2-2-2
111
100
()(0.11)(0.11)100n K R G s S S S S K R ξω==
++=
?==
b) 典型三阶系统
(1)典型三阶系统的方框图:见图2-2-3
图2-2-3
12()()()(1)(1)
K
G S H S S T S T S =
++12
K K 开环传函:其中,K=
开环增益T 模拟电路图:见图2-2-4
图2-2-4
32510
510()()(0.11)(0.511)1()()0,11.9619.619.60
011.9642.6R G S H S K S S S R G S H S S S S K K K ROUTH ==
++=?+++=<
?Ω
开环传递函数其中系统的特征方程为:+系统稳定
由判据,得:K=11.96R=42.9K 系统临界稳定K>11.96R<42.6K 系统不稳定
三、实验内容及步骤
准备:将“B7信号发生器”的G 和G1用“开关”连接,使运算放大器反馈网络上的场效应管3DJ6夹断。
1、典型二阶系统瞬态性能指标的测试
(1)按图2-2-2接线,r(t)输入为阶跃信号,搭建方法图2-2-1,R=10K ,按模拟电路图由左至右依次使用A2、A4、A3运放单元构建,第一级运放的反馈电阻由A2中IN 和OUT 之间的第三个开关拨至ON (由下至上),剩余的200K 反馈电阻由A5中的W2或W4来构建(注意在实验过程中不允许调节此电位器)。将W2的一端连至A2单元的IN 端、另一端连至A3单元的OUT 端。
(2)用示波器观察系统阶跃响应C(t),测量并记录超调量Mp ,峰值时间tp 和调节时间ts 。记录表2中。
(3)分别按R=10K 、40K 、100K (在A3运放单元中改变R 的值)改变系统开环增益,观察相应的阶跃响应C(t),测量并记录性能指标Mp 、ts 及系统的稳定性。并将测量值和计算值(实验前必须按公式计算出)进行比较。参数曲线及响应曲线,详见下表。
2、典型三阶系统的性能
(1) 按图2-2-4接线,R=30K,r(t)输入为阶跃信号。按模拟电路图中由左至右顺序依次使用A2、A4、A3、A1,构建第一级运放的反馈电阻由A2中IN和OUT之间的第三个开关拨至ON(由下至上),而剩余的运放和200K电阻由A6或A7运放单元和A5电位器自行搭建。
(2)观察系统的阶跃响应,并记录波形。减小开环增益(R=42.6;100K)在
A1运放单元中改变R的值,观察系统的阶跃响应(注意由于调节等幅振荡要求
电阻准确性较高,R最好用A5中的电位器调节。解法为将A1中IN和H之间的开关不要打开,第三级运放的输出端与A5的电位器一端相连,电位器的另一端与A1中的IN相连)。参数取值及响应曲线详见表3
控制系统时间响应分析”实验报告
控制系统时间响应分析”实验报告
实验一、“控制系统时间响应分析”实验报告 一、实验类型 验证性实验 二、实验目的 1、 求系统在时间常数τ不同取值时的单位脉冲、单位阶跃响应和任意输入响应,熟悉系统时间响应的定义和图形曲线 2、 求系统的上升时间、峰值时间、最大超调量和调整时间等性能指标,熟悉系统瞬态性能指标的定义。 三、实验仪器与设备(或工具软件) 计算机,MATLAB 软件 四、实验内容、实验方法与步骤 已知系统传递函数 50 )1(05.050)(2+++=s s s G τ 1、求系统在时间常数τ不同取值时的单位脉冲、单位阶跃响应和任意输入 响应。 应用impulse 函数,可以得到τ=0,τ=0.0125、τ=0.025时系统单位脉冲响 应;应用step 函数,同样可以得到τ=0,τ=0.0125、τ=0.025时系统单位阶跃响应。 2、求系统的瞬态性能指标 五、实验结果 1、系统在时间常数τ不同取值时的单位脉冲、单位阶跃响应和任意输入响 t=[0:0.01:0.8];%仿真时间区段 nG=[50]; tao=0; dG=[0.05 1+50*tao 50]; G1=tf(nG,dG); tao=0.0125; dG=[0.05 1+50*tao 50]; G2=tf(nG,dG); tao=0.025; dG=[0.05 1+50*tao 50]; G3=tf(nG,dG);%三种τ值下,系统的传递函数模型 [y1,T]=impulse(G1,t);[y1a,T]=step(G1,t); [y2,T]=impulse(G2,t);[y2a,T]=step(G2,t);
控制系统时间响应分析”实验报告
实验一、“控制系统时间响应分析”实验报告 一、实验类型 验证性实验 二、实验目的 1、 求系统在时间常数τ不同取值时的单位脉冲、单位阶跃响应和任意输入响应,熟悉系统时间响应的定义和图形曲线 2、 求系统的上升时间、峰值时间、最大超调量和调整时间等性能指标,熟悉系统瞬态性能指标的定义。 三、实验仪器与设备(或工具软件) 计算机,MATLAB 软件 四、实验内容、实验方法与步骤 已知系统传递函数 50 )1(05.050)(2+++=s s s G τ 1、求系统在时间常数τ不同取值时的单位脉冲、单位阶跃响应和任意输入响应。 应用impulse 函数,可以得到τ=0,τ=0.0125、τ=0.025时系统单位脉冲响应;应用step 函数,同样可以得到τ=0,τ=0.0125、τ=0.025时系统单位阶跃响应。 2、求系统的瞬态性能指标 五、实验结果 1、系统在时间常数τ不同取值时的单位脉冲、单位阶跃响应和任意输入响 t=[0:0.01:0.8];%仿真时间区段 nG=[50]; tao=0; dG=[0.05 1+50*tao 50]; G1=tf(nG ,dG); tao=0.0125; dG=[0.05 1+50*tao 50]; G2=tf(nG ,dG); tao=0.025; dG=[0.05 1+50*tao 50]; G3=tf(nG,dG);%三种τ值下,系统的传递函数模型 [y1,T]=impulse(G1,t);[y1a,T]=step(G1,t); [y2,T]=impulse(G2,t);[y2a,T]=step(G2,t); [y3,T]=impulse(G3,t);[y3a,T]=step(G3,t);%系统响应 subplot(131),plot(T,y1,'--',T,y2,'-.',T,y3,'-') legend('tao=0','tao=0.0125','tao=0.025') xlabel('t(sec)'),ylabel('x(t)');grid on; subplot(132),plot(T,y1a,'--',T,y2a,'-.',T,y3a,'-') legend('tao=0','tao=0.0125','tao=0.025') grid on;xlabel('t(sec)'),ylabel('x(t)');%产生图形 t=[0:0.01:1];u=sin(2*pi*t);% 仿真时间区段和输入 Tao=0.025;
临床现考中常见的问题
现考中的常见问题 一、现场考察的目的 1、评估是否遵循法规,指导原则及SOP进行Ⅱ、Ⅲ期临床试验。(四期不涉及现考) 2、确定受试者权益和安全性是否获得保障。 3、确定临床试验资料的真实性。 4、促进临床试验更加规范。 二、现场检查的类型 按检查方式分类 1、定期、常规检查 定期进行基地复核、机构复核 2、有因检查 在以下情况发生后进行的检查称为有因检查: 被人举报违规、严重违背GCP、同期承担过多项目或多个相同项目、入组率过高或过快、安全性或有效性结果异常、既往不良行为。 现场检查类型 1.按检查方式分类 a)、飞行检查: 当研究者涉嫌有违规操作时可进行的突击检查,且不需要提前通知 b)、跟踪检查: 在整个实验进行中或实验结束后针对整个实验操作各方面的规范性进行的检查 2、按检查对象分类 a)、机构/专业检查 基地核查、机构核查 b)、研究项目/专项检查 在药物报生产之后进行的检查 三、检查要点
1、实验条件 a)、承担临床试验机构及相关专业应具备相应资格。 b)、具有《药物临床试验批件》及伦理委员会批件。 c)、具有并遵循所制定的临床试验管理制度。 d)、试验人员承担的相应工作,研究时间应与原始记录和申报资料记载一致。 e)、仪器、设备应与试验项目适应,其型号、性能、使用记录等应与申报资料一致。 2、实验记录 知情同意书应由受试者或其法定代理人签署,必要时可电话核实。 3、试验用药的接收和使用 a)、质检报告、临床试验方案与总结报告,以及申请资料中试验用药批号应一致。 b)、试验用药的接收,使用和回收应有记录及相关人员签名,接收,使用及剩余数量间的关系应对应一致。 c)、试验用药的用法用量及使用总量应与用药原始记录及临床试验报告对应一致。 4、数据溯源 a)、CRF与原始资料(需核查原始病历,实验室检查,影像,ECG,Holter,胃肠镜等检查的原始记录,。。。。。。)以及申报资料须对应一致。 b)、原始资料中各种临床检查数据须能溯源,必要时应对临床检查部门(检验科、影像室、各种检查室等)进行核查。 现考中先考人员可抽取一些病例与原始数据核对,查看是否真是。 c)、临床试验总结报告中完成病例数与实际临床试验病例数对应一致。 在此过程中,可能存在以下问题,总结报告中各个中心的的病例数与分中心小结中的病例数不一致,是因为分中心小结中的病例是包括了这个中心的所有病例,而总结报告中的病例数不包括剔除的病例 d)、统计报告与临床试验总结报告须对应一致。 e) 、药动学与生物等效性试验的原始图谱溯源。 1)纸质图谱是否信息完整,并与数据库中电子图谱一致。 2)原始图谱及数据是否与总结报告对应一致。
当前工地试验室检测存在问题建议
浅谈当前工地试验室检测存在的问题与建议摘要:工地试验检测是公路、航道工程质量控制的主要手段。然而,随着近年来航道工程的迅猛发展,工地试验检测工作却出现了诸多与之不相适应的问题。笔者结合几年工地试验检测工作实践,对当前工地试验检测工作中普遍存在的问题进行了深入分析,并提出建议。 abstract: site experimental detection is the primary means of highway and waterway engineering quality control. however, with the rapid development in recent years, there are many incompatible problems occuring.based on years of practice, the author would like to conduct in-depth analysis and recommendations against current common problems. 关键词:工地试验室;检测;问题;建议 key words: site laboratory, detection, problems, suggestions 中图分类号:ts736+.2 文献标识码:b文章编号:2095-2104(2011)12-0000--02 工地试验室承担了工程项目大量的试验检测工作,而能反映工程建设质量的数据均是通过工地试验检测得来的。然而,工地试验检测往往会受到工程资金、进度、施工形象要求等方面的影响而不能很好地开展,甚至有的工程项目工地试验室形同虚设,试验检测工作只流于形式。笔者结合多年航道工程工地试验检测工作实践;
从新的角度进行电子产品稳定性测试
从新的角度进行 电子产品稳定性及可靠性测试(1)现有电子产品稳定性测试偏重于环境和机械测试,产品企业相关的测试流程已经完善。从现在的行业来看,包括三星的爆炸事件与苹果的异常关机事件都在表明,供电系统的稳定及可靠是亟待解决的问题。 一款产品要达到客户端,一般分为功能测试,性能测试及稳定性测试。从普遍经验来看,产品的损坏或者异常大部分出现在开关机及特殊状态(干扰或者意外)。正常工作状况下损坏几率微乎其微。 从电子产品的维护经验来看,元器件问题导致的损坏在20%左右,生产工艺问题导致的损坏一般在20%-30%(与生产规模相关),供电及特殊状态导致的损坏高达50%以上。前两者的讨论及改善我们已经做了很多和深入的研究,有各种有益的结果。现在更大的改善空间在于对供电及特殊状态的适应改善。 现有的可靠性测试一般分为环境测试和机械测试,环境测试一般进行温度、湿度、盐雾、粉尘对产品的影响,机械测试一般进行各种外力、震动及跌落等对产品的影响。现在社会上影响比较大的事件却跟供电部分的保护与供电适应范围有关系,那么电子产品的供电对产品有哪些影响,怎么测试呢? 电子产品的供电部分分为充电>电池----工作电路,三星的事件与充电与电池及其保护有关,苹果的事件与电池及其保护与工作电路的配合有关。 供电部分一般进行的测试项目:
开关机:功能性测试,测试产品能否正常开关机;性能测试,测试产品的开机电压,关机电压,开机时间,关机时间,电源的变化速度对产品的影响,开关机是否会导出产品的性能或者功能异常;稳定性测试,测试产品的相应功能是否在开关机时偶发性逻辑或者功能异常,不同的开关机配合环境测试,是否会导致异常。 电源瞬时跌落或者中断:电源的电压因为接触,或者其他原因会导致到工作电路部分的电源瞬时供应不足或者中断。这种异常状况会导致芯片本身的数据存储,处理,芯片间的通讯,芯片和元器件的控制及逻辑进行影响。要进行产品在允许的供电异常状态下,能够正常工作。 电源供电保护:电源的供电电压长时间过压欠压,短时间过压欠压,保护动作,保护时间,保护状态,保护逻辑及保护稳定性的测试。 电源干扰:所有的电路布线及连接对于干扰来说都是天线,一个供电有多个用电器(汽车,飞机,舰艇)时的供电互相干扰。比如汽车电子,就有ISO18650的行业测试标准,来专门测试供电部分对电子产品的影响。 其他异常:其他行业性的特色测试要求。或者实际使用又特殊环境的要求 电池保护及配合:具有电池的电子产品,在进行相关测试的时候,模拟电池的充放电特性及过充过放状态,来进行相关的配合充电器及与工作部分的配合。 以上测试配合环境测试同时进行,更能充分模拟产品在实际使用时的工作状况。 具体详细测试,请参考后续应用文章:
ELISA常见问题
1、ELISA试验的稳定性问题 做ELISA实验时,结果老是重复性不上,相同的材料和相同的操作方法做出的结果就截然不同,上午做时其OD在1.5,下午做时就是0.9了,所以都没有办法下结论,为什么会差异这么大呀? (1)多设平行空孔,请别人代劳,以判断究竟是否操作问题 (2)对于活性非常高的包被物和酶标记物,如果第一次选择的范围恰好在其平台位置边缘,那么在重复的时候,每次取样带来的微量误差就很容易导致大的偏差了,特别是线性比较好的原料试剂,这个就很正常了。建议每次取样的时候只使枪尖一点点位于液面下,以免吸嘴外面沾有少量抗原or抗体or酶而使结果重复不上。 2、酶不稳定,有何高招? (1)保存浓度尽量高些, (2)另外可以添加牛血清白蛋白等蛋白保护剂,以避免其被吸附或沉降以及被蛋白酶所降解。 (3)加入50%甘油-20度保存、避免反复冻融。 (4)还可以加入防腐剂防止长菌(注意不能用叠氮钠,其对HRP活性有很大影响)(5)现在一些公司也有商品化的酶标保护剂供应,可以考虑一下 酶类的稳定性与保存方法的很大关系。干燥的制品一般比较稳定,在低温情况下其活性可在数日甚至数年无明显变化,贮藏要求简单,只要将干燥的样品置于干燥器内(内装有干燥剂)密封,保持0-4度冰箱即可。液态稳定性较差,贮藏时应注意以下几点:1、样品不能太稀,必须浓缩到一定浓度才能封装贮藏,样品太稀易降解、变性。2、一般需加入防腐剂和稳定剂,酶常用的稳定剂有硫酸铵糊、蔗糖、甘油等,也可加入底物和辅酶以提高其稳定性。此外,钙、锌、硼酸等溶液对某些酶也有一定保护作用。3、贮藏温度要求低,避免反复冻融。 3、ELISA试验中不加标本的OD值反而高于加人的阴性标本的OD值,是什么原因呀? 做夹心法ELISA试验中不加标本的OD值反而高于加人的阴性标本的OD值,是什么原因呀? 最大的原因是封闭的效果不好,应该调整封闭液; 可以尝试不同的封闭剂(BSA、胶脂奶粉、明胶等)、不同的封闭浓度、时间,试试哪个效果好 阴性的里面的其他蛋白起到了封闭的效果 4、边缘的阴性OD值老是比中间的偏高,什么原因呢? 我做ELISA时,有一段时间在板的最后一条板孔的阴性的OD值经常比在中间的高,有时候高出0.1个OD,导致实验经常重复,但原因也找不到在哪里? 这可能是由于ELISA的边缘效应造成的。ELISA的边缘效应是指边缘孔与中心孔反应条件不一致,由于边缘效应的影响,同一标本在边缘孔测定的结果明显高于中央孔,且随边缘孔与中央孔的距离的增加而增强。原因在于试验过程中边缘孔与中央孔的温度、液体蒸发程度不同以及各孔表面存在光洁度等物理性状的差异有关。为克服其影响,应尽可能使用中
临床试验中经常遇到的100个问题
中国创新药咨询与服务先锋CRO 临床试验中经常遇到的100个问题
目录 1、什么是 GCP? (1) 2、为什么会有 GCP?GCP 是如何发展的? (1) 3、什么是 ICH?目的是什么? (1) 4、ICH GCP 是如何定义的? (2) 5、中国是否有 GCP?包括哪些内容? (2) 6、实施 GCP 的利弊有哪些? (2) 7、哪些人应了解 GCP? (3) 8、什么是“赫尔辛基宣言”? (3) 9、什么是伦理委员会?它是如何组成及运作的? (3) 10、需要呈送伦理委员会的文件有哪些? (4) 11、什么是临床试验方案?其目的是什么? (4) 12、什么是研究者手册?研究者手册包括哪些内容? (4) 13、谁是合格的研究者? (5) 14、为什么研究者要保证用于临床试验的时间? (5) 15、试验中心的人员及设备符合试验要求吗? (5) 16、申办者是否要为参加试验的受试者上保险或在发生试验用药品相关的损害时给予赔偿? (5) 17、GCP 对参加试验的研究者有哪些要求? (5) 18、什么是受试者知情同意?如何获得受试者知情同意书? (6) 19、是否允许先做常规校查,再获知情同意? (6) 20、试验组以外的人员是否可以参加本应由该试验组实施的临床试验? (6) 21、什么是受试者入组/筛选表? (6) 22、什么是病例报告表?如何填写病例报告表?如何更正病例报告表中的错误? (6) 23、什么是不良事件? (7) 24、什么是严重不良事件? (7) 25、如何收集不良事件? (7) 26、如何报告严重不良事件? (8) 27、试验中对试验用药品应如何管理?(何时才允许将试验用药品发送至医院?) (8) 28、对试验用药品的标签有何规定? (8) 29、什么是盲法试验? (8) 30、什么是紧急破盲表?破盲表应如何保存?在什么情况下允许破盲? (9) 31、谁应负责试验的统计分析? (9) 32、谁应负责撰写试验总结报告? (9) 33、什么是稽查?稽查员的职责是什么 (9) 34、常见的稽查对象是谁? (9) 35、什么是视察? (9) 36、什么是 SOP? (10) 37、在临床试验中如何尊重受试者的隐私权? (10) 38、在临床试验中如何保护受试者? (10) 39、如果不能找到合格的受试者应该怎么办? (11) 40、谁负责获得受试者知情同意书? (11) 41、可否在试验过程中更改知情同意书的内容? (11) 42、如何对试验用药品计数? (11) 43、为什么回收使用过的试验用药品包装非常重要? (12) 44、研究者从何处可以获得有关试验用药品的信息? (12) 45、试验方案的目的是什么? (12)
工地试验室常见问题
工地试验室检查中常见的78个问题 2016-01-08陈海东 作者陈海东本站原创,禁止转载 陈海东,监理检测网试验检测公益讲师。男1969年4月出生;江苏盐城人。盐城路桥建设工程有限公司中心试验室主任。 我们公路工程施工,目前第三方检测还没全面普及,特别是施工方、监理方,中标后成立试验室,这个工地试验室的性质隶属于中标单位自己。所有的检测是自检,自己建的试验室在很大的程度上要为各自己的利益说话了。当然业主现在一般是第三方检测了。加强工地试验室的管理就显得非常必要。 总结了两个方面78点,欢迎大家到监理检测网论坛中交流。 内业资料 1、工地试验室是由母体试验室授权的。工地试验室主任是由母体试验室任命的。 2、工地试验室有没有经过省厅、市局的质监部的备案。备案有没有过期 3、现场的试验人员与备案上的人员有没有变化,变化率为多大,有没有经过审批。 4、工地上的试验人员是否是母体公司注册人员。很多试验人员的证书不注册,就放在自己身上。江苏已在治理这些事。 5、作为母体的试验室,有没有对工地试验室进行监管检查,检查的记录如何。 6、试验室的仪器设备与投标书是否相符,能否达到工程检测的要求。 7、工地试验室不能检测的试验,外委什么单位做,有没有相关单位的资质、合同。监理检测网 8、上墙的制度要加盖受控章。 9、高速公路的持证试验人员,一个亿要有5~6个,二个亿要有9~10个。挂证也算啊。师证要全啊,路材桥全要。不然根本完不成大量的试验检测任务。相当还要辅助人员。 10、挂证人员的签字和资料的上签字核对一下笔迹就能发现问题。 11、台帐和试验记录要一致。 12、一个试验人员,同一天不可能做很多事,不能到处签字。 13、同一次的几个试验数理雷同太厉害。
电脑故障传统诊断奇冠诊断与稳定性测试卡
电脑故障传统诊断、奇冠诊断与稳定性测试卡 使用讲明书V1.1 (适用于台式机和笔记本电脑) 全球唯一,用卡必读 中国发明专利号:03126857.9
专利证书号:208776 侵权必究 中国·广东·奇冠电子有限公司研制
前言 特不感谢您选择奇冠公司的传奇稳(传统诊断——BIOS POST代码、奇冠诊断、奇冠稳定性测试,简称“传奇稳”)系列产品,假如您有什么疑问,请登陆我司网站https://www.wendangku.net/doc/5f11339768.html,查询详情解答;您还能够将具体问题发E-mail 到p678@https://www.wendangku.net/doc/5f11339768.html,,我们会及时回复您。感谢您的信赖和支持! 本卡采纳大规模IC集成模块,结构紧凑,稳定可靠,确保产品品质符合高标准要求。内部资源更丰富,抗干扰性能更优越,自身故障率极低。无须用户安装软件,软件全部内置,我们将前沿科技与使用者行为科学相结合,进行了人性化功能设计,使用特不方便。 本公司是一家专业研发、生产诊断卡的企业,生产的新一代、准确王、二合一卡系列及传奇稳系列产品已获CE认证并受中国国家专利爱护(专利号:03126857.9),侵权必究。我公司已不再生产传统诊断卡,请宽敞用户在购买时认准“奇冠”字样商标及防伪标识。本用户手册所提到的产品规格及资讯仅供参考,实际内容亦会随
时更新,恕不另行通知。假如您要了解最新产品资讯,请访问我公司网站。 本讲明书不断改进,欢迎用户向我司多提意见和建议。 免责声明:对使用本卡给用户造成的损失,本公司恕不承担。 欢迎访问广州奇冠电子公司网 https://www.wendangku.net/doc/5f11339768.html,
目录 一、用户必读 (1) (一)传统诊断部分 (1) (二)奇冠诊断部分 (1) (三)稳定性测试部分 (1) 二、传奇稳卡功能特点 (2) (一)传统故障诊断功能特点 (2) (二)奇冠诊断功能特点 (2) (三)稳定性测试功能特点 (2) 三、传奇稳卡部件介绍 (3) 四、传奇稳卡指示灯介绍 (4) (一)传奇稳卡指示灯含义 (4) 1.什么缘故CLK、FRAME、IRDY指示灯要改进, 改进后有何好处? (4)
(完整版)医疗器械临床试验EDC常见疑问
医疗器械临床试验EDC常见疑问 临床试验中,数据采集可分为传统的基于纸质病例报告表(CRF)和基于网络的电子病例报告表(eCRF)两种方式。其中,基于网络的eCRF也就是我们通常所了解的电子数据采集(Electronic Data Capture, EDC)。 目前,医疗器械临床试验由于起步晚等原因,尚处于从纸质向EDC转换的阶段,有部分申办方、研究者等临床试验相关人员对EDC的认识不足,甚至存在着一些误解。下面,针对这些常见的疑问进行解析。 问题一:什么是EDC? 电子数据采集(EDC)是一种基于计算机网络的用于临床试验数据采集的技术,通过软件、硬件、标准操作程序和人员配置的有机结合,以电子化的形式直接采集和传递临床数据。EDC应具备eCRF构建、数据保存和稽查轨迹、逻辑核查、数据质疑管理、源数据核查确认、电子签名、数据库的锁定、数据存储和导出等基本功能。 那我们所熟悉的纸质CRF与EDC之间有什么关联/区别。举个简单的例子,调查问卷的数据收集,电子问卷现今已基本替代以前纸质问卷的方式。纸质问卷需打印填写,收集填写完毕后需要整理录入,然后才能进行分析处理,而电子问卷可通过邮件/微信等网络途径收集,便可直接进行分析甚至直接得到结果。电子信息化时代,EDC是临床试验数据采集技术/方式发展的必然阶段,而且随着技术的进步,EDC正往功能更强大、更智能化的阶段发展,如与医院的HIS等系统对接自动识别采集数据,极大提高了数据采集效率和数据质量。至今,临床试验数据采集方式的发展历程[1]可见图1。 图1.数据采集方式的发展历程
问题二:EDC有什么法规支持? 临床试验的开展需严格遵循法规及相关指导原则的要求,自然,大家都很关注EDC相关法规的要求。 事实上,现今并没有现行法规把EDC使用作为强制性的要求。2016年,总局发布的《临床试验的电子数据采集技术指导原则》(114号)中,详细阐述了电子数据采集技术的概念和基本考虑,电子数据采集系统的基本技术要求以及在临床试验实施不同阶段的应用要求。国外也早已发布了相关的法规及指南,如:美国21号联邦法规第11部分(21 CFR Part 11)对电子记录和签名、计算机系统的验证、稽查轨迹,以及文件记录的复制等方面提出明确的要求。国内外EDC 的主要相关法规详见图2。 信息技术最大益处在于提供更大便利的情况下达到更规范化的标准,如上EDC介绍,EDC是技术的进步,是势不可挡的时代要求。十年前,我们普遍还在使用小灵通等按键手机,现今智能手机已全面替代并且更新换代极为迅速,没有任何法制的要求我们必须使用什么类型的手机,但时代会要求。在美国,现在已经有80%以上的临床试验在使用EDC,并且随着EDC相关技术的发展,EDC的使用比例还会继续上升[1]。在临床试验快速发展、规范化要求日益提高的阶段,纸质CRF的采集方式已显得捉襟见肘,EDC终将成为必然。 图2.国内外EDC的相关法规
工地试验室检查发现问题整改情况说明
Xxx试验室检查发现问题整改说明 2013年X月X日,XXX到我部检查工作,发现我部在试验室管理方面存在诸多问题。检查结束后,我部立即召开施工管理专题会,分析问题出现的原因,对试验室人员进行了处罚和教育,并要求试验室对照检查中发现的问题限期整改。同时,项目部要求其它职能部门以此次XXX检查为契机,全面展开自查自纠,举一反三,切实提高项目管理水平。现对检查发现的问题作简单说明: 问题一:混凝土拌和站配合比标识牌含水率填写未及时更新;标识牌上的监理人员在监理部名册中无法查到。 原因说明:试验人员疏于现场管理,没有及时对拌和站配合比标识牌进行更新;张东明为监理部年初聘请的监理工程师,后因故离职,目前试验监理工程师也姓张,填写错误是由于拌合站人员对监理人员不熟,工作疏忽所致。 整改情况:更新配合比标识牌内容,及时填写施工配合比。 问题二:砂石料堆放区标识牌检验日期为X月XX和X月XX 日,但工地试验室未能提供上述时间的检验合格报告。 原因说明:X月份,我部喷射混凝土回弹量很大,经讨论分析,认为是由于碎石生产线刚安装调试,材料粒径不稳定所致。为减少混凝土回弹量,试验室在检测频率符合要求的情况下,只对材料的粒径增加了试验,但对表观密度、针片状等指标未一一
作检测,因此,部分样品未出检验报告。审计组检查发现的24日和29日就属于这类情况,试验室对原材料做了筛分试验,但因检验指标不全,没有出试验报告。 整改情况:对照检测报告填写原材料标示标牌,保证试验资料的严肃性和准确性。 问题三:工地试验室养护室内温湿度自控仪、空调未使用,养护条件不能满足规范要求。 原因说明:养护室温湿度自控仪XX月XX日发生故障,不能使用。试验人员已报厂家维修,但因工地较偏僻,交通不便,检查时仪器尚未维修好。 整改情况:现养护室内温湿度自控仪已经维修好,现已正常使用,养护室内温度、湿度达到规范要求。 问题四:压力机台帐记录X月XX日使用了仪器,但未找到相对应的记录。 原因说明:经查询,X月XX日试验室为附近正在施工的XXXX 工程送来的试件进行了检测,因其不属于XXXX工程,故试验人员没有出具抗压强度报告。 整改情况:重新梳理了各类仪器的使用台账和试验记录,设专人统一管理。 审计组此次检查使我们认识到项目试验管理存在较大问题,其根本原因在于试验人员思想松懈,工作疏忽,对试验工作的重要性认识不足。项目部现已组织了为期一周的试验培训工作,力
触摸芯片稳定性的测试方法
触摸芯片稳定性的测试方法 关键词:触摸感应,误动作、可靠性测试。 (一)引言 触摸感应的操作面板因为其坚固、耐磨损、可以绝缘、隔尘、隔水,而且外观美观新颖而迅速在很多领域被应用,成为近年的热门技术。但很多采用了触摸感应面板的产品都遇到了诸如生产调试困难,触摸感应面板工作不稳定,在潮湿,强干扰环境下容易误动,造成客户退货的难题。 (二)问题 生产调试困难,无法上批量生产。触摸感应面板工作不稳定。在潮湿,强干扰环境下容易误动,造成客户退货。产品长期工作稳定性差,生产线调试好的产品,经过运输或长期工作以后灵敏度变化或经常误动而增加了很大的售后成本。 这些原因造成了很多厂家既希望采用这一新技术,又对采用了这个技术的产品是否能稳定工作心存疑虑。因为触摸感应面板简单的试用往往无法发现有什么不妥。经常要等到发货后顾客使用一段时间才会出现形形色色的问题。这时不可避免的会给厂家带来成本和声誉上的损失。 顾客遇到触摸感应面板的突出问题就是灵敏度和可靠性(无误动)各种环境下很难保持稳定,尤其是长期工作的情况。 (三)问题分析 触摸感应面板目前主流的技术是采用电容感应技术来实现。因为手指在感应盘上带来的电容变化极小,而且随着隔离的绝缘面板厚度增加,电容的大小会成指数降低。大概隔5mm 的钢化玻璃后,人的手指触摸只能带来不到0.5PF的电容变化。对于这样微小的测量量,湿度、温度的变化、电磁干扰、电源干扰等都会极大的影响测量电路的测量结果。如果没有特
殊、专业的处理办法很难保证触摸感应面板的工作稳定尤其是各种恶劣环境下的长期稳定性。 现在提供触摸感应芯片和方案的公司较多,他们的水平参差不齐。技术水平高的公司可以解决触摸感应面板设计的难点问题。有些公司提供的芯片和方案宣传作的很好,东西也较便宜,但产品却只能保证“能动”。如果没有经过仔细的验证很难保证顾客在各种使用环境下不会出问题。 我们完成了一个带触摸感应面板的产品设计后,必须自己用贴近顾客使用环境且相对严格的测试方法进行反复、长时间测试来确保产品的可靠性。 (四)测试方法 电子产品尤其是家电类的产品出厂往往需要通过EMC,FCC,EFT 等测试。这些测试需要专业的设备,而且通过了这些测试的产品往往也不能保证在实际的应用环境下就可靠。我们总结出了一些可以模拟实际使用环境下验证触摸感应面板性能的办法,在研发和小批量试产的条件下就能对触摸感应面板的性能做到心中有数。希望能与大家共同分享。 (五)测试前的准备 固定和密封好的待测试触摸感应面板。 蒸汽熨斗或电水壶一个 喷水壶一个 冷柜或电冰箱一台 电烘箱或电吹风一台 40W 老式电抗型镇流器启辉器日光灯一套 GSM手机(NOKIA,或SONY ERICSON)一台 无线对讲机一台
工地试验室检查中常见问题
工地试验室检查中常见问题 1、工地试验室是由母体试验室授权的,工地试验室主任是由母体试验室任命的。 2、作为母体的试验室,有没有对工地试验室进行监管检查,检查的记录如何。 3、试验室的仪器设备与投标书是否相符,能否达到工程检测的要求。 4、工地试验室不能检测的试验,外委单位做,有没有相关单位的资质、合同。 5、台帐和试验记录要一致。 6、一个试验人员,同一天不可能做很多事,不能到处签字。 7、同一次的几个试验数理雷同太厉害。 8、报验资料要有原件。至少是复印件加盖公公章。 9、灌砂试验的标准砂的标定时间不能长,最好每周一次,或者更短些时间。 10、EDTA滴定试验现场实际测定石灰剂量相同的但EDTA的消耗量不相同。石灰剂量的工作曲线不能是一直到工程结束,就一条工作曲线。 11、灌砂试验中的铝盒编号同一天不能有相同编号。一个路基段面的含水量测定40、50个点全在最佳含水量附近,石灰剂量也在设计值附近,而实际上不太可能。 12、钢筋报检的吨位一定要报验资料与后面附的质保书的吨位相符。 13、石子压碎值试验的标定数量一般在2700g左右。 14、仪器的标定证书拿回来,要确认,并要注明有无修正因子,如有是多少。 15、自标的仪器,自标的人员要到地级市以上的计量部门办个校验员证。 16、钢筋焊接的搭接长度按实测量。 17、冷弯后钢材要留样。
18、坍落度试验注意是两个平均,保留位精确到5mm,实测是精确到1mm。 19、水泥负压筛的标定要定期标定。 20、水泥胶砂试件养护的小盒子内要放垫子。 21、养护室内的试块数量一定要与台帐相符。 22、养护室的温湿度记录表一定要每天记录。 23、砂子的细度模数相差超过0.2,应重新取样进行试验。 24、细集料的含泥量相差超过0.5%,应重新取样进行试验。 25、无侧限试件的强度不均匀系数要小于6,而实际压出来的数据一般不易达到。 试验操作 26、灌砂试验中的试洞中要清整干净。 27、灌砂试验一天的数量要与试验室的试验能力相匹配。如铝盒、烘箱、化学溶液等。 28、现场灌砂的标定毛面时砂筒锥体的标准砂的质量一般要比标定标锥时标准砂的质量要多一点。 29、化学药品台帐的化学药品消耗台帐上的数量剩余数,要有损耗,不能一点损耗没有。化学分析室内要有废液桶。 30、各科室的烘箱要与试验能力相配套。特别是土工室、集料室。 31、试验室的温度,各个室的要求不一样,各不相同。 32、压碎值试验中一定要有捣棒。 33、回弹仪要标定,还要有记录。保护层、回弹检测要有代表必性。 34、钢筋冷弯试验的冷弯压头一定要全,例如3mm、4mm、100mm、128mm的压头。 35、砂、石子、水泥、石灰的试验频率一定要与试验能力相匹配,含试验人员和试验仪器。 36、所有的试模一定要有编号,含弹模、胶砂试模、砂浆试模、灰土试模、马氏试模等。
常见智能设备稳定性测试的质量标准
常见智能设备稳定性测试的质量标准 智能设备(如手机、手表)在整个项目中有一个最重要的测试项,那就是稳定性测试。我们都知道压力测试,但是稳定性又不完全等同于压力测试。压力测试侧重于单个模块测试次数压力,不考虑测试设备数量,而稳定性测试测试所有重要模块一起长时间的循环测试,并且测试的设备数量非常多,基本都是几百台连续5~7*24小时的压力测试。 这还是常规的软件测试过程中的稳定性测试,而产线安排的稳定性测试使用的机器更多,达到几千台的规模。在项目量产前必须有达到一定规模的稳定性测试。 经过长时间的稳定性测试,可以发现一些非常低概率的问题,减少到达用户后出现一些千奇百怪的问题,影响用户体验,严重的遭到用户退机和投诉。 任何测试都必须有质量目标(也即准入准出标准),什么阶段达到什么目标,稳定性也不例外。稳定性测试主要关注如死机、重启、冻屏、上层应用Crash、无法开机等问题,质量目标中的问题也即统计这些。下面说一说常见的稳定性质量目标。 百万分之缺陷率(PPM:parts per million)就是每一百万个产品中会出现问题的设备统计标准。计算公式为: PPM= (问题数* 100,0000 )/ 测试时长/ 测试设备数量 如使用200台设备进行5*24小时的稳定性测试,一共发现3个问题,则PPM的值为125,计算方式为3*1000000/120/200。 这个时候我们在不同的测试阶段可以制定不同的PPM作为不同阶段的准入准出标准。 该项标准也经常用于产品生产过程中的不良率统计,例如汽车、零部件等。
千小时故障率,就是将规定好的测试时长中出现的问题转化为千小时出现的故障率,主要的难点在于怎么统计测试时长,同时需要规定统计的问题类型。例如可以将常规功能测试、压力测试、Beta用户试用等测试向所有时间、所发现的问题数进行统计。 例如在测试第一个阶段,所有测试市场有20000小时,统计的周期是1个月,出现了问题70个问题(统计范围内的问题,这个需要前期就确定好),则转化为千小时故障率值为3.5(70/20000,然后将分母转化为1000即可,即3.5/1000,最终千小时故障率的值就是3.5)。 同PPM的值一样,不同的阶段设定不同的值即可,这种方式主要用户最后的量产质量目标,因为在接近量产时问题数比较少。 一般我们的智能设备厂商都进行了埋点信息的收集,简单的理解就是你点击了哪个按钮,经常打开什么应用,出现了什么问题,后台都会上报到服务器中,然后厂家会进行大数据分析和解决。你们看到的问题现象只是做了界面处理而已。 该种方式也经常运用于汽车、飞机和各种产品运行时长的统计,值越小说明稳定性越好。 另一种简单的统计方式就是平均故障间隔时间(MTBF,Mean Time Between Failure)的统计方式了,类似于PPM的统计方式,就是使用总测试时长/问题数,然后得到一个值,这个值一般比较大,该种方式统计的方式适用于测试设备和测试时间比较少的情况。 MTBF值= 总测试时长/ 问题数 例如投入了50台机器,测试了24小时,一共是1200小时,如果MTBF的目标是1200的时候则只能出现1个问题,出现了2个问题则不合格。
工地试验室常见不规范现象情况汇总
工地试验室常见不规范现象
以下收录了目前部分工地试验室检查常见的一些问题。 一、环境: 1、养护室温湿度记录室内温湿度与控制器温湿度对比记录没有;试件间距偏小。 2、有温湿度要求的胶材室、混凝土养护室、水泥标准养护箱记录不准确,水泥室温湿度记录不及时,未体现样品状态调节过程。 3、有的养护室未用循环水喷淋。 4、操作室无禁示标识。 5、化学室环境条件达不到要求,无通风换气装置。 二、仪器设备: 1、仪器检定计划漏项。新仪器、小仪器不检定、不校准;新进仪器不及时检定;回弹仪率定用钢砧有的不送检;有的未对混凝土弹性模量、抗压、抗渗试模进行校验。 2、仪器不配套,有主机少配件,有回弹仪、少钢砧、电热干燥箱上部温度计等等。云母试验钢针不是专用的,无1L砂子堆积密度试验用量筒,无K30试验用水平尺。 3、试验仪器状态标识贴的不全(合格、准用、停用),
尤其是器具: 百分表、压力表、钢砧、直尺、游标卡尺、含气量测定仪少标识。 4、精密仪器防护不到位,1%及以上精密天平、精密分析仪器无防尘、防潮措施(精密天平不放硅胶、无罩布)。 5、试验仪器自校器具不全,记录不写仪器校验编号,不注明校验依据。【塞尺精度为0.02mm,试模校准数据记录记到0.01mm】。 6、检定校准证书确认依据不准确,不结合试验规程对仪器性能要求进行确认。仪器校准周期错误,砼试模检定周期应为6个月,写为1年,K30检定周期,应为一年,写为24个月。仪器确认记录未归入仪器档案。 测力环无线性公式,含气量测定仪无体积标定曲线。 7、胶砂振实台、水泥胶砂流动度试验台尺寸未按规程要求制作。 8、仪器运转记录中运行时间记录不规范,只记到了日,没准确到时分(h,min)。 9、现场设备台账与记录不完善,现场设备出入库记录未逐个建立,2台K30记录在一起。 10、碱含量试验(火焰光度计法)室内光线明暗程度达不
第三章 系统的时间响应分析
第三章 系统的时间响应 3-1 什么是时间响应? 答:时间响应是指系统的 响应(输出)在时域上的表现形式或系统的动力学方程在一定初始条件下的解。 3.2 时间响应由哪两部分组成?各部分的定义是什么? 答:按分类的原则不同,时间响应有初始状态为零时,由系统的输入引起的响应;零输入响应,即系统的 输入为零时,由初始状态引起的响应。 按响应的性质分为强迫响应和自由响应。 对于稳定的系统,其时间响应又可分为瞬态响应和稳态响应。 3.3时间响应的瞬态响应反映哪方面的性能?而稳态响应反映哪方面的性能? 答:瞬态响应反映了系统的稳定性和响应的快速性两方面的性能;稳态响应反映了系统响应的准确性。 3.4 设系统的单位脉冲响应函数如下,试求这些系统的传递函数. 1.25(1)()0.0125;t w t e -= (2)()510s i n (44 w t t t =++); );t -3(3)w(t)=0.1(1-e (4)()0.01w t t = 解:(1) 11()()()()()00 w t x t L X s L G s X s i --????===???? ()1X s i = (),()()G s G s L w t =???????? -1w(t)=L 所以,0.01251.251)()()0.0125 1.25 t G s L w t L e s -??===???? ??+??( (2)()()G s L w t =???? 5510sin(4)sin 4cos422L t t t s s = ++=++???????? 5452()2222161616 s s s s s s = ++=++++
GMP产品稳定性考察管理规程
产品稳定性考察管理规程 1. 目的 建立一个产品稳定性考察管理规程,使能在产品有效期内监控已上市药品的质量,以发现药品与生产相关的稳定性问题,并确定药品能够在标示的贮存条件下,符合质量的各项要求。 2. 范围 已获准上市的市售包装药品。 3. 责任 QC部负责执行本规程。 4. 内容 4.1由够资格的专业技术人员制定稳定性计划,报主管部门负责人批准后执行。 4.2由授权人担任稳定性试验的全面工作。 4.3稳定性分类 4.3.1 影响因素试验 4.3.2 加速试验 4.3.3 长期试验 考察产品分为以下四类: A类:新产品头3批产品做长期稳定性考察;直至转正后。 B类:当影响产品质量的主要因素,如工艺改进、设备变更、改变内包装形式、主 要原辅料供应商变更的头三批产品做长期稳定性考察; C类:生产过程中遇到特殊情况,可能会影响质量稳定性的产品,如返工、或有回 收操作的批次,该批产品做长期稳定性考察。 D类:除上述A、B C类之外的产品,长期生产的产品每年选择至少1批产品 做长期稳定性考察,除当年未生产 4.4考察原则 4.4.1正常批量生产的最初一批产品应当列入持续稳定性考察计划,以进一步确认有效期。 4.4.2正常情况下,每一品种的每一规格、每一内包装形式的药品每年考察一个批次。4.4.3 特殊情况下,重大变更或生产和包装有重大偏差的药品以及重新加工、返工或回收的批次应列入稳定性考察,并增加考察批次,一般应不少于三批。 4.6制定稳定性计划 4.6.1质量保证部QA A员于每年年初依据本年度的生产计划制订年度稳定性试验计划,确定 本年度将进行的和可能要增加进入稳定性试验程序的品种,并于每年年终对本年度公 司的稳定性试验工作做出年度总结报告。 4.6.2 对不符合质量标准的结果或重要的异常趋势进行调查。任何已确认的不符合质量标准的
工地试验室检测操作质量通病防治措施
工地试验室检测操作质量通病防治措施 第一部分:表观特征 (一)水泥检测 1、抗压试验时水泥试件中心与夹具压板受压中心允许偏差超标。 2、盛水容器未润湿,搅拌锅擦拭过干或过湿,加水量偏离规范要求。 3、试模涂油过多或过少,过多引起试模表面产生气泡,过少则产生粘模。 4、试模变形或安装不密,易漏浆。
5、未按规定每月对叶片与锅壁的最近间隙进行测量监控,导致胶砂试样搅拌不均匀,使组内检测结果波动大。 6、强度试件成型时,刮平手法不规范,对已成型试件扰动大,易引起试件出现裂纹或其他缺陷。 7、胶砂强度试件制作时加料不匀,导致试件成型不均,组内检测结果波动大。
8、凝结时间测试时装料过多或过少,过多导致试样拍打不密,凝结时间偏长。 9、维卡仪的试杆滑动不够顺滑,导致水泥标准稠度用水量偏大,凝结时间偏短。10、水泥密度测试用无水煤油未进行无水处理,导致水泥密度偏差大;水泥密度未进行平行试验。 (二)砂石料检测 1、表观密度检测时,没有对加水静置最后2小时起直至试验结束的温差进行测量控制,影响检测结果。 2、筛分试验时,筛出量未达到小于试样总量的0.1%时即停止筛分。 3、筛分、表观密度、堆积密度、含泥量检测等没有按规定进行两个样两次的平行试验。 4、对试样烘干至“恒重”,没有按规范操作,没有达到“恒重”状态。 5、砂、石容重测定结果未根据容量筒校准结果进行修正。 6、含泥量和泥块含量检测浸泡时间不足或超时,结果受影响;倾倒浑浊液时过快,造成部分小于0.075mm砂粒流失,导致含泥量结果偏大。 (三)砼抗压试验
1、检测前未进行试块外观尺寸、垂直度、平整度的检查,剔除偏差超标试块; 试块从养护室取出后未及时试验,检测前表面未能按规定保持潮湿。
003关于化学药稳定性申报要求的常见问题答疑
发布日期20030804 栏目化药药物评价>>化药质量控制 标题关于化学药稳定性申报要求的常见问题答疑 作者审评三部 部门 正文内容关于化学药稳定性申报要求的常见问题答疑 新的注册管理办法实施以后,进口注册和新药申报中出现了一些新问题,我们汇总了化学药稳定性申报资料中一些常见的咨询问题,解答如下,供申报单位参考。 1.创新药的用药剂量要在临床1期或2期后才能确定,那么我们申请临床批件时,稳定性资料可以只报1个剂量制剂的资料吗? 答:为了保证临床用药的质量符合要求,需提供所有申报规格的稳定性研究资料。对 于多个规格的产品,可参考ICH Q1D的要求,采用括号法进行研究。 2.申请新药临床和生产时报送的稳定性研究资料中,3批中试规模样品的长期留样试验资料,是否要求这3批样品是连续生产的? 答:稳定性研究的三批样品应具有代表性,以预测产品的有效期,但不需要连续生产 的样品。 3.申报临床试验的稳定性资料至少提供多长时间的数据? 答:一般要求提供加速试验3个月以上,长期留样6个月以上的试验资料,应能基本 保证临床研究期间样品的稳定。 4.国外厂家提供的进口产品的稳定性数据一般只有实验数据和结论,中心在审评进口 产品的稳定性实验数据时,有时会要求厂家提供典型图谱,有时则不需要,请问对典 型图谱的要求掌握一个什么样的原则? 答:对于进口注册申请药品的稳定性研究资料需至少提供有代表性的典型图谱,包括 起始点、终点、及质量有明显变化的中间点,加速试验和长期留样试验要求起码提供 3批样品的图谱,影响因素试验要求提供1批样品的图谱。图谱中要有中文标示。 5.化药14号稳定性研究要求做与包材一起的稳定性考察,与原来的仿市售包装考察稳定性有何区别? 答:基本没有区别。 6.申报生产的资料中稳定性试验资料,能否仅附申请临床时的稳定性资料?因为一般 药厂药品临床实验做完即申报生产,从生产车间生产的样品稳定性试验数据不足,临 床前的样品实际已为中试规模的产品了,这时的稳定性数据一般可作够2~3年,可暂定有效期。且批生产时的质量标准为试行标准,待2年的试行期结束,试生产转正时,从车间里生产的大批量的样品稳定性数据也作够2年,该数据最有效的制定药品的有 效期。 答:1)如果临床前的三批样品已达到中试规模,申报生产时可继续提供这三批样品的 稳定性研究资料,以确定有效期。2)如果临床前样品为小试样品,申报生产时需提供
- 指导原则解读系列专题_二十一_化学药物稳定性研究的试验方法和设计_宁黎丽
- 中药稳定性指导原则
- 从新的角度进行电子产品稳定性测试
- 常见智能设备稳定性测试的质量标准
- 生化试剂性能评估及稳定性测试流程和方法-20091026
- 留样、稳定性试验与持续稳定性考察的关系
- 触摸按键稳定性的测试方法
- 003关于化学药稳定性申报要求的常见问题答疑
- 稳定性试验常见问题
- 药物制剂的稳定性测试及影响因素
- 稳定性试验常见问题
- 触摸芯片稳定性的测试方法
- 药品稳定性研究—周立春(上海)2015.10.
- 中药稳定性指导原则资料
- 生物制品稳定性研究相关问题的考虑
- 稳定性试验常见问题
- 保健食品卫生学稳定性试验和质量标准要点简介
- 结构与稳定性
- 稳定性可靠性测试
- 稳定性试验培训(参考ICH)
