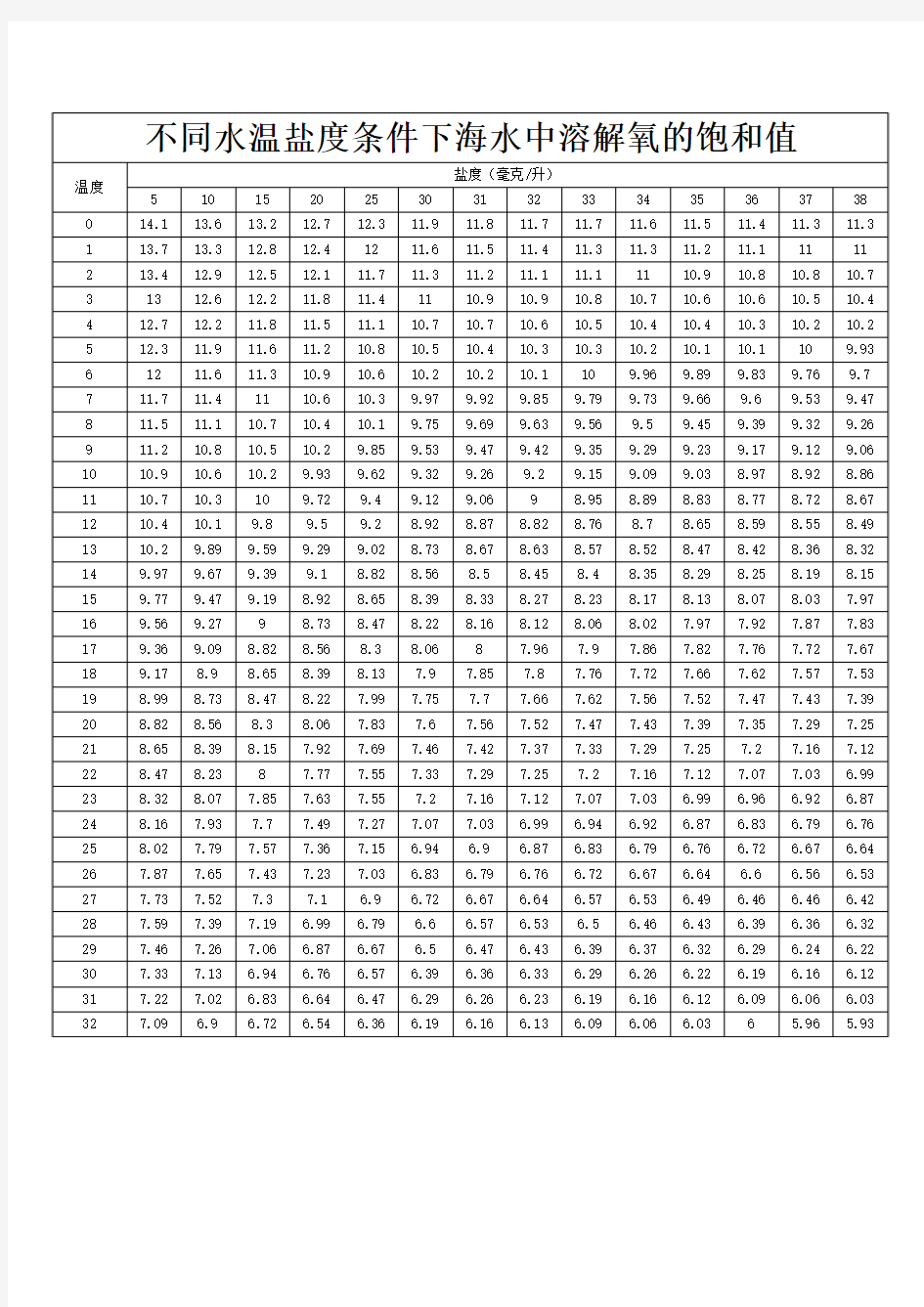
不同水温盐度条件下海水中溶解氧的饱和值
最新水质分析中的常用指标
1 水质分析中的常用指标 2 1、有机化学指标 3 4 溶解氧 (Dissolved oxygen简称DO) 5 指溶解在水中的分子态氧(O2),简称DO)。水中溶解氧的含量与大气压、水6 温及含盐量等因素有关。大气压力下降、水温升高、含盐量增加,都会导致溶7 解氧含量减低。 8 一般清洁的河流,DO可接近其温度的饱和值,当有大量藻类繁殖时,溶解9 氧可能过饱和;当水体受到有机物质、无机还原物质污染时,会使溶解氧含量降10 低,甚至趋于零,此时厌氧细菌繁殖活跃,水质恶化。水中溶解氧低于3~4mg/L 11 时,许多鱼类呼吸困难,窒息死亡。溶解氧是表示水污染状态的重要指标之一。 12 化学需氧量(Chemical oxygen demand 简称COD) 13 化学需氧量是指以重铬酸钾(K2Cr2O7)或高锰酸钾(KMnO4)为氧化剂,氧化14 水中的还原性物质所消耗氧化剂的量,结果折算成氧的量(以mg/L计)。水中15 还原性物质包括有机物和亚xiao 酸盐、硫化物、亚铁盐等无机物。化学需氧量16 反应了水中受还原性物质污染的程度。基于水体被有机物污染是很普遍的现象,17 该指标也作为有机物相对含量的综合指标之一,在与水质有关的各种法令中均18 采用它作为控制项目。 19 注:我国颁布的环境地面水质标准(1988年)中,规定了以酸性重铬酸钾法20 测得的COD值称为化学需氧量,(简称CODCr),而将高锰酸钾法测得的COD值21 称为高锰酸盐指数,(简称CODMn)。 22 高锰酸盐指数,耗氧量(CODMn)
23 高锰酸盐指数,又称为耗氧量,是反映水体中有机及无机可氧化物质污染24 的常用指标。定义为:在一定条件下,用高锰酸钾氧化水样中的某些有机物及25 无机还原性物质,由消耗的高锰酸钾量计算相当的氧量。它反映了水中悬浮和26 溶解的可被高锰酸钾氧化的那一部分无机物和有机物的量。 27 高锰酸盐指数在以往的水质监测分析中,亦有被称为化学需氧量的高锰28 酸钾法。但是,由于这种方法在规定条件下,水中有机物只能部分被氧化,并29 不是理论上的需氧量,也不是反映水体中总有机物含量的尺度,因此,用高锰酸30 盐指数这一术语作为水质的一项指标,以有别于重铬酸钾法的化学需氧量,更31 符合于客观实际。 32 CODcr一般为CODMn的2到5倍,我们在实际工作中得到的数据基本上都在33 这个范围 34 生化需氧量(Biochemical oxygen demand简称BOD) 35 生化需氧量是指在有溶解氧的条件下,好氧微生物在分解水中有机物的生36 物化学氧化过程中所消耗的溶解氧量。同时亦包括如硫化物、亚铁等还原性无37 机物质氧化所消耗的氧量,但这部分通常占很小比例。 38 有机物在微生物作用下好氧分解大体上分为两个阶段。 39 1)含碳物质氧化阶段,主要是含碳有机物氧化为二氧化碳和水; 40 2)硝化阶段,主要是含氮有机化合物在硝化菌的作用下分解为亚xiao 酸盐41 和xiao 酸盐。约在5-7日后才显著进行。故目前常用的20℃五天培养法(BOD5 42 法)测定BOD值一般不包括硝化阶段。 43 BOD是反映水体被有机物污染程度的综合指标,也是研究废水的可生化降解44 性和生化处理效果,以及生化处理废水工艺设计和动力学研究中的重要参数。
实验二 水中溶解氧的测定教案汇总
1 实验二 水中溶解氧的测定 【实验目的】 1、学习溶解氧水样的采取方法。 2、掌握用间接碘量法测定水样中溶解氧的方法原理及基本操作。 【实验原理】 溶解于水中的氧称为溶解氧,水中的溶解氧来自空气中的氧及水生植物释放出来的氧,水越深,水温越高,水中含盐量越多,还原性物质越多,溶解氧越少。溶解氧有利于水生生物的生存。如许多鱼类在水中含溶解氧低于3-4mg/L 时就不能生存,但对于金属设备有腐蚀作用,如锅炉水中溶解氧含量应低于0.05-0.1mg/L .所以,在工业供水分析中对溶解氧的测定是很重要的。同时,溶解氧的测定对水体自净作用的研究有极其重要的作用,它可以帮助了解水体在不同的地点进行自净的速度。 溶解氧的测定方法有膜电极法、比色法和碘量法。对溶解氧含量较高的水样,常采用碘量法测定,下面是碘量法的测定原理。 水样中加入硫酸锰和氢氧化钠溶液,生成氢氧化锰沉淀,这一沉淀中的锰,是与水中的溶解氧定量反应的。 Mn 2++ 2OH -=Mn(OH)2↓(白色) (1) 当有溶解氧时, Mn(OH)2立即被氧化: 2Mn(OH)2+O 2=2MnO(OH)2↓(棕色) (2) 溶液酸化后,四价锰将碘离子氧化成游离碘:MnO(OH)2+2I -+4H +=Mn 2++I 2+3H 2O (3) 析出的碘用Na 2S 2O 3滴定: I 2+2 Na 2S 2O 3 == 2I -+S 4O 62- (4) 由反应方程式(1)、(2)、(3)、(4)可知: n 2O :n -23 2 O S =1:4 。由Na 2S 2O 3的浓度及 消耗的体积可计算水中溶解氧的含量。 溶解氧ρO 2(mg/L )= 100000 .324 11????V C V , 式中 V 1 –-滴定消耗Na 2S 2O 3标准溶液的体积(mL ); V —水样体积 (mL ); C ——Na 2S 2O 3标准溶液的浓度(mol.L -1). 如果水样中有大量有机物,或其它还原性物质时,会使结果偏低,而当水样中含有氧化性物质时可使结果偏高,此时应作校正.采用双瓶法可以消除氧化物的干扰.所谓的双瓶法,即取两个溶解氧瓶,一瓶按碘量法测定.另一瓶先加H 2SO 4,再加碱性碘化钾和硫酸锰,生成的碘用Na 2S 2O 3滴定,记录消耗Na 2S 2O 3标准液的体积V 2 。V 2即为水中氧化性物质消耗的Na 2S 2O 3标液体积,由一瓶中消耗的Na 2S 2O 3标液体积V 1中扣除.用双瓶法的结果
水中溶解氧的测定实验报告.
溶解氧的测定实验报告 易倩 一、实验目的 1.理解碘量法测定水中溶解氧的原理: 2.学会溶解氧采样瓶的使用方法: 3.掌握碘量法测定水中溶解氧的操作技术要点。 二、实验原理 溶于水中的氧称为溶解氧,当水受到还原性物质污染时,溶解氧即下降,而有藻类繁殖时,溶解氧呈过饱和,因此,水中溶解氧的变化情况在一定程度上反映了水体受污染的程度。 碘量法测定溶解氧的原理:在水中加入硫酸锰及碱性碘化钾溶液,生成氢氧化锰沉淀。此时氢氧化锰性质极不稳定,迅速与水中溶解氧化合生成锰酸锰: MnSO4+2aOH=Mn(OH)2↓(白色)++Na2SO4 2Mn(OH)2+O2=2MnO(OH)2(棕色) H2MnO3十Mn(OH)2=MnMnO3↓(棕色沉淀)+2H2O 加入浓硫酸使棕色沉淀(MnMn02)与溶液中所加入的碘化钾发生反应,而析出碘,溶解氧越多,析出的碘也越多,溶液的颜色也就越深2KI+H2SO4=2HI+K2SO4 MnMnO3+2H2SO4+2HI=2MnSO4+I2+3H2O I2+2Na2S2O3=2NaI+Na2S4O6 用移液管取一定量的反应完毕的水样,以淀粉做指示剂,用标准溶液滴定,计算出水样中溶解氧的含量。 三、仪器 1.250ml—300ml溶解氧瓶 2.50ml酸式滴定管。 3.250ml锥形瓶 4.移液管 5.250ml碘量瓶 6.洗耳球 四、试剂 l、硫酸锰溶液。溶解480g分析纯硫酸锰(MnS04· H20)溶于蒸馏水中,过滤后稀释成1000ml.此溶液加至酸化过的碘化钾溶液中,遇淀粉不得产生蓝色。 2、碱性碘化钾溶液。取500g氢氧化钠溶解于300—400ml蒸馏水中(如氢
实验二_水中溶解氧的测定
水中溶解氧的测定--碘量法 一、实验原理 水中溶解氧的测定,一般用碘量法。在水中加入硫酸锰及碱性碘化钾溶液,生成氢氧化锰沉淀。此时氢氧化锰性质极不稳定,迅速与水中溶解氧化合生成锰酸锰: 2MnSO 4+4NaOH=2Mn(OH) 2 ↓+2Na 2 SO 4 2Mn(OH) 2+O 2 =2H 2 MnO 3 H 2MnO 3 十Mn(OH) 2 =MnMnO 3 ↓+2H 2 O (棕色沉淀) 加入浓硫酸使棕色沉淀(MnMn0 2 )与溶液中所加入的碘化钾发生反应,而析出碘,溶解氧越多,析出的碘也越多,溶液的颜色也就越深。 2KI+H 2SO 4 =2HI+K 2 SO 4 MnMnO 3+2H 2 SO 4 +2HI=2MnSO 4 +I 2 +3H 2 O I 2+2Na 2 S 2 O 3 =2NaI+Na 2 S 4 O 6 用移液管取一定量的反应完毕的水样,以淀粉做指示剂,用标准溶液滴定,计算出水样中溶解氧的含量。 二、实验用品: 1、仪器:溶解氧瓶(250ml)锥形瓶(250ml)酸式滴定管(25ml) 移液管(50m1)吸球 2、药品:硫酸锰溶液碱性碘化钾溶液浓硫酸淀粉溶液(1%) 硫代硫酸钠溶液(0.025mol/L) 三、实验方法 (一)水样的采集与固定 1、用溶解氧瓶取水面下20—50cm的河水、池塘水、湖水或海水,使水样充满250ml的磨口瓶中,用尖嘴塞慢慢盖上,不留气泡。 2、在河岸边取下瓶盖,用移液管吸取硫酸锰溶液1ml插入瓶内液面下,缓慢放出溶液于溶解氧瓶中。 3、取另一只移液管,按上述操作往水样中加入2ml碱性碘化钾溶液,盖紧瓶
塞,将瓶颠倒振摇使之充分摇匀。此时,水样中的氧被固定生成锰酸锰(MnMnO 3 ) 棕色沉淀。将固定了溶解氧的水样带回实验室备用。 (二)酸化 往水样中加入2ml浓硫酸,盖上瓶塞,摇匀,直至沉淀物完全溶解为止(若 没全溶解还可再加少量的浓酸)。此时,溶液中有I 2 产生,将瓶在阴暗处放5 分钟,使I 2 全部析出来。 (三)用标准Na 2S 2 O 3 溶液滴定 1、用50ml移液管从瓶中取水样于锥形瓶中。 2、用标准Na 2SN 2 O 3 溶液滴定至浅黄色。 3、向锥形瓶中加入淀粉溶液2ml(此时确芤合岳渡?。 4、继续用Na 2S 2 O 3 标准溶液滴定至蓝色变成无色为止。 5、记下消耗Na 2S 2 O 3 标准溶液的体积。 6、按上述方法平行测定三次。 (四)计算 溶解氧(mg/L)=C Na2S2O3×V Na2S2O3×32/4×1000/V水 O 2―→2Mn(OH) 2 ―→MnMnO 3 ―→2I 2 ―→4Na 2 S 2 O 3 1mol的O 2和4mol的Na 2 S 2 O 3 相当 用硫代硫酸钠的摩尔数乘氧的摩尔数除以4可得到氧的质量(mg),再乘1000可得每升水样所含氧的毫克数: CNa 2S 2 O 3 ——硫代硫酸钠摩尔浓度(0.0250mol/L) VNa 2S 2 O 3 ——硫代硫酸钠体积(m1) V水——水样的体积(ml) (具体公式同学们也可见教材123页) (五)参考资料 溶解于水中的氧称为溶解氧,以每升水中含氧(O 2 )的毫克数表示。水中溶解氧的含量与大气压力、空气中氧的分压及水的温度有密切的关系。在 1.013×105Pa的大气压力下,空气中含氧气20.9%时,氧在不同温度的淡水中的溶解度也不同。 如果大气压力改变,可按下式计算溶解氧的含量:
海水溶解氧的调查
海洋调查方法 ——海水溶解氧的调查 姓名:______________________ 学号:_______________________ 学院:_______________________ 专业:_______________________
海水溶解氧的调查 摘要:溶解在海水中的氧是海洋生命活动不可缺少的物质。它的含量在海洋中的分布,既受化学过程和生物过程的影响,还受物理过程的影响。这方面的研究,从19世纪就已经开始。在20世纪初期建立了适合现场分析的温克勒方法以后,进展比较快,至40年代前后,已取得了关于大洋中氧含量分布的比较完整的资料。 关键字:海水溶解氧碘量法电流测定法 一、调查目的 1.通过对水中溶解氧含量的测定了解水体受有机物污染情况。 2.学习滴定分析方法进行水质监测。 3.学习掌握移液、滴定等基本操作技能。 二、调查对象 海洋溶解氧:Dissolved Oxygen)是指溶解于水中分子状态的氧,即水中的O2,用DO表示。溶解氧是水生生物生存不可缺少的条件。溶解氧的一个来源是水中溶解氧未饱和时,大气中的氧气向水体渗入;另一个来源是水中植物通过光合作用释放出的氧。 三、调查原理 水中溶解氧的测定,一般用碘量法。在水中加入硫酸锰及碱性碘化钾溶液,生成氢氧化锰沉淀。此时氢氧化锰性质极不稳定,迅速与水中溶解氧化合生成锰酸锰: 2MnSO4+4NaOH=2Mn(OH)2↓+2Na2SO4 2Mn(OH)2+O2=2H2MnO3 H2MnO3十Mn(OH)2=MnMnO3↓+2H2O (棕色沉淀) 加入浓硫酸使棕色沉淀(MnMn02)与溶液中所加入的碘化钾发生反应,而析出碘,溶解氧越多,析出的碘也越多,溶液的颜色也就越深。 2KI+H2SO4=2HI+K2SO4 MnMnO3+2H2SO4+2HI=2MnSO4+I2+3H2O I2+2Na2S2O3=2NaI+Na2S4O6 用移液管取一定量的反应完毕的水样,以淀粉做指示剂,用标准溶液滴定,计算出水样中溶解氧的含量。 四、调查药品 1、仪器:溶解氧瓶(250ml) 锥形瓶(250ml) 酸式滴定管(25ml) 移液管(50m1) 吸球 2、药品:硫酸锰溶液碱性碘化钾溶液浓硫酸淀粉溶液(1%) 硫代硫酸钠溶液(0.025mol/L) 五、调查方法 1、碘量法 (一)水样的采集与固定 1、用溶解氧瓶取水面下20—50cm海水,使水样充满250ml的磨口瓶中,用尖嘴塞慢慢盖上,不留气泡。 2、在海边取下瓶盖,用移液管吸取硫酸锰溶液1ml插入瓶内液面下,缓慢放出溶液于溶解氧瓶中。 3、取另一只移液管,按上述操作往水样中加入2ml碱性碘化钾溶液,盖紧瓶
水中溶解氧的测定实验报告
溶解氧的测定实验报告 xx 一、实验目的 1.理解碘量法测定水中溶解氧的原理: 2.学会溶解氧采样瓶的使用方法: 3.掌握碘量法测定水中溶解氧的操作技术要点。 二、实验原理 溶于水中的氧称为溶解氧,当水受到还原性物质污染时,溶解氧即下降,而有藻类繁殖时,溶解氧呈过饱和,因此,水中溶解氧的变化情况在一定程度上反映了水体受污染的程度。 碘量法测定溶解氧的原理: 在水中加入硫酸锰及碱性碘化钾溶液,生成氢氧化锰沉淀。此时氢氧化锰性质极不稳定,迅速与水中溶解氧化合生成锰酸锰: MnSO 4+2aOH=Mn(OH) 2↓(白色)++Na 2SO42Mn(OH) 2+O 2=2MnO(OH) 2(棕色) H 2MnO
3十Mn(OH) 2=MnO 3↓(棕色沉淀)+2H 2O 加入浓硫酸使棕色沉淀(Mn0 2)与溶液中所加入的碘化钾发生反应,而析出碘,溶解氧越多,析出的碘也越多,溶液的颜色也就越深 2KI+H 2SO 4=2HI+K 2SO4 MnO 3+2H 2SO 4+2HI=2MnSO 4+I 2+3H 2O I2+2Na 2S 2O 3=2NaI+Na 2S
4O6用移液管取一定量的反应完毕的水样,以淀粉做指示剂,用标准溶液滴定,计算出水样中溶解氧的含量。 三、仪器 1.250ml—300ml溶解氧瓶 2.50ml酸式滴定管。 3.250ml锥形瓶 4.移液管 5.250ml碘量瓶 6.洗耳球 四、试剂 l、硫酸锰溶液。溶解480g分析纯硫酸锰(MnS0 4· H 20)溶于蒸馏水中,过滤后稀释成1000ml.此溶液加至酸化过的碘化钾溶液中,遇淀粉不得产生蓝色。 2、碱性碘化钾溶液。取500g氢氧化钠溶解于300—400ml蒸馏水中(如氢氧化钠溶液表面吸收二氧化碳生成了碳酸钠,此时如有沉淀生成,可过滤除去)。 另取得气150g碘化钾溶解于200ml蒸馏水中,待氢氧化钠冷却后,将两溶液合并,混匀,用水稀释至1000ml。如有沉淀,则放置过夜后,倾出上层清液,贮于棕色瓶中,用橡皮塞塞紧,闭光保存。此溶液酸化后,与淀粉应不呈蓝色。 3.1%淀粉溶液:
水中溶氧检测摘要本文综述了水体溶解氧的各种检测方法及原理,诸如
水中溶氧检测 摘要:本文综述了水体溶解氧的各种检测方法及原理,诸如碘量法、电流测定法(Clark 溶氧电极)、电导测定法、荧光淬灭法等,比较各种方法的优缺点,对荧光淬灭法的应用前景进行了初步探讨。 关键词:溶解氧、荧光淬灭、环境监测 引言随着当今世界工业、农业的迅猛发展,大量的工业废水、农田排水向江河湖海排放,同时,我国城市生活污水大约有80%未经处理直接排放,小城镇及广大农村生活污水大多处于无序排放状态[1],使得许多地方的水质日益恶化,水污染和水资源短缺日益严重,所以迫切需要对污水进行及时监控和有效处理。其中,水中溶解氧含量是进行水质监测时的一项重要指标。 溶解氧(Dissolved Oxygen)是指溶解于水中分子状态的氧,即水中的O2,用DO表示。溶解氧是水生生物生存不可缺少的条件。溶解氧的一个来源是水中溶解氧未饱和时,大气中的氧气向水体渗入;另一个来源是水中植物通过光合作用释放出的氧。溶解氧随着温度、气压、盐分的变化而变化,一般说来,温度越高,溶解的盐分越大,水中的溶解氧越低;气压越高,水中的溶解氧越高。溶解氧除了被通常水中硫化物、亚硝酸根、亚铁离子等还原性物质所消耗外,也被水中微生物的呼吸作用以及水中有机物质被好氧微生物的氧化分解所消耗。所以说溶解氧是水体的资本,是水体自净能力的表示。天然水中溶解氧近于饱和值(9ppm),藻类繁殖旺盛时,溶解氧含量下降。水体受有机物及还原性物质污染可使溶解氧降低,对于水产养殖业来说,水体溶解氧对水中生物如鱼类的生存有着至关重要的影响,当溶解氧低于4mg/L时,就会引起鱼类窒息死亡,对于人类来说,健康的饮用水中溶解氧含量不得小于6mg/L。当溶解氧(DO)消耗速率大于氧气向水体中溶入的速率时,溶解氧的含量可趋近于0,此时厌氧菌得以繁殖,使水体恶化,所以溶解氧大小能够反映出水体受到的污染,特别是有机物污染的程度,它是水体污染程度的重要指标,也是衡量水质的综合指标[2]。因此,水体溶解氧含量的测量,对于环境监测以及水产养殖业的发展都具有重要意义。 1.水体溶解氧的各种检测方法及原理 1.1 碘量法(GB7489-87)(Iodometric)碘量法(等效于国际标准ISO 5813-1983)是测定水中溶解氧的基准方法,使用化学检测方法,测量准确度高,是最早用于检测溶解氧的方法。其原理是在水样中加入硫酸锰和碱性碘化钾,生成氢氧化锰沉淀。此时氢氧化锰性质极不稳定,迅速与水中溶解氧化合生成锰酸锰:4MnSO4+8NaOH = 4Mn(OH)2↓+4Na2SO4 (1) 2Mn(OH)2+O2 = 2H2MnO3↓ (2) 2H2MnO3+2Mn(OH)3 = 2MnMnO3↓+4H2O (3) 加入浓硫酸使已化合的溶解氧(以MnMnO3的形式存在)与溶液中所加入的碘化钾发生反应而析出碘:4KI+2H2SO4 = 4HI+2K2SO4 (4) 2MnMnO3+4H2SO4+HI = 4MnSO4+2I2+6H2O (5) 再以淀粉作指示剂,用硫代硫酸钠滴定释放出的碘,来计算溶解氧的含量[3],化学方程式为:2Na2S2O3+I2 = Na2S4O6+4NaI (6) 设V为Na2S2O3溶液的用量(mL),M为Na2S2O3的浓度(mol/L),a为滴定时所取水样体积(mL),DO可按下式计算[2]:DO(mol/L)= (7) 在没有干扰的情况下,此方法适用于各种溶解氧浓度大于0.2mg/L和小于氧的饱和度两倍(约20mg/L)的水样。当水中可能含有亚硝酸盐、铁离子、游离氯时,可能会对测定产生干扰,此时应采用碘量法的修正法。具体作法是在加硫酸锰和碱性碘化钾溶液固定水样的时候,加入NaN3溶液,或配成碱性碘化钾-叠氮化钠溶液加于水样中,Fe3+较高时,
请问哪几种方法可以提高水中溶解氧的含量.doc
请问哪几种方法可以提高水中溶解氧的含量 增加水面上的大气压力。增加水面上的气体的氧分压直至是纯氧。降低水的温度。降低水中的 生物耗氧量和化学耗氧量。 2\氧气是一种比较难溶以水的气体,可以用纯氧直接加到水里,但要用扩散管,所谓扩散管是一些能把气体分散分细的出气装置,象水族箱用的沙气头、沙气条等,同时要把水搅拌均匀受 溶氧气 1.增加曝气量或曝气设备。 2.增加曝气面积(或者曝气头的面积)。 3.通过改变曝气头来改变的气泡直径(变小),提高气体与水的接触面积。 4.增加池体高度,延长气体与水接触时间。 5.将空气曝气改成纯氧曝气。 6.降低水温,提高氧的溶解量。还有什么想到了再补充吧。 提高转速或通纯氧 溶氧量:水中氧气的溶解量。 发酵生产中,一般以通气比来表示通气量,通常以每分钟内通过单位体积培养液的空气体积比来表示。 溶氧量可以通过通气量来控制。 发酵转速确定不能只根据DO,而且根据实际情况,比如空气的供应量和菌种的耐受及搅拌叶情况。如果空气供应是限制因素,那么只能将DO设计低一些,这时即便是提高搅拌转速也不能有效提高DO,反而增加了菌体的损伤,降低产率。如果手中有大量的数据,可以拟合出搅拌,DO和空气流量的关系。这时就可以根据模型进行确定。如果拟合不出来模型就用统计的方法,估计出一个经验的控制方法。 C、N源及C/N比对微生物 碳氮比(C/N) 碳氮比是指微生物体或其它有机物中所含碳素和氮素重量的比值。 微生物活动和繁殖所要求的适宜C/N比一般为25:1。因为微生物每合成1份有机物质需要利用5份碳素和1份氮素,同时还需要利用20份碳素作为能量来源。 当堆肥材料的C/N大于25:1时,微生物不能大量繁殖,而且从有机物中释放同的氮素全部为微生物自身生长所利用。当堆肥材料的C/N小于25:1时,微生物繁殖快,堆肥材料分解也快,
自来水的溶解氧测定
自来水的溶解氧测定 溶于水中的氧称为溶解氧,用DO表示,单位为mg O2/ L。天然水中溶解氧的饱和含量与空气中氧的分压、大气压力和水温有密切关系,与水体中的含盐量也有一定的关系。大气压力减小、温度升高,水中含盐量增加,都会使水中溶解氧减小,其中温度影响比较显著。清洁地面水溶解氧一般接近饱和状态。水体被有机物质污染后,溶解氧就会不断降低,当水中的溶解氧就得不到及时补充,溶解氧将逐渐降低,甚至趋近于零,使厌氧菌繁殖,有机物质腐败,水质发臭。通过对溶解氧的测定,对研究水源自净作用的、水污染控制和废水处理工艺控制中有着重要的意义。溶解氧DO是水质综合指标之一,作为水源DO≥5mg O2 / L。 一、实验目的 1. 通过该实验了解检测水中溶解氧的测定方法,对自来水水的质量进行评价。 2. 了解分析化学实验的要求 3. 了解滴定分析基本技能 二、原理 于水样中加入硫酸锰MnSO4和NaOH,水中的O2将Mn2+氧化成水合氧化锰[MnO(OH)2]棕色沉淀,将水中全部溶解氧固定起来;在酸性条件下,MnO(OH)2与KI作用,释放出等化学计量的I2,然后,以淀粉为指示剂,用硫代硫酸钠(Na2S2O3)标准溶液滴定至蓝色消失,指示终点的到达。根据Na2S2O3标准溶液的消耗量,计算水中DO的含量。 三、仪器和试剂 1. 50mL滴定管、250mL溶解氧瓶、250mL锥形瓶、1mL、2mL、5mL、100mL 移液管 2. 硫酸锰溶液、碱性碘化钾溶液、1%(m / v)淀粉溶液、0.01 Na2S2O3标准溶液。 四、实验步骤 1. 溶解氧的固定 沿溶解氧瓶直接注入水样,当注入水样溢流出瓶容积的1/3~1/2左右,迅速盖上瓶塞,加入1mL硫酸锰溶液(加注时,应将移液管插入溶解氧瓶液面下,切勿将移液管中的空气注入瓶中)。按上法加入2mL碱性碘化钾溶液。盖紧瓶塞,颠倒混合3次,静置。待生成的棕色沉淀降至瓶一半深度时,再次颠倒混合均匀,然后进行溶解氧的测定。 2. 溶解氧的测定 轻轻打开溶解氧瓶塞,立即用移液管加入硫酸3 – 5 mL,盖上瓶塞,颠倒混
水中溶解氧的测定解读
实验五水中溶解氧的测定 1 实验目的 溶解氧是重要的水质指标,通过本实验,掌握用碘量法测定DO的经典方法。 2 原理 在水样中加入硫酸锰和碱性碘化钾溶液,水中溶解氧能迅速将二价锰氧化成四价锰的氢氧化物沉淀。加酸溶解沉淀后,碘离子被氧化析出与溶解氧量相当的游离碘。以淀粉为指示剂,标准硫代硫酸钠溶液滴定,计算溶解氧含量。 3 仪器 (1)溶解氧瓶。 (2)250mL碘量瓶或锥形瓶。 (3)25mL酸式滴定管。 (4)lmL、2mL定量吸管。 (5)100mL移液管。 4 试剂 (1)硫酸锰溶液称取480gMnS04·4H2O或364gMnSO4·4H2O溶解于水中,稀释至1L。此溶液在酸性时,加人碘化钾后,不得析出游离碘。 (2)碱性碘化钾溶液称取500g氢氧化钠溶解于300~400mL水中,另称取150g碘化钾溶于200mL水中,待氢氧化钠溶液冷却后,将两种溶液合并,混合,用水稀释至1L。若有沉淀则放置过夜后倾出上清液,贮于塑料瓶中用黑纸包裹避光。 (3)浓硫酸。 (4)0.5%淀粉溶液称0.5g可溶性淀粉,用少量水调成糊状,再用煮沸的水冲到100mL,冷却后,加入0.1g水杨酸或0.4g二氯化锌防腐。
(5)硫代硫酸钠标准溶液 称取约25g 分析纯硫代硫酸钠(Na 2S 2O 3·5H 2O),溶于煮沸放冷的水中,稀释至1000mL ,加人0.4g 氢氧化钠或数小粒碘化汞,贮于棕色瓶内防止分解。此溶液物质的量浓度c(Na 2S 2O 3·5H 2O)约为0.1mol /L ,再用下法标定准确浓度。 碘酸钾(碘酸钠)标定法 精确称取0.1500g 干燥的分析纯碘酸钾(KIO 3)于250mL 碘量瓶中,加入100mL 水,加热溶解,加入3g 碘化钾及10mL 冰醋酸,静置5min 。用已配制的硫代硫酸钠溶液滴定,直至颜色变为淡黄色,加入1mL 淀粉溶液,继续滴定至蓝色刚好消失为止,记录消耗硫代硫酸钠量,按下式计算硫代硫酸钠溶液浓度。 ()V W V W O H O S Na c ?=?=?03567.06000 01.21452322 式中 W ——碘酸钾质量,g ; V ——消耗硫代硫酸钠溶液量,mL 。 5 步骤 (1)采样时,注意瓶内不能留有空气泡,密封,立即送回实验室。 (2)用虹吸法把水样转移到溶解瓶内,并使水样从瓶口溢流出数秒钟。 (3)用定量吸管插入液面下,加入1mL 硫酸锰溶液和2mL 碱性碘化钾溶液,盖好瓶塞,勿使瓶内有气泡,颠倒混合数次,静置。 (4)待棕色絮状沉淀下沉,轻轻打开溶解氧瓶塞,立即用吸管插入液面下加入2mL 浓硫酸,盖好瓶塞,颠倒混合摇匀至沉淀物全部溶解为止(如沉淀物溶解不完全,需再加少量酸使其全部溶解)。放置暗处5min ,用移液管吸取l00mL 上述溶液,注入250mL 锥形瓶中,用硫代硫酸钠标准溶液滴定到溶液呈微黄色,加入lmL 淀粉溶液,继续滴定至蓝色刚好褪去为止。记录硫代硫酸钠溶液用量。 6 计算 100 10008c ??V 溶解氧= (O 2,mg /L) 式中 C ——硫代硫酸钠溶液浓度,mol /L ; V ——滴定时消耗硫代硫酸钠溶液体积,mL 。
地面水体中微生物分解有机物的过程消耗水中的溶解氧的量解读
地面水体中微生物分解有机物的过程消耗水中的溶解氧的量,称生化需氧量,通常记为BOD,常用单位为毫克/升。一般有机物在微生物作用下,其降解过程可分为两个阶段,第一阶段是有机物转化为二氧化碳、氨和水的过程,第二阶段则是氨进一步在亚硝化细菌和硝化细菌的作用下,转化为亚硝酸盐和硝酸盐,即所谓硝化过程。BOD一般指的是第一阶段生化反应的耗氧量。微生物分解有机物的速度和程度同温度、时间有关、最适宜的温度是15~30℃,从理论上讲,为了完成有机物的生物氧化需要无限长的时间,但是对于实际应用,可以认为反应可以在20天内完成,称为BOD20,根据实际经验发现,经5天培养后测得的BOD约占总BOD的70~80%,能够代表水中有机物的耗氧量。为使BOD值有可比性,因而采用在20℃条件下,培养五天后测定溶解氧消耗量作为标准方法,称五日生化需氧量,以BOD5表示。BOD反映水体中可被微生物分解的有机物总量,以每升水中消耗溶解氧的毫克数来表示。BOD小于1mg/L表示水体清洁;大于3-4mg/l,表示受到有机物的污染。但BOD的测定时间长;对毒性大的废水因微生物活动受到抑制,而难以准确测定。 三.化学需氧量(Chemical Oxygen Demand,COD) 水体中能被氧化的物质在规定条件下进行化学氧化过程中所消耗氧化剂的量,以每升水样消耗氧的毫克数表示,通常记为COD。在COD测定过程中,有机物被氧化成二氧化碳和水。水中各种有机物进行化学氧化反应的难易程度是不同的,因此化学需氧量只表示在规定条件下,水中可被氧化物质的需氧量的总和。当前测定化学需氧量常用的方法有KMnO4和K2CrO7法,前者用于测定较清洁的水样,后者用于污染严重的水样和工业废水。同一水样用上述两种方法测定的结果是不同的,因此在报告化学需氧量的测定结果时要注明测定方法。 COD与BOD比较,COD的测定不受水质条件限制,测定的时间短。但是COD不能区分可被生物氧化的和难以被生物氧化的有机物不能表示出微生物所能氧化的有机物量,而且化学氧化剂不仅不能氧化全部有机物,反而会把某些还原性的无机物也氧化了。所以采用BOD 作为有机物污染程度的指标较为合适,在水质条件限制不能做BOD测定时,可用COD代替。水质相对稳定条件下,COD与BOD之间有一定关系:一般重铬酸钾法COD>B OD5>高锰酸钾法COD
溶解氧的测定方法汇总
溶解氧 溶解在水中的分子态氧称为溶解氧。天然水的溶解氧含量取决于水体与大气中氧的平衡。溶解氧的饱和和含量和空气中氧的分压、大气压力、水温有密切关系。清洁地面水溶解氧一般接近饱和。由于藻类的生长,溶解氧可能过饱和。水体受有机、无机还原性物质污染,使溶解氧降低。当大气中的氧来不及补充时,水中溶解氧逐渐降低,以至趋近于零,此时厌氧菌繁殖,水质恶化。废水中溶解氧的含量取决于废水排出前的工艺过程,一般含量较低,差异很大。 1、方法的选择 测定水中溶解氧通常采用碘量法及其修正法和膜电极法。清洁水可直接采用碘量法测定。水样有色或含有氧化性及还原性物质、藻类、悬浮物等干扰测定。氧化性物质可使碘化物游离出碘,产生正干扰;某些还原性物质可把碘还原成碘化物,产生负干扰;有机物(如腐植酸、丹宁酸、木质素等)可能被部分氧化,产生正干扰。所以大部分受污染的地表水和工业废水,必须采用修正的碘量法和膜电极法测定。 水样中亚硝酸盐氮含量高于0.05mg/L,二价铁低于1 mg/L时,采用叠氮化钠修正法。此法适用于多数污水及生化处理出水;水样中二价铁高于 1 mg/L,采用高锰酸钾修正法;水样有色或有悬浮物,采用明矾絮凝修正法;含有活性污泥悬浮物的水样,采用硫酸铜—氨基磺酸絮凝修正法。 膜电极法是根据分子氧透过薄膜的扩散速率来测定水中溶解氧。方法简便、快速,干扰少,可用于现场测定。 2、水样的采用与保存 用碘量法测定水中溶解氧,水样常采集到溶解氧瓶中。采集水样时,要注意不使水样曝气或有气泡存在采样瓶中。可用水样冲洗溶解氧瓶后,沿瓶壁直接倾注水样或用缸吸法将细管插入溶解氧瓶底部,注入水样至溢流出瓶容积的1/3~1/2左右。 水样采集后,为防止溶解氧的变化,应立即加固定剂于样品中,并存于冷暗处,同时记录水温和大气压力。 一、碘量法
测定水中的溶解氧(碘量法)知识讲解
实验1:测定水中的溶解氧(碘量法) 一、实验目的 1.熟悉并掌握碘量法测定溶解氧的基本原理。 2.熟悉并掌握标准溶液的配置和标定方法。 3.练习实际测量以及滴定的操作,并了解碘量法滴定的注意事项。 二、实验原理 水中溶解氧的测定,一般用碘量法。使用碘量法测定水中溶解氧是基于溶解氧的氧化性能。当水样中加入硫酸锰和碱性KI溶液时,立即生成Mn(OH)2沉淀。但Mn(OH)2极不稳定,迅速与水中溶解氧化反应生成锰酸锰沉淀。在加入硫酸酸化后,已固定的溶解氧(以锰酸锰的形式存在)将KI氧化并释放出游离碘。然后用硫代硫酸钠标准溶液滴定,换算出溶解氧的含量。 反应方程式: 2MnSO4+4NaOH=2Mn(OH)2↓+2Na2SO4 2Mn(OH)2+O2=2H2MnO3↓ H2MnO3十Mn(OH)2=MnMnO3↓(棕色沉淀)+2H2O 加入浓硫酸后的反应方程式: 2KI+H2SO4=2HI+K2SO4 MnMnO3+2H2SO4+2HI=2MnSO4+I2↓+3H2O I2+2Na2S2O3=2NaI+Na2S4O6 此法适用于含少量还原性物质及硝酸氮含量<0.1mg/L、铁含量不大于1mg/L,较为清洁的水样。 三、实验仪器与试剂 仪器:250mL溶解氧瓶,50mL碱式滴定管,250mL锥形瓶,移液管(1、2、100mL),容量瓶(100、250、1000mL),洗耳球,标签纸,封口膜。 试剂: 1)硫酸锰溶液:称取36g MnSO4·4H2O,溶于蒸馏水中,转至100mL容量瓶,定容至标线,摇匀。(此溶液加至酸化过的碘化钾溶液中,遇淀粉不得产生
蓝色。) 2) 碱性KI溶液:称取125g NaOH溶于100~150mL去离子水中,另称取37.5g KI溶于50mL蒸馏水中。待NaOH溶液冷却后将两种溶液合并混和均匀,转移至250mL容量瓶中,用水定容至标线,摇匀。若有沉淀,则放置过夜后,倾出上层清液,储于塑料瓶中,用黑纸包裹避光保存。此溶液酸化后,遇淀粉不得产生蓝色。 3) 1%淀粉溶液: 称取1g可溶性淀粉,用少量水调成糊状,再用刚煮沸的水冲稀至100mL。冷却后,加入0.1g水杨酸或0.4g氯化锌防腐。 4) 0.02500mol/L(1/6K2Cr2O7)重铬酸钾标准溶液:称取于0.1226g 在 105~110℃烘干2小时并冷却的K2Cr2O7,溶于水,移入100mL容量瓶中,用水稀释至标线,摇匀。 5) 0.025mol/L硫代硫酸钠溶液:称取6.2g硫代硫酸钠(Na2S2O3·5H2O),溶于煮沸放冷的水中,加入0.2g碳酸钠,转移至1000mL容量瓶中,用去离子水稀释至标线,摇匀。储于棕色瓶中,使用前用0.02500mol/L重铬酸钾标准溶液标定。 6) 浓硫酸 7) 稀硫酸(1+5) 四、 五、实验步骤 1.水样采集和溶解氧的固定 1)采样地点:积水潭桥西侧。 2)用溶解氧瓶取水面下20~50cm的积水潭河水,采集水样时,要注意:注入水样至溢流出瓶容积的1/3-1/2左右。注意不要使水样曝气或有 气泡残存在溶解氧瓶中。 3)在河岸边取下瓶盖,用移液管吸取硫酸锰溶液1ml插入瓶内液面下,缓慢放出溶液于溶解氧瓶中。取另一只移液管,按上述操作往水样中 加入2ml碱性碘化钾溶液,盖紧瓶塞,不留气泡,将瓶颠倒振摇使之
水体中溶解氧的含量变化及相关问题
水体中溶解氧的含量变化及相关问题 /L,对于水中鱼类而言,溶解氧需大于4mg/L才能保证其正常的生命活动。1 影响水体中溶解氧含量的条件水体,不同于单纯的水。它除了包括水之外,还包括水中的植物、动物、底泥等,属于生态系统的概念范畴。因此水体中的含氧量与水体中生物群落的组成,分布等密切相关。1、1 两种作用水体中溶解氧的含量受到两种作用的影响:一是耗氧作用。包括需氧有机物降解时的耗氧、生物呼吸时的耗氧以及无机物的氧化耗氧等。所谓需氧有机物,是指在微生物的生物化学作用的分解过程中需要消耗氧的有机物。如糖类、蛋白质、脂质、木质素等。这类污染物若过量排放,会大量消耗水中的溶解氧。生物呼吸的耗氧,则指水中植物、动物及需氧细菌等需氧生物所耗的氧。无机物的的氧化耗氧则指如Fe、H2s等还原性物质在氧化过程中所消耗的氧。其中,需氧有机物降解和生物呼吸所耗氧是主要的。另一种作用是富氧作用。主要包括空气中氧的溶解和水生植物的光和作用等。1、2 环境因素天然水体溶解氧的含量是各种环境因素综合作用的结果。除与水体中生物数量和有机物数量有关外,还与大气中的氧分压、水温、水层、水面状态、水的流动方式等因素有关。正常情况下,地表水的溶解氧含量一般为5mg/L~10mg/L,一般清洁河流、湖泊可大于7mg/L,有风浪时,海水溶氧量可达 14mg/L,水藻繁生的水体,溶氧量常处于过饱和状态,地下水溶氧
量较少,深层水中甚至无氧。2 几种常见情况下的变化2、1 正常情况下的变化正常情况下,各种水体都能保持一定的溶解氧水平,但由于各种因素的综合影响,两种作用相互消长,使得水体中的溶解氧呈现一定的时空变化。 (1)在时间上,主要存在日变化和季节变化。这主要是因为温度和光照(包括光照强度与日照长短)等因素会随着昼夜交替、季节变更而发生变化。这些变化进而影响水体中植物的光和作用,需氧生物的耗氧情况,以及氧在水体中的溶解,从而影响水体中溶解氧的含量变化。以季节为例:我国南方湖泊生态系统一般在4月~5月时会出现一个溶氧量的高峰,这是由于此时气候已逐渐转暖,水温较高,光照强度逐渐增强,日照时间也不断延长,再加上冬季积累的无机养分,利于浮游植物大量繁殖;而且由于动物数量的增长总是滞后于植物,此时水中动物相对数量较少,耗氧量较少,所以,水中溶解氧会有大幅度增加。此后,由于无机养分的消耗,动物数量的增加,限制了水中植物数量增长;而且,动物的排泄物和动物遗体的分解,也造成需氧型细菌耗氧量增加,因此,水中溶解氧会降至一个较低水平。而到了秋冬季,气温下降,光强减弱,日照缩短,水体生物群落中各种群的密度都会下降,生物的生命活动也所减弱,但由于空气与水体仍然存在氧的溶解平衡,所以,水体中溶解氧能保持一个不低的水平。(2)在空间上,主要存在垂直方向即不同深度的变化,这是由于光能影响植物在水中的垂直分布,进而影响动物等其他需
- 天然水的溶解氧解读
- 电化学探头法测定水溶解氧关键技术解读
- 水中溶氧检测摘要本文综述了水体溶解氧的各种检测方法及原理,诸如
- 地面水体中微生物分解有机物的过程消耗水中的溶解氧的量解读
- 水体中溶解氧的含量变化及相关问题
- 实验二_水中溶解氧的测定
- 自来水的溶解氧测定
- 便携式溶解氧仪使用说明书解读
- 溶解氧含量的影响因素有哪些
- 水中溶解氧的测定实验报告
- 湟水流域水中溶解氧_DO_的含量及其规律分析
- 自来水的溶解氧测定解读
- 水中溶解氧的测定实验报告.
- 请问哪几种方法可以提高水中溶解氧的含量.doc
- 测定水中的溶解氧(碘量法)知识讲解
- 最新水质分析中的常用指标
- 溶解氧--溶解氧的含量及其影响因素
- 溶解氧--溶解氧的含量及其影响因素
- 水中溶解氧含量的测定
- 实验二 水中溶解氧的测定教案汇总
