2014ESCEACTS 心肌血运重建指南

女性急性心肌梗死指南
女性急性心肌梗死指南 心血管疾病是美国女性死亡的主要原因,有数据显示自1984 年以来,女性的心血管疾病年死亡率(CVD)一直高于男性。但在过去的十年里,女性心血管疾病死亡率已不断降低(见图1),这归功于健康意识的提升、对风险因素的日趋关注和及时有效的治疗。 因此,美国心脏病学会发表了首部针对女性患者的急性心肌梗死(AMI)的科学声明,对女性急性心梗的危险因素、临床表现、发病机制、治疗和预后进行了详细阐述。 图1 近十年女性心血管疾病死亡率变动情况 危险因素 尽管男女的冠心病危险因素大多相似,但还是有部分因素更适用于女性,包括吸烟、高血压、血脂异常、2 型糖尿病和肥胖、抑郁和其他社会心理层面的危险因素。 AMI 发病机制 有证据表明,男女之间的AMI 发病机制有所不同,这与冠心病发病的性别差异相关。其主要差异在于斑块的特征(破裂或侵蚀)以及冠脉痉挛(CAS)和自发性冠脉夹层。病理结果显示,在AMI 人群中,男性更加倾向于发生斑块破裂,而女性更加容易发生斑块侵蚀。冠脉痉挛的常见症状为休息时反复胸痛和短暂的ST 段抬高,但少见引发急性心梗。其原因亦是多因素的,包括迷走神经因素、血管平滑肌高反应性、内皮细胞功能失调和自主神经系统失衡。吸烟是急性冠脉综合征主要的危险因素,也可由自主神经活动变化、吸食可卡因、服用麻黄碱和其他药物诱发。相比男性,女性冠脉痉挛患者通常年龄较大,较少吸烟且少有明显的阻塞性冠心病。 自发性冠脉夹层是急性心梗极其罕见的病因,但多发生于女性,所以如果年轻女性有急性冠脉综合征的临床表现但无典型的动脉粥样硬化危险因素,则应高度怀疑该病因。
临床表现 越来越多证据显示,ACS 患者的临床表现存在性别差异。尽管大多数AMI 患者都会出现典型的胸痛或胸部不适症状,但女性常表现为不典型胸痛和心绞痛样症状如呼吸困难、虚弱、疲劳和消化不良(如下表所示)。 了解临床表现的性别差异有助于及时鉴别缺血症状、准确分诊以及更好的检查与治疗,否则或可导致女性患者被误诊、耽误血运重建的最佳时间并增加AMI 死亡率。另外,有研究显示AMI 发病后,女性就医普遍比男性慢,可能是缺乏危险意识、较为被动、错误理解病因和自我护理能力低的缘故。 治疗 尽管治疗可以降低死亡率,但AMI 发病期间女性还是经常得不到合理治疗。在溶栓治疗或PCI 方面女性的预后虽然比男性差,但其中影响因素较多。 1. ST 段抬高型心肌梗死(STEMI)的血运重建 1)溶栓治疗 无论性别和年龄的差异,发病早期及时溶栓都可以降低死亡率。最新指南指出,如果患者就诊的医院没有能力行PCI 或者预测患者入院后无法在发病后120 min 黄金时间内及时行PCI,且患者无溶栓禁忌证,推荐使用溶栓治疗。但指南中并没有进一步指出性别差异的推荐治疗方案。 有研究发现,或许是女性基础状态比较差的缘故(包括年龄和糖尿病、高血压和心衰的发病率),女性溶栓后死亡率和患病率明显比男性高。另外,女性更容易发生非致死性的并发症,如休克、心衰、再梗死、反复缺血、出血和卒中。尽管临床预后有性别差异,但溶栓效果并没有表现出太多的性别差异。 由于女性的出血风险较高(尤其是中度和重度出血),而且又较多的相对禁忌证(老龄、高血压和体格较小),使得内科医生不太愿意对女性患者使用溶栓治疗。另外,即使是经期的女性,溶栓治疗所带来的严重出血和非经期女性的比例差异并不明显。 总的来说,溶栓治疗还是利大于弊,可有效减少发病后12 小时内的死亡率和患病率。另外,针对没有禁忌证且预测患者入院后无法在发病后120 min 黄金时间内及时行PCI,纤维蛋白溶解对STEMI 患者的治疗起着很重要的作用。
2014ESC心肌血运重建指南
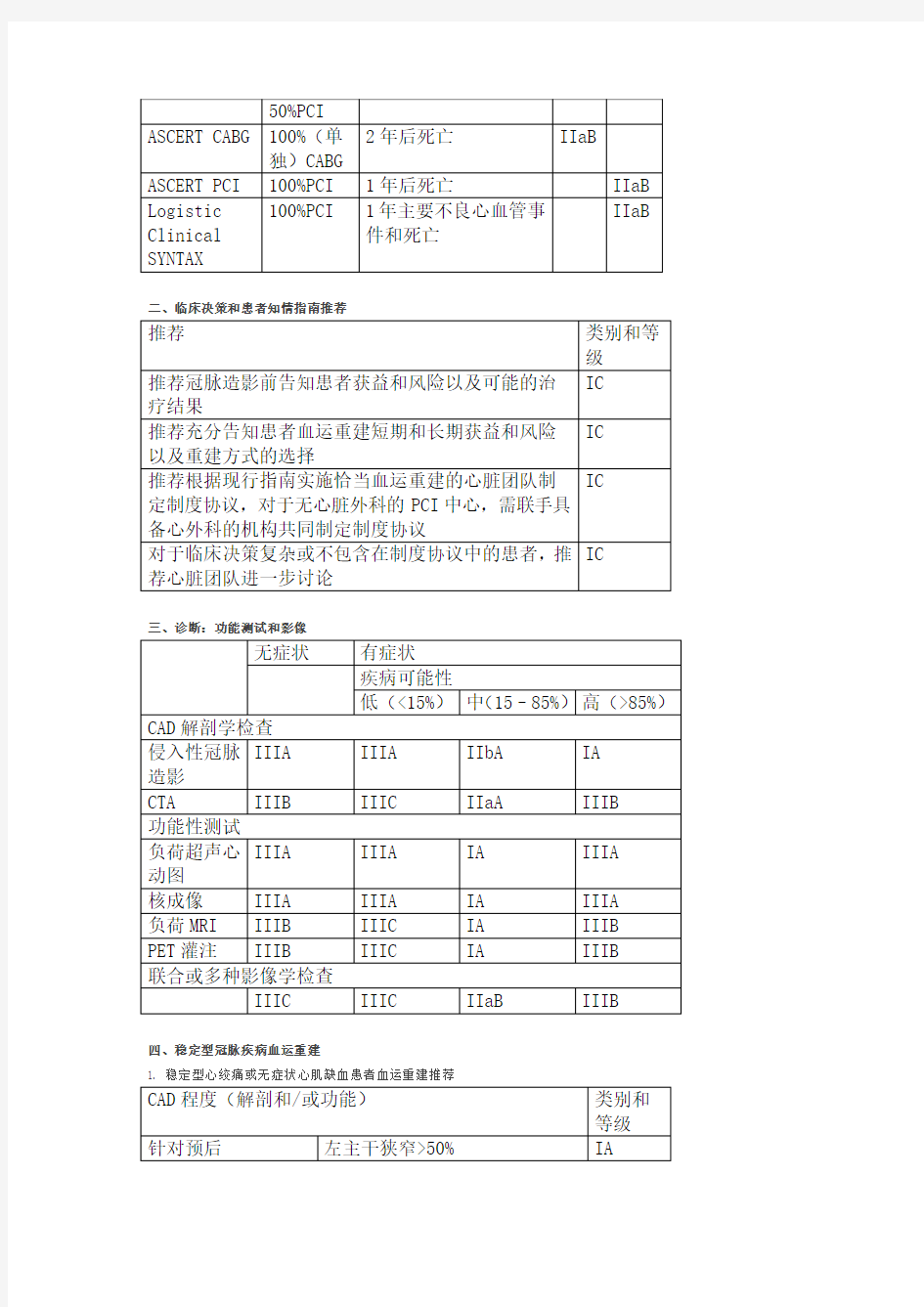
2014ESC/EACTS 心肌血运重建指南 2014-09-10 12:04来源:丁香园作者:iang 字体大小 -|+ 编者按:欧洲心脏病协会(ESC)2014 年会上发布了2014ESC/EACTS 心肌血运重建指南,本文就指南主要内容进行编译,现将译文与读者分享。 首先介绍一下推荐类别和证据等级的定义。 推荐类别 推荐类别 定义 所用词汇 I类 证据支持和/或普遍认同治疗或操作有益、有用、有效 推荐/建议 II类 针对治疗或操作有用性/有效性的证据存在争议和/或观点存在差异 IIa类 证据/观点偏向有用/有效 应该考虑 IIb类 有用/有效性证据/观点支持不足 可以考虑 III类 证据表明和/或普遍观点认为治疗或操作无用/无效,有些情况下可能是有害的 不推荐 证据等级 A级 数据来源多项随机临床试验或荟萃分析 B级 数据来源单项随机对照试验或大型非随机试验 C级 专家共识和/或小型试验、回顾性研究和注册研究 注:下文表格中的类别与等级均以类别+ 等级的方式呈现 一、风险评估 1. 短期(院内或30 天内)预后风险评估模型 评分 冠脉干预方式 结局 推荐
CABG PCI STS评分 100%(单独)CABG 院内或30天死亡和院内致残 IB EuroSCPRE II 47%(单独)CABG 院内死亡 IIaB IIbC ACEF 院内或30天死亡 IIbC IIbC NCRD CathPCI 100%PCI 院内死亡 IIbB EuroSCORE 64%(单独)CABG 操作死亡 IIIB IIIC 2. 长期(≥1 年)预后风险评估模型评分 冠脉干预方式 结局 推荐 CABG PCI SYNTAX 主要不良心脑血管事件 IB
激光在心血管疾病治疗中应用的新进展
激光在心血管疾病治疗中应用的新进展本文从网络收集而来,上传到平台为了帮到更多的人,如果您需要使用本文档,请点击下载按钮下载本文档(有偿下载),另外祝您生活愉快,工作顺利,万事如意! 激光在心血管疾病中主要用于治疗冠心病、周围血管疾病、心脏瓣膜病、先天性心脏病和肥厚性心肌病等。直接心肌血运重建术(direct myocardial revascularization,DMR),亦称经心肌血运重建术(transmyocardial revascularization,TMR)或激光心肌血运重建术(transmyocardial laser revascularization,TMLR),是近年来应用于外科临床的新技术。经皮直接心肌血运重建术(percutaneous direct myocardial revascularization,PDMR)是在TMR基础上发展起来的用于心内科临床的一种全新型冠心病介入治疗技术,是冠心病治疗史上的又一新进展。这些都为过去常规内外科治疗不能奏效的冠心病病人提供了一种新的有效的治疗方法[1,2]。一、DMR的分类根据操作技术(外科手术或经皮)、心肌打孔方向(经心外膜或心内膜)将DMR分为两大类[1]:(1)外科DMR:经开胸、胸部小切口或胸腔镜,用CO2激光或Ho∶YAG 激光经心外膜进行心肌打孔;(2)经皮DMR:即PDMR,经皮穿刺股动脉,将光导纤维直接送至心室腔内,通过光导纤维传送脉冲激光经心内膜进行心肌打孔。两
种术式均可将药物直接注入缺血心肌。二、历史回顾1933年Wearn等[3]发现人类心脏也存在类似爬行动物心脏循环系统的窦状隙样网状结构,为开辟全新的冠心病治疗途径奠定了坚实的解剖学基础。根据这一发现以及爬行动物心肌内窦状隙对心内膜下灌注起重要作用,研究者试图寻找新的方法,通过已经存在的或新产生的心肌内窦状隙增加心肌的血液供应。30年代Beck[4]和40年代Vineberg[5]创用的将大网膜、壁层心包或纵隔脂肪缝合到心脏表面或将乳内动脉埋入心肌,试图经心肌内窦状隙重建心肌血运的方法,后来都因冠状动脉搭桥术(CABG)和经皮冠状动脉腔内成形术(PTCA)的开展而黯然失色。1965年Sen 等[6]首先采用针头穿刺心肌产生心肌内孔道以达到心肌血运重建的目的,开创了经心肌血运重建的先河。与冠状动脉堵塞的对照犬相比,进行心肌血运重建术犬的心肌梗死面积缩小,存活率明显提高。1969年Hershey和White[7]首先将“经心肌针头穿刺血运重建术”用于病人,以终止难治性心肌缺血引起的心室颤动。70年代MirhosEini等率先开展了应用激光进行经心肌血运重建的实验研究,80年代初首次在临床应用CO2激光对1例行CABG未获完全血运重建的术中病人实施TMR获得成功[8,9]。90年代,Frazier等[10]
急性心肌梗死合并心源性休克的现代治疗策略(全文)
急性心肌梗死合并心源性休克的现代治疗策略(全文) 心源性休克(Cardiogenic shock,CS)是指由于心脏泵功能衰竭,心排出量锐减,导致脏器和组织严重灌注不足的临床综合征。急性心肌梗死(Acute myocardial infarction,AMI)是心源性休克最常见的原因。尽管治疗手段取得很大进步,但心源性休克仍占据AMI住院患者死亡原因排名的首位,AMI合并心源性休克死亡率高达50-60%。 本文将重点探讨AMI合并心源性休克的治疗策略,从早期血运重建、血管活性药物、机械循环支持、团队管理模式4个方面,梳理最新研究证据,分析解读指南变迁,分享实践经验体会。 (一) 早期血运重建 心源性休克管理的最初目标是识别和去除所有可逆的原因。理论上,AMI合并心源性休克最根本的治疗措施是紧急血运重建,挽救濒死和顿抑心肌,减少缺血坏死范围,维持心排血量,从源头阻断难治性心源性休克的恶性循环。 1.早期血运重建的地位
早期血运重建是AMI合并CS患者最重要的治疗策略,欧美指南一致强烈推荐早期血运重建,为I类推荐级别,B级证据水平,唯一的RCT证据来自SHOCK研究。SHOCK研究长期随访结果表明,与单纯药物治疗相比,早期血运重建可以明显降低AMI合并CS患者6个月、1年和6年死亡率,每实施8例早期血运重建可以挽救1个患者生命。早期血运重建是目前唯一证明可以降低AMI合并CS患者死亡率的治疗措施,但注册数据表明目前早期血运重建率仍不令人满意,仅占50-70%。因此临床实践中我们应该遵从指南,尽量提高早期血运重建率,同时也需要进行严格的筛选,高龄、心肺复苏后、既往心肌梗死及合并疾病多的患者可能无法从早期血运重建获益。 2.PCI还是CABG? 理论上血运重建方式影响心源性休克患者预后。目前尚无随机对照研究比较CABG和PCI疗效,有限的观察性数据显示两者死亡率相似,但注册研究中实施CABG的患者仅占5-10%。SHOCK研究中,接受PCI和CABG的比例分别为63%和37%,两者30天、1年及6年死亡率相似。虽然ACC/AHA和ESC指南均推荐根据冠脉解剖选择血运重建方式,但由于急诊CABG操作复杂、手术风险高,临床可行性极差,我们的经验是仅在冠脉解剖十分不适合PCI或PCI失败时才考虑CABG。
第三次心肌梗死全球通用定义(中译全文)
2012年第三次心肌梗死全球通用定义(中译全文)2013-07-08 05:58:24| 分类:冠心病 | 标签: |举报 |字号大中小订阅 ESC/ACC/HAH/WHF心肌梗死全球通用定义工作组 柳州市人民医院心内科 胡世红教授译自:European Heart Journal (2012) 33, 2551–2567 内容表 缩略语和词头语 心肌梗死的定义 急性心肌梗死的定义 既往心肌梗死的定义 引言 心肌缺血和梗死的病理特征 心肌损伤伴坏死的生物标志物的检出 心肌缺血和心肌梗死的临床特征 心肌梗死的临床分型 自发性心肌梗死(1型心肌梗死) 继发于氧供需不平衡的心肌梗死(2型心肌梗死) 由于心肌梗死所致的心脏死亡(3型心肌梗死) 与血运重建术相关的心肌梗死 心肌梗死的心电图检出 既往心肌梗死 无症状性心肌梗死 与心肌梗死心电图诊断相混淆的情况 成像技术 超声心动图 放射性核素成像 磁共振成像 计算机体层摄影术 应用于急性心肌梗死的成像 应用于心肌梗死晚期表现的成像 伴随PCI的心肌梗死诊断的诊断标准(4型心肌梗死) 伴随CABG的心肌梗死的诊断标准(5型心肌梗死) 对拟行其它心脏手术患者心肌梗死的评估 与非心脏手术相关的心肌梗死 在重症监护病房的心脏梗死
再发心肌梗死 与心力衰竭相关的心肌损伤或心肌梗死 在临床试验中心肌梗死的应用和质量保证 方案 调整心肌梗死定义的公共政策意义 心肌梗死定义的全球看法 利益冲突 致谢 参考文献 缩略语和词头语 ACCF 美国心脏病学院基金会 ACS 急性冠脉综合征 AHA 美国心脏病协会 CAD 冠心病 CABG 冠状动脉旁路移植术 CKMB 肌酸激酶MB同工酶 cTn 心肌肌钙蛋白 CT 计算机体层摄影 CV 变异系数 ECG 心电图 FDG 氟脱氧葡萄糖 HF 心力衰竭 LBBB 左束支传导阻滞 LV 左心室 LVH 左心室肥厚 MI 心肌梗死 mIBG 间碘苯甲胍 MONICA 心血管病趋势和决定因素的多国监测MPS 心肌灌注闪烁扫描术 MRI 磁共振成像 mV 毫伏 Non-Q MI 无Q波型心肌梗死 NSTEMI 非ST-段抬高型心肌梗死 PCI 经皮冠状动脉介入治疗 PET 正电子发射断层摄影 Q wave MI Q波型心肌梗死 RBBB 右束支传导阻滞 SPECT 单光子发射计算机断层摄影
(急诊科)急性ST段抬高心肌梗死临床路径
时间到达急诊科(0—10分钟)到达急诊科(11—30分钟) 主要诊疗工作□询问病史与体格检查 □建立静脉通道 □心电和血压监测 □描记并评价“18导联”心电图 □开始急救和常规治疗 □急请心血管内科二线医师会诊(5分钟 内到达):复核诊断、组织急救治疗 □迅速评估“溶栓治疗”或“直接PCI治疗” 的适应证和禁忌证 □确定再灌注治疗方案 □对拟行“直接PCI”者,尽快术前准备(药 物、实验室检查、交待病情、签署知情同意书、 通知术者和导管室、运送准备等) □对拟行“溶栓治疗”者,立即准备、签署 知情同意书并尽早实施 重点医嘱□描记“18导联”心电图 □卧床、禁活动 □吸氧(鼻导管、面罩无创通气、有创 通气 □重症监护(持续心电、血压和血氧饱 和度监测等) □开始急性心肌梗死急救和“常规治疗” 咀嚼服用阿司匹林、氯吡格雷各300 mg(无禁忌症) □急性心肌梗死护理常规 □特级护理、卧床、禁食 □镇静止痛 □静脉滴注硝酸甘油 □尽快准备和开始急诊“溶栓”治疗 □从速准备和开始急诊PCI治疗 □实验室检查(溶栓或急诊PCI前必查项 目) □建立静脉通道 □血清心肌酶学和损伤标志物测定(不必
等结果) 主要护理工作□建立静脉通道 □给予吸氧 □实施重症监护、做好除颤准备 □配合急救治疗(静脉/口服给药等) □静脉抽血准备 □完成护理记录 □指导家属完成急诊挂号、交费和办理 “入院手续”等工作 □急性心肌梗死护理常规 □完成护理记录 □特级护理 □观察并记录溶栓治疗过程中的病情变化 及救治过程 □配合监护和急救治疗 □配合急诊PCI术前准备 □做好急诊PCI患者转运准备 病情变异记录□无□有,原因: 1. 2. □无□有,原因: 1. 2. 护士 签名 白班夜班白班夜班 医师 签名 注:适用于STEMI发病<12小时者,择期PCI患者不适用本流程。时间到达急诊科(31—90分钟) 住院第1天 (进入CCU24h内) 主要诊疗工作□ 做好患者“急诊室导管室CCU”安全转运准备 □ 密切观察并记录溶栓过程中的病情变 化和救治情况 □ 尽早运送患者到导管室,实施“直接 PCI”治疗 □ 密切观察并记录“直接PCI”治疗中的病情变化和 救治过程 □ 溶栓或介入治疗后患者安全运送至CCU继续治 疗 □ 重症监护和救治 □ 监护、急救和常规药物治疗 □ 密切观察、防治心肌梗死并发症 □ 密切观察和防治溶栓和介入并 发症 □ 完成病历书写和病程记录 □ 上级医师查房:诊断、鉴别诊断、危险性 分层分析、确定诊疗方案 □ 预防感染(必要时) □ 实验室检查 □ 梗死范围和心功能评价
ESCEACTS血运重建指南解读及第4版心肌梗死全球通用定义解读
ESC/EACTS血运重建指南解读及第4版心肌梗死全球通用定义解读 从1812年第一次描述心绞痛症状至今的200余年中,人类对冠心病的认识经历了从大体解剖层次到细胞和分子生物学水平的飞跃,但如何准确诊断和进行最佳治疗一直是临床实践所面临的挑战1。2018年8月ESC 年会发布的《2018年ESC/EACTS血运重建指南》和《第4版心肌梗死全球通用定义》全面总结梳理了目前血运重建和心肌梗死主要循证医学证据,对临床实践具有非常高的指导价值。 一.《2018年ESC/EACTS血运重建指南》 在最佳药物治疗基础上依据循证医学证据进行血运重建治疗能够改善冠心病的预后。1969年Favalo ro首次描述了冠状动脉旁路手术(CABG),8年后A n dreas Grüntzig进行了首例冠状动脉介入术(PCI),50年后的今天CABG和PCI仍是冠心病血运重建的主要方式,但医学技术的进步使得我们可以达到更好的治疗终点。 冠心病患者的预后取决于心肌缺血的存在和程度,血运重建以减少心肌缺血为首要目标,其基础在于准确识别心肌缺血。近年来冠脉生理学和腔内影像学检查技术在血运重建的决策中扮演了越来越重要的角色,新指南的相关推荐也反映了这一趋势。基于DEFER2、FAME3、FAMEII4等里
程碑式的研究证据,新指南推荐在临界病变(IA)和多支病变(IIa B)中进行冠脉血流储备分数(FFR)检查。非血管扩张剂依赖的瞬时无波形曲线比值(iFR)理论基础与FFR相似,DEFINE-FLAIR5和iFR-SWEDEHEART6研究1年随访结果表明iFR指导血运重建不劣于FFR,因此在临界病变的评估中也获得了IA级别的推荐。但是目前静息Pd/Pa、CT-FFR等其他冠脉功能学检测手段循证医学证据仍不充分,新指南中未予明确推荐。血管内超声(IVUS)和光学相干成像(OCT)等腔内影像学检查手段可以提供管腔面积、斑块负荷、斑块成分等诸多信息。2015年发表一项纳入了123例无保护左主干病变患者的RCT研究表明,2年的随访中IVUS指导的PCI治疗与冠脉造影相比能显著减少MACE事件,更多的非RCT研究数据也支持这一结论7。在新指南中推荐对无保护左主干病变进行IVUS检查评估病变严重程度(IIaB)。与IVUS相比,OCT研究证据较少,目前尚无以硬终点为主要研究终点的RCT研究发表,因此新指南对OCT作为指导血运重建治疗的诊断工具未予明确推荐。 稳定性冠心病血运重建治疗指征主要为缓解症状和改善预后,新指南强调血运重建策略的选择应从外科手术风险、病变解剖复杂程度、达到完全血运重建的可能性三个维度综合分析。STS评分和EUROSCO RE II评分为目前CABG手术风险评估的主要手段,在CABG研究队列中STS评分表现出了更优的围术期风险评估能力,因此STS评分(IB)推荐级别高于EUROCSO REII评分(IIb B)。SYNTAX积分所体现的病变解剖复杂程度对于CABG和PCI的选择具有重要意义,对于左主干和多支病变推荐
急性心肌梗死临床路径
急性ST段抬高心肌梗死临床路径 (2009版) 一、急性ST段抬高心肌梗死(STEMI)临床路径标准住院流程(一)适用对象。第一诊断为急性ST段抬高心肌梗死(STEMI)(ICD10:I21.0- I21.3)(二)诊断依据。 根据《急性ST段抬高心肌梗死的诊断与治疗指南》(中华医学会心血管病分会,2001年)、2007年ACC/AHA及2008年ESC 相关指南 1.持续剧烈胸痛>30分,含服硝酸甘油(NTG)不缓解; 2.相邻两个或两个以上导联心电图ST段抬高≥0.1mv; 3.心肌损伤标记物(肌酸激酶CK、CK同功酶MB、心肌特异的 肌钙蛋白cTNT和cTNI、肌红蛋白)异常升高(注:符合前两 项条件时,即确定诊断为STEMI,不能因为等待心肌标志物检 测的结果而延误再灌注治疗的开始)。 (三)治疗方案的选择及依据。 根据《急性ST段抬高心肌梗死的诊断与治疗指南》(中华医学会心血管病分会,2001年)、2007年ACC/AHA及2008年ESC 相关指南 1.一般治疗 2.再灌注治疗 (1)直接PCI(经皮冠状动脉介入治疗)(以下为优先选择指征):
①具备急诊PCI的条件,发病<12小时的所有患者;尤其是 发病时间>3小时的患者; ②高危患者。如并发心源性休克,但AMI<36小时,休克<18 小时,尤其是发病时间>3小时的患者; ③有溶栓禁忌证者; ④高度疑诊为STEMI者。 急诊PCI指标:从急诊室至血管开通(door-to-balloon time)<90分钟。 (2)静脉溶栓治疗(以下为优先选择指征): ①无溶栓禁忌证,发病<12小时的所有患者,尤其是发病时间 ≤3小时的患者; ②无条件行急诊PCI; ③PCI需延误时间者(door-to-balloon time>90分钟)。 溶栓指标:从急诊室到溶栓治疗开始(door-to needle time)<30分钟。(四)标准住院日为:10-14 天。 (五)进入路径标准。 1.第一诊断必须符合ICD10:I21.0- I21.3急性ST段抬高心肌梗 死疾病编码; 2.除外主动脉夹层、急性肺栓塞等疾病或严重机械性并发症者; 3.当患者同时具有其他疾病诊断时,如在住院期间不需特殊处理 也不影响第一诊断的临床路径流程实施,可以进入路径。(六)术前准备(术前评估)就诊当天所必需的检查项目。 1. 心电、血压监护;
ESC非心脏手术心血管疾病评估及防治指南精选文档
E S C非心脏手术心血管疾病评估及防治指南精 选文档 TTMS system office room 【TTMS16H-TTMS2A-TTMS8Q8-
ESC/ESA 非心脏手术心血管疾病评估及防治最新指南 2014年8月1日,欧洲心脏病学会(ESC)与欧洲麻醉学会(ESA)联合发布了非心脏手术中心血管疾病(CVD)的评估及防治的最新指南。该指南汇集当今欧洲医学界非心脏手术方面的最新进展,同时继承了已往指南的合理内容。 有趣的是,除了ESC/ESA发布的最新指南,ACC/AHA也发布了非心脏手术CVD评估防治指南(详见2014ACC/AHA?非心脏手术围手术期β受体阻滞剂评估意见),建议读者综合两者长处进行阅读学习。 以下为ESC/ESA非心脏手术CVD评估及防治最新指南要点概述,其中涉及到的指南内容推荐等级及证据等级参考ACC/AHA 成人稳定型缺血心脏病指南更新的附表一。另有关 ESC/ESA 及 ACC/AHA 指南进一步分析见解读非心脏手术防治心血管疾病领域的两大指南 一、重视CVD并发症 ESC/ESA在新指南指出了当前非心脏手术中CVD并发症带来的治疗损失,而且统计结果显示随着欧洲老龄化等问题日趋严重,非心脏手术CVD并发症比例也相应升高。 严格来说,非心脏手术后CVD并发症好发于明确诊断或无症状的缺血型心脏病(IHD)、左室功能不全、心脏瓣膜疾病(VHD)及心律失常的患者。非心脏手术引起长时间血液动力学异常及心脏异常负荷。
造成围手术期心肌缺血的机制主要有两点: (1)冠脉狭窄引起血液动力学波动,造成血流受限,进而出现因代谢需求异常引起的血液供需比例失调。 (2)压力异常引起的不稳定动脉粥样斑块破裂导致急性冠脉综合征(ACS),常伴有血管炎症、血管收缩功能改变及凝血异常。 指南指出老龄化自身对于非心脏手术CVD并发症的影响较小,急症或重症心脏、肺部及肾脏疾病与CVD并发症风险率关联性更为显着。因此,以上因素也应纳入CVD 并发症的评估指标。下表为各种介入或手术治疗风险率归类。
急性心肌梗死的早期诊断和优化治疗教学文稿
急性心肌梗死的早期诊断和优化治疗
急性心肌梗死的早期诊断和优化治疗 葛均波戴宇翔 复旦大学附属中山医院心内科,上海市心血管病研究所 Email: ge.junbo@https://www.wendangku.net/doc/6e7439674.html, 近年来得益于急性心肌梗死(acute myocardial infarction,AMI)在早期诊断和早期再灌注治疗等方面的众多研究进展,ACC/AHA和ESC关于AMI的指南不断得到更新[1-5]。但我们需看到,AMI仍然是全球范围内的主要死因之一。据中国心血管病报告2015显示,近10年来我国AMI发病率快速上升,死亡率居高不下。China PEACE研究[6]显示过去10年间尽管AMI患者直接冠脉介入治疗的比例显著增高,但总的再灌注治疗比例分别并无增加,患者就诊延迟是导致再灌注治疗比例低的主要原因,因而对于AMI的规范化救治依然任重而道远。 (一)心脏肌钙蛋白在AMI早期诊断中的价值 自20世纪90年代早期起,临床上就将心脏肌钙蛋白(cTn)作为AMII最敏感和最特异的的生物标志物。随着检测方法敏感性的提高,cTn已被广泛认可为AMI早期诊断和危险分层的首选生物标志物[7]。2012年第三版心肌梗死全球统一定义[8],建议使用cTn作为AMI的首要诊断指标,并以cTn第99百分位值及其动态变化作为主要判断标准。ACC/AHA和ESC关于STEMI和NSTE-ACS指南均强调了心肌损伤标志物在早期诊断中的重要性,尤其是高敏心脏肌钙蛋白(hs-cTn)的重要价值。 与标准cTn检测相比,高敏心脏肌钙蛋白(hs-cTn)检测对于急性心肌梗死有较高的预测价值,可以减少“cTn盲区”时间,更早地检测AMI[9]。ESC指南[4]着重推荐了hs-cTn 0/3小时(标准方案)或0/1小时(新方案,根据APACE研究和TRAPID-AMI研究,基线hs-cTnT<12ng/L且1小时绝对变化<3ng/L时,可排除心肌梗死,阴性预测值为99.1~99.9%,基线hs-cTnT≥52ng/L 或1小时绝对变化≥5ng/L,心肌梗死可能性大,阳性预测值为77.2-78.2%)快速诊断AMI。 (二)AMI非梗死相关血管处理优化再灌注治疗策略
急性心肌梗死合并心源性休克的血运重建策略
急性心肌梗死合并心源性休克的血运重建策略 心源性休克是急性心肌梗死最严重的并发症之一,近年来,随着早期血运重建的广泛开展,急性心肌梗死合并心源性休克的发生率已经明显降低,但死亡率仍然很高,已经成为急性心肌梗死患者院内死亡最重要的原因,因此急性心肌梗死合并心源性休克仍然是治疗的重点和难点。此外,急性心肌梗死伴心源性休克患者往往合并多支血管病变(Multiple vascular lesions, MVD),其最佳血运重建策略尚无定论。 一、心源性休克定义及病因 心源性休克(cardiogenic shock, CS)是心脏泵衰竭的极期表现,由于心排血功能衰竭,不能维持最低限度心输出量,导致血压下降,组织灌注不足,引起全身性微循环功能障碍,从而出现一系列缺血、缺氧、代谢障碍及重要脏器损伤为特征的病理生理过程。其中急性心肌梗死是心源性休克最常见的原因,此外,少见的原因主要为包括继发于急性心肌梗死引发的机械并发症,如室间隔破裂、游离壁破裂、乳头肌断裂或者功能不全引起的急性缺血性二尖瓣返流以及等。确诊心源性休克包括以下方面:(1)低血压:收缩压<90 mmHg以下至少30分钟,或原有高血压的患者血压降幅>60 mmHg;(2)组织低灌注:四肢湿冷、少尿(<30 ml/h),血气低氧及代酸;(3)血流动力学异常或影像学改变:心脏指数下降,肺楔
压增高;胸片提示肺淤血、肺水肿。大部分CS出现在急性心肌梗死发病48 h内,其发病率在5%~15%之间,而且多数患者的死亡率在50%以上。有报导显示STEMI患者约5%~9%发生心源性休克,而在非ST段抬高性心肌梗死患者中的发生率则占前者的一半。 二、急性心肌梗死合并心源性休克早期血运重建的重要性 早期再灌注为急性心肌梗死后挽救濒危心肌, 缩小梗死范围、防止和逆转心源性休克,降低心源性休克病死率的有效措施。心肌梗死发生到心源性休克的时间很短, 血流动力学差, 进行介入治疗的机会较入院后发生心源性休克的患者少,住院死亡率、24 h 死亡率也较入院后发生心源性休克的患者高。紧急血运重建能显著降低心源性休克直接入院患者的死亡率降至与入院后发生心源性休克患者相仿的死亡率。因心源性休克直接入院患者的预后较差, 但通过急诊血运重建后的获益与入院后发生心源性休克患者相似。心源性休克的患者需要立即快速送至具有急诊经皮冠状动脉介入治疗(PCI)或冠状动脉旁路移植术(CABG)能力的医院进行救治[1]。SHOCK研究[2]共纳入2002年-2011年间来自国家住院患者案例(NIS)数据库的急性心梗合并心源性休克的患者60833例,目的在于观察早期冠脉血运重建策略对急性心梗患者复杂心源性休克的治疗效果。采用倾向得分匹配对20644例患者(10322例进行血运重建术,10322例进行药物治疗)的临床预后进行分析显示,进行血运重建及药物治疗的患者住院死
急性心肌梗死临床路径
急性心肌梗死临床路径 (2016年版) 一、标 准住院流程(一)适用对象。 第一诊断为急性心肌梗死(ICD-10:I21.900B~V)。 (二)诊断依据。 根据ICD10标准:I21.900B~V。急性心肌梗死是指在冠状动脉病变的基础上发生冠状动脉血供急剧减少或中断,使相应的心肌严重而持久地急性缺血导致心肌坏死。心肌梗死新定义(全球统一定义):因心肌缺血引起的心肌坏死均为心肌梗死。诊断标准:血清心肌标志物(主要是肌钙蛋白)升高(至少超过99%参考值上限),并至少伴有以下一项临床指标:(1) 典型心肌缺血症状(持续胸痛>30 分钟,含NTG 1-2 片不缓解,伴出汗、恶心呕吐、面色苍白); (2)新发生的缺血/缺血性ECG改变[包括T波增宽增高、 新发生的ST-T改变或左束支传导阻滞(LBBB)], ECG病理性Q波形成; (3)影像学证据显示有新发生的局部室壁运动异常; (4)冠脉造影或尸检证实冠状动脉内有血栓。 (三)进入路径标准。
1.第一诊断必须符合急性心肌梗死疾病编码(ICD-10: I21.900B~V)。 2.当患者同时具有其他疾病诊断,但在住院期间不需要特殊处理也不影响第一诊断的临床路径流程实施时,可以进入路径。 3.除外主动脉夹层、肺栓塞或严重机械性并发症者。 4.急诊PCI、溶栓或保守治疗的患者均可进入路径。急诊PCI、溶栓须符合适应证。 (四)标准住院日。 标准住院日:根据病情轻重及复杂程度,1-2周。 (五)住院期间的检查项目。 1.必需的检查项目 (1)血常规、尿常规、便常规+大便隐血; (2)肝功能、肾功能、电解质、血脂、血糖(空腹和餐后2小时)、DIC全套、CRP、proBNP、动脉血气分析、甲 功三项、 AA+ADP诱导的血小板聚集率; (3)心肌酶及心肌坏死标记物(q8h*3,qd*3); (4)胸部X 线片、心电图(q8h*3,qd*3)、床旁超声心动
急性ST段抬高型心肌梗死合并多支血管病变的血运重建策略
急性ST段抬高型心肌梗死合并多支血管病变的血运重建策略 有研究显示大约41%~67% 的STEMI 患者同时存在有临床缺血意义的多支血管病变(MVD),与单支血管病变相比,MVD 患者临床预后更差[1]。MVD 影响STEMI 患者预后的机制是多方面的,非梗死相关血管(non-IRA)病变导致非梗死区域心肌供血不足,使得患者整体心功能受到更大的影响,且再发急性冠状动脉综合征(ACS)的比例更高[2]。STEMI 患者不只是罪犯病变处于易损状态,而是存在多个易损或者已经破裂的斑块,non-IRA 斑块不稳定性导致的再发缺血事件,是导致MVD 的STEMI 患者预后相对较差的主要原因。 1 不同血运重建策略的利弊 存在MVD 时会扩大缺血心肌范围,增加心力衰竭和心律失常发生的概率。因此,积极干预non-IRA 病变能改善这部分患者的预后,理论上直接PCI 时同时干预存在显著狭窄的non-IRA 病变是最有效而经济的方法,其潜在的益处包括:(1)早期完全血运重建,改善心功能。(2)降低心源性休克发生率。(3)稳定其他可能破裂的斑块。(4)延长生存时间。(5)减少再次介入治疗所带来的再入院和并发症。(6)减少住院时间,降低费用。(7)减少手术次数,更易被患者接受。但是,直接PCI 同时积极干预non-IRA 病变,进行完全血运重建也可能带来相应风险,
包括:(1)干预non-IRA 可能在手术过程中加重心肌缺血的面积。(2)STEMI 患者往往处于高凝状态,血小板和凝血系统被激活,且可能存在多处不稳定病变,non-IRA 介入术后慢血流或无复流的发生概率增加,而一旦发生则可能造成心肌梗死面积的扩大。(3)直接PCI 术前常抗栓不充分,例如常用的抗血小板聚集药物氯吡格雷,即使服用600 mg 负荷剂量,达到抑制血小板聚集的高峰也需要2 h,这可能增加急性支架内血栓的风险;若多支血管同时发生支架内血栓,后果往往是灾难性的。(4)non-IRA 易发生痉挛,导致其功能性狭窄的程度往往被高估。(5)干预nonIRA 会导致操作时间延长、增加对比剂用量和对比剂肾病的发生率,这些对患者均是不利的[3]。因而,对于该类患者,选择何种血运重建策略,是单纯开通梗死相关血管(IRA-PCI),还是同时对多支血管完全血运重建(MV-PCI),以及血运重建时机如何选择,一直是急诊介入治疗领域存在争议的一个话题。针对合并MVD 的STEMI血运重建策略的研究不断进行,临床研究结果的相继公布推动了指南和治疗策略的不断更新。总体来说,目前这类患者的血运重建策略包括分期干预non-IRA 策略、传统(即根据造影的特征)同期MV-PCI 策略和血流储备分数(FFR)指导下处理有功能学意义的MV-PCI 策略。 2 STEMI 合并MVD 血运重建策略的早期研究结果和早期指南推荐 基于早期研究结果,早期美国心脏病学会/美国心脏协会 (ACC/AHA)、欧洲心脏协会(ESC)和中国有关STEMI 的指南均不建
ESCEACTS心肌血运重建管理指南要点
ESC/EACTS心肌血运重建管理指南要点
ACS =急性冠脉综合征; AF =心房颤动; AMI = 急性心肌梗死; BMS = 金属裸支架; CABG = 冠脉旁路移植术; CAD = 冠心病; CKD =慢性肾病; DAPT = 双联抗血小板治疗; DES = 药物洗脱支架; DUS = 双功超声; ECG = 心电图; EF = 射击血分数; FFR =冠脉血流储备分数; GP = 糖蛋白; IABP =主动脉内球囊反搏; iwFR =瞬时无波无线电;IMA =内乳动脉; IRA =梗死相关动脉; i.v. =静脉内; LAD = 左前降支; LM =左主干; LMWH =低分子肝素; LV = 左心室; LVEF = 左室射血分数; NSTE-ACS = 非ST段抬高的急性冠脉综合征; PCI =经皮冠脉介入治疗; PRECISE-DAPT = 在拟行支架植入和随后双联抗血小板治疗的患者中预测出血并发症; s.c. =皮下注射; SCAD = 稳定性冠心病; STEMI = ST-抬高的心肌梗死; STS = 胸外科学会; SYNTAX = 用紫杉醇支架经皮冠脉介入治疗与心脏外科的协同作用;TIA = 短暂性脑缺血发作; UFH =非组分肝素。 A推荐类别 B证据水平 C有证实的心肌缺血,一种血流动力学相关的病变,定义为FFR ≤0.80 或iwFR≤0.89, 或一支主要冠脉狭窄>90%。
D根据FFR <0.75,表明一种预后相关的病变。 E如果心脏团队担心手术风险或者经心脏团队充分咨询后,患者拒绝CABG,应当考虑PCI。 F这些推荐指的是得到大规模随机试验支持、有临床终点评估获得无条件欧盟质量标志的支架。
冠心病患者心肌血运重建的策略选择(全文)
冠心病患者心肌血运重建的策略选择(全文) 冠心病(coronary artery disease,CAD)是严重威胁人类健康的一种疾病,是全球导致中老年人死亡的首要病因。心肌血运重建是冠心病的重要治疗手段,通过血运重建,可以缓解患者的症状,改善患者的生活质量及延长其寿命。目前常见的血运重建方法有经皮冠状动脉介入治疗(PCI)和冠状动脉旁路移植术(CABG)。今年,欧洲心脏病学年会发布了2018年的《心肌血运重建指南》,文中对冠心病患者的血运重建策略进行了详细的阐述,本文将结合最新的指南共识进行述评,以期为冠心病患者的临床诊治提供启示。 一、心肌血运重建的适宜性 在临床实践中,对于何种冠心病患者需要进行心肌血运重建是值得广大临床医生注意的问题。总的治疗原则是要充分考虑血运重建对于患者临床结局(如死亡、症状、功能状态或生活质量)的影响,如果预期的临床获益超过手术的预期风险及负面影响即为适宜[1]。下面我们将对常见的冠心病患者进行详细介绍。 1.急性冠脉综合征(ACS)患者
ACS是冠心病的高危人群,大量临床研究均已证实,与单纯药物治疗相比,血运重建不仅能够改善ACS患者的临床症状,而且还能够降低患者的近期及远期心血管病事件风险,对于高危亚组人群则更为显著[2-4]。因此,在2018年ESC心肌血运重建指南中推荐[5]:1)对于ASC合并急性心衰或心源性休克的患者,需要紧急进行侵入性评估,如果冠脉解剖适宜,进行紧急PCI是指征,如果解剖结构不适宜,可推荐行紧急CABG,不推荐常规使用主动脉球囊反搏术(IABP);2)对于ST段抬高型心肌梗死(STEMI)患者,在症状发生2 h内实现再灌注,可使STEMI患者显著获益,而对缺血症状<12 h且ST段持续抬高的患者均推荐进行再灌注治疗,如果症状>12 h且持续存在症状或提示缺血的体征、血流动力学不稳定或危及生命的心律失常,也可以推荐PCI治疗;3)对于非ST段抬高型急性冠脉综合征(NSTE-ACS)患者,需要根据患者的状况进行危险程度分级,对于极高危患者(如血流动力学不稳定或心源性休克、危及生命的心律失常或心脏骤停、MI机械并发症、急性心衰、ST-T反复动态改变),可立即行侵入性检查(<2h)。对于高危患者(如根据心脏肌钙蛋白水平明确诊断非ST段抬高型心肌梗死、ST-T动态改变、GRACE评分>140),可早期行侵入性检查(<24h)。对于中危患者(如糖尿病或肾功能不全、LVEF<40%或充血性心力衰竭、早期或PCI/CABG后发生梗死后心绞痛、GRACE评分>109且<140,或非侵入性检查期间症状/缺血再发),可行非侵入性检查(<72h)。
心肌血运重建指南解读
68 《中国心血管医师》2011年 第1卷 第1期 欧 洲心脏病学学会(E S C )和欧洲心胸外科协会 (EACTS)于2010年8月联合发布了心肌血运重建指 南。该指南引入了最新的临床研究结果,系统客观地评价了冠心病的3种主要治疗(药物、介入和外科手术治疗),囊括了围血运重建期间可能发生的问题及合并的临床情况,是一个实用性较高的指南,是ESC和EACTS深度合作的经典范例。该指南开创性地强调了心脏团队(Heart?Team)在治疗决策中的重要性。对冠心病患者诊断评估,依据解剖学和临床表现进行血运重建等诸多问题做出了推荐;有关药物治疗、尤其是伴随血运重建的抗栓药物治疗的指导性建议,也是本次新指南的重要组成部分;最后,新指南还对血运重建患者的系统随访做出指导。1 治疗决策的选择 新指南全面考虑、优化心肌血运重建策略,提出“心脏团队”的概念。制定治疗决策和患者知情的程序应遵循“自主、有利、有效和公正”的医学伦理学原则,强调应为患者参与选择治疗方案提供充分机会。治疗决策应全面考虑临床因素,患者年龄、性别、种族、意愿以及技术因素。成立心脏团队(介入心脏病学家、临床心脏病学家和心脏外科专家)正是为了平衡多学科决策,有时还需要全科、麻醉科、老年科、ICU等专科医生的参与。尽管目前已经有多种危险评分系统用于评估血运重建患者的预后,但是还没有一种危险评分能准确预测患者预后。因此危险评分只能作为参考,临床判断和多学科对话是必需的。另外关于Ad?hoc?PCI的话题同样体现了“心脏团队”的理念。Ad?hoc?PCI指造影后立即行PCI,可简化治疗过程,减少穿刺并发症,节省费用和时间。但对38?000余例接受Ad?hoc?PCI患者的回顾分析发现,其中30%更适于接受冠状动脉旁路移植术(CABG)。因此Ad?hoc?PCI适于多数但非所有患者,不应作为常规做法,对于某些患者如慢性心力衰竭(CHF)、慢性肾脏病患者以及某些病变如病变本身高危、多只血管病变包括前降支受累的稳定型患者等不适合行Ad?hoc?PCI,需要进一步由心脏团队决定血运重建策略。 2 血运重建治疗前的诊断及评估策略 该指南所提出的血运重建治疗前对患者进行诊断及评估的相关策略对现阶段我国冠心病患者评估具有很重要的参考意义。对无症状患者进行包括冠脉解剖(冠脉CTA等)或冠脉功能(包括负荷超声、负荷核素等)的检查都不被推荐。对高度可疑冠心病患者推荐直接行冠脉造影(Ⅰ/A),而不推荐行冠脉CT检查(Ⅲ/B)。对中度可疑的患者推荐行负荷超声和核医学检查(Ⅰ/A),冠脉CTA也可以考虑(Ⅱa/B),而现有临床实践中经常有医生对无症状或高度可疑冠心病患者行冠脉CTA检查。由于负荷心电图准确性方面的欠缺,在该指南中并未明确推荐用于评价心肌缺血,而是推荐采用负荷超声等影像学方法,也值得我们借鉴。另外有创的冠脉功能评价指标血流储备分数(FFR)对于缺乏明确缺血信息的冠脉中度狭窄的评价也非常有意义。3 不同患者人群血运重建策略 3.1 稳定型冠心病患者 稳定型冠心病患者或无症状心肌缺血患者血运重建治疗的主要适应证是改善症状和(或)预后。该指南比较了不同治疗方法包括优化药物治疗(OMT)、PCI和CABG的优劣及针对不同临床情况如何选用两种血运重建方式。基于以下改善预后的考虑可行血运重建:①左主干病变>50%(Ⅰ/A);②前降支近段病变>50%(Ⅰ/A);③伴左室功能降低的2支或3支病变(Ⅰ/B);④证实有大面积心肌缺血(>10%左室)(Ⅰ/B);⑤仅1支通畅血管,狭窄>50%(Ⅰ/C);⑥非前降支近段的单支病变,且缺血≤10%(Ⅲ/A)。基于以下改善改善症状的考虑可行血运重建:① 2010年欧洲心脏病学学会/欧洲心胸外科协会 心肌血运重建指南解读 马 为,李建平(北京大学第一医院 心内科,北京 100034) 指南解读 Guideline Center
