理想气体的平均摩尔定压热容
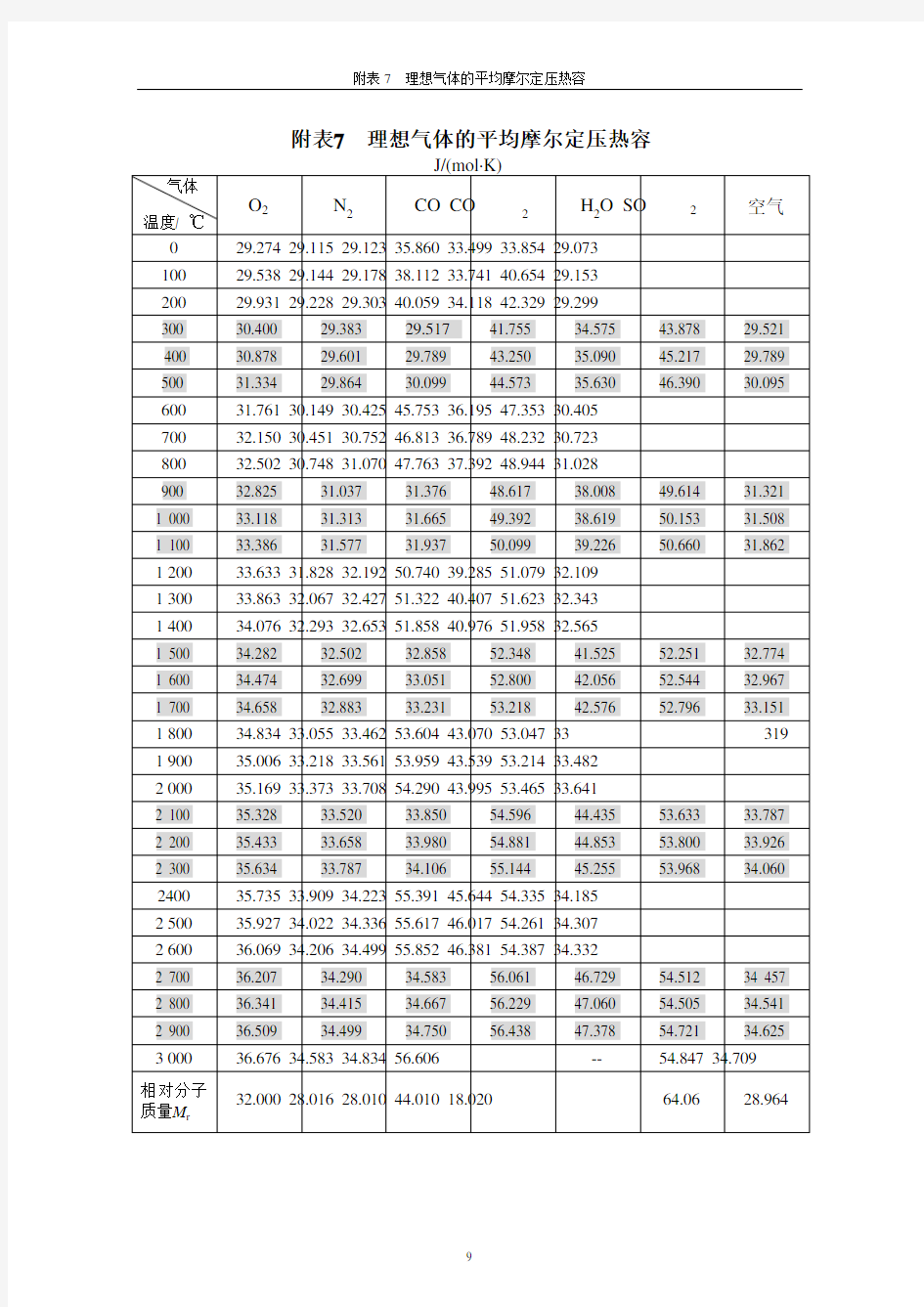
附表7 理想气体的平均摩尔定压热容
附表7 理想气体的平均摩尔定压热容
9
气体摩尔热容的计算
22.3 理想气体的热容 一. 一.???? 气体的摩尔热容 一个系统的温度升高dT 时,如果它所吸收的热量为dQ ,则系统的热容C 定义为 当系统的物质的量为1mol 时,它的热容叫摩尔热容,用C m 表示,单位是。当系统的质量为单位质量时,它的热容叫比热容,用c 表示,单位是。 由于热量是和具体过程有关,同一种气体,经历的过程不相同,吸收的热量也不相同,因此相应于不同的过程,其热容有不同的值。常用的有等容摩尔热容和等压摩尔热容。 等容摩尔热容是系统的体积保持不变的过程中的摩尔热容,记作C V , m 。 等压摩尔热容是系统的压强保持不变的过程中的摩尔热容,记作C p , m 。 二.理想气体的摩尔热容 下面讨论理想气体的摩尔热容。设1mol 的理想气体,经历一微小的准静态过程后,温度的变化为dT 。根据热力学第一定律,气体在这一过程中吸收的热量为 对于等容过程,理想气体在此过程中吸收的热量全部用来增加内能 已知1mol 理想气体的内能为 由此得 所以 如果理想气体经历的是一等压过程,则 根据理想气体的状态方程有 所以 比较等容摩尔热容C V , m 与等压摩尔热容C p , m ,不难看出 上式叫做迈耶公式。它的意义是,1mol 理想气体温度升高1K 时,在等压过程中比等容过程中要多吸收8.31J 的热量,为的是转化为膨胀时对外所做的功。 等压摩尔热容C p , m 与等容摩尔热容C V , m 的比值,用表示,叫做比热比 )/(K mol J ?)/(K kg J ?γR C R C m p m V /,/,,γ
热容时是成功的。但是,能量均分原理不能解释随着温度的变化而出现摩尔热容数值的变化。因此,上述理论是个近似理论,只有用量子理论才能较好地解决热容的问题。 例1.某种气体(视为理想气体)在标准状态下的密度为
气体摩尔热容的计算
22.3 理想气体的热容 一. 一. 气体的摩尔热容 一个系统的温度升高dT 时,如果它所吸收的热量为dQ ,则系统的热容C 定义为 当系统的物质的量为1mol 时,它的热容叫摩尔热容,用C m 表示,单位是。当系统的质量为单位质量时,它的热容叫比热容,用c 表示,单位是。 由于热量是和具体过程有关,同一种气体,经历的过程不相同,吸收的热量也不相同,因此相应于不同的过程,其热容有不同的值。常用的有等容摩尔热容和等压摩尔热容。 等容摩尔热容是系统的体积保持不变的过程中的摩尔热容,记作C V , m 。 等压摩尔热容是系统的压强保持不变的过程中的摩尔热容,记作C p , m 。 二.理想气体的摩尔热容 下面讨论理想气体的摩尔热容。设1mol 的理想气体,经历一微小的准静态过程后,温度的变化为dT 。根据热力学第一定律,气体在这一过程中吸收的热量为 对于等容过程,理想气体在此过程中吸收的热量全部用来增加内能 已知1mol 理想气体的内能为 由此得 dT dQ C = )/(K mol J ?)/(K kg J ?m V m V dT dQ C ,,??? ??=m p m p dT dQ C ,,??? ??=pdV dU dQ +=dU dQ =RT i U 2=
所以 如果理想气体经历的是一等压过程,则 根据理想气体的状态方程有 所以 比较等容摩尔热容C V , m 与等压摩尔热容C p , m ,不难看出 上式叫做迈耶公式。它的意义是,1mol 理想气体温度升高1K 时,在等压过程中比等容过程中要多吸收8.31J 的热量,为的是转化为膨胀时对外所做的功。 等压摩尔热容C p , m 与等容摩尔热容C V , m 的比值,用表示,叫做比热比 RdT i dU 2= R i dT dQ C m V m V 2=? ?? ??=,,pdV dU dQ +=RdT i dU 2=RdT pdV =R i dT dQ C m p m p 22+=? ?? ??=,,R C C m V m p +=,,γi i C C m V m p 2+= = ,,γR C R C m p m V /,/,,γ
理想气体的定压比热容cp
理想气体的定压比热容cp/(kj/kg·K) 名称分子式温度/℃ -40 10 60 110 160 260 360 460 760 1200 氢H214.83 14.29 14.11 14.09 14.18 14.43 14.67 14.84 15.02 16.25 氧O20.9378 0.9169 0.9169 0.9253 0.9420 0.9797 1.013 1.043 1.097 1.147 氮N2 1.089 1.043 1.026 1.026 1.034 1.059 1.089 1.118 1.172 1.252 氨NH3 2.005 2.043 2.114 2.186 2.303 2.508 2.700 2.881 3.329 3.869 一氧化碳CO 1.084 1.043 1.029 1.030 1.038 1.068 1.101 1.130 1.189 1.264 二氧化碳CO20.7997 0.8289 0.8709 0.9043 0.9546 1.030 1.097 1.147 1.243 1.340 二氧化硫SO20.5862 0.6071 0.6322 0.6573 0.6908 0.7411 0.7787 0.8122 0.8541 0.8960 硫化氢H2S 0.9839 0.9797 0.9964 1.013 1.051 1.118 1.176 1.235 1.361 1.524 甲烷CH4 2.077 2.189 2.336 2.466 2.675 3.031 3.383 3.689 4.568 5.355 乙烷C2H6 1.465 1.692 1.913 2.081 2.336 2.721 3.077 3.395 4.153 4.823 丙烷C3H8 1.344 1.603 1.846 2.026 2.290 2.684 3.031 3.337 4.036 4.652 正丁烷C4H10 1.361 1.612 1.846 2.022 2.282 2.663 3.002 3.295 3.965 4.555 正戊烷C5H12 1.352 1.603 1.838 2.009 2.265 2.646 2.977 3.266 3.923 4.492 正已烷C6H14 1.339 1.591 1.825 2.001 2.257 2.633 2.960 3.249 3.889 4.455 正庚烷C7H16 1.336 1.587 1.821 1.993 2.248 2.625 2.952 3.232 3.869 4.425 正辛烷C8H18 1.336 1.583 1.817 1.993 2.244 2.617 2.943 3.224 3.852 4.400 整壬烷C9H20 1.331 1.583 1.817 1.989 2.240 2.613 2.935 3.215 3.839 4.384 正癸烷C10H22 1.331 1.578 1.813 1.985 2.236 2.608 2.931 3.207 3.831 4.371 环戊烷C5H100.7913 1.105 1.800 1.578 1.863 2.273 2.629 2.935 3.630 4.199 甲基环戊烷C6H120.9295 1.231 1.499 1.687 1.964 2.361 2.705 3.002 3.663 4.216 乙基环戊烷C7H140.9504 1.256 1.528 1.721 1.997 2.399 2.738 3.035 3.689 4.442 环己烷C6H120.8499 1.181 1.469 1.679 1.976 2.412 2.784 3.107 3.831 4.371 甲基环己烷C7H140.9797 1.294 1.578 1.679 2.072 2.491 2.851 3.161 3.848 4.371 乙基环己烷C8H16 1.026 1.336 1.612 1.813 2.098 2.512 2.868 3.169 3.839 4.358 乙烯C2H4 1.298 1.495 1.687 1.829 2.043 2.357 2.633 2.872 3.416 3.919 丙稀C3H6 1.256 1.461 1.658 1.805 2.026 2.353 2.642 2.897 3.479 3.998 丁烯-1 C4H8 1.231 1.461 1.679 1.838 2.068 2.412 2.709 2.968 3.546 4.065 戊烯-1 C5H10 1.269 1.499 1.712 1.871 2.106 2.449 2.747 3.006 3.588 4.099 己烯-1 C6H12 1.277 1.507 1.725 1.884 2.123 2.466 2.767 3.031 3.613 4.124 庚烯-1 C7H14 1.281 1.516 1.733 1.897 2.135 2.483 2.784 3.048 3.630 4.141 辛烯-1 C8H16 1.285 1.520 1.742 1.905 2.144 2.491 2.797 3.061 3.643 4.153 环戊烯0.7704 1.038 1.281 1.453 1.699 2.060 2.369 2.642 3.249 3.726
气体摩尔热容的计算
气体摩尔热容的计算
————————————————————————————————作者: ————————————————————————————————日期: ?
22.3 理想气体的热容 一. 一. 气体的摩尔热容 一个系统的温度升高dT 时,如果它所吸收的热量为dQ ,则系统的热容C定义为 当系统的物质的量为1m ol时,它的热容叫摩尔热容,用C m 表示,单位是。当系统的质量为单位质量时,它的热容叫比热容,用c表示,单位是。 由于热量是和具体过程有关,同一种气体,经历的过程不相同,吸收的热量也不相同,因此相应于不同的过程,其热容有不同的值。常用的有等容摩尔热容和等压摩尔热容。 等容摩尔热容是系统的体积保持不变的过程中的摩尔热容,记作C V , m。 等压摩尔热容是系统的压强保持不变的过程中的摩尔热容,记作C p , m 。 二.理想气体的摩尔热容 下面讨论理想气体的摩尔热容。设1mol 的理想气体,经历一微小的准静态过程后,温度的变化为dT 。根据热力学第一定律,气体在这一过程中吸收的热量为 对于等容过程,理想气体在此过程中吸收的热量全部用来增加内能 已知1mol 理想气体的内能为 由此得 dT dQ C = )/(K mol J ?)/(K kg J ?m V m V dT dQ C ,,??? ??=m p m p dT dQ C ,,??? ??=pdV dU dQ +=dU dQ =RT i U 2=
所以 ?如果理想气体经历的是一等压过程,则 根据理想气体的状态方程有 所以 ?比较等容摩尔热容C V , m 与等压摩尔热容C p , m ,不难看出 上式叫做迈耶公式。它的意义是,1mol 理想气体温度升高1K 时,在等压过程中比等容过程中要多吸收8.31J 的热量,为的是转化为膨胀时对外所做的功。 ?等压摩尔热容C p , m 与等容摩尔热容CV , m的比值,用表示,叫做比热比 表22-1 理想气体的以及的理论值 C V ,m /R C p,m /R γ 单原子分子气体 1.5 2.5 1.67 刚性双原子分子气体 2.5 3.5 1.40 振动双原子分子气体 3.5 4.5 1.29 刚性多原子分子气体 3 4 1.33 RdT i dU 2= R i dT dQ C m V m V 2=? ?? ??=,,pdV dU dQ +=RdT i dU 2=RdT pdV =R i dT dQ C m p m p 22+=? ?? ??=,,R C C m V m p +=,,γi i C C m V m p 2+= = ,,γR C R C m p m V /,/,,γ
理想气体定压比热容
理想气体的定压比热容cp/(kJ/kg·K) 名称分子式温度/℃ -40 10 60 110 160 260 360 460 760 1200 氢H 14.83 14.29 14.11 14.09 14.18 14.43 14.67 14.84 15.02 16.25 2 氧O 0.9378 0.9169 0.9169 0.9253 0.9420 0.9797 1.013 1.043 1.097 1.147 2 氮N 1.089 1.043 1.026 1.026 1.034 1.059 1.089 1.118 1.172 1.252 2 氨NH 2.005 2.043 2.114 2.186 2.303 2.508 2.700 2.881 3.329 3.869 3 一氧化碳CO 1.084 1.043 1.029 1.030 1.038 1.068 1.101 1.130 1.189 1.264 二氧化碳CO 0.7997 0.8289 0.8709 0.9043 0.9546 1.030 1.097 1.147 1.243 1.340 2 二氧化硫SO 0.5862 0.6071 0.6322 0.6573 0.6908 0.7411 0.7787 0.8122 0.8541 0.8960 2 硫化氢H S 0.9839 0.9797 0.9964 1.013 1.051 1.118 1.176 1.235 1.361 1.524 2 甲烷CH 2.077 2.189 2.336 2.466 2.675 3.031 3.383 3.689 4.568 5.355 4 乙烷C H6 1.465 1.692 1.913 2.081 2.336 2.721 3.077 3.395 4.153 4.823 2 丙烷C H8 1.344 1.603 1.846 2.026 2.290 2.684 3.031 3.337 4.036 4.652 3 正丁烷C H10 1.361 1.612 1.846 2.022 2.282 2.663 3.002 3.295 3.965 4.555 4 正戊烷C H12 1.352 1.603 1.838 2.009 2.265 2.646 2.977 3.266 3.923 4.492 5 正已烷C H14 1.339 1.591 1.825 2.001 2.257 2.633 2.960 3.249 3.889 4.455 6 正庚烷C H16 1.336 1.587 1.821 1.993 2.248 2.625 2.952 3.232 3.869 4.425 7 正辛烷C H18 1.336 1.583 1.817 1.993 2.244 2.617 2.943 3.224 3.852 4.400 8 整壬烷C H20 1.331 1.583 1.817 1.989 2.240 2.613 2.935 3.215 3.839 4.384 9 正癸烷C H22 1.331 1.578 1.813 1.985 2.236 2.608 2.931 3.207 3.831 4.371 10 环戊烷C H100.7913 1.105 1.800 1.578 1.863 2.273 2.629 2.935 3.630 4.199 5 甲基环戊烷C H120.9295 1.231 1.499 1.687 1.964 2.361 2.705 3.002 3.663 4.216 6
理想气体比热、内能、焓和熵
理想气体的比热和热量 为了计算在状态变化过程中的吸热量和放热量,我们引入了比热容的概念。 一、比热容的定义 比热容与我们前面所讲过的比容、比内能、比焓、比功等参数类似,它是一个比参数,那么它的广延参数就是热容,所以在讲比热容之前我们先看一下热容。 1.热容 热容指的是物体在一定的准静态过程中,温度升高或降低1K 时吸收或放出的热量,用符号C 表示。 根据热容的定义,我们可以得到:若工质在一定的准静态过程中,温度变化了△T ,过程中热量为Q ,那么这个过程中的比热为: Q C T =? 而物体的比热容是随温度变化的,并不是一个常数,我们上面的表示方法仅仅表示的是工质在这一过程中的平均比热容,若我们精确的表示工质在某一温度处的热容,则: Q C dT δ= 单位为J/K 2.比热容 用符号c 表示,比热容是热容的比参数。比参数是广延参数与质量的比值。 所以比热容的定义为:1kg 物体在一定的准静态过程中温度升高或降低1K 时吸收或放出的热量。 C q c m dT δ== 单位:J/(kgK) 这个比容又叫比质量热容,除了比质量热容外,热容还有两种比参数,分别是容积比热和摩尔比热。 容积比热用符号c ’表示,指的是1Nm 3工质在一定的准静态过程中温度升高或降低1K 时吸收或放出的热量。单位为J/( Nm 3K)。 摩尔比热用符号Mc 表示,指的是1mol 工质在一定的准静态过程中温度升高或降低1K 时吸收或放出的热量。单位为J/( molK)。
三个比容之间的关系:'Mc M c Vm c =?=? 二、理想气体的比热 热量是过程参数,其数值的大小与所进行的热力过程有关,同样比热也是过程参数,也与工质所进行的热力过程有关,不同热力过程的比热值也是不相同的。在我们工程热力学的研究范围中,最常用到的比热有两种: 一个是定容过程的比热,一个是定压过程的比热。 定容过程:整个热力过程中工质的容积保持不变。比如固定容器中的气体被加热。 定压过程:整个热力过程中工质的压力保持不变。比如气缸活塞系统,活塞上放一质量不变的重物,对工质进行加热的过程。 两个过程的比热分别称为定容比热c v 和定压比热c p 。 1.定容比热c v 1kg 物体在定容过程中温度变化1K 时吸收或放出的热量。 定容过程的特点是:体积变化为0,即dv=0 对于可逆过程:q du pdv du δ=+= ∴v du pdv du c dT dT += = 即v du c dT = 2.定压比热c p 1kg 物体在定压过程中温度变化1K 时吸收或放出的热量。 定压过程的特点是:压力变化为0,即dp=0 对于可逆过程:q dh vdp dh δ=-= ∴p dh vdp dh c dT dT -= = 即p dh c dT = 这两个式子只适用于准静态过程、平衡过程、可逆过程。 对于理想气体来说,c v 、c p 仅是温度的函数,与其他参数无关。 三、c v 与c p 的关系 1.关系1
气体摩尔热容比测定
气体摩尔热容比的测定 实验目的: 1. 学习测定气体摩尔热容比的方法。 2. 熟练掌握物理天平、秒表及螺旋测微器的使用方法。 3. 熟练掌握直接测量值和间接测量值不确定度的计算。 实验仪器:(如图1) 气体摩尔热容比测定仪、秒表、螺旋测微器等 图1 图2 实验原理: 气体的摩尔定压热容C P 与摩尔定容热容C V 之比V P C /C =γ,在热力学过程特别是绝热过程中是一个很重要的参数,测定的方法有好多种。这里介绍一种较新颖的方法,通过测定钢球在特定容器中的振动周期来计算γ值。 如图2所示,钢球A的质量为m,半径为r(直径为d),当瓶子内压力P满足下面条件时钢球A处于力平衡状态。这时2 L r mg P P π+=,式中P L 为大气压强。当振动钢球处于小孔下方的半个振动周期时,注入气体使容器内的压力增大,使钢球向上移动,而当钢球处于小孔上方的半个振动周期时,容器内的气体将通过小孔流出,使钢球下沉。以后重复上述过程,只要适当控制注入气体的流量,钢球就能在玻璃管的小孔上下作简谐振动,振动周期可利用秒表来测得。 若物体(钢球)偏离平衡位置一个很小距离x,则贮气内的压力变化,物体
的运动方程为: dp r dt x d m 222π= (1) 因为物体振动过程相当快,所以可以看作绝热过程,绝热方程 (2) 常数=r PV 将(2)式求导数代入(1)式得 04222=+x mV p r dt x d γπ 此式即为熟知的简谐振动方程,它的解为 T mV p r πγ πω242== 4 242644pd T mV pr T mV ==γ (3) 式中各量均可方便测得,因而可算出γ值。 由气体运动论可以知道,γ值与气体分子的自由度数有关,对单原子气体(如氩)只有三个平均自由度,双原子气体(如氢)除上述3个平均自由度外还有2个转动自由度。对多原子气体,则具有3个转动自由度,比热容比γ与自由度i 的关系为i i 2+=γ 。 理论上得出: 单原子气体(Ar,He) i=3 67.1=γ 双原子气体(N 2,H 2,O 2) i=5 40.1=γ 多原子气体(CO 2,CH 4) i=6 33.1=γ 且与温度无关。 实验内容: 1、调节气泵上气量调节旋钮逆时针到最小,接通电源,控制气量大小,稍等半分钟,小钢球即可上下振动。 2、调节缓冲瓶口橡皮塞上调节阀和气泵上气量调节旋钮,使小钢球在玻璃管中以小孔为中心上下振动。 3、利用秒表计时,选择50次,记录小钢球振动50个周期所需要的时间,重复测量5次。
