最新最全最实用电极电势表
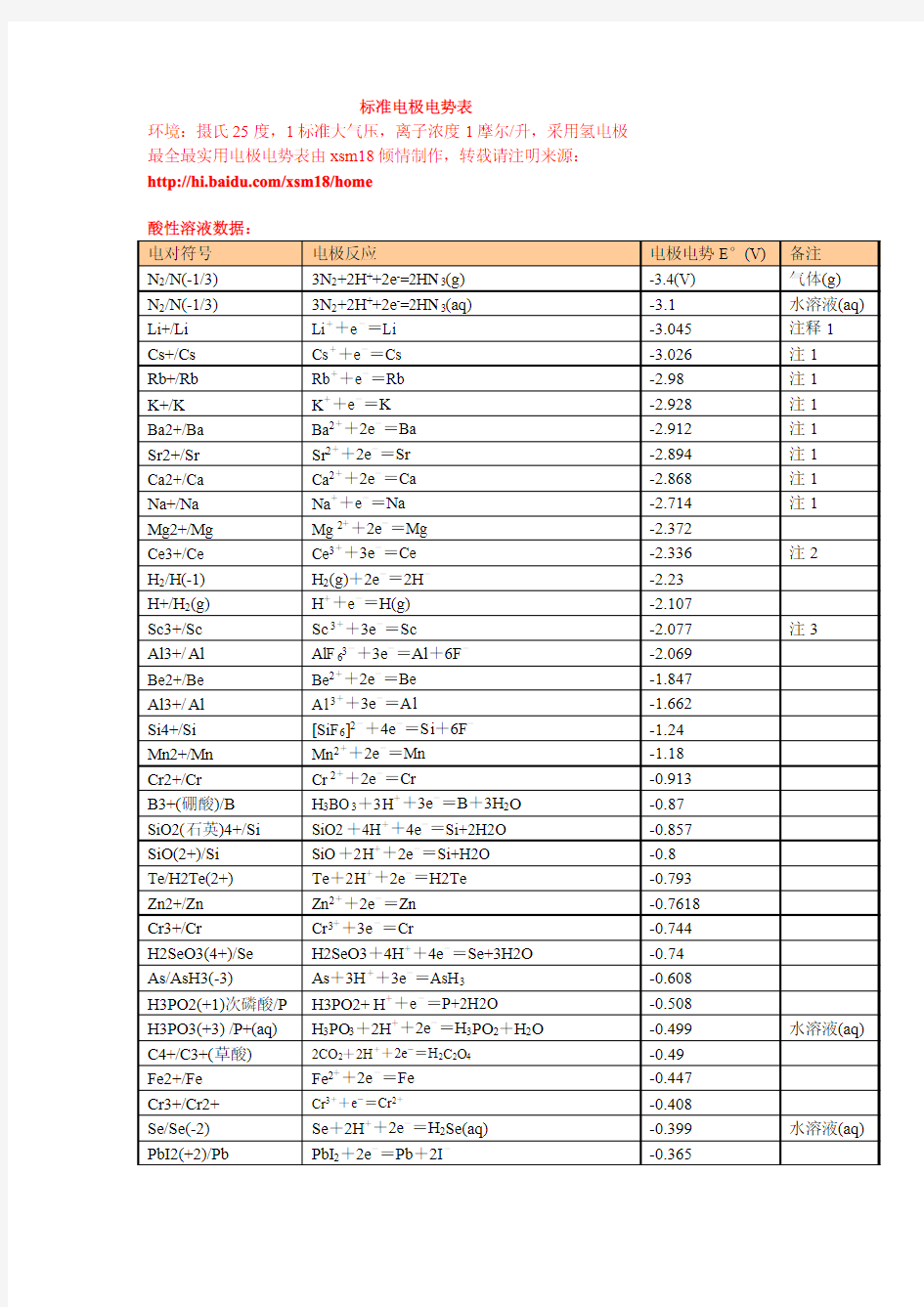

标准电极电势表
环境:摄氏25度,1标准大气压,离子浓度1摩尔/升,采用氢电极最全最实用电极电势表由xsm18倾情制作,转载请注明来源:https://www.wendangku.net/doc/7c16048974.html,/xsm18/home
PbSO4(+2)/Pb PbSO4+2e-=Pb+SO42--0.3588
PbBr2(+2)/Pb PbBr2+2e-=Pb+2Br--0.284
Co2+/Co Co2++2e-=Co-0.28
H3PO4/H3PO3H3PO4+2H++2e-=H3PO3+H2O-0.276
PbCl2(+2)/Pb PbI2+2e-=Pb+2I--0.2675
Ni2+/Ni Ni2++2e-=Ni-0.257
CO2/HCOOH(甲酸)CO2(g)+2H++2e-=HCOOH(aq)-0.199
CuI(+1)/Cu CuI+e-=Cu+I-0.1852
AgI(+1)/Ag AgI+e-=Ag+I-0.15224
Sn2+/Sn Sn2++2e-=Sn-0.1375
Pb2+/Pb Pb2++2e-=Pb-0.1262
C4+/C2+CO2(g)+2H++2e-=CO+H2O-0.12
P/PH3P(白磷)+3H++3e-=PH3(g)-0.063气体(g)
Hg2I2(+1)/Hg Hg2I2+2e-=2Hg+2I--0.0405
Fe3+/Fe Fe3++3e-=Fe-0.037
Ag2S(+1)/Ag Ag2S+2H++2e-=2Ag+H2S-0.0366
H+/H22H++2e-=H20.00
CuBr(+1)/Cu CuBr+e-=Cu+Br-0.033
AgBr(+1)/Ag AgBr+e-=Ag+Br-0.07133
Si/SiH4Si+4H++4e-=SiH40.102
C(石墨)/CH4C+4H++4e-=CH40.1316
CuCl(+1)/Cu CuCl+e-=Cu+Cl-0.137
Hg2Br2(+1)/Hg Hg2Br2+2e-=2Hg+2Br-0.13923
S/H2S(aq)S+2H++2e-=H2S(aq)0.142水溶液
Sn4+/Sn2+Sn4++2e-=Sn2+0.151
Cu2+/Cu+Cu2++e-=Cu+0.153
S6+/S4+SO42-+4H++2e-=H2SO3+H2O0.172
AgCl(+1)/Ag AgCl+e-=Ag+Cl-0.2223
As3+/As(亚砷酸)HAsO2(aq)+3H++3e-=As+2H2O0.2476HAsO2.H2O Hg2Cl2/Hg Hg2Cl2+2e-=2Hg+2Cl-0.268
Bi3+/Bi Bi3++3e-=Bi0.308
Cu2+/Cu Cu2++2e-=Cu0.337
AgIO3/Ag AgIO3+e-=Ag+IO3-0.354
S6+/S SO42-+8H++6e-=S+4H2O0.3572
Ag2CrO4/Ag Ag2CrO4+2e-=2Ag+CrO42-0.447铬酸银
S4+/S H2SO3+4H++4e-=S+3H2O0.449
Ag2C2O4/Ag Ag2C2O4+2e-=2Ag+C2O42-0.4647草酸银
Cu+/Cu Cu++e-=Cu0.521
I2/I-I2+2e-=2I-0.5355
AgBrO3/Ag AgBrO3+e-=Ag+BrO3-0.546
As5+/As3+H3AsO4(aq)+2H++2e-=HAsO2+2H2O0.56水溶液AgNO2/Ag AgNO2+e-=Ag+NO2-0.564
Te4+/Te TeO2+4H++4e-=Te+2H2O0.593
Hg2SO4/Hg Hg2SO4+2e-=2Hg+SO42-0.614
Ag2SO4/Ag Ag2SO4+2e-=2Ag+SO42-0.654
Pt4+(氯铂酸)/Pt2+[PtCl6]2-+2e-=[PtCl4]2-+2Cl-0.68
O2/O-O2+2H++2e-=H2O20.695
Pt2+/Pt(二氯化铂)[PtCl4]2-+2e-=Pt+4Cl-0.73
Se4+/Se H2SeO3+4H++4e-=Se+3H2O0.74
Fe3+/Fe2+Fe3++e-=Fe2+0.771
AgF/Ag AgF+e-=Ag+F-0.779
Hg+/Hg Hg22++2e-=2Hg0.788
Ag+/Ag Ag++e-=Ag0.7991
N5+/N4+(硝酸)2NO3-+4H++2e-=N2O4(g)+2H2O0.803气体(g) Hg2+/Hg Hg2++2e-=Hg(lq)0.853液态(水银) Si4+(石英)/Si SiO2+4H++4e-=Si+2H2O0.857
Hg2+/Hg+2Hg2++2e-=Hg22+0.92
N5+/N3+(亚硝酸)NO3-+3H++2e-=HNO2+H2O0.934
Pd2+/Pd Pd2++2e-=Pd0.951
N5+/N2+NO3-+4H++3e-=NO+2H2O0.957
Au3+/Au(三溴化金)AuBr2-+e-=Au+2Br-0.959
N3+/2+HNO2+H++e-=NO+H2O0.983
Au3+/Au(三氯化金)[AuCl4]-+3e-=Au+4Cl- 1.002
Te6+/Te4+H6TeO6+2H++2e-=TeO2+4H2O 1.02
N4+/N2+N2O4+4H++4e-=2NO+2H2O 1.03
Pt4+/Pt PtO2+4H++4e-=Pt+2H2O 1.045
Br2(lq)/Br-Br2(lq)+2e-=2Br- 1.0652液溴(lq)
N4+/N3+N2O4+2H++2e-=2HNO2 1.07
Br2(aq)/Br-Br2(aq)+2e-=2Br- 1.087水溶液(aq) Se6+/Se4+SeO42-+4H++2e-=H2SeO3+H2O 1.151
Cl5+/Cl4+ClO3-+2H++e-=ClO2+H2O 1.152
O2/H2O(g)O2+4H++4e-=2H2O(g) 1.185水蒸汽(g) Pt2+/Pt Pt2++2e-=Pt 1.188
Cl7+/Cl5+ClO4-+2H++2e-=ClO3-+H2O 1.189
I5+/I22IO3-+12H++10e-=I2(s)+6H2O 1.195碘单质(s) Cl5+/Cl3+ClO3-+3H++2e-=HClO2+H2O 1.21
Mn4+/Mn2+MnO2+4H++2e-=Mn2++2H2O 1.224
O2/H2O(液态水)O2+4H++4e-=2H2O 1.229常温水
S+(S2Cl2)/S S2Cl2+2e-=2S+2Cl- 1.23
Fe3O4/Fe2+Fe3O4+8H++2e-=3Fe2++4H2O 1.23
Tl3+/Tl+T13++2e-=Tl+ 1.25注4
Cl4+/Cl3+ClO2+H++e-=HClO2 1.277
N3+/N+2HNO2(aq)+4H++4e-=N2O(g)+3H2O 1.297
Cr6+/Cr3+Cr2O72-+14H++6e-=2Cr3++7H2O 1.33重铬酸根Br+/Br-HBrO+H++2e-=Br-+H2O 1.331
Cr6+/Cr3+HCrO4-+7H++3e-=Cr3++4H2O 1.35铬酸根
Cl2/Cl-Cl2(g)+2e-=2Cl- 1.358(g)氯气Au2O3(+3)/Au Au2O3+6H++6e-=2Au+3H2O 1.36
Cl7+/Cl-ClO4-+8H++8e-=Cl-+4H2O 1.388
Cl7+/Cl2ClO4-+8H++7e-=1/2Cl2+4H2O 1.392
Au3+/Au+Au3++2e-=Au+ 1.41
Br5+/Br-BrO3-+6H++6e-=Br-+3H2O 1.424
I+/I22HIO+2H++2e-=I2+2H2O 1.439
Cl5+/Cl-ClO3-+6H++6e-=Cl-+3H2O 1.451
Pb4+/Pb2+PbO2+4H++2e-=Pb2++2H2O 1.455
Cl5+/Cl2ClO3-+6H++5e-=1/2Cl2+3H2O 1.47
CrO2(+4)/Cr3+CrO2+4H++e-=Cr3++2H2O 1.48二氧化铬Cl+/Cl-HClO+H++2e-=Cl-+H2O 1.482
Au3+/Au Au3++3e-=Au 1.498
Mn7+/Mn2+MnO4-+8H++5e-=Mn2++4H2O 1.507
Cl4+/Cl-ClO2+4H++5e-=Cl-+2H2O 1.511
Br5+/Br2BrO3-+6H++5e-=l/2Br2+3H2O 1.52
Mn3+/Mn2+Mn3++e-=Mn2+ 1.5415注5
Cl3+/Cl-HClO2+3H++4e-=Cl-+2H2O 1.57
N2+/N+2NO+2H++2e-=N2O+H2O 1.59
Br+/Br2HBrO+H++e-=l/2Br2(aq)+H2O 1.595
I7+/I5+H5IO6+H++2e-=IO3-+3H2O 1.603注6
Cl+/Cl2HClO+H++e-=1/2Cl2+H2O 1.611
Cl3+/Cl2HClO2+3H++2e-=1/2Cl2+2H2O 1.628
Cl3+/Cl+HClO2+2H++2e-=HClO+H2O 1.645
Ni4+/Ni2+NiO2+4H++2e-=Ni2++2H2O 1.678
Mn7+/Mn4+MnO4-+4H++3e-=MnO2+2H2O 1.68注7
Pb4+/Pb2+PbO2+SO42-+4H++2e-=PbSO4+2H2O 1.69
Au+/Au Au++e-=Au 1.691
Ce4+/Ce3+Ce4++e-=Ce3+ 1.74注8
Br7+/Br5+BrO4-+2H++2e-=BrO3-+H2O 1.763注9
N+/N2N2O+2H++2e-=N2+H2O 1.766
O-(H2O2)/O2-(H2O)H2O2+2H++2e-=2H2O 1.776
NiO42-/NiO2NiO42-+4H++2e-=NiO2+2H2O 1.8
Co3+/Co2+Co3++e-=Co2+ 1.808
Co3+/Co2+Co3++e-=Co2+ 1.83稀硫酸中Co3+/Co2+Co3++e-=Co2+ 1.92稀高氯酸Ag2+/Ag+Ag2++e-=Ag+ 1.93稀硝酸Ag2+/Ag+Ag2++e-=Ag+ 1.98稀硫酸Ag2+/Ag+Ag2++e-=Ag+ 2.0稀高氯酸S2O82-/SO42-S2O82-+2e-=2SO42- 2.01
Bi5+/Bi3+BiO3-+2H++2e-=Bi3++H2O 2.03铋酸盐O3/O2-O3+2H++2e-=O2+H2O 2.076
XeO3/Xe XeO3+6H++6e-=Xe+3H2O 2.1
最全最实用电极电势表由xsm18倾情制作,转载请注明来源:
https://www.wendangku.net/doc/7c16048974.html,/xsm18/home
注释1:碱族和从钙开始的碱土元素均和水发生反应,其电极电势数值为理论计算值
注释2:铈元素(Ce)属于镧系元素,有稳定的+3,+4价,+3价有很强的还原性,+4有很强的氧化性,该元素有很好的代表性。
镧系元素都很活泼,活泼程度与镁元素相仿。它们的+3价电极电势数值也和镁2+接近,有的稍强些,有的稍弱些。
注释3:钪(Sc)元素为过渡元素的第一个元素,原子序数为21,和钙相邻,所以列于表上。注释4:铊(Tl)为硼族元素,列上的原因,它是一个强碱,碱性比氢氧化钠还强,弱于氢氧化钾,溶解度也很大,同时它有较强的
氧化性,电极电势为1.25,甚至能将氯离子氧化,这在过渡金属中是罕见的,所以列上。注释5:3+锰的电极电势数值资料不同,数值也不同,有1.488V,还有1.51V
注释6:高碘酸的电极电势,一些书籍包括兰氏化学手册认为是1.60,在国内,如吉林大学,武汉大学编写的大学化学教材中则用1.644的数值,而诸如宋天佑等人编写的,以及山东大学等采用的化学教材上则采用1.70V的数值
注释7:这个也是数值差异,还有1.69,1.70V的数值
注释8:同上,还有1.70,1.72的数值,本表采用的是实验观测数值,来自科学出版社1995年《无机化学丛书.卤素》,1.70的数值见兰氏化学手册
注释9:同上,有两个数值,1.763为传统教科书中观点,1.853为国外一些化学书籍采用数值,如兰氏,还有一些日文化学书籍也采用1.853V的数值
注释10:关于高氙酸的电极电势原来的化学教材认为是3.0,后来的书籍作了改变,有的认为是 2.36±0.2;有的认为是 2.42。在近年的化学竞赛题中多次出现:已知Eφ(H4XeO6/XeO3)=2.6V,φ(Am4+/Am3+)=2.62v,请判断Am4+是否能将XeO3氧化
为高氙酸,并说明理由。出题的是国家教委考试中心的权威人士。所以本表采用2.6V的数值,其他数值要么过低,要么过高。
注释11:二氟化氙的电极电势也有争议,传统认为是2.2V,我根据奈斯特方程计算的结果是2.4左右,数值从2.3到2.5之间浮动。但是国外新版的化学书籍采用了2.64的观点,兰氏化学手册从15版开始也采用此观点,故本表也用了2.64V的数值.
注释12:六氟化铂的电极电势为非标准电极电势,由于它氧化水,不能形成水溶液,所以没有标准电极电势,根据其反应自由能,和其他元素,特别是和氢气,氙,氧气的反应趋势,根据热力学数值,运用奈斯特方程计算,数值约为2.924,强于氟气,此数值为计算值,可能精确程度和以后的权威数值会有误差,但比氟强的趋势是完全正确的,其电势数值,肯定大于2.87
注释13,18,铽元素和镨元素属于镧系元素,存在不稳定的+4价,出现在氧化物和氟化物中,如二氧化铽,二氧化镨,四氟化铽,四氟化镨,有极强的氧化性,实验观测数值3.1±0.2和3.2±0.2,传统教材采用的是低标准,比如有些化学书籍用的数值是,铽2.9,镨,3.0;还有的用铽2.8,镨2.86,均为4+/3+。可以理解为它们有和氟相当或者稍强的氧化性,没有水溶液,只存在固体中。
注释15:三氟化氯的电极电势为非标准电极电势,其反应自由能为66.73千焦/摩尔。根据其和其他元素反应的比较。进行推算,其电极电势数值大于二氟化氙,约为2.8,接近氟。能将氙氧化成二氟化氙,产物为二氟化氙和氟化氯
注释16:由于六氟化氙只能用氟,二氟化二氧和二氟化氪来氧化氙合成,用其他氟化物不能合成,其反应活化能为约34千焦/摩尔,所以其电极电势已和氟相当,约2.86
注释17:由于氟能氧化水,没有水溶液,所以其电极电势也是计算值,约2.866
注释18:镧系元素镨Pr有不稳定的+4价,只存在于和氟,氧组成的化合物中,只有固体,没有水溶液(会将水氧化),Pr4+/Pr3+的氧化性极强,介于氟和氟原子之间。原来的化学书籍中其电极电势为2.86,现在为3.2±0.2,感觉为3.0V比较合适,因为它也不能将氟化氢氧化,其电势应该小于F2/HF的3.057,用纯氧,氟,二氟化氪在特殊条件下可以得到其+4价氧化物,氟化物
注释19:二氟化氪为吸热反应,同时其氪-氟键能很低,零下30度就开始分解,产物为氟和氪,25度明显分解,93度完全分解。所以其反应温度一般都在25度以下。
由于反应过程中瞬间产生Kr-F自由基,KrF+和Kr2F3+。因而有极强的氧化性。Kr-F自由基,KrF+和KR2F3+能将氧气氧化成+1/2价,将五氟化氯氧化成ClF5+
注释20:二氟化二氧零下57度完全分解,产物为氧气和氟。在零下100度以下也有比氟和三氟化氯更猛烈的氧化性,它可以将Pu氧化到+6价,氟需要加热到700度以上,同时需要强紫外线照射反应才能发生。能将氙氧化为+6价,氟需要加热加压才行,能将氯离子氧化成五氟化氯,但其氧化能力稍弱于KrF+和Kr2F3+。这是因为其反应温度过低的缘故;后者在较高温度反应的时候能瞬间存在加强了二氟化氪的氧化性;但在低温下二氟化氪的活性明显弱于二氟化二氧。其电极电势为观测计算值,非标准电极电势。
注释21:氟和氢的反应趋势极高,在黑暗出,低温也会反应。经过实验观察,在零下112度以上氟均能和氢反应,低于该温度反应停止。其电极电势观
测数值接近3.06.为3.057.同时氟-氢键键能高达568千焦/摩尔。目前已知存在的氧化剂均不能将氟化氢中的氟离子氧化;Pr4+/Pr3+也不能。
注释22:OH自由基有极强的氧化性,仅次于氟。电极电势数值有的资料为2.81,还有个别资料为2.71,本表采用传统化学教材数值。
注释23:二氟化氧和水蒸气接触发生爆炸反应,产物为氟化氢和氧气,和氙发生反应,产物为四氟化氙和氧气。根据其反应自由能和热力学数据计算,电极电势为2.962,稍强于六
氟化铂
注释24:HF2氢氟酸,液态氟化氢中存在大量二氟氢离子HF2-氢氟酸发生部分电离,电离产生的氟离子和大量没有电离的氟化氢分子发生缔合,变成二氟氢离子,在浓溶液中,氟化氢分子缔合,主要以H2F2的形式存在。电离产生的是氢离子和二氟氢离子,而不是氟离子H2F2====H++HF2-H2F2依然是一元酸,但已经是强酸了。浓度越大酸性约强,甚至可以和硝酸相当但浓度接近100%酸性又减弱。液态氟化氢的酸性和纯硫
酸相当。
最全最实用电极电势表由xsm18倾情制作,转载请注明来源:
https://www.wendangku.net/doc/7c16048974.html,/xsm18/home
S4+/S SO32-+3H2O+4e-=S+6OH--0.9
Cu2S/Cu Cu2S(g)+2e-=Cu+S2--0.89
P/P3-(磷化氢)P+3H2O+3e-=PH3(g)+3OH--0.88 Fe2+/Fe Fe(OH)2+2e-=Fe+2OH--0.877 N5+/N4+2NO3-+2H2O+2e-=N2O4+4OH--0.85
H+/H22H2O+2e-=H2+2OH--0.828 Co2+/Co Co(OH)2+2e-=Co+2OH--0.73
Ni2+/Ni Ni(OH)2+2e-=Ni+2OH--0.72 As5+/As3+AsO43-+2H2O+2e-=AsO2-+4OH--0.71 Ag2S/Ag Ag2S+2e-=Ag+S2--0.691 HgS/Hg HgS+2e-=Hg+S2--0.69 As3+/As AsO2-+2H2O+3e-=As+4OH--0.68 CoCO3/Co-(碳酸钴)CoCO3+2e-=Co+C O32--0.64 PbO/Pb PbO+H2O+2e-=Pb+2OH--0.581 S4+/S2+(硫代硫酸)2SO32-+3H2O+4e-=S2O32-+6OH--0.576 Te4+/Te TeO32-+3H2O+4e-=Te+6OH-0.57
O2/O2-O2+e-=O2--0.563 Fe3+/Fe2+Fe(OH)3+e-=Fe(OH)2+OH--0.56 Pb2+/Pb(氢氧化铅)HPbO2-+H2O+2e-=Pb+3OH--0.54 PbCO3/Pb PbCO3+2e-=Pb+C O32--0.509 S/S2-S+2e-=S2--0.47627 Bi3+/Bi Bi2O3+3H2O+6e-=2Bi+6OH--0.46
N3+/N2+NO2-+H2O+e-=NO+2OH--0.46 Se4+/Se SeO32-+3H2O+4e-=Se+6OH--0.366 Cu+/Cu Cu2O+H2O+2e-=2Cu+2OH--0.358 Tl+/Tl(氢氧化亚铊)Tl(OH)+e-=Tl+OH--0.343 Cu2+/Cu Cu(OH)2+2e-=Cu+2OH--0.222 O2/H2O2O2+2H2O+2e-=H2O2+2OH--0.146 Cr6+/Cr3+CrO42-+4H2O+3e-=Cr(OH)3+5OH--0.13 Cu2+/Cu2Cu(OH)2+2e-=Cu2O+2OH-+H2O-0.08
Tl3+/Tl+Tl(OH)3+2e-=TlOH+2OH--0.05 Mn4+/Mn2+MnO2+2H2O+2e-=Mn(OH)2+2OH--0.05 AgCN/Ag AgCN+e-=Ag+CN--0.017 N5+/N3+NO3-+H2O+2e-=NO2-+2OH-0.01
Se6+/Se4+SeO42-+H2O+2e-=SeO32-+2OH-0.05
Pd2+/Pd Pd(OH)2+2e-=Pd+2OH-0.07
Hg2+/Hg HgO+H2O+2e-=Hg+2OH-0.0977 Co3+/Co2+(氨配体)[Co(NH3)6]3++e-=[Co(NH3)6]2+0.108
Pt2+/Pt Pt(OH)2+2e-=Pt+2OH-0.14
I5+/I+IO3-+2H2O+4e-=IO-+4OH-0.15
Mn3+/Mn2+Mn(OH)3+e-=Mn(OH)2+OH-0.15
N3+/N+2NO2-+3H2O+4e-=N2O+6OH-0.15
Co3+/Co2+Co(OH)3+e-=Co(OH)2+OH-0.17
注释1:数据来自山东大学出版社《无机化学教程》2001年版,宋其圣等人编写。
注释2:Xe6+/Xe在碱性环境的电极电势,也有两个数值,1.24和0.9,在国内多本大学教材查到的是1.24,少量书籍认为和高氙酸/氙酸数据相同为0.9.根据实验现象可知,Xe6+/Xe 在碱性环境可以被臭氧氧化成高氙酸,故实际氧化能力弱于臭氧,同时其反应速度明显慢于高氙酸,其实际氧化能力应弱于高氙酸,用0.9的数值比较合理。
最全最实用电极电势表由xsm18倾情制作,转载请注明来源:
https://www.wendangku.net/doc/7c16048974.html,/xsm18/home
本表参考书籍:
1.Ravid R.Lide<
2.J.A.Dean Ed,Lange’s Handbook of Chemistry,13th.edition,1985
3.Vanýsek,Petr(2007).“Electrochemical Series”,in Handbook of Chemistry
and Physics:88th Edition(Chemical Rubber Company).
4.Bard, A.J.,Faulkner,L.R.(2001).Electrochemical Methods.Fundamentals and
Applic ations,2nd edition(John Wiley and Sons Inc).
5.《実験の化学指針》,柴田茂雄さんら著
6.Lange’s Handbook of Chemistry,Edition13,15,16.(兰氏化学手册)
7.《无机化学》第三版,第四版,武大,吉大宋天佑等主编
8.《无机化学丛书》科学出版社,1998
9.《无机化学》第五版,大连理工大学2005年
10.《无机化学教程》2001年版,宋其圣等人编写
11.《无机化学》第四版,北京师范大学,南京师范大学,华中师范大学编,高等教育出版社2004年
12.《无机化学》申洋文主编,2002年化学工业出版社。
最全最实用电极电势表由xsm18倾情制作,转载请注明来源:
https://www.wendangku.net/doc/7c16048974.html,/xsm18/home
电位差计的原理和使用
实验八 电位差计的原理和使用 【实验目的】 1.掌握电位差计的工作原理和正确使用方法,加深对补偿法测量原理的理解和运用。 2.训练简单测量电路的设计和测量条件的选择。 【实验仪器】 UJ31型直流电位差计、SS1791双路输出直流稳压电源、标准电池、标准电阻、AC15/5灵敏电流计、FJ31型直流分压箱、滑线变阻器、直流电阻箱、待校验电表、待测干电池、待测电阻、开关和导线等。 【实验原理】 如图5.8.1所示,电位差计的工作原理是根据电 压补偿法,先使标准电池E n 与测量电路中的精密电阻R n 的两端电势差U st 相比较,再使被测电势差(或电压)E x 与准确可变的电势差U x 相比较,通过检流计G 两次指零来获得测量结果。电压补偿原理也可从电势差计的“校准”和“测量”两个步骤中理解。 校准:将K 2打向“标准”位置,检流计和校准电路联接,R n 取一预定值,其大小由标准电池E S 的电动势确定;把K 1合上,调节R P ,使检流计G 指零,即E n = IR n ,此时测量电路的工作电流已调好为 I = E n /R n 。校准工作电流的目的:使测量电路中的R x 流过一个已知的标准电流I o ,以保证R x 电阻盘上的电压示值(刻度值)与其(精密电阻R x 上的)实际电压值相一致。 测量:将K 2打向“未知”位置,检流计和被测电路联接,保持I o 不变(即R P 不变),K 1合上,调节R x ,使检流计G 指零,即有E x = U x = I o R x 。 由此可得x n n x R R E E = 。由于箱式电位差计面板上的测量盘是根据R x 电阻值标出其对应的电压刻度值,因此只要读出R x 电阻盘刻度的电压读数,即为被测电动势E x 的测量值。 所以,电位差计使用时,一定要先“校准”,后“测量”,两者不能倒置。 【实验装置】 1. UJ31型电位差计 UJ31型箱式电位差计是一种测量低电势的电位差计,其测量范围为 mV .V 1171-μ(1K 置1?档)或mV V 17110-μ(1K 置10?档)。使用 图5.8.1 电位差计的工作原理 图5.8.2 UJ31型电位差计面板图 + - -++- + -标准 检流计 5.7-6.4V 未知1 未知2 K 1 R P2 R P3 R P1 R n K 2 I II III 1.01×10 ×1 未知1 未知2 标准断断粗 中 细 ×1 ×0.1 ×0.001 粗细短路
标准电极电势表
标准电极电势表 标准电极电势可以用来计算化学电池或原电池的电化学势或电极电势。本表中所给出的电极电势以标准氢电极为参比电极,溶液中离子有效浓度为1mol/L ,气体分压为100kPa ,温度为298K ,所有离子的数据都在水溶液中测得。[1][2][3][4][5][6][7][8][9]单击每栏上方的符号可将数据按元素符号或标准电极电势值排序。 注:(s ) – 固体;(l ) – 液体;(g ) – 气体;(aq ) – 水溶液;(Hg ) – 汞齐。 半反应 E° (V)[注 1] 来源 Ba + + e ? Ba(s ) ?4.38 [10][1][3] Sr + + e ? Sr(s ) ?4.10 [11][1][3] Ca + + e ? Ca(s ) ?3.8 [11][1][3] Pr 3+ + e ? Pr 2+ ?3.1 [11] ?N 2(g ) + H + + e ? HN 3(aq ) ?3.09 [6] Li + + e ? Li(s ) ?3.0401 [5] N 2(g ) + 4?H 2O + 2?e ? 2?NH 2OH (aq ) + 2?OH ? ?3.04 [6] Cs + + e ? Cs(s ) ?3.026 [5] Ca(OH) 2(s ) + 2?e ? Ca(s ) + 2 OH ? ?3.02 [11] Rb + + e ? Rb(s ) ?2.98 [4] K + + e ? K(s ) ?2.931 [5]
半反应E° (V)[注 1]来源Mg+ + e? Mg(s) ?2.93 [10] Ba2+ + 2?e? Ba(s) ?2.912 [5] ? La(s) + 3OH??2.90 [5] La(OH) Fr+ + e? Fr(s) ?2.9 [11] Sr2+ + 2?e? Sr(s) ?2.899 [5] ? Sr(s) + 2?OH??2.88 [11] Sr(OH) Ca2+ + 2?e? Ca(s) ?2.868 [5] Eu2+ + 2?e? Eu(s) ?2.812 [5] Ra2+ + 2?e? Ra(s) ?2.8 [5] Yb2+ + 2?e? Yb(s) ?2.76 [11][1] Na+ + e? Na(s) ?2.71 [5][9] Sm2+ + 2?e? Sm(s) ?2.68 [11][1] No2+ + 2?e? No(s) ?2.50 [11] ?Hf(s) + 4?OH??2.50 [11] HfO(OH)
标准电极电势表(全)
在酸性溶液中(298K) 电对方程式E/V Li(I)-(0)Li++e-=Li-Cs(I)-(0)Cs++e-=Cs-Rb(I)-(0)Rb++e-=Rb- K(I)-(0)K++e-=K-Ba(II)-(0)Ba2++2e-=Ba-Sr(II)-(0)Sr2++2e-=Sr-Ca(II)-(0)Ca2++2e-=Ca-Na(I)-(0)Na++e-=Na-La(III)-(0)La3++3e-=La-Mg(II)-(0)Mg2++2e-=Mg-Ce(III)-(0)Ce3++3e-=Ce- H(0)-(-I)H2(g)+2e-=2H--Al(III)-(0)AlF63-+3e-=Al+6F--Th(IV)-(0)Th4++4e-=Th-Be(II)-(0)Be2++2e-=Be- U(III)-(0)U3++3e-=U-Hf(IV)-(0)HfO2++2H++4e-=Hf+H2O-Al(III)-(0)Al3++3e-=Al-Ti(II)-(0)Ti2++2e-=Ti-Zr(IV)-(0)ZrO2+4H++4e-=Zr+2H2O-Si(IV)-(0)[SiF6]2-+4e-=Si+6F--Mn(II)-(0)Mn2++2e-=Mn-Cr(II)-(0)Cr2++2e-=Cr-Ti(III)-(II)Ti3++e-=Ti2+- B(III)-(0)H3BO3+3H++3e-=B+3H2O-*Ti(IV)-(0)TiO2+4H++4e-=Ti+2H2O-Te(0)-(-II)Te+2H++2e-=H2Te-Zn(II)-(0)Zn2++2e-=Zn-Ta(V)-(0)Ta2O5+10H++10e-=2Ta+5H2O-Cr(III)-(0)Cr3++3e-=Cr-Nb(V)-(0)Nb2O5+l0H++10e-=2Nb+5H2O-As(0)-(-III)As+3H++3e-=AsH3- U(IV)-(III)U4++e-=U3+-Ga(III)-(0)Ga3++3e-=Ga-
标准电极电势表
标准电极电势表 目录[隐藏] 电极电势的产生—双电层理论 定义 公式 电极电势内容 标准电极电势表 [编辑本段] 电极电势的产生—双电层理论 德国化学家能斯特(H.W.Nernst)提出了双电层理论(electron double lay er theory)解释电极电势的产生的原因。当金属放入溶液中时,一方面金属晶体中处于热运动的金属离子在极性水分子的作用下,离开金属表面进入溶液。金属性质越活泼,这种趋势就越大;另一方面溶液中的金属离子,由于受到金属表面电子的吸引,而在金属表面沉积,溶液中金属离子的浓度越大,这种趋势也越大。在一定浓度的溶液中达到平衡后,在金属和溶液两相界面上形成了一个带相反电荷的双电层(electron double layer),双电层的厚度虽然很小(约为10-8厘米数量级), 但却在金属和溶液之间产生了电势差。通常人们就把产生在金属和盐溶液之间的双电层间的电势差称为金属的电极电势(electrode potential),并以此描述电极得失电子能力的相对强弱。电极电势以符号E Mn+/ M表示, 单位为V(伏)。如锌的电极电势以EZn2+/ Zn 表示, 铜的电极电势以ECu2+/Cu 表示。 电极电势的大小主要取决于电极的本性,并受温度、介质和离子浓度等因素的影响。 [编辑本段] 定义 标准电极电势是可逆电极在标准状态及平衡态时的电势,也就是标准态时的电极电势. 标准电极电势有很大的实用价值,可用来判断氧化剂与还原剂的相对强弱,判断氧化还原反应的进行方向,计算原电池的电动势、反应自由能、平衡常数,计算其他半反应的标准电极电势,等等。将半反应按电极电势由低到高排序,可以得到标准电极电势表,可十分简明地判断氧还反应的方向. [编辑本段] 公式
中科院电化学问答答案
2005年电化学和电分析化学 1、标准电极电位和条件电位 各种标准状态下的被测电极与标准氢电极组成原电池,标准氢电极作为阳极(发生那氧化反应)用实验的方法测得的该电池电动势的数值,就是被测电极的标准电极电位。 对于实际体系,在某一特定条件下,该电对的氧化型的总浓度和还原型的总浓度均为1mol/L时的实际电位,就叫条件电位。 2、双电层 当电极插入溶液中后,在电极和溶液之间便有一个界面。如果导体电荷带正电荷,会对溶液中的负离子产生吸引作用,同时对正离子也有一定的排斥作用。结果在电极附近就会聚集很多负离子,叫做吸附层,在吸附层外一微小区域,由于静电引力的存在,也有电荷过剩现象存在,称为扩散层,这种结构就叫做双电层。3、极限电流和扩散电流 在电化学反应中,电解开始后,随着外加电压的继续增大,电流急剧上升,最后当外加电压增加到一定数值时,电流不再增加,达到一个极限值。此时的电流称为极限电流。极限电流与残余电流之差称为扩散电流。 4、半电池的形式电势 5、交流伏安法 在电路里负载两端并联一电压表,电路里串联电流表,通过电压和电流计算出阻抗,包括电容的容抗和电感的感抗。 二简答题 1、何谓循环伏安法?主要用于研究什么?从可逆性角度简述循环伏安曲线有几 类?具体依据及特点? 循环伏安法是以快速线性扫描的形式施加以三角波电压于工作电极上,得到循环伏安曲线的一种方法。 一般用于研究电极过程的可逆性、吸附性以及测定可逆体系标准电极电位,鉴别电极反应产物和研究化学反应控制的各个电极过程。 从可逆性的角度可有三类循环伏安曲线:(1)可逆过程ΔEp= 2.2RT/nF = 56.5/n mv,一般说来,ΔEp与实验条件有关,其数值在55/n ~65/n mv 时,可判断为
电化学原理思考题答案解析
第三章 1.自发形成的双电层和强制形成的双电层在性质和结构上有无不同为什么2.理想极化电极和不极化电极有什么区别它们在电化学中有什么重要用途答:当电极反应速率为0,电流全部用于改变双电层的电极体系的电极称为理想极化电极,可用于界面结构和性质的研究。理想不极化电极是指当电极反应速率和电子反应速率相等时,极化作用和去极化作用平衡,无极化现象,通向界面的电流全部用于电化学反应,可用作参比电极。 3.什么是电毛细现象为什么电毛细曲线是具有极大值的抛物线形状 答:电毛细现象是指界面张力随电极电位变化的现象。溶液界面存在双电层,剩余电荷无论带正电还是负电,同性电荷间相互排斥,使界面扩大,而界面张力力图使界面缩小,两者作用效果相反,因此带电界面的张力比不带电时小,且电荷密度越大,界面张力越小,因此电毛细曲线是具有极大值的抛物线形状。 4.标准氢电极的表面剩余电荷是否为零用什么办法能确定其表面带电状况答:不一定,标准氢电极电位为0指的是氢标电位,是人为规定的,电极表面剩余电荷密度为0时的电位指的是零电荷电位,其数值并不一定为0;因为形成相间电位差的原因除了离子双电层外,还有吸附双电层\ 偶极子双电层\金属表面电位。可通过零电荷电位判断电极表面带电状况,测定氢标电极的零电荷电位,若小于0则电极带正电,反之带负电。 5.你能根据电毛细曲线的基本规律分析气泡在电极上的附着力与电极电位有什么关系吗为什么有这种关系(提示:液体对电极表面的润湿性越高,气体在电极表面的附着力就越小。)6.为什么在微分电容曲线中,当电极电位绝对值较大时,会出现“平台”7.双电层的电容为什么会随电极电位变化试根据双电层结构的物理模型和数学模型型以解释。 8.双电层的积分电容和微分电容有什么区别和联系9.试述交流电桥法测量微分电容曲线的原理。10.影响双电层结构的主要因素是什么为什么 答:静电作用和热运动。静电作用使符号相反的剩余电荷相互靠近,贴于电极表面排列,热运动使荷电粒子外散,在这两种作用下界面层由紧密层和分散层组成。11.什么叫ψ1电位能否说ψ1电位的大小只取决于电解质总浓度而与电解质本性无关ψ1电位的符号是否总是与双电层总电位的符号一致为什么 答:距离电极表面d处的电位叫ψ1电位。不能,因为不同的紧密层d的大小不同,而紧密层的厚度显然与电解质本性有关,所以不能说ψ1电位的大小只取决于电解质总浓度而与电解质本性无关。当发生超载吸附时ψ1电位的符号与双电层总电位的符号不一致。 12.试述双电层方程式的推导思路。推导的结果说明了什么问题 13.如何通过微分电容曲线和电毛细曲线的分析来判断不同电位下的双电层结构答:14.比较用微分电容法和电毛细曲线法求解电极表面剩余电荷密度的优缺点。15.什么是特性吸附哪些类型的物质具有特性吸附的能力答:溶液中的各种粒子还可能因非静电作用力而发生吸附称为特性吸附。大部分无机阴离子,部分无机阳离子以及表面活性有机分子可发生特性吸附。
等电位
等电位联结:将建筑物内部和建筑物本身的所有的大金属构件全部用母排或导线进行电气连接,使整个建筑物的正常非带电导体处于电气连通状态。等电位联结分为总等电位联结(MEB)、辅助等电位联结(SEB)、局部等电位联结(LEB)。 什么是等电位联结?就是将建筑物内部和建筑物本身的所有的大金属构件全部用母排或导线进行电气连接,使整个建筑物的正常非带电导体处于电气连通状态。 怎样做等电位联结?等电位联结分为:总等电位联结(MEB)和局部等电位联结(LEB) 。国家建筑标准设计图集《等电位联结安装》(02D501-2)对建筑物的等电位联结具体做法作了详细介绍。 总等电位联结做法是通过每一进线配电箱近旁的总等电位联结母排将下列导电部分互相连通:进线配电箱的PE(PEN)母排、公用设施的上、下水、热力、煤气等金属管道、建筑物金属结构和接地引出线。它的作用在于降低建筑物内间接接触电压和不同金属部件间的电位差,并消除自建筑物外经电气线路和各种金属管道引入的危险故障电压的危害。 局部等电位联结做法是在一局部范围内通过局部等电位联结端子板将下列部分用 6mm2黄绿双色塑料铜芯线互相连通:柱内墙面侧钢筋、壁内和楼板中的钢筋网、金属结构件、公用设施的金属管道、用电设备外壳(可不包括地漏、扶手、浴巾架、肥皂盒等孤立小物件)等。一般是在浴室、游泳池、喷水池、医院手术室、农牧场等场所采用。要求等电位联结端子板与等电位联结范围内的金属管道等金属末端之间的电阻不超过3Ω。 等电位联结有什么作用?主要是各种保护作用: 1.雷击保护IEC标准中指出,等电位连接是内部防雷措施的一部分。当雷击建筑物时,雷电传输有梯度,垂直相邻层金属构架节点上的电位差可能达到10kV量级,危险极大。但等电位联结将本层柱内主筋、建筑物的金属构架、金属装置、电气装置、电信装置等连接起来,形成一个等电位连接网络,可防止直击雷、感应雷、或其他形式的雷,避免火灾、爆炸、生命危险和设备损坏。 2.静电防护静电是指分布在电介质表面或体积内,以及在绝缘导体表面处于静止状态的电荷。传送或分离固体绝缘物料、输送或搅拌粉体物料、流动或冲刷绝缘液体、高速喷射蒸汽或气体,都会产生和积累危险的静电。静电电量虽然不大,但电压很高,容易产生火花放电,引起火灾、爆炸或电击。等电位联结可以将静电电荷收集并传送到接地网,从而消除和防止静电危害。 3.电磁干扰防护在供电系统故障或直击雷放电过程中,强大的脉冲电流对周围的导线或金属物形成电磁感应,敏感电子设备处于其中,可以造成数据丢失、系统崩溃等。通常,屏蔽是减少电磁波破坏的基本措施,在机房系统分界面做的等电位连接,由于保证所有屏蔽和设备外壳之间实现良好的电气连接,最大限度减小了电位差,外部电流不能侵入系统,得以有效防护了电磁干扰。 4.触电保护1999年6月开始实行的新的建设部《住宅设计规范》中,有一项不太引人瞩目的条款:城镇新建住宅中的卫生间宜做等电位连接。专家通俗的解释是:浴室等电位连接就是保护你不会在洗澡的时候被电着。电热水器、坐浴盆、电热墙,浴霸以及传统的电灯……都有漏电的危险,电气设备外壳虽然与PE线联结,当仍可能会出现足以引起伤害的
等电位联结安装标准图的编制说明
等电位联结安装标准图的编制说明作者:徐华 摘要作者结合对《等电位联结安装》(97SD567)国标图的修编,谈了对等电位联结的一些新认识,同时对实施过程中出现的问题作简要探讨。 关键词等电位联结接地故障防雷等电位电涌防护器IEC 目前,我国许多新修订的规范、标准逐步同国际电工标准(IEC标准)接轨。等电位联结在电气设计中,是一种行之有效的安全措施,早已为国际上许多国家所采用。我国对等电位联结的作用在认识上也有了长足的进步,1997年编制的《等电位联结安装》提出了一些基本做法,自试用以来收到了施工过程中对许多实际问题的反映,特别是信息技术的迅猛发展,对防雷、接地、等电位有了更高的要求,因此我们参考国际、国内的新标准、新做法对原标准图97SD567作了修编,新的图集号是02D501-2,下面主要对新图册做一些说明 1 等电位联结的分类
笔者在编制97SD567时,曾对"等电位联结"和"等电位连接"分析比较,决定本图册采用"等电位联结"这一名称,但现实工作中,这两个词往往还混淆不清,在此想强调一下,任何标准、规范要想正确的贯彻执行,必须要有规范的名称,具体分析见"浅谈《等电位联结安装》标准图的编制"(《现代建筑电气设计技术文集》第233页。在总说明中,把等电位联结分为三个层次,即总等电位联结,辅助等电位联结,局部等电位联结分别作了详细说明。 总等电位联结作用于全建筑物,由等电位联结端子板放射连接或链接进出建筑物的金属管道、金属结构构件等。辅助等电位联结是在导电部分间,用导线直接连通,使其电位相等或接近,一般是在电气装置的某部分接地故障保护不能满足切断回路的时间要求时,作辅助等电位联结。 局部等电位联结是在一局部场所范围内通过局部等电位联结端子板把各可导电 部分连通,一般是在浴室、游泳池、医院手术室、农牧业等特别危险场所,发生电击事故的危险性较大,要求更低的接触电压,或为满足信息系统抗干扰的要求,一般局部等电位联结也都有一个端子板或者连成环形。简单地说,局部等电位联结可以看成是在这局部范围内的总等电位联结。其区别可借助图集第6页图理解。
最新最全最实用电极电势表
标准电极电势表 环境:摄氏25度,1标准大气压,离子浓度1摩尔/升,采用氢电极最全最实用电极电势表由xsm18倾情制作,转载请注明来源:https://www.wendangku.net/doc/7c16048974.html,/xsm18/home
PbSO4(+2)/Pb PbSO4+2e-=Pb+SO42--0.3588 PbBr2(+2)/Pb PbBr2+2e-=Pb+2Br--0.284 Co2+/Co Co2++2e-=Co-0.28 H3PO4/H3PO3H3PO4+2H++2e-=H3PO3+H2O-0.276 PbCl2(+2)/Pb PbI2+2e-=Pb+2I--0.2675 Ni2+/Ni Ni2++2e-=Ni-0.257 CO2/HCOOH(甲酸)CO2(g)+2H++2e-=HCOOH(aq)-0.199 CuI(+1)/Cu CuI+e-=Cu+I-0.1852 AgI(+1)/Ag AgI+e-=Ag+I-0.15224 Sn2+/Sn Sn2++2e-=Sn-0.1375 Pb2+/Pb Pb2++2e-=Pb-0.1262 C4+/C2+CO2(g)+2H++2e-=CO+H2O-0.12 P/PH3P(白磷)+3H++3e-=PH3(g)-0.063气体(g) Hg2I2(+1)/Hg Hg2I2+2e-=2Hg+2I--0.0405 Fe3+/Fe Fe3++3e-=Fe-0.037 Ag2S(+1)/Ag Ag2S+2H++2e-=2Ag+H2S-0.0366 H+/H22H++2e-=H20.00 CuBr(+1)/Cu CuBr+e-=Cu+Br-0.033 AgBr(+1)/Ag AgBr+e-=Ag+Br-0.07133 Si/SiH4Si+4H++4e-=SiH40.102 C(石墨)/CH4C+4H++4e-=CH40.1316 CuCl(+1)/Cu CuCl+e-=Cu+Cl-0.137 Hg2Br2(+1)/Hg Hg2Br2+2e-=2Hg+2Br-0.13923 S/H2S(aq)S+2H++2e-=H2S(aq)0.142水溶液 Sn4+/Sn2+Sn4++2e-=Sn2+0.151 Cu2+/Cu+Cu2++e-=Cu+0.153 S6+/S4+SO42-+4H++2e-=H2SO3+H2O0.172 AgCl(+1)/Ag AgCl+e-=Ag+Cl-0.2223 As3+/As(亚砷酸)HAsO2(aq)+3H++3e-=As+2H2O0.2476HAsO2.H2O Hg2Cl2/Hg Hg2Cl2+2e-=2Hg+2Cl-0.268 Bi3+/Bi Bi3++3e-=Bi0.308 Cu2+/Cu Cu2++2e-=Cu0.337 AgIO3/Ag AgIO3+e-=Ag+IO3-0.354 S6+/S SO42-+8H++6e-=S+4H2O0.3572 Ag2CrO4/Ag Ag2CrO4+2e-=2Ag+CrO42-0.447铬酸银 S4+/S H2SO3+4H++4e-=S+3H2O0.449 Ag2C2O4/Ag Ag2C2O4+2e-=2Ag+C2O42-0.4647草酸银 Cu+/Cu Cu++e-=Cu0.521 I2/I-I2+2e-=2I-0.5355 AgBrO3/Ag AgBrO3+e-=Ag+BrO3-0.546 As5+/As3+H3AsO4(aq)+2H++2e-=HAsO2+2H2O0.56水溶液AgNO2/Ag AgNO2+e-=Ag+NO2-0.564 Te4+/Te TeO2+4H++4e-=Te+2H2O0.593
(完整版)电化学分析习题答案
电化学分析习题 一、选择题 1.不属于电化学分析法的是C A.电位分析法 B. 极谱分析法 C. 电子能谱法 D. 库仑滴定 2. Ag-AgCl参比电极的电极电位取决于电极内部溶液中的 B A.Ag+活度 B. Cl-活度 C. AgCl活度 D.Ag+和Cl-活度之和 3.正确的饱和甘汞电极半电池组成为B A. Hg/Hg2Cl2(1mol/L)/KCl(饱和) B.Hg/Hg2Cl2(固)/KCl(饱和) C.Hg/Hg2Cl2(固)/KCl(1mol/L) D.Hg/HgCl2(固)/KCl(饱和) 4.pH玻璃电极的膜电位产生是由于测定时,溶液中的 D A.H+离子穿过了玻璃膜 B.电子穿过了玻璃膜 C.Na+与水化玻璃膜上的Na +交换作用 D.H+与水化玻璃膜上的H+交换作用 5.玻璃电极使用前,需要C A.在酸性溶液中浸泡1h B.在碱性溶液中浸泡1h C.在水溶液中浸泡24h D.测量的pH不同,浸泡溶液不同 6.氟离子选择电极对氟离子具有较高的选择性是由于 B A.只有F-能透过晶体膜 B.F-能与晶体膜进行离子交换 C.由于F-体积比较小 D.只有F-能被吸附在晶体膜上 7. 在电位法中离子选择性电极的电位应与待测离子的浓度 D A. 成正比 B. 的对数成正比 C. 符合扩散电流公式的关系 D. 符合能斯特方程式 8. 当金属插入其金属盐溶液时,金属表面和溶液界面会形成双电层,所以产生了电位差。此电位差为B A.液接电位B.电极电位C.电动势D.膜电位 9. 用pH玻璃电极测定pH为13的试液,pH的测定值与实际值的关系为 B A.测定值大于实际值B.测定值小于实际值C.二者相等D.不确定10.直接电位中,加入TISAB的目的是为了 C A.提高溶液酸度 B.恒定指示电极电位 C.固定溶液中离子强度和消除共存离子干扰 D.与待测离子形成配合物 11.测量pH时,需要用标准pH溶液定位,这是为了 D A.避免产生酸差 B.避免产生碱差 C.消除温度的影响 D.消除不对称电位和液接电位的影响 12.玻璃电极不包括 C A.Ag-AgCl内参比电极B.一定浓度的HCl溶液 C.饱和KCl溶液D.玻璃膜 13.电位测定水中F-含量时,加入TISAB溶液,其中NaCl的作用是 B A.控制溶液的pH在一定范围内B.使溶液的离子强度保持一定值
标准电极电势表样本
标准电极电势表 标准电极电势能够用来计算化学电池或原电池的电化学势或电极电势。本表中所给出的电极电势以标准氢电极为参比电极, 溶液中离子有效浓度为1mol/L, 气体分压为100kPa, 温度为298K, 所有离子的数据都在水溶液中测得。[1][2][3][4][5][6][7][8][9]单击每栏上方的符号可将数据按元素符号或标准电极电势值排序。 注: (s) –固体; (l) –液体; (g) –气体; (aq) –水溶液; (Hg) –汞齐。 半反应E°(V)[注 1]来源 Ba++ e?Ba(s) ?4.38 [10][1][3] Sr++ e?Sr(s) ?4.10 [11][1][3] Ca++ e?Ca(s) ?3.8 [11][1][3] Pr3++ e?Pr2+?3.1 [11] ?N2(g) + H++ e?HN3(aq) ?3.09 [6] Li++ e?Li(s) ?3.0401 [5] N2(g) + 4?H2O + 2?e?2?NH2OH(aq) + 2?OH??3.04 [6] Cs++ e?Cs(s) ?3.026 [5]
半反应E°(V)[注 1]来源Ca(OH)2(s) + 2?e?Ca(s) + 2 OH??3.02 [11] Rb++ e?Rb(s) ?2.98 [4] K++ e?K(s) ?2.931 [5] Mg++ e?Mg(s) ?2.93 [10] Ba2++ 2?e?Ba(s) ?2.912 [5] La(OH)3(s) + 3?e?La(s) + 3OH??2.90 [5] Fr++ e?Fr(s) ?2.9 [11] Sr2++ 2?e?Sr(s) ?2.899 [5] Sr(OH)2(s) + 2?e?Sr(s) + 2?OH??2.88 [11] Ca2++ 2?e?Ca(s) ?2.868 [5] Eu2++ 2?e?Eu(s) ?2.812 [5] Ra2++ 2?e?Ra(s) ?2.8 [5] Yb2++ 2?e?Yb(s) ?2.76 [11][1] Na++ e?Na(s) ?2.71 [5][9]
电化学原理思考题答案
电化学原理思考题答案 (注:我只做了老师要求做的) 第三章 1.自发形成的双电层和强制形成的双电层在性质和结构上有无不同?为什么? 2.理想极化电极和不极化电极有什么区别?它们在电化学中有什么重要用途? 答:当电极反应速率为0,电流全部用于改变双电层的电极体系的电极称为理想极化电极,可用于界面结构和性质的研究。理想不极化电极是指当电极反应速率和电子反应速率相等时,极化作用和去极化作用平衡,无极化现象,通向界面的电流全部用于电化学反应,可用作参比电极。 3.什么是电毛细现象?为什么电毛细曲线是具有极大值的抛物线形状? 答:电毛细现象是指界面张力随电极电位变化的现象。溶液界面存在双电层,剩余电荷无论带正电还是负电,同性电荷间相互排斥,使界面扩大,而界面张力力图使界面缩小,两者作用效果相反,因此带电界面的张力比不带电时小,且电荷密度越大,界面张力越小,因此电毛细曲线是具有极大值的抛物线形状。 4.标准氢电极的表面剩余电荷是否为零?用什么办法能确定其表面带电状况? 答:不一定,标准氢电极电位为0指的是氢标电位,是人为规定的,电极表面剩余电荷密度为0时的电位指的是零电荷电位,其数值并不一定为0;因为形成相间电位差的原因除了离子双电层外,还有吸附双电层\偶极子双电层\金属表面电位。可通过零电荷电位判断电极表面带电状况,测定氢标电极的零电荷电位,若小于0则电极带正电,反之带负电。 5.你能根据电毛细曲线的基本规律分析气泡在电极上的附着力与电极电位有什么关系吗?为什么有这种关系?(提示:液体对电极表面的润湿性越高,气体在电极表面的附着力就越小。) 6.为什么在微分电容曲线中,当电极电位绝对值较大时,会出现“平台”? 7.双电层的电容为什么会随电极电位变化?试根据双电层结构的物理模型和数学模型型以解释。 8.双电层的积分电容和微分电容有什么区别和联系? 9.试述交流电桥法测量微分电容曲线的原理。 10.影响双电层结构的主要因素是什么?为什么? 答:静电作用和热运动。静电作用使符号相反的剩余电荷相互靠近,贴于电极表面排列,热运动使荷电粒子外散,在这两种作用下界面层由紧密层和分散层组成。 11.什么叫ψ1 电位?能否说ψ1 电位的大小只取决于电解质总浓度而与电解质本性无关?ψ1 电位的符号是否总是与双电层总电位的符号一致?为什么? 答:距离电极表面d处的电位叫ψ1电位。不能,因为不同的紧密层d的大小不同,而紧密层的厚度显然与电解质本性有关,所以不能说ψ1 电位的大小只取决于电解质总浓度而与电解质本性无关。当发生超载吸附时ψ1 电位的符号与双电层总电位的符号不一致。 12.试述双电层方程式的推导思路。推导的结果说明了什么问题? 13.如何通过微分电容曲线和电毛细曲线的分析来判断不同电位下的双电层结构? 答: 14.比较用微分电容法和电毛细曲线法求解电极表面剩余电荷密度的优缺点。 15.什么是特性吸附?哪些类型的物质具有特性吸附的能力? 答:溶液中的各种粒子还可能因非静电作用力而发生吸附称为特性吸附。大部分无机阴离子,部分无机阳离子以及表面活性有机分子可发生特性吸附。 16.用什么方法可以判断有无特性吸附及估计吸附量的大小?为什么? 17.试根据微分电容曲线和电毛细曲线的变化,说明有机分子的特性吸附有哪些特点?
标准电极电势表
标准电极电势表
标准电极电势表 目录[隐藏] 电极电势的产生—双电层理论 定义 公式 电极电势内容 标准电极电势表 [编辑本段] 电极电势的产生—双电层理论 德国化学家能斯特(H.W.Nernst)提出了双电层理论(electron double layer th eory)解释电极电势的产生的原因。当金属放入溶液中时,一方面金属晶体中处于热运动的金属离子在极性水分子的作用下,离开金属表面进入溶液。金属性质越活泼,这种趋势就越大;另一方面溶液中的金属离子,由于受到金属表面电子的吸引,而在金属表面沉积,溶液中金属离子的浓度越大,这种趋势也越大。在一定浓度的溶液中达到平衡后,在金属和溶液两相界面上形成了一个带相反电荷的双电层(e lectron double layer),双电层的厚度虽然很
小(约为10-8厘米数量级), 但却在金属和溶液之间产生了电势差。通常人们就把产生在金属和盐溶液之间的双电层间的电势差称为金属 的电极电势(electrode potential),并以此描述电极得失电子能力的相对强弱。电极电势以符号E Mn+/ M表示, 单位为V(伏)。如锌的电极电势以EZn2+/ Zn 表示, 铜的电极电势以ECu2+/Cu 表示。 电极电势的大小主要取决于电极的本性,并受温度、介质和离子浓度等因素的影响。[编辑本段] 定义 标准电极电势是可逆电极在标准状态及 平衡态时的电势,也就是标准态时的电极电势. 标准电极电势有很大的实用价值,可用来判断氧化剂与还原剂的相对强弱,判断氧化还原反应的进行方向,计算原电池的电动势、反应自由能、平衡常数,计算其他半反应的标准电极电势,等等。将半反应按电极电势由低到高排序,可以得到标准电极电势表,可十分简明地判断氧还反应的方向. [编辑本段]
(完整版)标准电极电势表(非常全)
标准电极电势 Standard Electrode Potentials 下表中所列的标准电极电势(25.0℃,101.325kPa)是相对于标准氢电极电势的值。标准氢电极电势被规定为零伏特(0.0V)。 序号(No.)电极过程(Electrode process)E?/V 1Ag++e═Ag0.7996 2Ag2++e═Ag+ 1.98 3AgBr+e═Ag+Br-0.0713 4AgBrO3+e═Ag+BrO3-0.546 5AgCl+e═Ag+Cl-0.222 6AgCN+e═Ag+CN--0.017 7Ag2CO3+2e═2Ag+CO32-0.47 8Ag2C2O4+2e═2Ag+C2O42-0.465 9Ag2CrO4+2e═2Ag+CrO42-0.447 10AgF+e═Ag+F-0.779 11Ag4[Fe(CN)6]+4e═4Ag+[Fe(CN)6]4-0.148 12AgI+e═Ag+I--0.152 13AgIO3+e═Ag+IO3-0.354 14Ag2MoO4+2e═2Ag+MoO42-0.457 15[Ag(NH3)2]++e═Ag+2NH30.373 16AgNO2+e═Ag+NO2-0.564 17Ag2O+H2O+2e═2Ag+2OH-0.342 182AgO+H2O+2e═Ag2O+2OH-0.607 19Ag2S+2e═2Ag+S2--0.691 20Ag2S+2H++2e═2Ag+H2S-0.0366 21AgSCN+e═Ag+SCN-0.0895 22Ag2SeO4+2e═2Ag+SeO42-0.363 23Ag2SO4+2e═2Ag+SO42-0.654 24Ag2WO4+2e═2Ag+WO42-0.466 25Al3+3e═Al-1.662 26AlF63-+3e═Al+6F--2.069 27Al(OH)3+3e═Al+3OH--2.31 28AlO2-+2H2O+3e═Al+4OH--2.35 29Am3++3e═Am-2.048 30Am4++e═Am3+ 2.6 31AmO22++4H++3e═Am3++2H2O 1.75 32As+3H++3e═AsH3-0.608 33As+3H2O+3e═AsH3+3OH--1.37 34As2O3+6H++6e═2As+3H2O0.234 35HAsO2+3H++3e═As+2H-2O0.248 36AsO2-+2H2O+3e═As+4OH--0.68 37H3-AsO4+2H++2e═HAsO2+2H2O0.56 38AsO43-+2H2O+2e═AsO2-+4OH--0.71 39AsS2-+3e═As+2S2--0.75 40AsS43-+2e═ AsS2-+2S2--0.6 41Au++e═Au 1.692 42Au3++3e═Au 1.498
电化学原理简答题
第三章电极/溶液界面的结构与性质 1.为什么电毛细曲线是具有极大值的抛物线形状? 溶液界面存在双电层,剩余电荷无论带正电还是负电,同性电荷间相互排斥,使界面扩大,而界面张力力图使界面缩小,两者作用效果相反,因此带电界面的张力比不带电时小,且电荷密度越大,界面张力越小,因此电毛细曲线是具有极大值的抛物线形状。 2.标准氢电极的表面剩余电荷是否为零? 不一定,标准氢电极电位为0指的是氢标电位,是人为规定的,电极表面剩余电荷密度为0时的电位指的是零电荷电位,其数值并不一定为0;因为形成相间电位差的原因除了离子双电层外, 还有吸附双电层\偶极子双电层\金属表面电位。 3.影响双电层结构的主要因素是什么?为什么? 静电作用和热运动。静电作用使符号相反的剩余电荷相互靠近,贴于电极表面排列,热运动使荷电粒子外散,在这两种作用下界面层由紧密层和分散层组成。 4.什么叫Ψ1电位?能否说Ψ1电位的大小只取决于电解质总浓度而与电解质本性无关?Ψ1电位的符号是否总是与双电层总电位的符号一致?为什么? 距离电极表面d处的电位叫Ψ1电位。不能,因为不同的紧密层d的大小不同,而紧密层的厚度显然与电解质本性有关,所以不能说Ψ1电位的大小只取决于电解质总浓度而与电解质本性无关。当发生超载吸附时Ψ1电位的符号与双电层总电位的符号不一致。 5.简要概括电极/溶液界面发展的四个阶段、优缺点及其主要内容。 ①亥姆赫兹紧密双电层模型: 主要内容:将双电层比作是平行板电容器 优点:a能够解释界面张力随电极电位变化 b能够解释微分电容曲线上所出现的平台区域 缺点:a解释不了界面电容随电极电位和溶液总浓度的变化规律 b解释不了在稀溶液中,零电荷电位下微分电容最小等实验事实 ②Gouy和Chapman分散层模型: 主要内容:溶液中的离子在静电作用和热运动作用下,按位能场中粒子的波尔兹曼分配律分布,完全忽略紧密层,只考虑分散层。 优点:a能较好解释微分电容最小值的出现 b能较好解释电容随电极电位的变化规律 缺点:a理论计算微分电容值与实验事实相差太大 b解释不了微分电容曲线上的“平台区”的出现 ③Stern模型(双电层静电模型): 主要内容:双电层由紧密层和分散层两部分组成。 优点:a说明了微分电容随电极电位绝对值和溶液总浓度增大而增加的原因 b从理论上估算表征分散层特征的某些重要参数
标准电极电势表(全)
1 在酸性溶液中 (298K) 电对方程式E /V Li(I)-(0) Li++e-=Li -3.0401 Cs(I)-(0) Cs++e-=Cs -3.026 Rb(I)-(0) Rb++e-=Rb -2.98 K(I)-(0) K++e-=K -2.931 Ba(II)-(0) Ba2++2e-=Ba -2.912 Sr(II)-(0) Sr2++2e-=Sr -2.89 Ca(II)-(0) Ca2++2e-=Ca -2.868 Na(I)-(0) Na++e-=Na -2.71 La(III)-(0) La3++3e-=La -2.379 Mg(II)-(0) Mg2++2e-=Mg -2.372 Ce(III)-(0) Ce3++3e-=Ce -2.336 H(0)-(-I) H 2 (g)+2e-=2H--2.23 Al(III)-(0) AlF 6 3-+3e-=Al+6F--2.069 Th(IV)-(0) Th4++4e-=Th -1.899 Be(II)-(0) Be2++2e-=Be -1.847 U(III)-(0) U3++3e-=U -1.798 Hf(IV)-(0) HfO2++2H++4e-=Hf+H 2 O -1.724 Al(III)-(0) Al3++3e-=Al -1.662 Ti(II)-(0) Ti2++2e-=Ti -1.630 Zr(IV)-(0) ZrO 2+4H++4e-=Zr+2H 2 O -1.553 Si(IV)-(0) [SiF 6 ]2-+4e-=Si+6F--1.24 Mn(II)-(0) Mn2++2e-=Mn -1.185 Cr(II)-(0) Cr2++2e-=Cr -0.913 Ti(III)-(II) Ti3++e-=Ti2+-0.9 B(III)-(0) H 3BO 3 +3H++3e-=B+3H 2 O -0.8698 *Ti(IV)-(0) TiO 2+4H++4e-=Ti+2H 2 O -0.86 Te(0)-(-II) Te+2H++2e-=H 2 Te -0.793 Zn(II)-(0) Zn2++2e-=Zn -0.7618 Ta(V)-(0) Ta 2O 5 +10H++10e-=2Ta+5H 2 O -0.750 Cr(III)-(0) Cr3++3e-=Cr -0.744 Nb(V)-(0) Nb 2O 5 +l0H++10e-=2Nb+5H 2 O -0.644 As(0)-(-III) As+3H++3e-=AsH 3 -0.608 U(IV)-(III) U4++e-=U3+-0.607 Ga(III)-(0) Ga3++3e-=Ga -0.549
