离子浓度大小强化练习(晚测)

22周晚测溶液中离子浓度大小强化练习(70满分)
1.在Na2S溶液中存在的下列关系不正确的是()
A.c(Na+)=2c(S2-)+2c(HS-)+2c(H2S)
B.c(Na+)+c(H+)=2c(OH-)+c(HS-)+c(S2-)
C.c(OH-)=c(H+)+c(HS-)+2c(H2S)
D.c(Na+)>c(S2-)>c(OH-)>c(HS-)2.实验测得常温下0.1mol/L某一元酸(HA)溶液的pH值等于1,0.1mol/L某一元碱(BOH)溶液里c(H+)/c(OH-)=10-12。将此两种溶液等体积混合后,所得溶液的各离子的浓度由大到小排列的顺序不正确是()
A.c(B+)>c(A-)>c(OH-)>c(H+) B.c(A-)>c(B+)>c(H+)>c(OH-)
C.c(B+)=c(A-)>c(H+)=c(OH-) D.c(B+)>c(A-)>c(H+)>c(OH-)
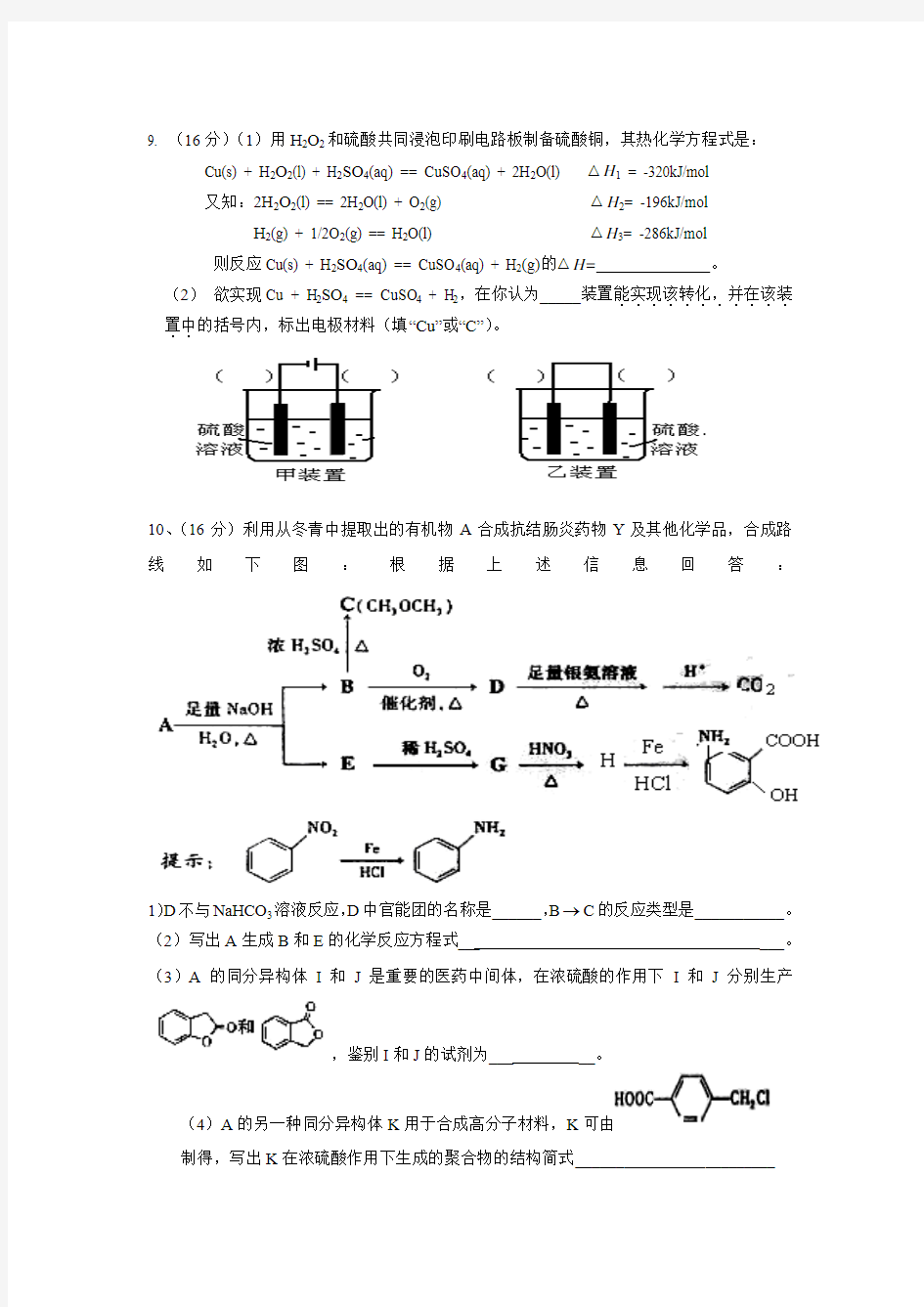
3.设氨水的pH=x,某盐酸的pH=y,已知x+y=14,且x>11。将上述两溶液分别取等体积充分混合后,所得溶液中各离子浓度由大到小的顺序是()
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(NH4+)>c(Cl-)>c(H+)>c(OH-)
C.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
4、下列溶液中各微粒的浓度关系不.正确的是()
A.0.1mol·L-1HCOOH溶液中:c(HCOO-)+c(OH-)==c(H+)
B.1L0.lmol/LCuSO4·(NH4)2SO4·6H2O的溶液中:c(SO42-)>c(NH4+))>c(Cu2+)>c(H+)>c(OH-) C.0.1 mol·L-1NaHCO3溶液中:c(Na+)+c(H+)+ =c(HCO3-)+2c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合:c(Na+)>c(HX)>c(X-)>c(H+)>(OH-) 5.在常温下10mL pH=10的KOH溶液中,加人pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后体积不变),则对反应后溶液的叙述正确的是()
A c(A-)<(K+)
B c(H+)=c(OH-) C V总≥20mL D V总≤20mL 6.已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图,向100 mL该条件下的CaSO4饱和溶液中,加入400mL 0.01 mol/L的Na2SO4溶液,下列叙述正确的是() 沉淀,最终溶液中c(SO2-4)较原来大 A.溶液中析出CaSO B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO2-4)都变小 C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO2-4)都变小 D.溶液中无沉淀析出,但最终溶液中c(SO2-4)较原来大 7 (双选)将相同物质的量浓度的某弱酸HX溶液与NaX溶液等 体积混合,测得混合后溶液中c(Na+)>c(X-),则下列关系错误的是()。 A.c(H+)>c(OH-) B.c(HX)<c(X-) C.c(X-)+c(HX)=2 c(Na+) D.c(HX)+c(H+)=c(Na+)+c(OH-) 8.(双选)0.1mol/LKHSO4和0.1mol/LNa2S溶液等体积混合后,溶液能使pH试纸变蓝,则离子浓度关系正确的是() A c(SO42-)>c(HS-)>c(OH-)>c(H+) B c(Na+)>c(K+)>c(H+)>c(OH-) C c(Na+)=c(S2-)+c(H2S)+c(HS-)+c(SO42-) D c(Na+)+c(K+)+c(H+)=c(SO42-)+c(S2-)+c(HS-)+c(OH-) 9. (16分)(1)用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜,其热化学方程式是: Cu(s) + H2O2(l) + H2SO4(aq) == CuSO4(aq) + 2H2O(l) △H1 = -320kJ/mol 又知:2H2O2(l) == 2H2O(l) + O2(g) △H2= -196kJ/mol H2(g) + 1/2O2(g) == H2O(l) △H3= -286kJ/mol 则反应Cu(s) + H2SO4(aq) == CuSO4(aq) + H2(g)的△H=。 (2)欲实现Cu + H2SO4 == CuSO4 + H2,在你认为_____装置能实现 ....装. ..,并在该 ...该.转化 置中 ..的括号内,标出电极材料(填“Cu”或“C”)。 10、(16分)利用从冬青中提取出的有机物A合成抗结肠炎药物Y及其他化学品,合成路线如下图:根据上述信息回答: 1)D不与NaHCO3溶液反应,D中官能团的名称是______,B C的反应类型是___________。(2)写出A生成B和E的化学反应方程式___ ___。(3)A的同分异构体I和J是重要的医药中间体,在浓硫酸的作用下I和J分别生产 ,鉴别I和J的试剂为_____。 (4)A的另一种同分异构体K用于合成高分子材料,K可由 制得,写出K在浓硫酸作用下生成的聚合物的结构简式_______________ 选择共36分1.B 2 D . 3 C 4.D 5D. 6 A. 7 AB 8AC 9. +64 kJ/mol(4分)(2)乙 10(16分)(1)醛基(3分,写结构简式不得分)取代反应(3分,不写“反应” 二字不得分)(2) FeCl或溴水(3分,任意一种物质均可得3分) (3) 3 溶液中离子浓度大小的比较自测题答案70满分 选择共36分1.B 2 D . 3 C 4.D 5D. 6 A. 7 AB 8AC 9. +64 kJ/mol(4分)(2)乙 10(16分)(1)醛基(3分,写结构简式不得分)取代反应(3分,不写“反应”二字不得分)(2) FeCl或溴水(3分,任意一种物质均可得3分) (3) 3 溶液中离子浓度大小的比较自测题答案70满分 选择共36分1.B 2 D . 3 C 4.D 5D. 6 A. 7 AB 8AC 9. +64 kJ/mol(4分)(2)乙 10(16分) (1)醛基(3分,写结构简式不得分)取代反应(3分,不写“反应”二字不得分)(2) FeCl或溴水(3分,任意一种物质均可得3分) (3) 3 溶液中离子浓度大小的比较自测题答案70满分 选择共36分1.B 2 D . 3 C 4.D 5D. 6 A. 7 AB 8AC 9. +64 kJ/mol(4分)(2)乙 10(16分)(1)醛基(3分,写结构简式不得分)取代反应(3分,不写“反应”二字不得分)(2) FeCl或溴水(3分,任意一种物质均可得3分) (3) 3 选择共36分1.B 2 D . 3 C 4.D 5D. 6 A. 7 AB 8AC 9. +64 kJ/mol(4分)(2)乙 10(16分)(1)醛基(3分,写结构简式不得分)取代反应(3分,不写“反应” 二字不得分)(2) FeCl或溴水(3分,任意一种物质均可得3分) (3) 3 溶液中离子浓度大小的比较自测题答案70满分 选择共36分1.B 2 D . 3 C 4.D 5D. 6 A. 7 AB 8AC 9. +64 kJ/mol(4分)(2)乙 10(16分)(1)醛基(3分,写结构简式不得分)取代反应(3分,不写“反应”二字不得分)(2) FeCl或溴水(3分,任意一种物质均可得3分) (3) 3 溶液中离子浓度大小的比较自测题答案70满分 选择共36分1.B 2 D . 3 C 4.D 5D. 6 A. 7 AB 8AC 9. +64 kJ/mol(4分)(2)乙 10(16分) (1)醛基(3分,写结构简式不得分)取代反应(3分,不写“反应”二字不得分)(2) FeCl或溴水(3分,任意一种物质均可得3分) (3) 3 溶液中离子浓度大小的比较自测题答案70满分 选择共36分1.B 2 D . 3 C 4.D 5D. 6 A. 7 AB 8AC 9. +64 kJ/mol(4分)(2)乙 10(16分)(1)醛基(3分,写结构简式不得分)取代反应(3分,不写“反应”二字不得分)(2) FeCl或溴水(3分,任意一种物质均可得3分) (3) 3 选择共36分1.B 2 D . 3 C 4.D 5D. 6 A. 7 AB 8AC 9. +64 kJ/mol(4分)(2)乙 10(16分)(1)醛基(3分,写结构简式不得分)取代反应(3分,不写“反应” 二字不得分)(2) FeCl或溴水(3分,任意一种物质均可得3分) (3) 3 溶液中离子浓度大小的比较自测题答案70满分 选择共36分1.B 2 D . 3 C 4.D 5D. 6 A. 7 AB 8AC 9. +64 kJ/mol(4分)(2)乙 10(16分)(1)醛基(3分,写结构简式不得分)取代反应(3分,不写“反应”二字不得分)(2) FeCl或溴水(3分,任意一种物质均可得3分) (3) 3 溶液中离子浓度大小的比较自测题答案70满分 选择共36分1.B 2 D . 3 C 4.D 5D. 6 A. 7 AB 8AC 9. +64 kJ/mol(4分)(2)乙 10(16分) (1)醛基(3分,写结构简式不得分)取代反应(3分,不写“反应”二字不得分)(2) FeCl或溴水(3分,任意一种物质均可得3分) (3) 3 溶液中离子浓度大小的比较自测题答案70满分 选择共36分1.B 2 D . 3 C 4.D 5D. 6 A. 7 AB 8AC 9. +64 kJ/mol(4分)(2)乙 10(16分)(1)醛基(3分,写结构简式不得分)取代反应(3分,不写“反应”二字不得分)(2) FeCl或溴水(3分,任意一种物质均可得3分) (3) 3 CPU:AMD双核 硬盘:500G 显卡:七彩虹NV512M 内存:2G 显示器:非利普19寸LCD液晶 主板:微星(什么型号忘了,能支持就行)光驱:DVD 键盘光标随便 电源:400瓦的就行 14分)碳酸钠与工农业生产、日常生活紧密相关.工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题: 方案一:沉淀分析法 (1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀________(填操作)、洗 涤、烘干、称量.洗涤沉淀的操作是______________________________________ ________________________________________________________________________. 方案二:气体分析法 (2)把一定量的样品与足量盐酸反应后,用如图装置测定产生CO2气体的体积,为了测 定结果准确,B中的溶液最好采用________,但选用该溶液后实验结果仍然不够准确,其原因是_______________________________________________________. [来源:学|科|网] 方案三:质量差分析法 (3)把一定质量的样品和足量的稀硫酸反应,采用如图所示装置,通过称量反应前后盛 有碱石灰的干燥管质量,利用其质量差求算样品的纯度. 该实验的操作步骤有:①在干燥管内填满碱石灰,质量为m g②取n g样品装入广口瓶中③检验装置的气密性 ④缓慢鼓入空气数分钟,再称量干燥管质量为w g⑤关闭止水夹⑥打开止水夹⑦ 缓慢加入稀硫酸至不再产生气体为止⑧缓慢鼓入空气数分钟 Ⅰ.正确的操作顺序是(填写序号): ③→________→⑥→________→⑤→________→⑦→________→④ Ⅱ.若去掉装置A,测定结果________;若去掉装置B,测定结果________(填“偏大”、“偏小”或“无影响”). 答案:(1)过滤沿玻璃棒缓慢地向过滤器中的沉淀上加蒸馏水至浸没过沉淀物,使水自然流下,重复2~3次 (2)饱和NaHCO3溶液CO2气体中混有的HCl气体与NaHCO3溶液作用生成CO2 (3)Ⅰ.②⑧①⑥Ⅱ.偏大偏大 有机晚测练习 7、煤、石油、天然气是重要的能源和化工原料,下列说法正确的是() A.石油裂解得到的汽油是纯净物B.石油产品都可用于聚合反应 C.水煤气是通过煤的液化得到的气态燃料D.天然气是清洁燃料 8、下列关于有机物的说法中,正确的一组是() ①淀粉、油脂、蛋白质在一定条件下都能发生水解反应②“乙醇汽油”是在汽油中加入适量乙醇而成的一种燃料,它是一种新型化合物③除去乙酸乙酯中残留的乙酸,加过量饱和碳酸钠溶液振荡后,静置分液④石油的分馏和煤的气化都是化学变化⑤淀粉遇碘酒变蓝色,葡萄糖能与新制Cu(OH)2发生反应⑥塑料、橡胶和纤维素都是合成高分子材料A.①③⑤B.②④⑥C.①②⑤D.③④⑥ 9、可用于鉴别以下三种化合物的一组试剂是() 乙酰水杨酸丁香酚肉桂酸 ①银氨溶液②溴的四氯化碳溶液③氯化铁溶液④氢氧化钠溶液 A.③与④B.②与③C.①与④D.①与② 10、某有机物的结构简式为: CH2CHO CH2COOH HO CH2OH,它在一定条件下可能发生的反应有 ()①加成反应②水解反应③酯化反应④氧化反应⑤中和反应⑥消去反应⑦还原反应⑧聚合反应 A.②③④⑦⑧B.①③⑤⑥⑦C.①③④⑤⑦⑧D.②③④⑤⑥⑧ 11、一次性使用的聚苯乙烯(CH CH 2 n )材料易造成“白色污染”,其替代物聚乳酸 ()是由乳酸( CH COOH OH CH3 )聚合而成的,聚乳酸可在乳酸菌 的作用下降解。下列说法中正确的是() A.聚苯乙烯的单体为CH2CH3 B.聚苯乙烯与聚乳酸的聚合方式相似 C.聚苯乙烯和聚乳酸均为纯净物D.乳酸可发生消去反应12、下列化合物的核磁共振氢谱中出现三组峰的是:() A.2,2,3,3一四甲基丁烷B.2,5一二甲基己烷 C.3,4一二甲基己烷D.2,3,4一三甲基戊烷 22、下列有关除去杂质的的操作中,不正确的是( ) A. 乙醇(乙酸) 加生石灰,蒸馏 B. 苯(苯酚) 加浓溴水,过滤。 C. 溴乙烷(乙醇) 加蒸馏水,分液 D. 乙酸乙酯(乙醇) 加乙酸、浓硫酸,加热 23、PPA 是一种常用的抗感冒药,但该药品能引起血压升高,甚至 中风、肾功能衰竭等危险。因此,我国已发布了停用含PPA 感 冒药的通知。已知PPA 由四种元素构成,且这四种元素均位于 元素周期表的前两周期,其比例模型如图所示。下列有关PPA 的说法中正确的是( ) A .PPA 的分子式为C 9H 13NO B .PPA 既能与盐酸反应,又能与氢氧化钠溶液反应 C .PPA 能发生取代、加成、氧化和消去反应 D .PPA 分子中所有碳原子一定在同一平面上 30、(16分)有机物A 的结构简式是 , 它可以通过不同的反应得到下列物 质: B . C . D . (1)A 的分子式为 ,A 中含氧官能团的名称是: 。 (2)写出由A 制取B 的化学方程式: 。 (3)写出A 制取C 、D 两种物质的、反应类型:A→C : A→D : (4)写出两种既可以看做酯类又可以看做酚类,且分子中苯环上连有三种取代基的A 的同 分异构体的结构简式是 、 (要求这两种同分异构体中苯环上 的取代基至至少有一种不同)。 31、(16分)已知A 物质是石油化工的重要产物,也是衡量一个国家石化工业的标志,根据 图示回答下列问题: (1)写出A 、E 、G 的结构简式:A ,E ,G ; (2)反应②的化学方程式(包括反应条件)是 , 反应④化学方程式(包括反应条件) 是 ; (3)写出①、⑤的反应类型:① 、⑤ 。 33、(16分)请根据下列反应图示中各有机化合物的关系(无机物均已略去未写),回答问题: (1)写出下列有机物的结构简式; A:,D:,F: (2)写出下列反应的反应类型:A→B:;D→E:。 (3)写出下列反应的化学方程式: A→C:; E→G:。 30(16分)、(1)C9H10O3(2分)羟基、羧基(2分,写结构简式不得分) Δ (2)+H2O(4分,反应条件2分,不写水不得分) (3)消去反应取代反应(各2分,共4分,不写“反应”二字不得分) (4) ((共4分,各2分,取代基位置不作限 制,合理即可) 31、(16分) (1)A:CH2=CH2E:G:HOOC(CH2)4COOH(各2分,共6分)(2)(共6分,每个方程式3分,反应物、生成物有错误不得分,反应条件各1分)(3)加成反应缩聚反应(各2分,共4分,不写“反应”二字不得分) 高二化学溶液中离子浓度大小比较专题(用) 一、相关知识点梳理: 1、电解质的电离 强电解质在水溶液中是完全电离的,在溶液中不存在电解质分子。弱电解质在水溶液中 是少部分发生电离的。多元弱酸如H 2CO 3 还要考虑分步电离: H 2CO 3 H++HCO 3 -;HCO 3 -H++CO 3 2-。 2、水的电离 水是一种极弱的电解质,它能微弱地电离, H 2 O H++OH-。水电离出的[H+]=[OH-] 在一定温度下,纯水中[H+]与[OH-]的乘积是一个常数:水的离子积Kw=[H+]·[OH-],在25℃时,Kw=1×10-14。 在纯水中加入酸或碱,抑制了水的电离,使水的电离度变小,在纯水中加入弱酸强碱盐、弱碱强酸盐,促进了水的电离,使水的电离度变大。 3、盐类水解 在溶液中盐的离子跟水所电离出的H+或OH-生成弱电解质的反应,叫做盐类的水解。关于盐的水解有这么一个顺口溜“谁弱谁水解,谁强显谁性” 多元弱酸盐还要考虑分步水解,如CO 32-+H 2 O HCO 3 -+OH-、HCO 3 -+H 2 O H 2 CO 3 +OH-。 4、电解质溶液中的守恒关系 电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等。 如Na 2CO 3 溶液中:[Na+]+[H+]=[HCO 3 -]+2[CO 3 2-]+[OH-] 物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等,但离子或分子中某种特定元素的原子的总数是不会改变的。 如Na 2CO 3 溶液中n(Na+):n(c)=2:1,推出: c(Na+)=2c(HCO 3 -)+2c(CO 3 2-)+2c(H 2 CO 3 ) 水的电离守恒(也称质子守恒):是指在强碱弱酸盐或强酸弱碱盐溶液中,由水所电离的H+与OH-量相等。 如在0.1mol·L-1的Na 2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H 2 S)。 质子守恒:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。例如在NH 4 HCO溶液中H O+、H CO为得到质子后的产物;NH、OH-、CO2-为失去质子后的产物,故有以下关系: c(H 3O+)+c(H 2 CO 3 )=c(NH 3 )+c(OH-)+c(CO 3 2-)。 列守恒关系式要注意以下三点: ①要善于通过离子发生的变化,找出溶液中所有离子和分子,不能遗漏。 ②电荷守恒要注意离子浓度前面的系数;物料守恒要弄清发生变化的元素各离子的浓 度与未发生变化的元素之间的关系;质子守恒要找出所有能得失质子的微粒,不能遗漏。 ③某些关系式既不是电荷守恒也不是物料守恒通常是两种守恒关系式通过某种变式 而得。 解题指导 电解质溶液中离子浓度大小比较问题,是高考的“热点”之一。多年以来全国高考化 离子浓度大小比较练习 鲁迅中学城南校区王芳 1.下列溶液中微粒的物质的量浓度关系一定正确的是()。 A.25 ℃时pH=10的NaOH溶液与pH=10的氨水中:c(Na+)>c(NH+4) B.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) C.在NaHA溶液中(H2A为弱酸):c(Na+)>c(HA-)>c(OH-)>c(H+) D.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO2-4)>c(NH+4)>c(OH-)=c(H+) 2.在25 ℃下,取0.2 mol·L-1 HX溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是 A.混合溶液中由水电离出的c(OH-)小于0.2 mol·L-1HX溶液中由水电离出的c(H+) B.c(Na+)=c(X-)+c(HX)=0.2 mol·L-1 C.c(Na+)-c(X-)=9.9×10-7mol·L-1 D.c(OH-)=c(HX)+c(H+)=1×10-8mol·L-1 3.下列有关电解质溶液中微粒的物质的量浓度关系正确的是 A.0.1 mol·L-1某二元弱酸的酸式盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) B.25 ℃,pH=12的氨水和pH=2的盐酸等体积混合:c(Cl-)>c(NH+4)>c(H+)>c(OH -) C.将pH=5的醋酸溶液稀释后,恢复至原温度,pH和K W均增大 D.向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO2-4)>c(NH+4)>c(H+)>c(OH-) 4.下列浓度关系正确的是()。 A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)] B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) 高中化学离子浓度大小比较练习题 一、单选题 -7 -11 -1 1.25 C° 时,H2CO3 ,的K al =4. 2 10-7,K a2=5. 6 10-11。室温下向10 mL0. 1 mol L-1 Na2CO3 中逐滴加入0. 1 mol L-1HCl 。图是溶液中含 C 微粒物质的量分数随pH 降低而变化的图像( CO2 因有逸出未画出)。下列说法错误的是( ) A. A 点溶液的pH<11 B. B 点溶液:c Na+=c HCO3-+c CO32-+c H2CO3 2- + C. A →B 的过程中,离子反应方程式为:CO23-H+HCO 3 D. 分步加入酚酞和甲基橙,用中和滴定法可测定 Na2CO 3 ,与NaHCO 3 ,混合物组成 - 1 -1 2.实验测得0.5mol L·- 1CH 3COONa 溶液、0.5mol L·-1 CuSO4 溶液以及H2O 的pH 随温度变化的曲线如图所示。下列说法正确的是( ) +- A. 随温度升高,纯水中c(H+)>c(OH - ) c R( COOH ) c(RCOOH)+c(RCOO -) CH 3CH 2COOH)溶液中 δRCOOH 与 pH 的关系如图所示。下列说法正确的是 ( ) A. 图中 M 、N 两点对应溶液中的 c(OH )比较:前者 >后者 B. 丙酸的电离常数 K= 10 4.88 C. 等浓度的 HCOONa 和CH 3CH 2 COONa 两种榕液的 pH 比较:前者 > 后者 D. 将 0. 1 mol/L 的 HCOOH 溶液与 0. 1 mol/L 的 HCOO-Na 溶 液 等 体 积 混 合 , 所 得 溶 液 中 : c Na >c H COOH >c H - COOH - >cc HO + 4. 常温下 ,Ksp(CaF 2)=4×10-9,Ksp (CaSO 4)=9.1×10-6。取一定量的 CaF 2固体溶于水 ,溶液中离子浓度 的 变化与时间的变化关系如图所示。下列有关说法正确 ( ) A. M 点表示 CaF 2 的不饱和溶液 B. 常温下 ,CaF 2的饱和溶液中 ,c(F -) = 10-3 mol/L C. 温度不变, t 时刻改变的条件可能是向溶液中加 了 KF 固体, CaF 2的 K sp 增大 D. 常温下 ,向 100 mL CaF 2的饱和溶液中加入 100 mL 0.2 mol/L Na 2SO 4溶液,平衡后溶液中的 c(Ca 2+) 约为 9. 1× 10-5 mol/L 5. 常温下将 NaOH 溶液滴加到己二酸( H 2X )溶液中,混合溶液的 pH 与离子浓度变化的关系如图 所 示。下列叙述错误的是( ) B. 随温度升 高, CH 3COONa 溶液的 c(OH )减小 C. 随温度升高, CuSO 4 溶液的 pH 变化是 K w 改变与水解平衡移动共同作用的结果 D. 随温度升高, 动方向不 CH 3COONa 溶液和 CuSO 4 溶液的 pH 均降低,是因为 CH 3COO - 、 Cu 2+水解平衡 移 3.25 C °时,改变 0. 1 mol/L 弱酸 RCOOH 溶液的 pH ,溶液中 RCOOH 分 子 的 物 质 的 量 分 数 δRCOOH 随 之 改 变 [ 已 知 δ(RCOOH )= ] ,甲酸 (HCOOH) 与丙酸 高二化学盐溶液中离子浓度大小比较练习题 一、单选题 1.下列说法正确的是( ) A.常温下,pH=3的HX(一元酸)溶液与pH=11的YOH(一元碱)溶液等体积混合,所得溶液的pH一定等于7 B.在相同温度下,浓度均为0.1mol·L-1的(NH4)2Fe(SO4)2和(NH4)2SO4溶液中,c(NH4+)相同 C.在pH<7的CH3COOH和CH3COONa的混合液中,c(Na+)>c(CH3COO-)>c(H+)>c(OH-) D.将CH3COOH和NaOH混合后,离子浓度有可能为c(CH3COO-)>c(Na+)>c(H+)>c(OH-) 2.今有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份溶液进行如下实验: (1)第一份加入AgNO3溶液有沉淀产生 (2)第二份加足量NaOH溶液加热后,收集到无色刺激性气味气体 (3)第三份加足量BaCl2溶液后,得白色沉淀,经足量盐酸洗涤后,沉淀部分溶解。 根据上述实验,以下推测正确的是( ) A.K+一定存在 B.CO32-一定存在 C.Cl-一定存在 D.Ba2+一定不存在,Mg2+可能存在 3.水的电离平衡曲线如图所示,下列说法正确的是( ) A.图中五点K W间的关系:B=C=A=D=E B.若从A点到D点,可采用:温度不变在水中加入少量的酸 C.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体 D.若处在B点时,将pH=2的硫酸与pH=10的KOH溶液等体积混合,溶液显酸性 4.下列叙述正确的是( ) A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 D.向0.1 mol/L的氨水中加入少量硫酸铵固体,溶液PH值增大 5.已知0.1mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中 c(H+)/c(CH3COOH)值增大,可以采取的措施是( ) A.加少量烧碱溶液 B.降低温度 C.加少量冰醋酸 D.加水 6.已知①氢硫酸是具有较强还原性的二元弱酸,②CuSO4+H2S=CuS↓+H2SO4。在氢硫酸溶液中,通入或加入少量的下列物质:①O2;②Cl2;③SO2;④CuSO4。能使溶液中的c(H+)增大的是( ) A.①② B.②④ C.②③④ D.① 溶液中离子浓度大小的比较 1.溶液中离子浓度大小比较的规律 (1)多元弱酸溶液,根据多步电离分析。如H3PO4的溶液中,c(H+)>c(H2PO4-)>c(HPO42-) > c(PO43-)。多元弱酸的正盐溶液根据弱酸根的分步水解分析:如Na CO3溶液中,c(Na+)>c(CO32-)>c(OH-)> 2 c(HCO3-)。 (2)不同溶液中同一离子浓度的比较,则要注意分析溶液中其他离子对其的影响。如在①NH4Cl ②CH3COONH4③NH4HSO4溶液中,c(NH4+)浓度的大小为③>①>②。 (3)如果题目中指明溶质只有一种物质(该溶质经常是可水解的盐),要首先考虑原有阳离子和阴离子的个数,水解程度如何,水解后溶液显酸性还是显碱性。 (4)如果题目中指明是两种物质,则要考虑两种物质能否发生化学反应,有无剩余,剩余物质是强电解质还是弱电解质;若恰好反应,则按照“溶质是一种物质”进行处理;若是混合溶液,应注意分析其电离、水解的相对强弱,进行综合分析。 (5)若题中全部使用的是“>”或“<”,应主要考虑电解质的强弱、水解的难易、各粒子个数的原有情况和变化情况(增多了还是减少了)。 (6)对于HA 和NaA的混合溶液(多元弱酸的酸式盐:NaHA),在比较盐或酸的水解、电离对溶液酸、碱性的影响时,由于溶液中的Na+保持不变,若水解大于电离,则有c(HA) > c(Na+)>c(A-) ,显碱性;若电离大于水解,则有c(A-) > c(Na+)> c(HA),显酸性。若电离、水解完全相同(或不水解、不电离),则c(HA) =c(Na+)=c(A-),但无论是水解部分还是电离部分,都只能占c(HA)或c(A-)的百分之几到百分之零点几,因此,由它们的酸或盐电离和水解所产生的c(H+) 或c(OH-)都很小。 【例1】把0.2 mol·L-1的偏铝酸钠溶液和0.4 mol·L-1的盐酸溶液等体积混合,混合溶液中离子浓度由大到小的顺序正确的是 A.c(Cl-)>c(Al3+)>c(Na+)>c(H+)>c(OH-)B.c(Cl-)>c(Al3+)>c(Na+)> c(OH-)> c(H+) C.c(Cl-)> c(Na+) > c(Al3+) > c(H+) > c(OH-) D.c(Na+)> c(Cl-)> c(Al3+) > c(OH-) > c(H+) 【解析】偏铝酸钠与盐酸混合后,发生反应:NaAlO2+HCl+H2O ===NaCl+Al(OH)3,显然,盐酸过量,过量的盐酸与Al(OH)3进一步反应:Al(OH)3+3HCl=== AlCl3+ 3H2O,故反应后,溶液为AlCl3与NaCl的混合溶液,Cl-浓度最大,反应前后不变,故仍然最大,有部分Al存在于没有溶解的Al(OH)3沉淀中,若Al全部进入溶液中与Na+浓度相同,故c(Na+) > c(Al3+),由于AlCl3水解溶液呈酸性,故c(H+) > c(OH-),故正确答案为C。 【答案】C。 【例2】某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离: H2A H++HA-HA-H++A2- 已知相同浓度时的H2A的电离比HA-电离容易,设有下列四种溶液: A.0.01 mol·L-1的H2A溶液 B.0.01 mol·L-1的NaHA溶液 C.0.02 mol·L-1的HCl与0.04 mol·L-1NaHA溶液等体积混合液 D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液。据此,填写下列空白(填代号): (1)c(H+)最大的是_______,最小的是______。 (2)c(H2A)最大的是______,最小的是______。 (3)c(A2-)最大的是_______,最小的是______。 (1)A D(2)A D(3)D A 【例3】把0.02 mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液以等体积混合,若c(H+)>c(OH —),则混合液中粒子浓度关系正确的是( ) A.c(CH3COO-)>c(Na+) B.c(CH3COOH)>c(CH3COO-) 溶液中离子浓度大小比较专题(用) 相关知识点: 1、电解质的电离 电解质溶解于水或受热熔化时,离解成能自由移动的离子的过程叫做电离。 强电解质如NaCl、HCl、NaOH等在水溶液中是完全电离的,在溶液中不存在电解质分子。弱电解质在水溶液中是少部分发生电离的。25℃0.1mol/L的如CH3COOH溶液中,CH3COOH的电离度只有1.32%,溶液中存在较大量的H2O和CH3COOH分子,少量的H+、CH3COO-和极少量的OH-离子。多元弱酸如H2CO3还要考虑分步电离: H2CO3H++HCO3-;HCO3-H++CO32-。 2、水的电离 水是一种极弱的电解质,它能微弱地电离,生成H3O+和OH-,H2O H++OH-。在25℃(常温)时,纯水中[H+]=[OH-]=1×10-7mol/L。 在一定温度下,[H+]与[OH-]的乘积是一个常数:水的离子积Kw=[H+]·[OH-],在25℃时,Kw=1×10-14。 在纯水中加入酸或碱,抑制了水的电离,使水的电离度变小,水电离出的[H+]水和[OH-]水均小于10-7mol/L。在纯水中加入弱酸强碱盐、弱碱强酸盐,促进了水的电离,使水的电离度变大,水电离出的[H+]水或[OH-]均大于10-7mol/L。 3、盐类水解 在溶液中盐的离子跟水所电离出的H+或OH-生成弱电解质的反应,叫做盐类的水解。 强酸弱碱盐如NH4Cl、Al2(SO4)3等水解后溶液呈酸性;强碱弱酸盐如CH3COONa、Na2CO3等水解后溶液呈碱性。多元弱酸盐还要考虑分步水解,如CO32-+H2O HCO3-+OH-、HCO3-+H2O H2CO3+OH-。 4、电解质溶液中的守恒关系 电荷守恒:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数 相等。 如NaHCO3溶液中:n(Na+)+n(H+)=n(HCO3-)+2n(CO32-)+n(OH-)推出:[Na+]+[H+]=[HCO3-]+2[CO32-]+[OH-] 如Na2CO3溶液中:c(Na+) +c(H+)=2c(CO32-)+c(OH-)+c(HCO3-) 物料守恒:电解质溶液中由于电离或水解因素,离子会发生变化变成其它离子或分子等, 但离子或分子中某种特定元素的原子的总数是不会改变的。 如NaHCO3溶液中n(Na+):n(c)=1:1,推出:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) =c(HAc)+c(Ac-); 如HAc 溶液中:c(HAc) 总 水的电离守恒(也称质子守恒):是指在强碱弱酸盐或强酸弱碱盐溶液中,由水所电离的H+与OH-量相等。 如在0.1mol·L-1的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S)。 质子守恒:电解质溶液中分子或离子得到或失去质子(H+)的物质的量应相等。例如在NH4HCO3溶液中H3O+、H2CO3为得到质子后的产物;NH3、OH-、CO32-为失去质子后的 盐溶液中离子浓度大小的比较一、基本知识在盐溶液中存在平衡:水的电离平衡、盐的水解、弱电解质的电离平衡。 (H+)与c(OH-)的关系: 中性溶液:c(H+)=c(OH-)(如NaCl溶液) 酸性溶液:c(H+)>c(OH-)(如NH4Cl溶液) 碱性溶液:c(H+)<c(OH-)(如Na2CO3溶液) 恒温时:c(H+)·c(OH-)=定值(常温时为10-14) 2.电荷守恒:盐溶液中阴、阳离子所带的电荷总数相等。 如NH4Cl溶液中:c(NH4+)+c(H+)=c(Cl-)+c(OH-) 如Na2CO3溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) 3.物料守恒:某元素各种不同存在形态的微粒,物质的量总和不变。 如 mol/L NH4Cl溶液中:c(NH4+)+c(NH3·H2O)= mol/L 如 mol/L Na2CO3溶液中:c(CO32-)+c(HCO3-)+c(H2CO3)= mol/L 4.质子守恒:溶液中水电离出的H+与OH-相等 如Na2CO3溶液中:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) 二、解题方法和步骤 1.判断水解、电离哪个为主。 (1)盐离子不水解不电离:强酸强碱盐,如NaCl、Na2SO4等。 (2)盐离子只水解不电离:强酸弱碱或弱酸强碱形成的正盐,如NH4Cl、Na2CO3等。 (3)盐离子既水解又电离:多元弱酸形成的酸式盐, 以水解为主的有NaHCO3、NaHS、Na2HPO4等; 以电离为主的有NaHSO3和NaH2PO4等。 (4)根据题意判断: 如某温度下NaHB强电解质溶液中: 当c(H+)>c(OH-)时:以HB-的电离为主; 当c(H+)<c(OH-)时,以HB-的水解为主。 对于弱酸HX与强碱盐(NaX式)的混合溶液中: 溶液中的守恒规律及离子浓度大小的比较(两课时) 学习目标: 1、复习巩固弱电解质的电离和盐的水解的规律 2、学会书写电荷守恒,物料守恒,质子守恒的关系式 3、掌握单一溶液和混合溶液中离子浓度大小的比较规律 一、溶液中的守恒规律 1.电荷守恒:电解质溶液中所有阳离子所带有的正电荷总数与所有的阴离子所带的负电荷总数相等。如:CH3COONa溶液中,n(Na+)+n(H+)=n(Ac-)+n(OH-) 推导出: c(Na+)+c(H+)=c(Ac-)+c(OH-) 一般用物质的量浓度表示等式关系 Na2CO3溶液,电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) 练习写出下列溶液的电荷守恒关系式 NH4Cl NaHCO3 (NH4)2SO4 【注意】书写电荷守恒式必须①准确的判断溶液中离子的种类;②弄清离子浓度和电荷的关系。【应用练习】: ①25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的PH=7时,下列关系正确的是 A.c(NH4+)=c(SO42-) B.c(NH4+)>c(SO42-) C.c(NH4+) 但离子或分子中某种特定元素的原子的总数是不会改变的。如Na2CO3溶液中n(Na+):n(c)=2:1,推出:c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3) CH3COONa溶液中物料守恒 c(Na+)=c(CH3COO-)+c(CH3COOH) 练习写出下列溶液的物料守恒关系式 NH4Cl NaHCO3 (NH4)2SO4 3.质子守恒: 如碳酸钠溶液中由电荷守恒和物料守恒两式联立,将Na+离子消掉可得: c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)。此关系式也可以按下列方法进行分析,由于指定溶液中氢原子的物质的量为定值,所以无论溶液中结合氢离子还是失去氢离子,但氢原子总数始终为定值,也就是说结合的氢离子的量和失去氢离子的量相等。可以用图示分析如下: 由得失氢离子守恒可得:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)。 练习:写出下列溶液的质子守恒关系式 NH4Cl NaHCO3 (NH4)2SO4 达标练习: 写出下列溶液的三大守恒关系式 Na2S 电荷守恒 物料守恒 质子守恒 二、溶液中离子浓度大小的比较规律 (1)不同物质同种离子浓度比较型 离子浓度大小比较专题 一、电离理论和水解理论 1.电离理论: ⑴弱电解质的电离是微弱的,电离消耗的电解质及产生的微粒都是少量的,同时注意考虑水的 电离的存在;例如 NH3·H2O 溶液中微粒浓度大小关系。b5E2RGbCAP 【分析】 由于在 NH3· H2O 溶液中存在下列电离平衡: NH3· H2O NH4++OH-, H2O 溶液中离子浓度大小比较总结归类(超全) 一、电离平衡理论和水解平衡理论 1.电离理论:⑴弱电解质的电离是微弱的,电离消耗的电解质及产生的微粒都是少量的,同时注意考虑水的电离的存在;例如NH3·H2O溶液中微粒浓度大小关系。 【分析】由于在NH3·H2O溶液中存在下列电离平衡:NH3·H2O NH4++OH-,H2O H++OH-,所以溶液中微粒浓度关系为:c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)。 ⑵多元弱酸的电离是分步的,主要以第一步电离为主;例如H2S溶液中微粒浓度大小关系。 【分析】由于H2S溶液中存在下列平衡:H2S HS-+H+,HS-S2-+H+,H2O H++OH-,所以溶液中微粒浓度关系为:c(H2S)>c(H+)>c(HS-)>c(OH-)。 2.水解理论: ⑴弱酸的阴离子和弱碱的阳离子因水解而损耗;如NaHCO3溶液中有:c(Na+)>c(HCO3-)。 ⑵弱酸的阴离子和弱碱的阳离子的水解是微量的(双水解除外),因此水解生成的弱电解质及产生H+的(或OH-)也是微量,但由于水的电离平衡和盐类水解平衡的存在,所以水解后的酸性溶液中c(H+)(或碱性溶液中的c(OH-))总是大于水解产生的弱电解质的浓度;例如(NH4)2SO4溶液中微粒浓度关系。【分析】因溶液中存在下列关系:(NH4)2SO4=2NH4++SO42-, 2H2O2OH-+2H+, 2NH3·H2O,由于水电离产生的c(H+)水=c(OH-)水,而水电离产生的一部分OH-与NH4+结合产生NH3·H2O,另一部分OH-仍存在于溶液中,所以溶液中微粒浓度关系为:c(NH4+)>c(SO42-)>c(H+)>c(NH3·H2O)>c(OH-)。 ⑶一般来说“谁弱谁水解,谁强显谁性”,如水解呈酸性的溶液中c(H+)>c(OH-),水解呈碱性的溶液中c(OH-)>c(H+); ⑷多元弱酸的酸根离子的水解是分步进行的,主要以第一步水解为主。例如Na2CO3溶液中微粒浓度关系。 【分析】因碳酸钠溶液水解平衡为:CO32-+H2O HCO3- +OH-,H2O+HCO3-H2CO3+OH-,所以溶液中部分微粒浓度的关系为:c(CO32-)>c(HCO3-)。 二、电荷守恒和物料守恒 仅供学习与交流,如有侵权请联系网站删除谢谢2 图像类离子浓度大小比较 一、选择题 1.常温下,向等体积、等物质的量浓度的盐酸、醋酸溶液中分别滴入LNaOH溶液,测得溶液的pH与NaOH溶液体积的关系如图所示。下列说法错误的是 A.图中曲线①表示NaOH溶液滴定盐酸时的pH变化 B.酸溶液的体积均为10 mL C.a点:c(CH3COOH)>c(CH3COO-) D.a点:c(H+)+c(Na+)=c(OH-)+c(CH3COO-) 2.室温下,将1.000mol/L盐酸滴入20.00mL1.000mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是 A.a点由水电离出的c(H+)=1.0×10-14mol/L B.b点时c(NH4+)+c(NH3·H2O)=c(Cl-) C.c点时消耗的盐酸体积:V(HCl)<20.00mL D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 3.用·L-1的NaOH溶液滴定·L-1的H2C2O4(草酸)溶液的滴定曲线如图所示。下列说法不正确的是() A.草酸是弱酸 B.X点:c(H2C2O4)+c(HC2O4-)=c(Na+)-c(C2O42-) C.Y点:c(H2C2O4)+c(HC2O4-)=c(OH-)-c(H+) D.滴定过程中始终存在:c(OH-)+2c(C2O42-)+ c(HC2O4-)= c(Na+)+ c(H+) 4.常温下,相同pH的氢氧化钠和醋酸钠溶液分别加水稀释,平衡时pH随溶液体积变化的曲线如下图所示,则下列叙述正确的是 A.b、c两点溶液的导电能力相同 B.a、b、c三点溶液中水的电离程度a>c>b C.c点溶液中c(H+)=c(OH-)+c(CH3COOH) D.用等浓度的盐酸分别与等体积的b,c处溶液恰好完全反应,消耗盐酸体积V b=V c 5.常温下,向20 mL某浓度的盐酸中逐滴加入 mol/L的氨水,溶液pH的变化与加入氨水的体积关系如图所示。下列叙述正确的是 A.盐酸的物质的量浓度为l mol/L B.在①、②之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-) C.在点②所示溶液中:c(NH4+)=c(Cl-)>c(OH-)=c(H+),且V<20 D.在点③所示溶液中:由水电离出的c(OH-)>l0-7mol/L 6.亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆等漂白。亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。经测定,25℃时各组分含量随pH变化情况如图所示(Cl -没有画出)。则下列分析不正确的是() A.亚氯酸钠在碱性条件下较稳定 B.25℃时,HClO2的电离平衡常数的数值K a=10-6 C.使用该漂白剂的最佳pH为3 D.25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合,混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-) 7.常温下,用?L-1HCl溶液滴定浓度为?L-1Na2CO3溶液,所得滴定曲线如图所示。下列微粒浓度大小关系正确的是 第六讲:《离子浓度大小比较》 一、解题思路 大小关系:盐溶液中的离子 > 水解平衡或电离平衡产生的离子 1.无反应:电荷守恒 三等式:原子守恒 质子守恒 2.有反应:先反应后比较 二、分类比较 (一)无反应的溶液中离子浓度大小比较 1.CH3COONa 溶液 2.Na2CO3溶液 3.NaHCO3溶液 4.H2SO3溶液 5.浓度相同的下列溶液中NH4+浓度最大的是 A. NH4Cl B. NH4HSO4 C. CH3COONH4 D. (NH4)2 SO4 (二)与反应有关的溶液中离子浓度大小比较 6.0.1mol/L HAC与0.1mol/L NaOH溶液等体积混合,混合后溶液中离子浓度关系: 7.0.2mol/L HAC与0.1mol/L NaOH溶液等体积混合,混合后溶液中离子浓度关系:8.0.2mol/L NaAC与0.1mol/L HCl溶液等体积混合,混合后溶液中离子浓度关系:9.pH=3的HAC与pH=11的NaOH溶液等体积混合,混合后溶液中离子浓度关系: 10.向10mL0.1mol/L HAC中加入0.1mol/L的NaOH 使溶液呈中性,混合后溶液中离子浓度关系如何? 加入NaOH溶液的体积 10mL(填大于,小于或等于) 11.向150mL1 mol/L的NaOH溶液中通入标准状况下2.24L 的CO2 ,充分反应后溶液中离子 浓度关系如何? 12.某溶液中含有Na +、 AC -、 H +、OH - 四种离子,溶液中溶质可能是什么?对应溶液的酸碱 性如何? 三、同步练习 1.下列溶液,阴离子总浓度最小的是 A. 0.2 mol / L NaCl B. 0.1 mol / L Mg(OH)2 C. 0.2 mol / L K 2S D. 0.2 mol / L (NH 4)2SO 4 2.硫化钠水溶液中存在着多种离子和分子,下列关系式正确的是 A. c (OH -)=c (HS -)+c (H +)+c (H 2S ) B. c (OH -)=c (HS -)+c (H +)+2 c (H 2S ) C. c (Na +)=c (S 2-)+c (HS -)+c (H 2S ) D. c (Na +)=2 c (S 2-)+2 c (HS -)+2 c (H 2S ) 3.将0.1mol ·L -1的醋酸钠溶液20mL 与0.1mol ·L -1盐酸10mL 混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是 A .c (CH 3COO -)>c (Cl -)>c (CH 3COOH )>c (H +) B .c (CH 3COO -)>c (Cl -)>c (H +)> c (CH 3COOH ) C .c (CH 3 COO -)= c (Cl -)>c (H +)> c (CH 3COOH ) D .c (Na +)+c (H +)= c (CH 3COO -)+ c (Cl -)+c (OH -) 4.将相同物质的量浓度的某弱酸HX 与NaX 溶液等体积混合,测得混合溶液中C (Na +)> C(X -),则下列关系错误的是 A .C (OH -) 高考总复习离子浓度的大小比较 【高考展望】 电解质溶液中离子浓度大小比较问题,是高考的“热点”之一。多年以来全国高考化学试卷年年涉及这种题型,受到高考命题者的青睐。这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、水的电离、pH值、离子反应、盐类水解等基本概念的掌握程度及对这些知识的综合运用能力。 【方法点拨】 解答此类题时必须有正确的思路,首先确定平衡溶液中的溶质,是单一溶质,还是含多个溶质;然后从宏观和微观上进行分析。宏观上掌握解题的三个思维基点即抓住三大守恒:电荷守恒、物料守恒、质子守恒,并能做出相应的变形。微观上抓住电离平衡、水解平衡,分清主次。总的来说就是要先整体,后局部;先宏观,后微观;先定性,后定量。 【知识升华】 一、电解质溶液中的守恒关系 1.电荷守恒: ⑴电荷守恒的含义:电解质溶液中所有阳离子所带有的正电荷数与所有的阴离子所带的负电荷数相等. ⑵电荷守恒式的书写: 如Na2CO3溶液中由于存在下列电离和水解关系: Na2CO3=2Na++CO32-, H2O H++OH-, CO32-+H2O HCO3-+OH-, H2O+HCO3-H2CO3+OH-, 所以溶液中所有的阳离子有Na+、H+,阴离子有CO32-、HCO3-、OH-,根据电荷守恒有:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)。 又如CH3COONa溶液中由于存在下列电离和水解关系: CH3COONa=CH3COO-+Na+, CH3COO-+H2O CH3COOH+OH-, H2O H++OH-, 所以溶液中所有的阳离子为Na+、H+,所有的阴离子为CH3COO-、OH-,因此电荷守恒式为: c(Na+)+c(H+)=c(CH3COO-)+c(OH-)。 【注意】书写电荷守恒式必须做到:①准确的判断溶液中离子的种类;②弄清离子浓度和电荷浓度的关系。 2.物料守恒: ⑴含义:指某微粒的原始浓度等于它在溶液中各种存在形式的微粒浓度之和。 ⑵物料守恒式的书写: 如:Na2CO3溶液中由于存在下列电离和水解关系: Na2CO3=2Na++CO32-, 离子浓度大小的比较 1?关于小苏打水溶液的表述不正确的是 ( ) A 、C ( Na +)=C(HCO 3-)+C(CO 32-)+C(H 2CO 3) B 、 C ( Na + ) +C(H +)=C(HCO 3-)+C(CO 32-)+C(OH -) D 、存在的电离有 :NaHCO 3 = Na + + HCO 3 , HCO 3 H + + OH 2?常温下,将PH = 2的盐酸与 PH = 12的氨水等体积混合后,离子浓度的关系正确的是 ( ) A 、 C ( C 「) >C(NH 4+)>C(H +)>C(OH -) B 、 C(NH 4+)> C ( Cl -) > C(H +)>C(OH -) C 、C ( Cl -) =C(NH 4+)>C(H +)=C(OH -) D 、C(NH 4+)>C ( Cl -) >C(OH -)>C(H +) 3. (09四川卷12)关于浓度均为0.1 mol/L 的三种溶液:①氨水、②盐酸、③氯化铵溶液, 下列说法不正确的是 A. c ( NH +4厂③〉① B 水电离出的c (H +):②〉① C. ①和②等体积混合后的溶液:c ( H + )= c(OH l+c(NH 3H 2O) D. ①和③等体积混合后的溶液:c ( NH +4 )> c(Cl ")>c(OH ")> c(H +) 4. 已知乙酸(HA )的酸性比甲酸 (HB )弱,在物质的量浓度均为 0.1mol/L 的NaA 和 NaB 混合溶液中,下列排序正确的是 ( ) 5 .常温下,将醋酸和氢氧化钠溶液混合,所得溶液pH = 7 ,则此溶液中 c 、HCO 3 —的电离程度小于 HCO 3—的水解程度 H ++ CO 32—, H 2O A. c (OH)> c (HA)> c (HB)> c (H + ) C . c (OH -)>c (B -)> c (A -)> c (H +) B. C (OH -)>C (A -)>C (B -)> c (H + ) D . c (OH -)> c (HB)> c (HA)> c (H + ) A. [CH3COO — ] > [Na + ] B. [CH3COO — ]v [Na + ] 离子浓度大小的比较专题 高考必备化学知识得分点 离子浓度大小的比较专题 电解质溶液中离子浓度大小比较问题,是历年高考的热点之一.决定离子浓度大小的因素很多,诸如物质的量、电离程度、盐类水解、物质之间的反应等.要正确解题必须熟练掌握平衡知识,如电离平衡、水解平衡等;另外还要有守恒意识,如电荷守恒、物料守恒、质子守恒等。如何高效地解答此类问题,建议采取如下学习策略 一、理清一条思路,掌握分析方法 2、要养成认真、细致、严谨的解题习惯,在形成正确解题思路的基础上学会常规分析方法,例如:关键性离子定位法、守恒判断法、淘汰法、 整体思维法等。 二、熟悉二大理论,构建思维基点 1、电离(即电离理论) 知识点2:碱:电离时生成的阴离子只有OH -的化合物。 附:酸性和碱性强弱的判断依据 元素非金属性越强,其最高价氧化物对应水化物(最高价含氧酸)的酸性越强 即活泼非金属如Cl ;S ;N 对应的最高价含氧酸HC .lO 4;H 2SO 4;HNO 3为强酸 较不活泼非金属如C ;Si ;P 对应的最高价含氧酸H 2CO 3 ; H 2 SiO 3 ;H 3PO 4为弱酸 注:同种非金属元素对应的含氧酸,非金属元素的化 合价越高,酸性越强。如H 2SO 4强酸,而亚硫酸H 2SO 3为弱酸; 高氯酸HC .lO 4(最强酸),而次氯酸HC . lO(极弱酸)。 因此比较含氧酸酸性强弱,必须同为最高价含氧酸才能比较。 元素金属性越强,其最高价氧化物对应水化物(氢氧化物)的碱性越强 即活泼金属如K ;Na ;Ca 对应的氢氧化物KOH ;NaOH ; Ca(OH)2为强碱 强碱(4种): KOH ;NaOH ; Ca(OH)2 ; Ba(OH)2 碱 弱碱:Mg(OH)2 ;Fe(OH)3 ;Cu(OH)2 ;NH 3.H 2O…… 可溶性碱: KOH ;NaOH ; 离子浓度大小比较习题一(12.17) 1. 对于0.1 mol·L-1 Na2SO3溶液,正确的是 A.升高温度,溶液pH降低B.c(Na+)=2c(SO2-3)+c(HSO-3)+c(H2SO3) C.c(Na+)+c(H+)=2c(SO2-3)+2c(HSO-3)+c(OH-) D.加入少量NaOH固体,c(SO2-3)与c(Na+)均增大 2. 常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中 A c(HCOO-) > c(Na+) B c(HCOO-) < c(Na+) C c(HCOO-) = c(Na+) D 无法确定c(HCOO-) 和c(Na+) 的关系 3.下列关于电解质溶液的叙述正确的是 A.常温下,在pH=7的醋酸钠和醋酸混合溶液中,c(CH3COO-)>c(Na+) B.稀释醋酸溶液,溶液中所有离子的浓度均降低 C.在pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl-) D.在0.1 mol·L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) 4.下列溶液中微粒浓度关系一定正确的是 A.氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH+4) B.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) C.0.1 mol·L-1的硫酸铵溶液中:c(NH+4)>c(SO2-4)>c(H+) D.0.1 mol·L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) 5. 将pH=2的盐酸和pH=12的氨水等体积混合后,在所得的混合溶液中,下列关系式正确的是A.c(Cl-)>c(NH+4)>c(OH-)>c(H+) B.c(NH+4)>c(Cl-)>c(H+)>c(OH-) C.c(Cl-)>c(NH+4)>c(H+)>c(OH-) D.c(NH+4)>c(Cl-)>c(OH-)>c(H+) 6. 在10mL0.1mol·L-NaOH溶液中加入同体积、同浓度的HAc溶液,反应后溶液中各微粒的浓度 关系错误的是 A. C(Na+)>C(Ac-)>C(H+)>C(OH-) B.C(Na+)>C(Ac-)>C(OH-)>C(H+) C.C(Na+)=C(Ac-)>C(HAc) D.C(Na+)+C(H+)=C(Ac-)+C(OH-) 7.将0.2mol/L的NH4NO3溶液与0.1mol/L的NaOH溶液等体积混合,下列有关混合溶液中微粒 的浓度关系正确的是 A、c(NH4+)=c(Na+)>c(OH—)>c(NH3·H2O) B、c(NH4+)=c(Na+)>c(NH3·H2O)>c(OH—) C、c(NH4+)>c(Na+)>c(NH3·H2O)>c(OH—) D、c(NH4+)+c(Na+)+c(H+)=c(OH—)+c(NO3—) 8.室温时,将浓度和体积分别为c1、V1的NaOH溶液和c2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是 A.若pH>7,则一定是c1V1=c2V2 B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-) C.当pH=7时,若V1=V2,则一定是c2>c1 D.若V1=V2,c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+)高二化学溶液中离子浓度大小比较专题
离子浓度大小比较练习
高中化学离子浓度大小比较练习题(附答案)
高二化学盐溶液中离子浓度大小比较练习题(附答案)
溶液中离子浓度大小的比较方法与技巧
化学选修4溶液中离子浓度大小比较专题复习资料
盐溶液中离子浓度大小的比较
溶液中的守恒规律和离子浓度大小的比较
高中化学《离子浓度大小比较》专题讲解及例题分析
H++OH-,所以溶液中微粒浓度关系为:c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)。p1EanqFDPw ⑵多元弱酸的电离是分步的,主要以第一步电离为主;例如 H2S 溶液中微粒浓度大小关系。 【分析】由于 H2S 溶液中存在下列平衡:H2S HS-+H+,HSS2-+H+,H2O
H++OH-,所以溶液中微粒浓度关系为:c(H2S )>c(H+)>c(HS-)>c(OH-)。DXDiTa9E3d 2.水解理论: ⑴弱酸的阴离子和弱碱的阳离子因水解而损耗;如 NaHCO3 溶液中有:c(Na+)>c(HCO3-)。 ⑵弱酸的阴离子和弱碱的阳离子的水解是微量的(双水解除外),因此水解生成的弱电解质及 产生 H+的(或 OH-)也是微量,但由于水的电离平衡和盐类水解平衡的存在,所以水解后的 酸性溶液中 c(H+) (或碱性溶液中的 c(OH-)) 总是大于水解产生的弱电解质的浓度; 例如 (NH4) 2SO4 溶液中微粒浓度关系。RTCrpUDGiT 【分析】因溶液中存在下列关系:(NH4)2SO4=2NH4++SO42-, + 2H2O 2OH-+2H+,
2 NH3·H2O,由于水电离产生的 c(H+)水=c(OH-)水,而水电离产生的一部分 OH-与 NH4+结合产生 NH3·H2O,另一部分 OH-仍存在于溶液中,所以溶液中微粒浓度关系为:c(NH4+)>c(SO42-) >c(H+)>c(NH3·H2O)>c(OH-)。5PCzVD7HxA ⑶一般来说“谁弱谁水解,谁强显谁性”,如水解呈酸性的溶液中 c(H+)>c(OH-),水解呈碱 性的溶液中 c(OH-)>c(H+);jLBHrnAILg ⑷多元弱酸的酸根离子的水解是分步进行的,主要以第一步水解为主。例如 Na2CO3 溶液中微 粒浓度关系。 【分析】 因碳酸钠溶液水解平衡为: CO32-+H2O HCO3-+OH-, H2O+HCO3H2CO3+OH-,
xHAQX74J0X
所以溶液中部分微粒浓度的关系为:c(CO32-)>c(HCO3-)>c(OH-)。 二、电荷守恒和物料守恒 1.电荷守恒:溶液中离子浓度大小比较总结归类(超全)知识讲解
图像类离子浓度大小比较
专题复习6:离子浓度大小比较
2018人教版高中化学47总复习:离子浓度的大小比较(提高)知识讲解
离子浓度大小的比较练习题(精选)
离子浓度大小的比较专题
离子浓度大小比较练习题
- 2018人教版高中化学47总复习:离子浓度的大小比较(提高)知识讲解
- 详解溶液中离子浓度大小的判断
- 电解质溶液中离子浓度大小的判断
- 离子浓度大小的比较方法及规律
- 离子浓度大小的判断方法及解析
- 溶液中离子浓度大小的比较方法与技巧.
- 高中化学离子浓度大小比较专练
- 离子浓度大小比较课件
- 离子浓度大小的比较练习题(精选)
- 溶液中离子浓度大小比较总结归类
- 溶液中离子浓度大小比较总结归类(超全)知识讲解
- 离子浓度大小比较(总结全面)
- 溶液中离子浓度大小比较总结归类(超全)
- 离子浓度大小比较
- 离子浓度大小比较
- 《离子浓度大小比较》课件
- 离子浓度大小比较
- 离子浓度大小的比较
- 离子浓度大小比较教案复习课程
- 盐溶液中离子浓度大小的比较
