共价键中σ键和π键的比较
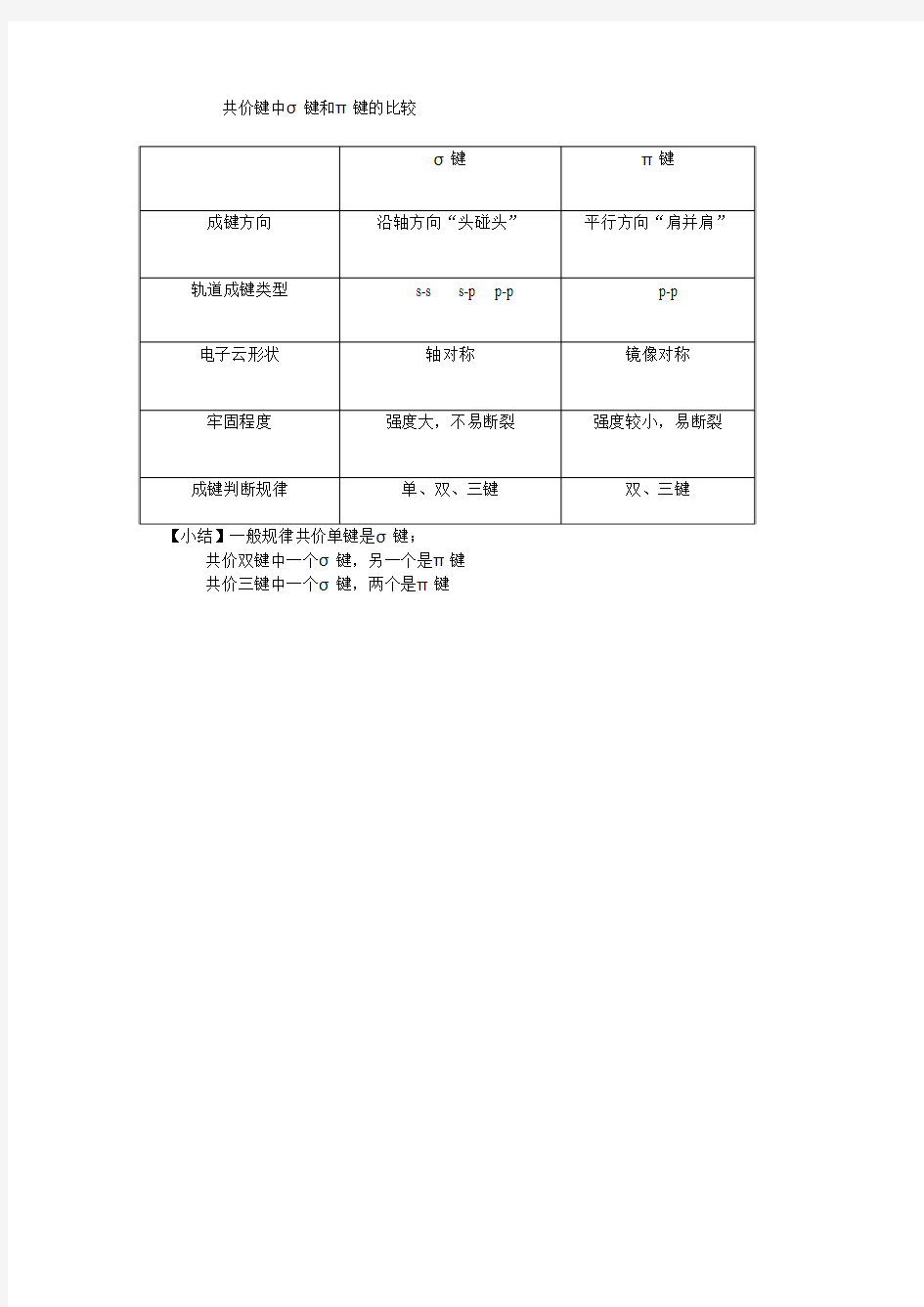
共价键中σ键和π键的比较
【小结】一般规律共价单键是σ键;
共价双键中一个σ键,另一个是π键
共价三键中一个σ键,两个是π键
CAD快捷键大全(完整版)
CAD快捷键全集 F1: 获取帮助 F2: 实现作图窗和文本窗口的切换 F3: 控制是否实现对象自动捕捉 F4: 数字化仪控制 F5: 等轴测平面切换 F6: 控制状态行上坐标的显示方式 F7: 栅格显示模式控制 F8: 正交模式控制 F9: 栅格捕捉模式控制 F10: 极轴模式控制 F11: 对象追踪式控制 Ctrl+1: 打开特性对话框 Ctrl+2: 打开图象资源管理器 Ctrl+3:打开工具选项板 Ctrl+4:图纸集管理器 Ctrl+5:信息选项板 Ctrl+6: 打开图象数据原子 Ctrl+7:标记集管理器 Ctrl+8:超级计算器 Ctrl+9:隐藏/显示命令行 Ctrl+0:隐藏/显示快捷图标 AA: 测量区域和周长(area) AL: 对齐(align) AR: 阵列(array) AP: 加载*lsp程系 AV: 打开视图对话框(dsviewer) SE: 草图设置 ①捕捉和栅格②极轴追踪 ③对象捕捉④动态输入ST: 打开字体设置对话框(style) SO: 绘制二围面( 2d solid) SP: 拼音的校核(spell) SC: 缩放比例(scale) (边界创建,包括创建闭合多段线和面域) SN: 栅格捕捉模式设置(snap) DT: 文本的设置(dtext) DI: 测量两点间的距离 OI:插入外部对相 Ctrl+A:全选 Ctrl+B: 栅格捕捉模式控制(F9) Ctrl+C: 将选择的对象复制到剪切板上Ctrl+D:开/关坐标值 Ctrl+E:确定轴测图方向 Ctrl+F: 控制是否实现对象自动捕捉(f3) Ctrl+G: 栅格显示模式控制(F7) Ctrl+H:pickstyle Ctrl+I:空空 Ctrl+J: 重复执行上一步命令 Ctrl+K: 超级链接 Ctrl+L:正交开/关 Ctrl+M: 打开选项对话框 Ctrl+N: 新建图形文件 Ctrl+O: 打开图象文件 Ctrl+P: 打开打印对说框 Ctrl+Q:退出 Ctrl+R:空空 Ctrl+S: 保存文件 Ctrl+T:数字化仪关 Ctrl+U: 极轴模式控制(F10) Ctrl+V: 粘贴剪贴板上的内容 Ctrl+W: 对象追踪式控制(F11) Ctrl+X: 剪切所选择的内容
ps最齐全快捷键合集
photoshop常用快捷键大全(最全的一篇了) 在网上收集的一次,快捷键最全的,分类也最清晰的一个快捷键汇总。希望对新手朋友的学习有所帮助。 一、文件 新建CTRL+N 打开CTRL+O 打开为ALT+CTRL+O 关闭CTRL+W 保存CTRL+S 另存为CTRL+SHIFT+S 另存为网页格式CTRL+ALT+S 打印设置CTRL+ALT+P 页面设置CTRL+SHIFT+P 打印CTRL+P 退出CTRL+Q 二、编辑 撤消CTRL+Z 向前一步CTRL+SHIFT+Z 向后一步CTRL+ALT+Z 退取CTRL+SHIFT+F 剪切CTRL+X 复制CTRL+C 合并复制CTRL+SHIFT+C 粘贴CTRL+V 原位粘贴CTRL+SHIFT+V 自由变换CTRL+T 再次变换CTRL+SHIFT+T 色彩设置CTRL+SHIFT+K 三、图象 调整→色阶CTRL+L 调整→自动色阶CTRL+SHIFT+L 调整→自动对比度CTRL+SHIFT+ALT+L 调整→曲线CTRL+M 调整→色彩平衡CTRL+B 调整→色相/饱和度CTRL+U 调整→去色CTRL+SHIFT+U 调整→反向CTRL+I 提取CTRL+ALT+X 液化CTRL+SHIFT+X 四、图层 新建图层CTRL+SHIFT+N 新建通过复制的图层CTRL+J 与前一图层编组CTRL+G 取消编组CTRL+SHIFT+G
合并图层CTRL+E 合并可见图层CTRL+SHIFT+E 五、选择 全选CTRL+A 取消选择CTRL+D 全部选择CTRL+SHIFT+D 反选CTRL+SHIFT+I 羽化CTRL+ALT+D 六、滤镜 上次滤镜操作CTRL+F 七、视图 校验颜色CTRL+Y 色域警告CTRL+SHIFT+Y 放大CTRL++ 缩小CTRL+- 满画布显示CTRL+0 实际像素CTRL+ALT+0 显示附加CTRL+H 显示网格CTRL+ALT+' 显示标尺CTRL+R 启用对齐CTRL+; 琐定参考线CTRL+ALT+; 八、窗口 关闭全部CTRL+SHIFT+W 九、帮助 目录F1 常用工具: 矩形、椭圆选框工具【M】 裁剪工具【C】 移动工具【V】 套索、多边形套索、磁性套索【L】魔棒工具【W】 喷枪工具【J】 画笔工具【B】 像皮图章、图案图章【S】 历史记录画笔工具【Y】 像皮擦工具【E】 铅笔、直线工具【N】 模糊、锐化、涂抹工具【R】 减淡、加深、海棉工具【O】 钢笔、自由钢笔、磁性钢笔【P】添加锚点工具【+】 删除锚点工具【-】 直接选取工具【A】
九年级化学共价键和离子键的区别判断
共价键 ?共价键: 1.本质原子之间形成共用电子对(或电子云重叠),使得电子出现在核间的概率增大。 2.特征 具有方向性与饱和性。 (1)共价键的饱和性一个原子中的一个未成对电子与另一个原子中的一个未成对电 子配对成键后,一般来说就不能再与其他原子的未成对电子配对成键了,即每个原子所能形成共价键的总数或以单键连接的原子数目是一定的,这称为共价键的饱和性。 例如,氯原子中只有一个未成对电子,所以两个氯原子之间可以形成一个共价键,结合成氯分子,表示为氮原子中有三个未成对电子,两个氮原子之间能够以共价三键结合成氮分子,表示为一个氮原子也可与_二个氢原子以三个 共价键结合成氨分子,表示为 (2)共价键的方向性 共价键将尽可能沿着电子出现概率最大的方向形成,这就是共价键的方向性。除s 轨道是球形对称外,其他原子轨道都具有一定的空间分布。在形成共价键时,原子轨道重叠得越多,电子在核间出现的概率越大,所形成的共价键就越牢固。 例如,硫原子的价电子排布是有两个未成对电子,如果它们分布在互相垂直的轨道中,那么当硫原子和氢原子结合生成硫化氢分子时,一个氢
原子的1s轨道上的电子能与硫原子的轨道上的电子配对成键,另一个氢原子的1s轨道上的电子只能与硫原子的轨道上的电子配对成键。 说明: ①共价键的饱和性决定着各种原子形成分子时相互结合的数量关系。如一个氢分子只能由两个氢原子构成,一个水分子只能由两个氢原子和一个氧原子构成。 ②共价键的方向性决定着分子的空间构型。 3.分类 (1)按成键原子是否相同或共用电子对是否偏移分 (2)按成键方式分
(3)按共用电子对数分 ?离子键和共价键:
Word组合快捷键大全
Word组合快捷键大全 Ctrl+Shift+Spacebar 创建不间断空格 Ctrl+连字符创建不间断连字符 Ctrl+B 使字符变为粗体 Ctrl+I 使字符变为斜体 Ctrl+U 为字符添加下划线 Ctrl+Shift+< 缩小字号 Ctrl+Shift+> 增大字号 Ctrl+Q 删除段落格式 Ctrl+Spacebar 删除字符格式 Ctrl+C 复制所选文本或对象 Ctrl+X 剪切所选文本或对象 Ctrl+V 粘贴文本或对象 Ctrl+Z 撤消上一操作 Ctrl+Y 重复上一操作 F1 获得联机帮助或Office 助手 F2 移动文字或图形 F3 插入自动图文集词条(在Word 显示该词条之后) F4 重复上一项操作 F5 选择“编辑”菜单中的“定位”命令 F6 前往下一个窗格或框架 F7 选择“工具”菜单中的“拼写和语法”命令F8 扩展所选内容 F9 更新选定域 F10 激活菜单栏 F11 前往下一个域 F12 选择“文件”菜单中的“另存为”命令Shift+功能键 Shift+F1 组合键启动上下文相关帮助或显示格式 Shift+F2 组合键复制文本 Shift+F3 组合键改变字母大小写 Shift+F4 组合键重复“查找”或“定位”操作Shift+F5 组合键移动到上一处修订 Shift+F6 组合键前往上一个 Word组合快捷键大全! Ctrl+Shift+Spacebar 创建不间断空格 Ctrl+连字符创建不间断连字符 Ctrl+B 使字符变为粗体 Ctrl+I 使字符变为斜体 Ctrl+U 为字符添加下划线 Ctrl+Shift+< 缩小字号Ctrl+Shift+> 增大字号 Ctrl+Q 删除段落格式 Ctrl+Spacebar 删除字符格式 Ctrl+C 复制所选文本或对象 Ctrl+X 剪切所选文本或对象 Ctrl+V 粘贴文本或对象 Ctrl+Z 撤消上一操作 Ctrl+Y 重复上一操作 F1 获得联机帮助或Office 助手 F2 移动文字或图形 F3 插入自动图文集词条(在Word 显示该词条之后) F4 重复上一项操作 F5 选择“编辑”菜单中的“定位”命令 F6 前往下一个窗格或框架 F7 选择“工具”菜单中的“拼写和语法”命令F8 扩展所选内容 F9 更新选定域 F10 激活菜单栏 F11 前往下一个域 F12 选择“文件”菜单中的“另存为”命令Shift+功能键 Shift+F1 组合键启动上下文相关帮助或显示格式 Shift+F2 组合键复制文本 Shift+F3 组合键改变字母大小写 Shift+F4 组合键重复“查找”或“定位”操作Shift+F5 组合键移动到上一处修订 Shift+F6 组合键前往上一个窗格或框架Shift+F7 组合键选择“同义词库”命令(位于“工具”菜单的“语言”子菜单中) Shift+F8 组合键缩小所选内容 Shift+F9 组合键在域代码和其结果之间进行切换 Shift+F10 组合键显示快捷菜单 Shift+F11 组合键前往上一个域 Shift+F12 组合键选择“文件”菜单上的“保存”命令 Ctrl+功能键 Ctrl+F2 组合键选择“文件”菜单上的“打印预览”命令 Ctrl+F3 组合键剪切至图文场 Ctrl+F4 组合键关闭窗口 Ctrl+F5 组合键还原文档窗口文档大小
离子键和共价键的辨析
离子键和共价键的辨析 摘要:本文对高一化学第五章化学键一节中“离子键”与“共价键”进行了辨析,以帮助学生们更好地理解有关知识,在解题过程中驾轻就熟,运用自如。 关键字:离子键、共价键、形成条件、存在形式、电子式 离子键和共价键同属于化学键,它们都是相邻的原子之间强烈的相互作用,由于离子键和共价键是微观领域的结构,学生们在学习过程中容易混淆这两个概念,在解题过程中常常出错,为了帮助学生更好的掌握离子键和共价键的概念,以及离子化合物和共价化合物的电子式表示方法,我对离子键和共价键进行了深入的辨析。 [例1]、在①H2、②NaCl、③H2O、④Na2O2、、⑤H2O2、⑥NH4Cl、⑦CO2、⑧NH4NO3、 ⑨Na2O、⑩HCl这些物质中,只含有离子键的 是:, 只含有共价键的是:, 即含有离子键又含有共价键的是:, 属于离子化合物的是:,属于共价化合物的是:。 有共价键的化合物,对于既有离子键又有共价键的化合物感到疑惑,难以分辨。对此
准确理解上述概念,并充分了解实例,可以使我们快速、正确地得出答案: 这些物质中,只含有离子键的是:②⑨, 只含有共价键的是:①③④⑤⑥⑦⑧⑩, 即含有离子键又含有共价键的是:④⑥⑧, 属于离子化合物的是:②④⑥⑧⑨, 属于共价化合物的是:③⑤⑦⑩。 通过这题我们发现其中的联系,可以概括总结得出结论: a、离子化合物中一定含有离子键,也可能含有共价键 b、共价化合物中一定含有共价键,一定不含有离子键 c、离子键只存在于离子化合物中,不存在共价化合物中 d、共价键可能存在于单质、离子化合物和共价化合物中 以上基础知识和规律的熟练掌握,有助于我们解决形式多样的此类试题。 [例2]、下列化合物中,含有共价键的离子化合物是:() A、NH3 B、CaCl2 C、NaOH D、NH4Cl E、Na2S F、SO2 解析:NH3、SO2是只含共价键的共价化合物;CaCl2、Na2S是只含离子键的离子化合物;NaOH、NH4Cl是既含共价键又含离子键的离子化合物。 答案:C、D [例3]、下列各组物质中,化学键类型完全相同的是:() A、Na2O、Na2O2 B、HI、NaI C、H2O、H2O2 D、NaCl、NH4Cl 解析:A、Na2O只含有离子键,Na2O2既含离子键又含有共价键; B、HI中只含有共价键,NaI中只含有离子键; C、H2O和H2O2中都只含有共价键; D、NaCl只含有离子键,NH4Cl既含离子键又含有共价键。 答案:C [例4]、下列关于化学键的叙述正确的是:() A、阴、阳离子通过静电吸引形成的强烈的相互作用 B、非金属原子间不可能形成离子化合物 C、金属元素与非金属元素化合时,不一定形成离子键 D、只有活泼金属与活泼非金属之间才能形成离子键 解析:A、错。离子键是阴阳离子通过静电引力形成的,静电引力作用包括引力和斥力; B、错。非金属原子间可能形成离子化合物,例如:NH4Cl、NH4NO3等铵盐; C、正确。某些不活泼金属与非金属之间形成共价键,例如:AlCl3 D、错。形成离子键的也可以是带电荷的原子团,例如:(NH4)2SO4等。 答案:C 化学反应的过程,本质上是旧化学键的断裂和新化学键形成的过程。离子键和共价键都属于化学键,都是相邻原子之间的强烈地相互作用。用电子式表示物质及其形成过程,能够更加生动、形象地反映出化学反应中电子得失和偏移的情况,以便更好地理解和认识形成物质的键的类型(离子键还是共价键)和方式(通过阴、阳离子还是共用电子对形成)。电子式是本节的重、难点,特别是用电子式表示离子化合物和共价化合物的形成过程,是考试中常易出错的知识点。
2014CAD快捷键大全
CAD快捷键 L, *LINE 直线 ML, *MLINE 多线(创建多条平行线) PL, *PLINE 多段线 PE, *PEDIT 编辑多段线 SPL, *SPLINE 样条曲线 SPE, *SPLINEDIT 编辑样条曲线 XL, *XLINE 构造线(创建无限长的线) A, *ARC 圆弧 C, *CIRCLE 圆 DO, *DONUT 圆环 EL, *ELLIPSE 椭圆 PO, *POINT 点 DCE, *DIMCENTER 中心标记 POL, *POLYGON 正多边形 REC, *RECTANG 矩形 REA *全部图增长 REG, *REGION 面域 H, *BHATCH 图案填充 BH, *BHATCH 图案填充 -H, *HATCH HE, *HATCHEDIT 图案填充...(修改一个图案或渐变填充)SO, *SOLID 二维填充(创建实体填充的三角形和四边形)*revcloud 修订云线 *ellipse 椭圆弧 DI, *DIST 距离 ME, *MEASURE 定距等分 DIV, *DIVIDE 定数等分 DT, *TEXT 单行文字 T, *MTEXT 多行文字 -T, *-MTEXT 多行文字(命令行输入) MT, *MTEXT 多行文字 ED, *DDEDIT 编辑文字、标注文字、属性定义和特征控制框ST, *STYLE 文字样式 B, *BLOCK 创建块... -B, *-BLOCK 创建块...(命令行输入) I, *INSERT 插入块 -I, *-INSERT 插入块(命令行输入) W, *WBLOCK “写块”对话框(将对象或块写入新图形文件)
化学必修二离子键共价键判断练习题(附答案)
2020年03月08日化学必修二离子键共价键判断练习题学校:___________ 注意事项:注意事项: 2、请将答案正确填写在答题卡上 第1卷 一、单选题 A.带相反电荷离子之间的相互吸引称为离子键 B.金属元素与非金属元素化合时,不一定形成离子键 C.某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键 D.非金属元素原子间也可能形成离子键 2.下列关于离子键的说法中正确的是( ) A.离子键是由阴、阳离子通过静电作用达到平衡时形成的 B.只有金属和非金属化合时才能形成离子键 C.凡是含有离子键的化合物一定含有金属元素 D.含有离子键的化合物不一定是离子化合物 3.下列各组物质中,化学键类型不同的是( ) A.NaCl和K2S B.H2O和NH3 C.CaF2和CsCl https://www.wendangku.net/doc/b96741161.html,l4和Na2O 4.下表物质与其所含化学键类型、所属化合物类型完全正确的一组是() 5.下列叙述正确的是() A.带相反电荷的离子之间的相互吸引称为离子键 B.非金属原子间不可能形成离子键 C.金属元素与非金属元素化合时,一定形成离子键
D.某元素的原子最外层只有一个电子,它跟卤素结合时形成的化学键不一定是离子键 6.下列关于离子键的说法中不正确的是() A.离子键就是阴、阳离子间强烈的相互作用 B.非金属元素形成的化合物中不可能存在离子键 C.离子键不可能存在于单质分子中 D.活泼金属和活泼非金属化合时能形成离子键 7.下列说法正确的是() A. HCl的电子式为H:Cl B. H2O2中含有离子键 C. 质量数为12的C原子符号为12C D. 用电子式表示KBr的形成过程: 二、填空题 :①碘的升华②氧气溶于水③氯化钠溶于水④烧碱熔化⑤氯化氢溶于水⑥氯化铵受热分解 (1)化学键没有被破坏的是;仅发生离子键破坏的是。 (2)既发生离子键破坏,又发生共价键破坏的是。 (3)N2的电子式为;Na2O2的电子式为;CO2的电子式为 。 9.写出NH3的电子式______________ 10.写出(NH4)2S的电子式:_____________。 11.写出下列物质的电子式 (1)H2O2 ; (2)N2 ; (3)NaClO ; (4)CCl4; (5)用电子式表示MgF2的形成过程. 12.写出下列各粒子的化学式。 (1)由2个原子构成的具有10个电子的分子是;阴离子是。 (2)由4个原子构成的具有10个电子的分子是;阳离子是。 (3)由3个原子构成的具有18个电子的分子是。 (4)由5个原子构成的具有10个电子的阳离子是。 13.写出Cl-的结构示意图:_____________
离子键共价键金属键比较
※离子键 定义:是原子得失电子形成的阴、阳离子靠静电作用形成的化学键。无方向性,无饱和性。 形成原因:离子键是由电子转移(失去电子者为阳离子,获得电子者为阴离子)形成的。即正离子和负离子之间由于静电引力所形成的化学键。离子既可以是单离子,如 Na+、K+;也可以由原子团形成,如 Cl-,NO3- 等含有离子键的物质(高中要求记住的) ☆离子化合物: ○1活泼金属阳离子和活泼非金属阴离子形成的盐类 例如 KCl Cs2SO4 KNO3 Na2S 等 ○2所有铵盐 例如NH4Cl (NH4)2SO4 ○3低价金属氧化物(注意必须是低价+1或+2价) 例如 Na2O K2O CaO ○4强碱(弱碱有些并不是) 例如 NaOH KOH ○5过氧化物超氧化物碳化钙(CaC2 电石) 例如 Na2O2 CaO2 KO2 BaO4 注意:含有离子键的化合物一定是离子化合物! ※共价键 定义:原子间通过共用电子对(电子云重叠)形成的化学键,有方向性,有饱和性。 共价键的形成是相邻两个原子之间自旋方向相反的电子相互配对,此时原子轨道相互重叠,两核间的电子云密度相对地增大,从而增加对两核的引力。因为只有自旋方向相反的电子才能配对成键,所以共价键有饱和性;另外,原子轨道互相重叠时,必须满足对称条件和最大重叠条件,所以共价键有方向性。共价键又可分为三种: ○1非极性共价键: 形成共价键的电子云正好位于键合的两个原子正中间,不偏移。如金刚石的C—C键。 ○2极性共价键: 形成共价键的电子云偏于对电子引力较大的一个原子,如H—Cl键,电子云偏于Cl一侧,可表示为H→Cl。 ○3配位键: 共享的电子对只有一个原子单独提供。如NH4+,N提供孤对电子,H+提供空轨道。 ☆共价化合物: ○1非金属之间形成的化合物(除铵盐) ○2少数盐类( AlCl3和 FeCl3) ○3所有酸类 区别离子化合物和共价化合物——熔融状态下是否导电。 一般来说在高中阶段,只要你在题目中看到的化合物含有第一主族的金属(碱金属) 那么一定是离子键。只要你看到题目所给的化合物没有金属元素那么是共价键(除了铵盐)。 ※金属键 定义:金属晶体中金属原子(或离子)与自由电子形成的化学键。无方向性,无饱和性。 形成原因:金属元素的原子在形成金属时,原子间的有价电子可以自由地从一个原子跑到另一个原子,好象是价电子为许多原子所共有。金属的许多物理性质,如光泽,延性,展性,导热性,导电性和金属键都有关系。 键长,键能,键角。原子半径,离子半径比较。原子半径在同一元素周期内从左到右递减,在同一族内从上到下递增。结合电子层数和核电荷数比较。 1同一元素的微粒,电子数越多,半径越大。如Na>Na+,Cl
共价键的形成
专题三第三单元共价键原子晶体 第一课时共价键的形成 【学习目标】 1.复习化学键的概念,用电子式表示常见物质的离子键或共价键的形成过程。 2.知道共价键的形成和特征。 【阅读要求及检测】 一.共价键: (1)概念:原子间通过形成的相互作用。 (2)用电子式表示H2、HCl、Cl2的形成过程 H2 HCl Cl2 (3)形成共价键的条件 ①两原子都有②两原子电负性_____或________③成键原子的原子轨道在空间上发生 _____ (4)成键原因:原子通过共用电子对形成共价键后,体系总能量降低。 (5)存在范围:①非金属单质②共价化合物③离子化合物中的原子团(6)共价化合物:主要以共价键结合形成的化合物,叫做共价化合物。 包括:。 (7)强弱比较:共价键的强弱:相似的共价键,成键原子的半径越,键长越,键越强,越不容易断裂。 [例1].关于共价键的说法正确的是( ) A. 金属原子在化学反应中只能丢失电子,因而不能形成共价键 B. 离子化合物中不可能含有共价键 C. 共价键也存在电子得失; D. 由共价键形成的分子可以是单质分子,也可以是化合物分子 [例2].下列微粒中,既含有离子键又含有共价键的是() A.Ca(OH)2B.H2O2C.Na2O D.MgCl2 【要点精讲及典型例题】 二.共价键的形成过程与表示方法 1.共价键的形成过程:成键原子相互接近,原子轨道重叠,自旋方向相反电子形成共用电子对,核间电子密度增加,体系能量降低,引力与斥力达到平衡状态,形成稳定的共价键。 2.表示方法: (1)能量变化图 (2)原子轨道重叠图
三:共价键的饱和性与方向性(共价键的特征) 1. 共价键的饱和性:一个原子有几个未成对电子,便可和几个自旋方向相的电子 配对成键,这就是共价键的饱和性。 2. 共价键的方向性:共价键形成时,两个参与成键的原子轨道总是尽可能着, 而且原子轨道重叠越多,电子在两核间出现概率越_______,形成的共价键越。 共价键的_______性决定了共价化合物的分子组成,共价键的_______性决定了分子空间构型。 3. 由于原子轨道在空间有一定取向,除了s轨道呈球对称外,p、d、f轨道在空间都有 一定的伸展方向。只有沿着一定的方向才能最大程度的重叠,故共价键是有方向性的。两个原子轨道重叠部分越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定。 [例3] 关于化学键的下列叙述中,正确的是() A、离子化合物可能含共价键,共价化合物中不含离子键 B、共价化合物可能含离子键,离子化合物中只含离子键 C、构成单质分子的微粒一定含有共价键 D、在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核 与原子核之间的静电排斥作用。 [例4] H2O分子中每个O原子结合2个H原子的根本原因是() A.共价键的方向性 B.共价键的饱和性 C.共价键的键角D.共价键的键长 【自我检测】 1.能证明AlCl3为共价化合物的是() A.AlCl3溶液容易导电 B.AlCl3溶液呈酸性 C.熔融AlCl3不能导电 D.AlCl3溶于水可以电离出Al3+和Cl- 2.下列每组物质发生状态变化所克服的微粒间的作用属于同种类型的是()A.食盐和蔗糖熔化B.钢和硫熔化 C.碘和干冰升华D.二氧化碳和氧化钠熔化 3.相距很远的两个氢原子相互逐渐接近,在这一过程中体系能量将() A.先变大后变小B.先变小后变大 C.逐渐变小D.逐渐增大 4.下列不属于共价键成键因素的是() A.共用电子对在两原子核之间高概率出现 B.共用的电子必须配对 C.成键后体系能量降低,趋于稳定 D.两原子核体积大小要适中 12.下列说法正确的是:() A. 若把H2S分子写成H3S分子,违背了共价键的饱和性 B. H3O+离子的存在,说明共价键不应有饱和性 C. 所有共价键都有方向性 D. 两个原子轨道发生重叠后,两核间的电子不仅仅存在于两核之间,而是绕两个原子核运动
Word快捷键大全已分类并排版修订稿
W o r d快捷键大全已分 类并排版 集团文件发布号:(9816-UATWW-MWUB-WUNN-INNUL-DQQTY-
比较实用的W O R D小技巧:CTRL+O打开 CTRL+P打印 CTRL+A全选 CTRL+G/H查找/替换 CTRL+B加粗文字(在选中目标情况下) CTRL+U绘制下划线(在选中目标情况下) CTRL+I倾斜文字(在选中目标情况下) CTRL+E居中(操作同上) CTRL+R右对齐(操作同上) CTRL+[/]对文字进行大小设置(在选中目标情况下) CTRL+D字体设置(在选中目标情况下) CTRL+N全文删除 CTRL+M左边距(在选中目标情况下) CTRL+Q两边对齐(无首行缩进),(在选中目标情况下)或将光标放置目标文字的段尾,亦可操作 CTRL+J两端对齐(操作同上) CTRL+K插入超链接 CTRL+T/Y可进行首行缩进(将光标移到需做此操作的段尾,或将此段选中进行操作)Ctrl+A(或Ctrl+小键盘上数字5):选中全文 Ctrl+B:给选中的文字加粗(再按一次,取消加粗) Ctrl+C:将选中的文字复制到剪贴板中
Ctrl+D:打开“字体”对话框,快速成字体的各种设置 Ctrl+E:使光标所在行的文本居中 Ctrl+F:打开“查找与替换”对话框,并定位在“查找”标签上 Ctrl+G:打开“查找与替换”对话框,并定位在“定位”标签上 Ctrl+H:打开“查找与替换”对话框,并定位在“替换”标签上 Ctrl+I:使选中的文字倾斜(再按一次,取消倾斜) Ctrl+K:打开“插入超链接”对话框 Ctrl+Shift+L:给光标所在行的文本加上“项目符号” Ctrl+M:同时增加首行和悬挂缩进 Ctrl+Shift+M:同时减少首行和悬挂缩进 Ctrl+N:新建一个空文档 Ctrl+O(或Ctrl+F12):打开“打开”对话框 Ctrl+P(或Ctrl+Shift+F12):打开“打印”对话框 Ctrl+R:使光标所在行的文本右对齐 Ctrl+S:为新文档打开“另保存为”对话框,或对当前文档进行保存 Ctrl+T:增加首行缩进 Ctrl+Shift+T:减少首行缩进 Ctrl+U:给选中的文字加上下划线(再按一次,去年下划线) Ctrl+V:将剪贴板中的文本或图片粘贴到光标处。若剪贴板中有多个内容,则将最后一条内容粘贴到光标处 Ctrl+X:将选中的文字剪切到剪贴板中 Ctrl+Z:撤销刚才进行的操作(可以多次使用) Ctrl+0:将选中的文本每段前增加12磅的间距
离子键和共价键
离子键和共价键 班级:姓名: 1.下列关于离子键的说法中,正确的是 A.阴阳离子间的相互吸引即离子健 B.非金属元素所组成的化合物中不可能有离子键 C.一个阳离子只可与一个阴离子之间存在离子键 D.活泼金属与活泼非金属化合时一般形成离子键 2.下列物质中,可证明某化合物内一定存在离子键的是 A可溶于水 B 水溶液能导电 C 融熔状态能导电D水溶液不导电3.下列说法中不正确的是 A在共价化合物中也可能含有离子键 B非金属之间形成的化学键一定是共价键C含有共价键的化合物不一定是共价化合物D含有离子键的化合物一定是离子化合物4.下列固体或分子中,含有化学键类型有差异的一组是 A.Ne、He B.MgF2、H2O2 C.NaOH、NH4Cl D.NaCl、KCl 5.下列物质的电子式书写正确的是 6.下列分子中所有原子都满足最外层为8电子结构的是 A SiCl4 B H2O C BF3 D PCl5 7.下列过程中,共价键被破坏的是 A.碘升华B.冰融化C.NaCl溶于水D.水通电生成氢气和氧气8.下列物质的变化中,需克服分子间的作用力的是 A.二氧化硅的熔化 B.碳酸钙受热分解 C.冰熔化 D.氧化铝熔化 9.下列物质的性质,不是由于氢键引起的是 A.沸点:H2O>H2S B.溶解性:NH3(易溶于水)>PH3(难溶于水) C.稳定性:H2O>H2S D. 等质量的体积:冰>水 10.下列判断不正确的是 A.沸点:HI> HC1 B.半径:S2- > Na+ C.熔点:CS2> CO2 D.酸性:HClO> H2CO3 11.有人认为在元素周期表中,位于IA族的氢元素,也可以放在ⅦA族,下列物质能支持这种观点的是 A.HF B. H3O+ C. NaH D. H2O2 12.1999年曾报道合成和分离了含高能量的正离子N5+的化合物N5AsF6,下列错误的是A.N5+共有34个核外电子B、N5+中氮—氮原子间以共用电子对结合 C.化合物N5AsF6中As化合价为+1 D、化合物N5AsF6中F化合价为-1 13.A+、B2+、C-、D2-四种离子具有相同.电子层结构。现有以下排列顺序: ①B2+>A+>C->D2-; ②C->D2->A+>B2+; ③B2+>A+>D2->C-; ④D2->C->A+>B2+。 四种离子的半径由大到小以及四种元素原子序数由大到小的顺序分别是 A.①④B.④①C.②③D.③② 14.下列顺序不正确的是 A.微粒半径H+
word2013快捷键大全
WORD2013快捷键 按 Ctrl+F。 此时将打开“搜索”对话框,并且光标已就位,您可以随时键入内容。 在框中键入搜索文本。 按 Enter。 要打印本主题,请按 Tab 直到选中“全部显示”,按 Enter,然后按 Ctrl+P。 Microsoft Office 基础 显示和使用窗口 若要按 切换到下一个窗口。Alt+Tab 切换到上一个窗口。Alt+Shift+Ta b 关闭活动窗口。Ctrl+W 或 Ctrl+F4 在将活动窗口最大化后再还原其大小。Alt+F5 从程序窗口中的一个任务窗格移动到另一个任务窗格(沿顺时针方向)。可能 F6 需要多次按F6。 从程序窗口中的一个任务窗格移动到另一个任务窗格(逆时针方向)。Shift+F6 当有多个窗口打开时,切换到下一个窗口。Ctrl+F6 切换到上一个窗口。Ctrl+Shift+F6 将所选的窗口最大化或还原其大小。Ctrl+F10 将屏幕上的图片复制到剪贴板上。Print Screen 将所选窗口上的图片复制到剪贴板上。Alt+Print Screen 使用对话框 若要按 移动到下一个选项或选项组。Tab
移动到上一个选项或选项卡组。Shift+Tab 切换到对话框中的下一个选项卡。Ctrl+Tab 切换到对话框中的上一个选项卡。Ctrl+Shift+Tab 在打开的下拉列表中的各选项之间或一组选项中的各选项之间移 箭头键 动。 执行分配给所选按钮的操作;选中或清除所选的复选框。空格键 选择选项;选中或清除复选框。Alt+选项中加下划线的字 母 打开所选的下拉列表。Alt+向下键 从下拉列表中选择选项。下拉列表中某个选项的首 字母 关闭所选的下拉列表;取消命令并关闭对话框。Esc 运行所选的命令。Enter 使用对话框内的编辑框 编辑框是个空白区域,可以在其中键入或粘贴条目,例如用户名或文件夹的路径。 若要按 移至条目的开头。Home 移至条目的结尾。End 向左或向右移动一个字符。向左键或向右键 向左移动一个字词。Ctrl+向左键 向右移动一个字词。Ctrl+向右键 向左选取或取消选取一个字符。Shift+向左键 向右选取或取消选取一个字符。Shift+向右键 向左选取或取消选取一个单词。Ctrl+Shift+向左键 向右选取或取消选取一个单词。Ctrl+Shift+向右键 选择从插入点到条目开头之间的内容。Shift+Home 选择从插入点到条目结尾之间的内容。Shift+End 使用“打开”和“另存为”对话框
word中的快捷键集锦
word中的快捷键集锦 word中的快捷键,整理出来供大家参考! Ctrl+A(E):选取整篇文档(=Ctrl+Num5) Ctrl+B(E):将所选文档加粗(=Ctrl+Shift+B) Ctrl+C(E):复制所选内容并将其放入剪贴板 Ctrl+D(O):修改选定字符格式 Ctrl+E(O):段落居中 Ctrl+H(E):查找并修改指定文字或格式 Ctrl+I(O):倾斜所选文字(切换方式) Ctrl+N(F):创建新文档或模板 Ctrl+O(F):打开已有的文档或模板 Ctrl+P(F):打印文档(=Ctrl+Shift+F12) Ctrl+S(F):保存当前活动文档 Ctrl+U(O):给所选内容添加下划线 Ctrl+V(E):在插入点插入剪贴板内容 Ctrl+X(E):剪切所选内容并将其放入剪贴板 Ctrl+Y(E):重复上一步操作(=F4=Alt+Enter) Ctrl+Z(E):取消上一步操作(=Alt+Backspace) Ctrl+1(O):将行距设为单倍行距 Ctrl+2(O):将行距设为2倍行距 Ctrl+5(O):将行距设为1.5倍行距 Ctrl+ ](O):按磅值增加所选定内容的字号 Ctrl+[(O):按磅值缩小所选定内容的字号 Ctrl+=(O):将选定内容设为下标(切换方式) Ctrl++(O):将选定内容设为上标(切换方式) Ctrl+*(V):显示/隐藏所有非打印字符 Ctrl+Tab(A):在单元格中插入制表符 Ctrl+Enter(O):在插入点插入一个分页符 Ctrl+Up(E):将插入点上移一个段落 Ctrl+Down(E):将插入点下移一个段落 Ctrl+Home(E):将插入点移到文档开始 Ctrl+End(E):将插入点移到文档结尾 Alt+/(A):快速选定整个表格 Ctrl+F2(F):打印预览 Ctrl+F10(W):将活动窗口最大化 F1:Word 帮助 Shift+F1(W):有关命令、屏幕区域的帮助信息或文字属性2.鼠标快捷键 双击单词或字:可选定这个英文单词或这个中文字 Ctrl+单击句子:选定一个句子 在段落中三击鼠标:选定一个段落 在选择条内单击鼠标:选定一行
高中化学《离子键与共价键》教学设计
离子键与共价键
一、教材分析 物质的结构是高中化学基础知识中的一块重要内容,是在学习原子结构和卤素及其化合物知识的基础 上,通过一些具体的事例,进一步认识物质的结构。从原子能通过不同的途径或方式构成性能各异的物质 引入化学键。又从原子趋向稳定的途径或方式引入离子键、共价键的形成过程。整个教学内容安排符合学 生的认知规律。也为学生以后学习元素及其化合物、能量和有机化合物打下必要的基础。b5E2RGbCAP 二、学情分析 学生已经掌握了原子结构、卤素及其化合物的相关知识,为学习本章的内容打下了基础。上节课又刚 刚学习了化学键,也为本节课的内容做好了铺垫。从原子趋向稳定的途径或方式引入离子键、共价键的形 成过程。整个教学内容安排符合学生的认知规律。p1EanqFDPw 三、教学目标 1.通过探究活动、分组讨论理解离子键、共价键概念,以及元素之间形成化学键的规律性,并学会用化学用 语表达。DXDiTa9E3d 2.通过参与离子键形成和共价键形成的探究,感受科学探究的一般方法,以及认识结构决定性质、性质反映 结构的规律。RTCrpUDGiT 3. 通过课堂探究、讨论,感触科学方法在化学研究中的重要性,养成实事求是的科学态度和勇于创新的科 学精神。5PCzVD7HxA 四、教学重点、难点 重点:离子键和共价键 难点:离子键的形成、共价键的形成 五、教学方法 讨论法、归纳法 六、教学过程 <引入> 相信大家在生活中都有这样的经验:在一些红白喜事的场合,吃饭时经常会遇到这样的情况:一张 桌子做了 7 个人,另一张桌子坐了 1 个人。因为在这种场合,大家基本上都是认识的,所以那 7 个人肯定 会叫那个人,快点过来吧。然后那个人在他们的召唤下就坐过去了,然后就可以开吃了。这种情况在化学 反应中也会出现:jLBHrnAILg 我们一起回顾一下之前学习过的一条化学方程式: 点燃 2Na+Cl2 2NaCl HCl 我们先来看一下钠原子和氯原子的结构
Na:
Cl:
我们知道:最外层排 8 个电子时是稳定结构。 (当然,K 层为最外层时排 2 个电子。 ) 所以,当钠原子遇上氯原子时,氯原子的七个电子肯定会叫钠原子上的这 1 个电子。 “你快点过来呀,你一 过来我们就稳定了。于是,钠原子上的这个电子经不起诱惑,跑到了氯原子上。xHAQX74J0X 钠原子失去电子之后变成什么?(钠离子)氯原子失去电子之后会变成什么?(氯离子) (写钠离子与氯离子的离子结构示意图。 )
word2007_快捷键大全
word2007快捷键 CTRL + SHIFT + F 选择 格式 " 工具栏上字体 列表。 CTRL + SHIFT + G 显示 字数统计 对话框。 CTRL + SHIFT + P 选择 格式 " 工具栏上字号 列表。 CTRL + SHIFT + S 选择 格式 " 工具栏上样式 列表。 ALT + N 如果显示 " 自动图文集 " 工具栏并且选中文本, Alt+N 显示创建自动图文集 " 对话框。 还, 创建自动图文集 " 对话框中建议一个自动图文集 " 词条名称。 触发 KeyTip N 开头活动选项卡上。 ALT + R 更改到 阅读版式 视图。 阅读版式 是否活动, Alt+R 显示研究任务窗格。 显示 审阅 选项卡。 如果 检查 选项卡处于活动状态, Alt+R 显示 研究 任务窗格。 常用快捷键 快捷键 作用 Ctrl+Shift+Spacebar 创建不间断空格 Ctrl+ -(连字符) 创建不间断连字符 Ctrl+B 使字符变为粗体 Ctrl+I 使字符变为斜体 Ctrl+U 为字符添加下划线 Ctrl+Shift+ 缩小字号 Ctrl+Shift+> 增大字号 Ctrl+Q 删除段落格式 Ctrl+Spacebar 删除字符格式 Ctrl+C 复制所选文本或对象 Ctrl+X 剪切所选文本或对象 Ctrl+V 粘贴文本或对象 Ctrl+Z 撤消上一操作 Ctrl+Y 重复上一操作 快捷键大全 1.用于设置字符格式和段落格式的快捷键 快捷键 作用 Alt + O + P 显示段落对话框 Ctrl+Shift+F 改变字体 Ctrl+Shift+P 改变字号 Ctrl+Shift+> 增大字号 Ctrl+Shift+< 减小字号 Ctrl+] 逐磅增大字号 Ctrl+[ 逐磅减小字号 Ctrl+D 改变字符格式("格式"菜单中的"字体"命令)
高一化学离子键共价键基础知识考查(附答案)
高一化学离子键共价键基础知识考查 一、单选题 1.某元素的原子最外层只有一个电子,它与卤素结合时,所形成的化学键( ) A.一定是离子键 B.一定是共价键 C.可能是离子键,也可能是共价键 D.以上说法都不正确 2.下列性质中,可以证明某化合物内一定存在离子键的是( ) A.可溶于水 B.有较高的熔点 C.水溶液能导电 D.熔融状态能导电 3.所含阴离子和阳离子的电子结构都与稀有气体元素原子的电子结构相同,且阳离子比阴离子少两个电子层的离子化合物是( ) A.2MgCl B.2BaF C.NaBr D.NaI 4.下列各式用电子式表示的物质的形成过程,其中正确的是( ) A. B. C. D. 5.下列每组物质中含有的化学键类型相同的是( ) A.NaCl 、HCl 、H 2O 、NaOH B.Cl 2、Na 2S 、HCl 、SO 2 C.HBr 、CO 2、H 2O 、CS 2 D.Na 2O 2、H 2O 2、H 2O 、O 3 6.在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( ) A.将SO 2通入水中 B.烧碱溶于水 C.将HCl 通入水中 D.硫酸氢钠溶于水 7.关于氢键,下列说法不正确的是( ) A.HF 的沸点比HCl 的沸点高是由于HF 分子间存在 氢键 B.水在结冰时体积嘭胀.是由于水分子之间存在氢键 C.3NH 的稳定性很强,是因为其分子间能形成氢键 D.在氨水中水分子和氨分子之间也存在着氢键 8.下列物质中,只含有一种化学键类型的是( ) A. Na 2O 2 B.Ca(OH)2 C. HClO D. Ne 9.下列关于离子键、共价键的各种叙述中正确的是( ) A.在离子化合物里,只存在离子键,没有共价键 B.非极性键只存在于双原子的单质分子中
WordExcel常用快捷键大全
W o r d E x c e l常用快捷 键大全 集团文件发布号:(9816-UATWW-MWUB-WUNN-INNUL-DQQTY-
也是我们经常用到的办公软件之一,它能有效的处理表格数据,面对大量表格中的大量数据,你不掌握一些快捷键是很吃力的。如果此时你能熟练运用快捷键,那可以极大的提高办事效率。为了大家的方便,办公组网特意搜集了资料,并进行了分类,下面就是Excel常用快捷键大全。 插入新工作表:Shift+F11或Alt+Shift+F1 移动到工作簿中的下一张工作表:Ctrl+PageDown 移动到工作簿中的上一张工作表:Ctrl+PageUp 选定当前工作表和下一张工作表:Shift+Ctrl+PageDown 取消选定多张工作表:Ctrl+ PageDown 选定其他的工作表:Ctrl+PageUp 选定当前工作表和上一张工作表:Shift+Ctrl+PageUp 对当前工作表重命名:Alt+O H R 移动或复制当前工作表:Alt+E M 删除当前工作表:Alt+E L
向上、下、左或右移动一个单元格:箭头键 移动到当前数据区域的边缘:Ctrl+箭头键 移动到行首:Home 移动到工作表的开头:Ctrl+Home 移动到工作表的最后一个单元格,位于数据中的最右列的最下行:Ctrl+End 向下移动一屏:PageDown 向上移动一屏:PageUp 向右移动一屏:Alt+PageDown 向左移动一屏:Alt+PageUp 切换到被拆分的工作表中的下一个窗格:Ctrl+F6 切换到被拆分的工作表中的上一个窗格:Shift+F6 滚动以显示活动单元格:Ctrl+Backspace 弹出“定位”对话框:F5 弹出“查找”对话框:Shift+F5
