CN201010180400C 一种磷酸镁铵缓释肥及其制备方法 1-8

(10)授权公告号 CN 102249769 B
(45)授权公告日 2013.02.13C N 102249769 B
*CN102249769B*
(21)申请号 201010180400.7
(22)申请日 2010.05.18
C05G 1/00(2006.01)
C05B 17/00(2006.01)
(73)专利权人北京有色金属研究总院
地址100088 北京市新街口外大街2号
专利权人有研稀土新材料股份有限公司
(72)发明人黄小卫 刘向生 张赫 龙志奇
赵娜 伍艳平 韩学伟 赵凤红
(74)专利代理机构北京众合诚成知识产权代理
有限公司 11246
代理人童晓琳
CN 101190809 A,2008.06.04,
CN 101172891 A,2008.05.07,
CN 101100398 A,2008.01.09,
CN 1397530 A,2003.02.19,
CN 1850740 A,2006.10.25,许延辉等.利用稀土冶炼氨氮废水制备磷酸铵镁的研究.《稀土》.2006,第27卷(第6期),56-58.刘金良等.磷酸铵镁法回收稀土分离废水中镁及氨氮的研究.《中国稀土学报》.2010,第28卷(第1期
),48-52.(54)发明名称
一种磷酸镁铵缓释肥及其制备方法
(57)摘要
本发明公开了属于废水处理及肥料制备技
术领域的一种磷酸镁铵缓释肥及其制备方法,一
种磷酸镁铵缓释肥,所述磷酸镁铵缓释肥中含有
钾、铁、钙、锌、钛、硫中的至少一种和稀土,所述稀
土以稀土氧化物(REO)的重量计,钾、铁、钙、锌、
钛、硫中的至少一种与REO 含量之和为0.01~
10wt %,P 2O 5含量为15~49wt %,N 含量为3~
10wt %,MgO 含量为16~26wt %。本发明以废水为
原料,提供一种磷酸镁铵缓释肥,使废水中氮、磷、
稀土、镁等有价资源得到有效低成本回收利用,不
仅解决了废水的污染问题,而且废水中氮、磷、稀
土、镁等有价资源得到有效低成本回收利用。(51)Int.Cl.(56)对比文件
审查员 徐静
权利要求书1页 说明书5页 附图1页
(19)中华人民共和国国家知识产权局(12)发明专利
权利要求书 1 页 说明书 5 页 附图 1 页
1/1页
1.一种磷酸镁铵缓释肥的制备方法,其特征在于,将原料1、原料2混合反应5-60min ,再与原料3混合反应,或将原料1、原料3混合反应5-60min ,再加入原料2进行混合反应,用碱性物质调节反应体系pH 为 8~11,反应液中镁离子、铵离子和磷酸根离子的重量比为Mg 2+:NH 4+:PO 43-=1.35~
2.0:1.00:5.28~5.54,反应10~300min ,使沉淀反应完全,所得沉淀经后处理即得到磷酸镁铵缓释肥,滤液中氨氮含量小于50mg/L ,磷含量小于10mg/L ,其中,原料1为同时含有稀土离子、镁离子和铵离子,且由一种或几种废水组成,原料2为含钾、铁、钙、锌、钛、硫离子中的至少一种离子的一种或几种废水,原料3为含磷酸根离子的废水。
2.根据权利要求1所述的一种磷酸镁铵缓释肥的制备方法,其特征在于,原料1中稀土离子以REO 计的含量为5~2000mg/L 。
3.根据权利要求1所述的一种磷酸镁铵缓释肥的制备方法,其特征在于,原料3含磷酸根离子的废水含有磷酸钠、磷酸氢二钠、磷酸二氢钠、磷酸、磷酸钾、磷酸二氢钾、磷酸氢二钾、磷酸氢二铵、磷酸二氢铵中的至少一种。
4.根据权利要求1所述的一种磷酸镁铵缓释肥的制备方法,其特征在于,原料3含磷酸根离子的废水含有磷酸钾、磷酸二氢钾、磷酸氢二钾、磷酸氢二铵、磷酸二氢铵中的至少一种。
5.根据权利要求1所述的一种磷酸镁铵缓释肥的制备方法,其特征在于,所述碱性物质为含钠、镁、铵、钾至少一种的碱性化合物和冶炼过程中的碱性废水中的一种或几种的混合物。
6.根据权利要求5所述的一种磷酸镁铵缓释肥的制备方法,其特征在于,所述碱性物质为含氧化镁、氢氧化镁、碳酸镁、氢氧化钠、碳酸钠、碳酸氢钠、氨水、碳酸铵、碳酸氢铵及冶炼过程中的碱性废水中的一种或几种的混合物。权 利 要 求 书CN 102249769 B
一种磷酸镁铵缓释肥及其制备方法
技术领域
[0001] 本发明属于废水处理及肥料制备技术领域,特别涉及一种磷酸镁铵缓释肥及其制备方法。
背景技术
[0002] 近年来,随着人口的激增、耕地的减少,粮食供需矛盾不断加剧,使得农业生产对肥料的依赖日益加强,这一切凸显了化肥在农业生产中的重要地位。然而,目前我国农业生产中的一个显著矛盾是化肥投入高但利用率偏低,这也成为制约我国农业发展的重要因素之一。我国现在使用的大多数化肥都是水溶性的,如钾肥、铁肥、锌肥和钛肥等,这些化肥施入土壤后,养分容易流失、分解或被固定,使养分利用率降低。更为重要的是,肥料的损耗不仅造成不可再生能源和资源的巨大浪费以及随之而来的经济上的重大损失,而且给我们实现粮食安全保障带来直接困难,给人类的生存环境造成巨大危害,如水体污染、温室效应等等。资源的耗竭和养分在环境中的过量累积都将使农业发展和环境保护承受较为严重的风险,因此,如何提高化肥的利用率,减少大气和环境污染,成了摆在我们面前的一项艰巨任务。
[0003] 稀土工业废水对环境的影响越来越受到关注。包头矿酸法冶炼工艺过程中产生大
量含硫酸铵、硫酸镁废水,水质指标为:pH值为6.5~7.0,NH
4+为5~10g/L,SO
4
2-为10~
40g/L,Mg2+为5~15g/L;稀土萃取分离工艺皂化过程产生大量氯化铵废水,水质指标为:pH值为4.0~5.0,NH
4
+为50~75g/L,Cl-为100~150g/L;单一稀土产品碳铵沉淀产生
的氯化铵废水,水质指标为:pH值为6.5~7.0,NH
4
+为20~40g/L,Cl-为40~80mg/L;稀土非皂化萃取分离过程中产生大量含氯化镁废水以及包头混合型稀土精矿、独居石、磷钇矿碱法冶炼过程中产生大量含磷酸根废水等。稀土冶炼分离废水中含有大量氨氮、磷、镁以及微量铁和稀土离子,对环境及地下水造成严重污染,如何综合处理稀土冶炼废水,回收利用有价值资源,保护生态环境,是行业急待解决的重要问题。目前,高浓度的氨氮废水,一般采用蒸发浓缩结晶回收,得到纯度较高的氯化铵或硫酸铵产品,但回收率较低,回收成本高。低浓度的氨氮废水,铵盐浓度低,且成分复杂,回收利用难度大、成本很高。
[0004] 我国稀土资源丰富,对稀土农用、稀土环境化学生态效应及稀土农用安全毒理卫生学评价等进行了深入研究。结果表明,稀土不但对环境友好,无毒无害,而且具有较好的调节植物生长、增强植物抗旱、抗病性及增加产量等作用。随着稀土在农业上的推广应用,提高农用稀土的利用效率显得非常必要。
发明内容
[0005] 稀土、钾、铁、钙、锌、钛和硫等有价元素经磷酸镁铵沉淀包裹后化学性质稳定,能被植物缓慢吸收,不会造成过量稀土、氨氮、磷等有益元素流失影响环境。因此可利用含铵、镁的废水与含磷、铁、稀土、钾等有价元素的废水进行混合沉淀反应等来处理工业废水,制备磷酸镁铵缓释肥,既可以回收低浓度的氨氮废水,又可以提高稀土、氮、磷、镁、铁、钾等有
价元素的利用效率,即在沉淀磷酸镁铵的过程中将废水中所含的稀土、钾、铁、钙等有益元素沉淀出来,使磷酸镁铵缓施肥对植物的作用效果更好、更全面,达到控制环境污染和废物利用的双重目的。
[0006] 大量试验研究结果表明,pH 是磷酸镁铵沉淀反应的主要影响因素,影响着磷酸根的存在形式继而影响反应进行的程度。由图1可以看出,pH <9时氮磷去除率随pH 值升高而增加,pH >9.0时,随pH 增加氨氮去除率呈缓慢增加达到一最大值而后下降的过程,磷去除率随pH 增加而迅速降低。当pH =9.0时,氨氮去除率达98%以上,氨氮残余含量降至20mg/L 左右,磷去除率99%以上,磷残余含量降至5mg/L 以下。
[0007] 本发明的目的是以废水为原料,提供一种磷酸镁铵缓释肥,使废水中氮、磷、稀土、镁等有价资源得到有效低成本回收利用。
[0008] 本发明提供了一种磷酸镁铵缓释肥,其中含有钾、铁、钙、锌、钛、硫中的至少一种和稀土,所述稀土以稀土氧化物(REO)的重量计,钾、铁、钙、锌、钛、硫中的至少一种与REO 含量之和为0.01~10wt %,磷酸镁铵缓释肥中,P 2O 5含量为15~49wt %,N 含量为3~10wt %,MgO 含量为16~26wt %。
[0009] 一种优选的技术方案如下:所述磷酸镁铵缓释肥中优选含有钾、铁、钛中的至少一种和稀土,所述稀土以REO 的重量计,钾、铁、钛中的至少一种与REO 含量之和优选0.1~5wt %,磷酸镁铵缓释肥中,P 2O 5含量优选18~49wt %,N 含量优选5~10wt %,MgO 含量为18~26wt %。
[0010] 其中所述稀土为La 、Ce 、Pr 、Nd 、Sm 、Eu 、Gd 、Tb 、Dy 、Ho 、Er 、Tm 、Yb 、Y 中的至少一种,优选La 、Ce 、Pr 、Nd 、Sm 、Gd 中的至少一种。
[0011] 一种磷酸镁铵缓释肥的制备方法,其制备步骤为:将原料1、原料2混合反应5~60min ,使稀土、钾、铁等沉淀析出,再与原料3混合反应,或将原料1、原料3混合反应5~60min ,再加入原料2进行混合反应,用碱性物质调节反应体系pH 为8~11,反应液中镁离子、铵离子和磷酸根离子的重量比为Mg 2+∶NH 4+∶PO 43-=1.35~2.0∶1.00∶5.28~
5.54,反应10~300min ,使磷酸镁铵沉淀反应完全,所得沉淀经后处理得到磷酸镁铵缓释肥,也可通过圆盘造粒或挤压造粒对其进行深加工,滤液中氨氮含量小于50mg/L ,磷含量小于10mg/L ,其中,原料1同时含有稀土离子、镁离子和铵离子,且由一种或几种废水组成,原料2为含钾、铁、钙、锌、钛、硫离子中的至少一种离子的一种或几种废水,原料3为含磷酸根离子的废水。
[0012] 所述原料1中稀土离子以REO 计的含量为5~2000mg/L 。
[0013] 所述含磷酸根离子的废水包括磷酸钠、磷酸氢二钠、磷酸二氢钠、磷酸、磷酸钾、磷酸二氢钾、磷酸氢二钾、磷酸氢二铵、磷酸二氢铵中的至少一种,优选磷酸钾、磷酸二氢钾、磷酸氢二钾、磷酸氢二铵、磷酸二氢铵中的至少一种。
[0014] 所述碱性物质为含钠、镁、铵、钾至少一种的碱性化合物和冶炼过程中的碱性废水中的一种或几种的混合物,优选含氧化镁、氢氧化镁、碳酸镁、氢氧化钠、碳酸钠、碳酸氢钠、氨水、碳酸铵、碳酸氢铵及冶炼过程中的碱性废水中的一种或几种的混合物。
[0015] 本发明的缓释肥的优点为:
[0016] (1)利用稀土工业废水和其他工业废水的混合沉淀反应,形成含钾、铁、钙、锌、钛、硫中的至少一种和稀土的磷酸镁铵缓释肥,不仅解决了废水的污染问题,而且废水中氮、
磷、稀土、镁等有价资源得到有效低成本回收利用。
[0017] (2)磷酸镁铵在水中溶解度极低,属枸溶性物质,只有在土壤微生物作用下缓慢分解提供植物养分,提高肥料的利用效率,另外含有微量稀土、钾、铁、钙、锌、钛、硫等植物有益元素,可以促进植物生长,提高农作物的产量,改善产品品质。
附图说明
[0018] 图1是pH对氨氮和磷去除率的影响;
[0019] 图2是不同实施例在土壤含水量为田间持水量60%时的释放情况。
具体实施方式
[0020] 下面结合附图对本发明作进一步说明:
[0021] 实例1
[0022] 将400mL由含有镧、铈、镁和铵的废水组成的原料1与200mL由含有铁的废水组成的原料2混合反应5min,其中原料1中镧和铈的含量以REO计为500mg/L,然后按化学计量关系加入含磷酸钠的废水(原料3)作沉淀剂,用氢氧化镁和氨水调节反应的pH为8.0,反
应液中镁离子、铵离子和磷酸根离子的重量比为Mg2+∶NH
4+∶PO
4
3-=1.35∶1.00∶5.28,
反应300min,使沉淀反应完全,所得沉淀经后处理即得磷酸镁铵缓释肥,其中REO、Fe、S含
量之和为0.5wt%,P
2O
5
含量为19wt%,N含量为3wt%,MgO含量为17%。滤液中氨氮含量
为45mg/L,磷含量为10mg/L。
[0023] 实例2
[0024] 将400mL由含有镁和铵的废水组成的原料1与200mL由含有钛的废水组成的原料2混合反应25min,其中原料1中镧、铈、镨和钕的含量以REO计为1000mg/L,然后按化学计量关系加入含磷酸钾的废水(原料3)作沉淀剂,用氧化镁和碱性废水调节反应
的pH为10.0,反应液中镁离子、铵离子和磷酸根离子的重量比为Mg2+∶NH
4+∶PO
4
3-=
1.45∶1.00∶5.34,反应60min,使沉淀反应完全,所得沉淀经后处理即得磷酸镁铵缓释
肥,其中REO、K、Ti、S总含量为1.2wt%,P
2O
5
含量为40.5wt%,N含量为5.6wt%,MgO含
量为22%。滤液中氨氮含量为20mg/L,磷含量为4mg/L。
[0025] 实例3
[0026] 将500mL由含有镧的硫酸镁废水和硝酸铵废水混合废水组成的原料1与450mL 含有硫酸铁、锌的废水组成的原料2混合反应60min,其中原料1中镧的含量以REO计为1500mg/L,然后按化学计量关系加入含磷酸钾或磷酸二氢钾或磷酸氢二钾的废水(原料3)作沉淀剂,用含氢氧化钠碱性废水调节反应的pH为9.5,反应液中镁离子、铵离子和磷酸根
离子的重量比为Mg2+∶NH
4+∶PO
4
3-=1.7∶1.00∶5.34,反应130min,使沉淀反应完全,
所得沉淀经后处理即得磷酸镁铵缓释肥,其中REO、Fe、K、Zn、S总含量为9.95wt%,P
2O
5
含
量为48.8wt%,N含量为4.5wt%,MgO含量为25.2%。滤液中氨氮含量为15mg/L,磷含量为2mg/L。
[0027] 实例4
[0028] 将含有镧、铈的氯化镁和硫酸镁的废水与硫酸铵和氯化铵的废水混合溶液作为原料1,其中镧和铈的含量以REO计为450mg/L,含铁、钙的氯化镁废水作为原料2,将500mL原
料1和450mL 原料2混合反应15min ,然后按化学计量关系加入含磷酸二氢铵或磷酸氢二铵的废水(原料3)作沉淀剂,用含氢氧化钠碱性废水调节反应的pH 为9.2,反应液中镁离子、铵离子和磷酸根离子的重量比为Mg 2+∶NH 4+∶PO 43-=1.9∶1.00∶5.5,反应230min ,使沉淀反应完全,所得沉淀经后处理即得磷酸镁铵肥,其中REO 、Fe 、Ca 、S 总含量为3.13wt %,P 2O 5含量为47.4wt %,N 含量为8.36wt %,MgO 含量为23.7%。滤液中氨氮含量为10mg/L ,磷含量为1mg/L 。
[0029] 实例5
[0030] 将含有铈的氯化镁和氯化铵废水为原料1,其中铈的含量以REO 计为5mg/L ,含铁的氯化镁废水为原料2,将100mL 原料1和200mL 原料2混合反应35min ,然后按化学计量关系加入磷酸氢二铵和磷酸二氢铵的废水(原料3)作为沉淀剂,用冶炼过程的碱性废水调节pH 为11,反应液中镁离子、铵离子和磷酸根离子的重量比为Mg 2+∶NH 4+∶PO 43-=
1.6∶1.00∶5.35,反应30min ,使沉淀反应完全,所得沉淀经后处理即得磷酸镁铵缓释肥,其中REO 、Fe 总含量为0.01wt %,P 2O 5含量为43wt %,N 含量为5.5wt %,MgO 含量为2
2.3%。滤液中氨氮含量为35mg/L ,磷含量为9mg/L 。
[0031] 实例6
[0032] 将含有镧、铈的氯化镁废水与氯化铵废水的混合废水作为原料1,其中镧和铈的含量以REO 计为50mg/L ,含氯化铁的废水为原料2,将1000mL 原料1和2000mL 原料2混合反应20min ,然后按化学计量关系加入含磷酸钠、磷酸氢二钠和磷酸二氢钠的废水(原料3)作沉淀剂,用氧化镁和氢氧化铵废水调节反应的pH 为10.2,反应液中镁离子、铵离子和磷酸根离子的重量比为Mg 2+∶NH 4+∶PO 43-=1.4∶1.00∶5.35,反应60min ,使沉淀反应完全,所得沉淀经后处理即得磷酸镁铵缓释肥,其中REO 、Fe 总含量为1.1wt %,P 2O 5含量为31wt %,N 含量为3.0wt %,MgO 含量为22.3%。滤液中氨氮含量为23mg/L ,磷含量为5mg/L
[0033] 实例7
[0034] 将含钐、钆的氯化镁废水与氯化铵和草酸铵的废水作为原料1,其中钐和钆的含量以REO 计为150mg/L ,含钛的草酸铵废水作为原料2,将500mL 原料1和200mL 原料2混合反应10min ,然后按化学计量关系加入含磷酸氢二钾和磷酸二氢钾的废水(原料3)作沉淀剂,用冶炼过程的碱性废水调节反应的pH 为9,反应液中镁离子、铵离子和磷酸根离子的重量比为Mg 2+∶NH 4+∶PO 43-=1.51∶1.00∶5.35,反应100min ,使沉淀反应完全,所得沉淀经后处理即得磷酸镁铵缓释肥,其中REO 、K 、Ti 总含量为4.5wt %,P 2O 5含量为47wt %,N 含量为6.8wt %,MgO 含量为23.1%。滤液中氨氮含量为12mg/L ,磷含量为3mg/L 。
[0035] 实例8
[0036] 将含钆的氯化镁废水与硝酸铵废水的混合溶液作为原料1,其中钆的含量以REO 计为150mg/L ,含硝酸铁的废水作为原料2,将25mL 原料1和10mL 原料2混合反应10min ,然后按化学计量关系加入含磷酸氢二铵和磷酸二氢铵的废水(原料3)作沉淀剂,用含氢氧化镁和氢氧化钠废水调节反应的pH 为8.5,反应液中镁离子、铵离子和磷酸根离子的重量比为Mg 2+∶NH 4+∶PO 43-=1.6∶1.00∶5.33,反应30min ,使沉淀反应完全,所得沉淀经后处理即得磷酸镁铵缓释肥,其中REO 、Fe 的总含量为0.25wt %,P 2O 5含量为22wt %,N 含量为3.5wt %,MgO 含量为16.2%。滤液中氨氮含量为35mg/L ,磷含量为6mg/L 。
[0037] 实例9
[0038] 将含La、Ce、Pr、Nd、Sm、Eu、Gd、Tb、Dy、Ho、Er、Tm、Yb、Y的硫酸镁废水与氯化铵废水的混合溶液作为原料1,其中La、Ce、Pr、Nd、Sm、Eu、Gd、Tb、Dy、Ho、Er、Tm、Yb和Y的含量以REO计为700mg/L,含有硫酸钛的废水作为原料2,将50mL原料1和20mL原料2混合反应15min,然后按化学计量关系加入含磷酸钠和磷酸二氢钠的废水(原料3)作沉淀剂,反应
液中镁离子、铵离子和磷酸根离子的重量比为Mg2+∶NH
4+∶PO
4
3-=1.8∶1.00∶5.33,用
碳酸钠调节反应的pH为9.0,反应60min,使沉淀反应完全,所得沉淀经后处理即得磷酸镁
铵缓释肥,其中REO、Ti、S的总含量为1.5wt%,P
2O
5
含量为45wt%,N含量为10wt%,MgO
含量为22.8%。滤液中氨氮含量为15mg/L,磷含量为3mg/L。
[0039] 实例10
[0040] 将含有镧、铈的氯化镁废水与氯化铵废水的混合废水作为原料1,其中镧和铈的含量以REO计为15mg/L,含氯化铁的废水为原料2,含磷酸钠、磷酸氢二钠和磷酸二氢钠的废水为原料3,将50mL原料1和按化学计量关系计算得到的原料3混合反应20min,然后加入20mL原料2,用氢氧化钠废水调节pH为10.2,反应液中镁离子、铵离子和磷酸根离子的重量
比为Mg2+∶NH
4+∶PO
4
3-=1.4∶1.00∶5.54,反应60min,使沉淀反应完全,所得沉淀经
后处理即得磷酸镁铵缓释肥,其中REO、Fe总含量为0.18wt%,P
2O
5
含量为31wt%,N含量
为3.0wt%,MgO含量为22.2%。滤液中氨氮含量为30mg/L,磷含量为9mg/L。
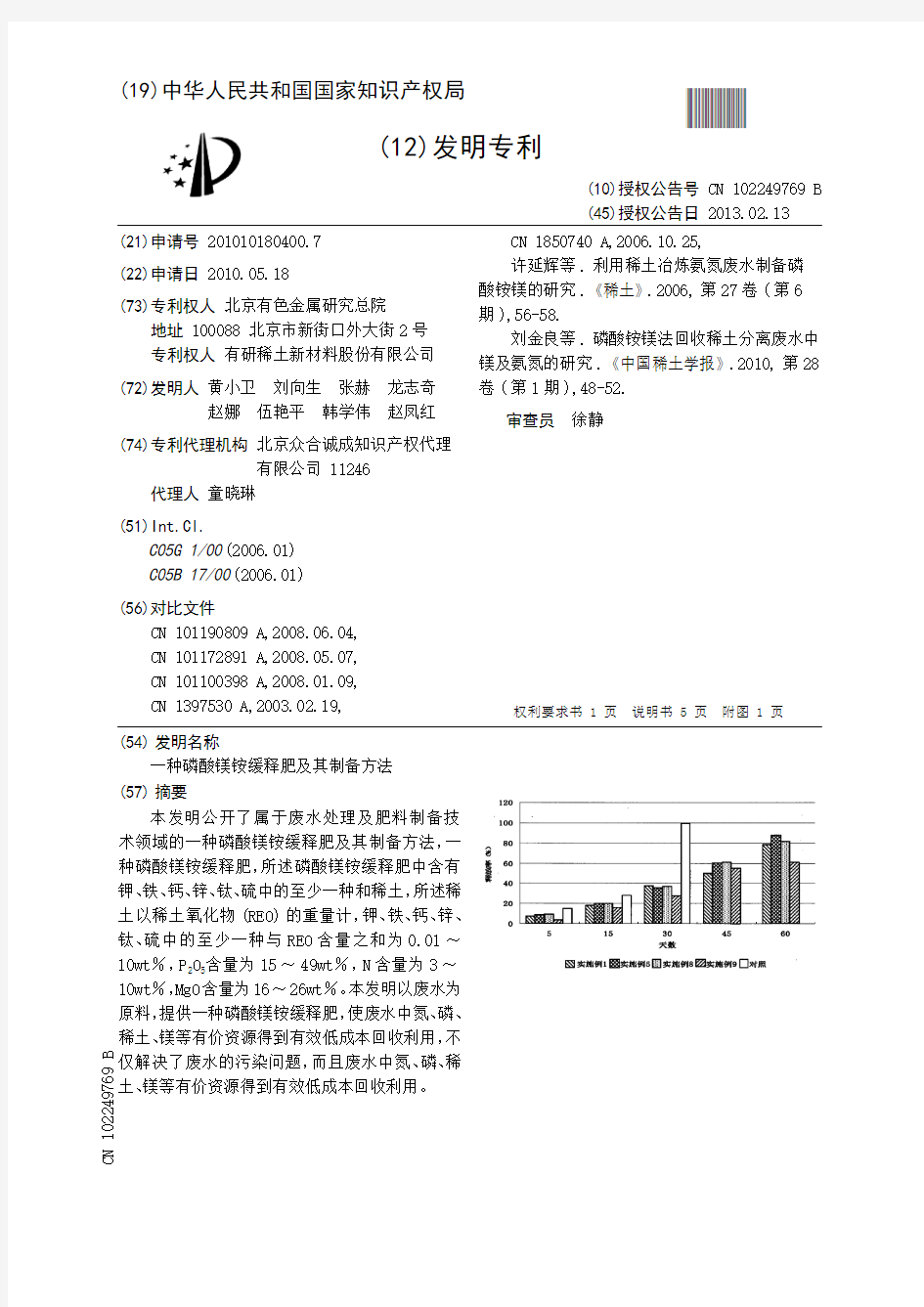
[0041] 对上述部分实施例所得产品在土壤中的释放速度进行了检测,从图2可以看出,实施例所得产品在60天时还没有释放完,而对照产品(普通磷肥)在30天内已释放完,因此,磷酸镁铵缓释肥的生物利用度也得以提高。
[0042] 对上述部分实施例所得产品进行了田间生物效果试验,结果表明,本发明所得产品可提高养分利用率,显著促进植物生长,提高抗性,增加产量,并改善农产品品质(表1)。[0043] 表1本发明缓释肥在种植业上的应用效果
[0044]
图1
图2
磷酸铵镁除磷脱氮技术
磷酸铵镁除磷脱氮技术 目前,生物脱氮除磷常采用A2O工艺,但其流程长且成本高,对进水氨氮浓度变化的适应性及抗负荷冲击的能力较差。本文介绍一种化学沉淀法,即MAP(Magnesium Ammonium Phosphate)脱氮除磷法。 1 MAP除磷脱氮的基本原理 向含NH4+和PO43-的废水中添加镁盐,发生的主要化学反应如下: Mg2++HPO42-+NH4++6H2O→MgNH4PO4·6H2O↓+H+(1) Mg2++PO43-+NH4++6H2O→MgNH4PO4·6H2O↓(2) Mg2++H2PO4-+NH4++6H2O→MgNH4PO4·6H2O↓+2H+(3) 再经重力沉淀或过滤,就得到MAP。其化学分子式是MgNH4PO4·6H2O,俗称鸟粪石;它的溶度积为2.5×10-13。因为它的养分比其它可溶肥的释放速率慢,可以作缓释肥(SRFs);肥效利用率高,施肥次数少;同时不会出现化肥灼烧的情况。 2 MAP除磷脱氮的影响因素和沉淀物组成分析 2.1 Mg2+,NH4+,PO43-三者在反应过程中的比例 在处理氨氮废水方面,将H3PO4加入到含有MgO的固体粉末中制成一种乳状液,对2.47×10-3mol/L氨氮废水进行处理,得出H3PO4与MgO的物质的量之比大于1.5时,氨氮去除率最高(90%以上),当进水氨氮质量浓度为42mg/L,在最佳条件下,氨氮质量浓度可降到0.5mg/L以下[1]。赵庆良[2]等人对5618mg/L氨氮的垃圾渗滤液进行处理,按n(Mg2+):(NH4+):n(PO43-)=1:1:1投加氯化镁和磷酸氢二钠,废水中氨氮质量浓度降为172mg/L,过量投加10%的镁盐或磷酸盐,氨氮质量浓度可分别降为112mg/L和158mg/L,继续提高镁盐或磷酸盐的量,废水中剩余氨氮质量浓度处在100mg/L左右,很难进一步降低。笔者对某一合金厂的质量浓度为1600mg/L的氨氮废水进行处理,按最佳配比n(Mg2+):(NH4+):n(PO43-)=1.3:1:1,加入硫酸镁和磷酸氢二钠,氨氮质量浓度可降到60mg/L,对某炼油厂的氨氮含量高(1231mg/L)的废水用此方法处理,氨氮质量浓度可降到112mg/L。 在除磷方面,国外有人证明,晶体纯度与初始氨氮质量浓度有关,最佳比例n(Mg2+):(NH4+):n (PO43-)=1:1.6:1,磷、镁去除率达95%以上[3]。Katsuura[4]认为n(Mg):n(P)为1.3:1时,除磷效果最好。 2.2 反应的pH值 MAP溶于酸不溶于碱,笔者对模拟氨氮废水进行重复验证,证明废水在pH值为7.0以上,才会出现小颗粒沉淀物,当用NaOH将pH值调至8.0以上时,会出现大量沉淀。pH值在7.0~10.5之间,主要的反应过程如式(1),(2),(3),当pH值上升到10.5~12之间,固定氨会从MgNH4PO4中游离出来,生成更难溶的Mg3(PO4)2(ksp=9.8×10-25)。 笔者在对无杂质氨氮废水与含杂质氨氮废水进行比较,发现前者pH值必须达到7.0以上,才会生成沉淀,而后者在pH值为6.3左右时,水中不断出现白色沉淀物,表明氨氮废水有比较大的悬浮颗粒时,沉淀物MAP可提前生成。 国内外的研究人员对MAP除磷脱氮最佳pH值进行了研究,结果见表1。
磷酸铵镁
1 文献综述 1.1 课题研究背景 现代工业的高速发展在给人类社会带来舒适便捷的同时,也衍生出许多威胁生态环境平衡的废水废气废渣。为了减少工业废弃物对环境的伤害,世界环保组织规定工业废弃物的排放需先经过处理知道达到排放标准。水是生命之源,因而在“三废”中工业废水是最常见且危害巨大的。工业废水中比较多见的是高氮磷废水,高氮磷废水虽然不含有重金属等有毒物质,但若直接排放入江海河流中也将会带来严重的环境问题,比如水体富营养化。 水体富营养化是水体因自然或人为因素纳人过量营养盐(主要为N、P),在适宜流场条件下藻类与其它水生生物的数量与结构发生异常变化,导致水质下降,甚至可能致使水体各项功能彻底瘫痪。富营养化会影响水体的水质,会造成水的透明度降低,使得阳光难以穿透水层,从而影响水中植物的光合作用,可能造成溶解氧的过饱和状态。溶解氧的过饱和以及水中溶解氧少,都对水生动物有害,造成鱼类大量死亡。同时,因为水体富营养化,水体表面生长着以蓝藻、绿藻等大量水藻,形成一层“绿色浮渣”,这样堆积于底层的有机物质会在厌氧条件下分解产生大量有害气体。此外,浮游生物产生的生物毒素也会伤害鱼虾。富营养化水中往往含有超标的硝酸盐和亚硝酸盐,人畜长期饮用这些有毒物质严重超标的水体,也会中毒或致病[1]。 因此,工业废水必须经过处理才能排放到湖泊江河中。其中高氮磷废水的传统处理方法有吹脱气提法、折点氯化法、离子交换法、混凝交换法、吸附法、生物法。 吹脱的优点是操作简便、易于控制且处理效果稳定,但使用石灰易产生水垢,塔板容易堵塞,且受环境温度影响较大,水温降低,脱氨效果降低,吹脱所需空气量较大,动力消耗大,运行成本较高,此外,逸出的游离氨易造成二次污染。 汽提法的优点:气提后的冷凝液可充分利用,对脱氨尾气进行有效回收,防止二次污染。但能量消耗大且控制步骤复杂。 折点氯化法优点:反应迅速,处理率达90%-100%,且处理效果稳定,不受水温影响,所需设备投资少。但液氯的安全使用和储存要求高,加氯量大,同时需要消耗碱来中和产生的酸,处理成本高,此外,副产物氯胺和氯代有机物会造成二次污染。 离子交换法:优点是工艺成熟,去除效率高。但操作过程复杂且饱和后再生费用高。 混凝沉淀法:优点:操作简单,易于控制,处理设备简单。但需要和其它工艺联合使用,单独使用很难满足出水要求,对水体pH值要求高,pH值改变时,沉淀物可能会溶解,还产生大量污泥,给污泥的处理带来了极大不便,污泥浓缩时,磷酸根会重新释放到上清液中,从而造成对水体的二次污染。
煤气化废水中有机物对磷酸铵镁结晶法去除氨氮的影响
第33卷一第11期2014年一一11月环一境一化一学ENVIRONMENTALCHEMISTRYVol.33,No.11 November2014一2014年1月14日收稿. 一?国家自然科学基金(50908109,51178208,51368024);云南省教育厅重点项目(2013Z123);校企预研基金(2013YT02)资助.一??通讯联系人,E?mail:huxuewei.env@gmail.comDOI:10.7524/j.issn.0254?6108.2014.11.010 煤气化废水中有机物对磷酸铵镁结晶法去除氨氮的影响? 胡学伟??一靳松望一王亚冰一夏丽娟一张雅琳(昆明理工大学环境科学与工程学院,昆明,650500) 摘一要一研究了杂环类(吡啶二喹啉)和酚类(间甲酚二二甲酚二苯酚)有机物对磷酸铵镁结晶法(MAP,magnesiumammoniumphosphate)处理废水中氨氮的影响.研究表明,杂环和酚类有机物均对MAP法的除氮效果产生抑制作用,杂环类有机物的抑制作用大于酚类有机物,其中加入吡啶二喹啉二间甲酚二二甲酚二苯酚相比于对照组(21mg四L-1),氨氮残余浓度分别升高45.17二56.66二43.01二50.68二49.72mg四L-1.因为络合作用和吸附作用,多组分体系MAP晶体产生的抑制作用强于单一组分体系. 关键词一杂环类有机物,酚类有机物,MAP,氨氮,煤气化废水. Effectoforganicsincoalgasificationwastewateronammonianitrogenremovalbymagnesiumammoniumphosphateprecipitation HUXuewei??一一JINSongwang一一WANGYabing一一XIALijuan一一ZHANGYalin (CollegeofEnvironmentalScienceandEngineering,KunmingUniversityofScienceandTechnology,Kunming,650500,China)Abstract:Lab?scalebatchexperimentswerecarriedouttoinvestigatetheeffectsofheterocyclicandphenoliccompoundsontheammonianitrogerremovalbymagnesiumammoniumphosphate(MAP)crystallization.Themorphologyoftheprecipitatesobtainedwasobservedwithmicroscope,andtheconcentrationofheterocyclicandphenoliccompoundswasanalyzedbyHPLC.TheresultsshowthatheterocyclicandphenoliccompoundssuppressedammoniumnitrogenremovalbyMAPcrystallization.Withtheadditionofpyridine,quinoline,m?cresol,dimethylphenolandphenol,theresidualammoniumnitrogenincreasedby45.17,56.66,43.01,50.68mg四L-1and49 72mg四L-1,respectively.Thesuppressionofheterocycliccompoundswasmoresignificantthanthatofphenoliccompounds.Becauseofcomplexationandadsorption,thesuppressionofmulti?componetsystemisstrongerthanthatofsingle?componetoneonammoniumremovalinMAPcrystallization. Keywords:heterocycliccompounds,phenoliccompounds,magnesiumammoniumphosphate(MAP),ammoniumnitrogen,coalgasificationwastewater.煤制油对于解决我国能源问题具有重要意义,但煤制油过程(煤气化制二甲醚路线)中煤气化废水作为一种难降解工业有机废水[1],对环境产生严重威胁,对煤制油的产业化应用造成严重障碍.煤制气废水主要组成成分为酚[2?3]二挥发酚二氨氮二石油类以及众多杂环化合物.煤气化废水中成分复杂的各类有毒有机物,会对传统的厌氧?缺氧?好氧(A/A/O)等脱氮工艺中的硝化反硝化微生物产生严重的毒性抑制,导致生物脱氮效率低下,出水难以满足排放及回用要求. 磷酸铵镁结晶法(MAP)法可去除废水中的氨氮[4],产生的MAP沉淀可回收并资源化利用[5?7],因此MAP方法已受到广泛关注[8?11],掌握各种因素对MAP法的影响规律,对提高MAP法的除氮效果具
磷酸镁铵的性质
磷酸镁铵的性质、制备方法及应用 山西大学环境资源学院程芳琴贺寿宝 磷酸镁铵,又名磷酸铵镁,俗称磷酸镁铵石、鸟粪石。英文名:Ammonium Magnesium Phosphate,分子式:NH4MgPo4·6H2O,分子量245.41.磷酸镁铵最早发现于鸟粪中,因而成为鸟粪石。除六水物外,还有一水物。 一、磷酸镁铵的性质和用途 磷酸镁铵属于无色斜方晶系。性状:白色结晶细粒或粉末,密度1.71g/ml,微溶于冷水,溶于热水和稀酸,不溶于乙醇,遇碱溶液则分解。磷酸镁铵在氨气流中加热到100℃时,脱去5分子结晶水,成为一水物。继续加热至600℃,分解成焦磷酸镁;其水溶液加热至48℃—50℃,析出一水物。 磷酸镁铵用作饲料添加剂,肥料添加剂。在医药上也有应用,也可用于提料,氨基甲酸酯、软泡阻燃剂的制造。磷酸镁铵在国外已被列入肥料之列,用作长效无机氨肥,主要用于果树、草坪、花卉等。 二、制备方法 1、磷酸盐法 ①磷酸二氢铵(钠)法 a、将磷酸二氢铵与氢氧化镁按一定比例,在40℃—65℃下反应生成磷酸镁铵,其反应式如下:NH4H2PO4+Mg(OH)2+4H2O—
NH4MgPO4·6H2O↓.上述反应在75℃—100℃下进行,生成NH4MgPO4·H2O,其反应式如下:NH4H2PO4+Mg(oh)2—NH4MgPO4·H2O+H2O. b、将氯化镁货硫酸镁溶液加入磷酸二氢铵(钠)溶液中,边搅拌边加入氨水,控制PH在6.0—6.5,可得硫酸镁按。其反应式如下:(NH4)2HPO4+MgSO4+NH3·H2O+5H2O—NH4MgPO4·6H2O↓+(NH4) 2SO4或Na2HPO4+MgCl2+NH3·H2O+5H2O—NH4MgPO4·6H2O↓+2NaCl.另外硫酸镁和氢氧化铵反应也可制成。 2、磷酸法 由磷酸、氧化镁货氢氧化镁、氨水直接反应制成,其反应式如下: H3PO4+MgO+NH3·H2O+4H2O—NH4MgPO4·6H2O↓或 H3PO4+Mg(OH)2+NH3·H2O+3H2O—NH4MgPO4·6H2O↓ 实验室方法:用磷酸和氢氧化镁支取磷酸镁铵。分2步进行:首 先在50—65℃,PH=4-6下,氢氧化镁和磷酸反应生成三水磷酸 铵镁,然后在75-100℃,PH=6-8下用浓氨水氨化生成磷酸铵镁, 其反应式:H3PO4+Mg(OH)2+H2O—MgHPO4·3H2OMgHPO4·3H2O+NH3— NH4MgPO4·6H2O↓+H20 3、硫铵过磷酸钙法 首先利用硫酸铵和过磷酸钙反应制得磷酸二氢铵,然后在镁离子 存在下,用碳酸氢铵调节同业的PH值在6-6.5制得,其反应式 如下:(NH4)2SO4+Ca〈H2PO4〉2·H2O+H2O—CaSO4·2H2O↓ +2NH4H2PO4,NH4H2PO4+MgSO4+2NH4HCO3+4H2O—NH4MgPO4·6H2O↓+2CO2
聚磷酸铵_APP_的合成与改性研究进展
聚磷酸铵(A PP )的合成与改性研究进展 李 蕾1,杨荣杰1,王雨钧2 (11北京理工大学材料科学与工程学院,北京 100081;2.北京鑫龙海防火器材有限公司,北京 100083) 摘要:聚磷酸铵是膨胀型阻燃剂的重要组成部分,而其本身所具有的高效、安全、经济等特点使得聚磷酸铵的生产成为阻燃剂发展一个重要课题。对聚磷酸铵现有的生产方法进行了分析比较,并介绍了几种简便易行的改性方法。关键词:聚磷酸铵;合成;改性 1 引言 阻燃剂是用以提高材料抗燃烧性,即阻止材料被引燃和抑制火焰传播的助剂,已广泛用于合成和天然高分子材料(包括塑料、橡胶、纤维、木材、纸张、油漆、涂料等)的阻燃。在塑料助剂领域,阻燃剂已跃居为仅次于增塑剂的第二大助剂类别。常用的阻燃剂按其所含的阻燃元素可分为卤系、磷系、铝镁系、硼系、钼系等[1]。 卤系阻燃剂虽然具有其他阻燃剂系列无可比拟的高效性,但是其对环境的危害是不可忽视的。因此不论是在灭火剂范围还是在阻燃领域中含有卤系元素的产品正逐步被替代[2]。氢氧化铝及氢氧化镁作为阻燃剂,其热稳定性好,吸热分解后不会产生有害的气体,抑烟能力好,而且价格便宜,是无机阻燃剂中的重要品种[3]。但是其应用于阻燃时,所需的添加量较大,与有机物质的相容性较差,影响产品的力学性能。以聚磷酸铵(A PP )为主要组分的膨胀型阻燃剂将是今后阻燃发展的重点方向之一。 膨胀型阻燃体系一般由以下三个部分组成:酸源、炭源、气源[4]。A PP 在这一体系中有多种功能,既可以作酸源又可以作气源。A PP 的阻燃机理是,催化降解,由于在整个膨胀体系中A PP 的质量百分比占到10%~20%,并不是平常意义上的催化[5]。A PP 同时含有磷、氮两种阻燃元素,作为无卤阻燃剂,在阻燃材料中具有重大价值。 2 A PP 发展历史和应用 聚磷酸铵(amm on ium po lyp ho sp hate ),简称 A PP ,是长链状含磷、 氮的无机聚合物,其分子通式为:(N H 4)n +2P n O 3n +1[6]。 A PP 热稳定性好,产品近于中性,并可以与其他 阻燃剂混用,分散性较好,同时价格便宜,毒性较低,使 用安全。因此广泛应用于配制膨胀型阻燃剂、防火涂 料、电缆防火处理、橡胶制品和塑料制品的阻燃。 根据聚合度的大小,A PP 可分为短链A PP (n =10~20),又称为水溶性A PP ;长链A PP (n >20),又称为水不溶性A PP 。当n 大于50时,分子式近似为(N H 4PO 3)n 。已知A PP 有五种不同的晶体结构: 2型、 2型、 2型、 2型、 2型,其中 2型晶粒具有不规则的外表面, 2型具有规则的表面,属于正交晶系。 2型为中间体, 2型和 2型为高温下的稳定结构[8]。在不同条件下,几种晶体结构之间可以相互转换。 3 A PP 的合成方法 日本、美国一些公司已经开发出水不溶性的A PP ,如Hoechest 公司开发的一种A PP 化合物(聚合度达2000),提高了A PP 的热稳定性,其溶解度几乎为0,且具有特别高的白度指数[7]。制备高聚合度的A PP 方法很多,总的来说,反应条件的控制对产品质 量影响很大,目前常见的生产方法有以下几种: 磷酸与尿素缩合法; 磷酸二氢铵与氨化缩合剂——尿素缩合法;聚磷酸氨化法; P 2O 52N H 32H 2O 高温气相反应法; 正磷酸铵与氨气高温中和法; 在A PP 存在下,磷酸与氨化缩合剂聚合法;磷酸二氢铵、五氧化二磷和氨气缩合法;磷酸和氨气缩合法等。 除前两种外,其他几种都需要在密闭体系中完成。(1)磷酸尿素缩合法是目前工业上常用的一种方法,该方法原料来源广,生产成本低。 其反应原理为;x H 3PO 4+x CO (N H 2) 2 (N H 4PO 3)x +x CO 2+x N H 3 在生产过程中有几个因素会影响到产品质量:原 3 42003年第6期消防技术与产品信息
磷酸镁铵处理高氨氮废水的技术经济核算
磷酸镁铵沉淀法去除氨氮的可行性论证核算结果 采用和不采用磷酸镁铵沉淀法去除氨氮后的4种废水SBR处理的需氧量 不采用磷酸镁铵沉淀法去除氨氮时4种废水SBR处理的碱度和甲醇投加核算结
操作参数: 搅拌时间:≤1h 搅拌速度:200 r /min pH:9.0~9.5 药剂投加量:见上表。
磷酸镁铵沉淀法去除氨氮的可行性论证核算过程1.MgNH4PO4·6H2O沉淀法去除氨氮的效率 表1 参考文献中关于MgNH4PO4·6H2O沉淀法去除氨氮的效果 *该研究的主要目的是除磷。 总结文献,关于MgNH4PO4·6H2O沉淀法去除氨氮的效率: (1)所有参考文献的氨氮平均去除率(%)=87.16 (2)低负荷(氨氮初始浓度为200mg/L)运行时的氨氮去除率平均值(%)=83.94 综合考虑,从实际工程实施的角度出发,认为该法的氨氮去除率以80%左右为宜。 2.贵州某化工有限公司合成氨废水水质核算 本计算主要核算两种废水的水质:
(1)第1种是《贵州某化工有限公司年产50万吨合成氨工程污水处理场、回用水处理装置技术规格书》(下称“规格书”)中定义的污水,即水量231m3/h的废水水质; (2)第2种是将160m3/h的脱盐水站装置浓排水与231m3/h的废水混合后的废水水质。分别核算如表2。 表2 废水水质核算表 (1)第1种污水水质指标中的COD Cr、BOD5、SS、NH4—N、CN、pH参照刘婕的计算结果;Ca2+、Mg2+、重碳酸根、碳酸根参照《规格书》中所提供的污水处理场装置达标污水水质表的数值;PO43-以0计算。 (2)脱盐水站装置浓排水水质指标中的COD Cr、SS、pH、Ca2+、Mg2+、PO43-参照《规格书》中所提供的数值;BOD5取较大值,20mg/L;NH4—N以《规格书》中的铵含量0.48mg/L计算。 (3)由于采用磷酸镁铵沉没法去除氨氮时,需要调pH值到9.0~9.5,所以废水水质指标中的硫化物、重碳酸根、碳酸根、磷酸根均可能影响投碱量。 进行磷酸镁铵沉没法去除氨氮时,对两种废水的核算如表3所示。 核(计)算过程说明: (1)该法的氨氮去除率以80%左右为宜; (2)以投加MgCl2/Na2HPO4作为沉淀剂,两种物质分别以无水MgCl2和Na2HPO4·12H2O计投加量; (3)25℃时MgNH4 PO4·6H2O的溶度积常数ksp = 2.5×10-13
磷酸铵镁样品测定方法
一.磷酸铵镁含量测定 秤取约1g试样,精确至0.0002g,置于100mL烧杯中加硝酸(1:1)溶解,全部转移到1000mL容量瓶中,用水稀释到刻度,摇匀。必要时过滤。移取25mL试验溶液,置于400mL高型烧杯中,加15mL硝酸(1:1)溶液,70mL水,微沸40min,用水冲洗表面皿和烧杯壁,控制试验溶液体积约为100mL。再加热至近沸腾,趁热加入50mL喹钼柠酮溶液,盖上表面皿,加热沸腾1min,保温30s(在加入试剂和加热过程中,不得使用明火,不得搅拌,以免凝结成块)。冷却至室温。用已于180℃±5℃下干燥45min的玻璃砂坩埚以倾析法抽滤,在烧杯中洗涤沉淀三次,每次用水15mL,将沉淀移入玻璃砂坩埚中,继续用水洗涤(所用洗涤水共约150mL),于180℃±5℃下干燥45min,或于250℃±5℃下干燥15min,在干燥器中冷却至室温,称量。同时进行空白试验。 空白试验除不加样品外,其他操作及加入试剂的种类和数量与测定试样相同。 样品中总磷酸盐(以P2O5计)含量:
换算成MgNH 4PO 4·6H 2O 含量 1212w w M M = 式中: 1w ——总磷酸盐(以P 2O 5 计)的含量 M 1——P 2O 5的摩尔质量142 g/mol M 2——MgNH 4PO 4·6H 2O 的摩尔质量245 g/mol 换算成MgNH 4PO 4含量: 131 2w w M M = 式中: 1w ——总磷酸盐(以P 2O 5 计)的含量 M 1——P 2O 5的摩尔质量142 g/mol M 3——MgNH 4PO 4的摩尔质量137 g/mol 二.水分含量测定 1.将坩埚放在120℃±5℃烘箱中干燥1h ,恒重,称质量m 1 2.称取一定量m 2样品置于坩埚中,放在120℃±5℃烘箱中干燥2h 3.称量烘干后的坩埚和样品总质量m 3 水分含量:
磷酸铵镁法处理含氮磷废水研究进展
磷酸铵镁法处理含氮磷废水研究进展 摘要:叙述了磷酸铵镁在废水中的形成机理及其在废水处理中的应用现状。在废水处理中利用镁盐作沉淀剂可以同时去除废水中的氮和磷,该方法去除率高、反应速度快、污泥体积小,同时还可回收磷酸铵镁,具有一定的应用前景。 关键词:磷酸铵镁; 化学沉淀; 条件溶度积; 废水处理 磷酸铵镁(MgNH4PO4·6H2O)俗称鸟粪石,英文名称struvite (magnesium ammonium phosphate) ,简称MAP。废水处理中的磷酸铵镁(MAP)法就是将 Mg2 +加入到含有磷酸盐和氨氮的污水中反应生成难溶的磷酸铵镁沉淀,从而去除污水中的磷酸盐和氨氮。 与传统活性污泥法相比,该方法可以减少49% 的污泥体积。磷酸铵镁不仅在化工、医药和建筑领域有广泛的应用,更是一种高效的缓释肥料,通过缓慢地释放养分极大限度地减少肥料中氮、磷进入附近水体,防止富营养化的发生。将废水中大量磷酸盐转化生成磷酸铵镁已经引起很多水处理专家的兴趣。 1 水中磷酸铵镁形成机理 1. 1 磷酸铵镁溶解度 磷酸铵镁是一种非常复杂的晶体化合物。水中 pH值的变化对其生成反应有很大影响,随pH值的变化,水中的NH4+、Mg2 +和PO43-浓度不断变化,当这三种离子的活度积超过了磷酸铵镁的溶度积常数 (Ksp)时,溶液过饱和然后发生沉淀。这三种离子的活度取决于体系的pH值和溶液中可溶的Mg、N和磷酸盐的浓度。另外,离子强度、温度以及水中的杂质都会对上述三种离子的活度产生影响,进而影响磷酸铵镁的沉淀。到目前为止,已经有许多人通过试验和化学平衡计算得出磷酸铵镁的溶度积常数 (3.89 ×10- 10~7.08 ×10- 14) 。 1. 2 磷酸铵镁条件溶度积 磷酸铵镁的溶解性并不是由它的溶度积常数单独控制,Adnan等[ 3 ]对比了磷酸铵镁在纯水和污泥消化液中的溶解情况,发现磷酸铵镁在消化液中更容易溶解。为了在工程上准确预测磷酸铵镁的溶解性, Stumm等引用了条件溶度积( PS )的概念,
检验案例:尿沉渣异常伴大量尿酸铵结晶及磷酸铵镁结晶
检验案例:尿沉渣异常伴大量尿酸铵结晶及磷酸铵镁结晶 1. 案例简介: 最近在工作中碰到一例尿沉渣异常,伴大量尿酸铵及磷酸铵镁结晶的病例,给大家介绍一下,病人尿沉渣结果如图1所示:图1. 尿沉渣结果尿沉渣结果显示,病人尿液中有大量红细胞及白细胞,手工复核镜检如图2-4所示: 图2. 镜检所见结晶 图3. 镜检所见结晶 图4. 镜检所见结晶2. 案例解析: 尿沉渣结果可见大量红细胞和白细胞,结晶显示为0。镜检复核后结果明显不一致,镜下可见大量的尿酸铵结晶以及少量磷酸铵镁结晶。尿沉渣仪器对结晶识别能力太差,暂不能代替镜检。 那么尿酸铵结晶和磷酸铵镁结晶作为生理性结晶,此时出现有何意义?尿路感染可以形成特殊成分的结石,其成分主要是磷酸镁铵、碳酸磷灰石及尿酸铵,称为感染性结石。炎症产生的有机物、细菌感染产生的结石基质、脓块及坏死组织可以做为结石核心,形成含钙结石。 造成感染性结石的主要危险因素是铵和尿液PH。泌尿系统感染常为各型变形杆菌、某些肺炎杆菌、绿脓杆菌、沙雷氏菌属、肠产气菌、葡萄球菌、普罗菲登斯菌(Providencia)
以及尿素支原体,这些细菌能够产生尿素酶,将尿液中的尿素分解为氨和二氧化碳,氨与水结合形成氢离子和铵离子,大大的增加尿pH值,铵与尿中的镁和磷酸根结合,形成磷酸镁铵,当感染持续存在,磷酸镁铵浓度逐渐增加,呈高度过饱和,析出即形成结石。另外,在碱性条件下,尿中的钙和磷酸根可以结合形成磷灰石,浓度高时析出形成结石。 在尿氨和碱性环境下,尿粘蛋白形成基质网架,使析出的结石盐易于附着、沉淀形成结石,因此感染容易导致结石,感染与泌尿系统其它因素一起还能够促进其它成分结石的形成。 由于以上因素,当磷酸铵镁结晶出现在慢性尿路感染患者尿液中可致尿路阻塞,产生尿路结石;而尿酸铵结晶在新鲜尿液中大量出现则提示膀胱细菌感染,新鲜尿液中大量出现伴有红细胞和尿痛,提示尿路结石。 3. 结语: 关注检验时间比较多,对我比较熟知的朋友肯定有印象,那就是我在检验时间写的第一篇《检验工作勿忽视镜检:生理性结晶毫无意义?它大有作用》。当时写的也是关于磷酸铵 镁结晶在慢性尿路感染患者尿液中出现的意义,当时没有拍图很是遗憾,这个案例也许可以弥补一下。 结晶意义固然有限,但是在某些特定的情况下意义还是有的。我希望的是大家能够积极的镜检,尽量让报告更完美,让其
磷酸钠的测定(磷酸铵镁沉淀—EDTA滴定法)
磷酸钠的测定(磷酸铵镁沉淀—EDTA滴定法) (本法非标准分析法) 制样:称取16.0g磷酸三钠或38.0g磷酸三钠·十二水,溶解后定容至1000ml。 取10.0ml(浓度约0.1mol/L)磷酸三钠的试样,先加10%的氨水1-2滴,再加0.1mol/L 的MgCl2标液25.0ml,微沸2min,冷却后,加50ml水,加10ml的氨—氯化氨缓冲溶液(PH=10),0.1g铬黑T(固体)指示剂,用0.1mol/L的EDTA标液滴定至纯蓝色。 计算:X%=K N (C1V1-C2V2) /10m 式中: K:配制试样的稀释倍数=试样总体积/ 测定时试样体积 m:样重(g) C1、V1:MgCl2标液的浓度和体积(不能用钙镁标液代替!) C2、V2:EDTA标液的浓度和体积 N磷酸三钠164.12 N磷酸三钠·十二水%= 380.12 N磷酸根%=96 本法可测定氯化钠和磷酸三钠混合物中的磷酸三钠 说明:如果试样含有能与EDTA络合的离子(如Ca、Mg)的试样,应先取同体积试液,不加MgCl2标液测定,在EDTA体积中扣除这部份体积。 氯化钠的含量 移取25.0ml溶液, 加两滴1%酚酞,用0.1mol/L的硫酸标准溶液滴至无色。加10%铬酸钾1ml,用0.1mol/L AgNO3标准溶液滴至浅棕色为终点。 NaCl%=233.76CV/m 碱度(mmol)=40C1V1(此为试样中总的碱度) m:样重(g) C、V: AgNO3标准溶液的浓度(mol/L)和用量(ml) C1、V1:硫酸标准溶液的浓度(mol/L)和用量(ml) 注:Na3PO4·12H2O在>100℃即失去结晶水
磷酸铵镁结晶法去除和回收养猪废水中营养元素的实验研究
第27卷第7期 2007年7月 环 境 科 学 学 报 Acta Scientiae Circu m stantiae Vol .27,No .7Jul .,2007 基金项目:中国环境科学研究院科技创新基金(No .20042021);国家人事部留学人员科技择优项目(No .2004299);国家人事部高层次留学人才回国工作项目(No .200422005) Supported by the I nnovati on Research Fund of Chinese Research Academy of Envir onmental Sciences (No .20042021),Selective 2Grant Pr ogra m for the Overseas Returned Scholars ofM inistry of Pers onnel of China (No .2004299)and Grant Pr ogra m for the H igh 2levelOverseas Returned Scholars ofM inistry of Pers onnel of China (No .200422005) 作者简介:袁鹏(1979—),女,助理研究员;3通讯作者(责任作者),E 2mail:s ongyh@craes .org .cn B i ography:Y UAN Peng (1979—),female,research assistant;3Correspond i n g author ,E 2mail:s ongyh@craes .org .cn 袁鹏,宋永会,袁芳,等.2007.磷酸铵镁结晶法去除和回收养猪废水中营养元素的实验研究[J ].环境科学学报,27(7):1127-1134 Yuan P,Song Y H,Yuan F,et al .2007.Nutrient re moval and recovery fr om s wine wastewater by crystallizati on of magnesium a mmonium phos phate[J ].Acta Scientiae Circum stantiae,27(7):1127-1134 磷酸铵镁结晶法去除和回收养猪废水中营养元素的 实验研究 袁鹏,宋永会3 ,袁芳,彭剑峰 中国环境科学研究院水污染控制技术研究室,北京100012 收稿日期:2006207227 修回日期:2007202213 录用日期:2007204205 摘要:以模拟养猪废水为处理对象,进行了磷酸铵镁结晶小试实验,考察了pH 值、NH +4、Mg 2+、Ca 2+和CO 2-3浓度对磷酸铵镁结晶反应的影 响;利用扫描电镜2能谱分析仪(SE M 2EDX )和X 射线衍射仪(XRD )对结晶产物进行了表征.结果表明,磷酸铵镁结晶反应的最佳pH 值范围为 9.5~10.5;随着NH +4与磷摩尔比的增加,磷的去除率增大;最佳的镁与磷的摩尔比为1.4∶1,过高的镁盐投加量对提高反应效率作用不明显; Ca 2+的存在对磷酸铵镁结晶产物的晶形、纯度均产生干扰,当Ca 2+增至一定浓度时,反应将生成无定形的磷酸钙沉淀;CO 2-3的存在会降低磷 的去除率,但不影响磷酸铵镁的晶形与纯度.关键词:磷酸铵镁;结晶反应;磷回收;晶体形态 文章编号:025322468(2007)0721127208 中图分类号:X703 文献标识码:A Nutr i en t rem ova l and recovery from sw i n e wa stewa ter by crysta lli za ti on of magnesi um amm on i u m phospha te Y UAN Peng,S ONG Yonghui 3 ,Y UAN Fang,PE NG J ianfeng Laborat ory of W ater Polluti on Contr ol Technol ogy of Chinese Research Academy of Envir onmental Sciences,Beijing 100012Rece i ved 27July 2006; rece i ved in revised for m 13February 2007; accepted 5Ap ril 2007 Abstract:U sing synthetic s wine waste water,s mall 2scale batch experi m ents were carried out t o investigate the effects of pH,ammonium nitr ogen concentrati on,magnesium (Mg )dosage,calcium (Ca )and carbonate (CO 2-3 )concentrati ons on magnesium a mmonium phos phate (MAP )crystallizati on .The mor phol ogy of the crystals obtained was observed with Scanning Electr on M icr oscopy with Energy D is persive X 2ray analysis (SE M 2EDX ),and the compositi on of the crystalswas analyzed by X 2rayD iffracti on (XRD ).The results show that the op ti m um pH value f orMAP crystallizati on is in the range of 9.5~10.5;the P re moval efficiency increases with the increase of N ∶P molar rati o;the op ti m um Mg ∶P molar rati o is 1.4∶1.Excessive Mg dosage does not have an obvi ous effect on the efficiency of MAP crystallizati on .The p resence of Ca disturbs the mor phol ogy and purity of the MAP p r oduct .Amor phous calcium phos phate will for m when Ca reaches a high enough concentrati on .CO 2-3 affects P removal efficiency,but does not obvi ously affect the mor phol ogy and purity ofMAP . Keywords:magnesium a mmonium phos phate (MAP );crystallizati on reacti on;phos phorus recovery;crystal mor phol ogy 1 引言(I ntr oducti on ) 磷是一种重要的矿产资源和化工原料,在其参 与环境(包括岩石、土壤和水)、生物、人体循环的过 程中,成为造成环境污染的一种重要成分;同时,磷 资源不仅十分有限,而且单向流动、难以再生.近年来,西方发达国家对磷的可持续利用高度重视,如何提高磷的利用效率,减少其造成的污染,成为广
磷酸镁铵的性质上课讲义
磷酸镁铵的性质
磷酸镁铵的性质、制备方法及应用 山西大学环境资源学院程芳琴贺寿宝 磷酸镁铵,又名磷酸铵镁,俗称磷酸镁铵石、鸟粪石。英文名:Ammonium Magnesium Phosphate,分子式: NH4MgPo4·6H2O,分子量245.41.磷酸镁铵最早发现于鸟粪中,因而成为鸟粪石。除六水物外,还有一水物。 一、磷酸镁铵的性质和用途 磷酸镁铵属于无色斜方晶系。性状:白色结晶细粒或粉末,密度1.71g/ml,微溶于冷水,溶于热水和稀酸,不溶于乙醇,遇碱溶液则分解。磷酸镁铵在氨气流中加热到100℃时,脱去5分子结晶水,成为一水物。继续加热至600℃,分解成焦磷酸镁;其水溶液加热至48℃—50℃,析出一水物。 磷酸镁铵用作饲料添加剂,肥料添加剂。在医药上也有应用,也可用于提料,氨基甲酸酯、软泡阻燃剂的制造。磷酸镁铵在国外已被列入肥料之列,用作长效无机氨肥,主要用于果树、草坪、花卉等。 二、制备方法 1、磷酸盐法 ①磷酸二氢铵(钠)法 a、将磷酸二氢铵与氢氧化镁按一定比例,在40℃—65℃下反应生成磷酸镁铵,其反应式如下:NH4H2PO4+Mg(OH)2+4H2O—
NH4MgPO4·6H2O↓.上述反应在75℃—100℃下进行,生成 NH4MgPO4·H2O,其反应式如下:NH4H2PO4+Mg(oh)2—NH4MgPO4·H2O+H2O. b、将氯化镁货硫酸镁溶液加入磷酸二氢铵(钠)溶液中,边搅 拌边加入氨水,控制PH在6.0—6.5,可得硫酸镁按。其反应 式如下:(NH4)2HPO4+MgSO4+NH3·H2O+5H2O—NH4MgPO4·6H2O↓+ (NH4)2SO4或Na2HPO4+MgCl2+NH3·H2O+5H2O—NH4MgPO4·6H2O↓ +2NaCl.另外硫酸镁和氢氧化铵反应也可制成。 2、磷酸法 由磷酸、氧化镁货氢氧化镁、氨水直接反应制成,其反应式如下: H3PO4+MgO+NH3·H2O+4H2O—NH4MgPO4·6H2O↓或 H3PO4+Mg(OH)2+NH3·H2O+3H2O—NH4MgPO4·6H2O↓ 实验室方法:用磷酸和氢氧化镁支取磷酸镁铵。分2步进行: 首先在50—65℃,PH=4-6下,氢氧化镁和磷酸反应生成三水磷 酸铵镁,然后在75-100℃,PH=6-8下用浓氨水氨化生成磷酸铵镁,其反应式:H3PO4+Mg(OH)2+H2O—MgHPO4·3H2OMgHPO4·3H2O+NH3—NH4MgPO4·6H2O↓+H20 3、硫铵过磷酸钙法 首先利用硫酸铵和过磷酸钙反应制得磷酸二氢铵,然后在镁离 子存在下,用碳酸氢铵调节同业的PH值在6-6.5制得,其反应 式如下:(NH4)2SO4+Ca〈H2PO4〉2·H2O+H2O—CaSO4·2H2O↓
磷酸铵镁法处理含氮废水
磷酸铵镁沉淀法去除NH3-N的实验 实验目的: 以磷酸铵镁沉淀法去除废水中NH3-N,通过实验确定Mg2+、PO43-的最佳投加量及反应最佳pH值。 准备: 称取1.6047g固体NH4Cl溶解于1L水中,所得溶液NH3-N值为510mg/L。实验中每份取100mL此溶液,计算当按Mg2+: PO43-: NH4+=1:1:1投加时,每份需加入硫酸镁0.73941g,磷酸氢二钠1.07442g。 实验一: 取5份配制好的上述氨氮溶液,每份100mL ; 按Mg2+: PO43-: NH4+=1:1:1,分别添加磷酸氢二钠1.07442g、硫酸镁0.73941g,搅拌均匀,溶液出现浑浊; 用NaOH调节溶液不同pH值,随着NaOH的加入,溶液浑浊程度加深,待pH 值稳定后,静置10min,沉淀完全分布烧杯底部,取上层澄清液,比较各溶液的NH3-N 去除率如下: 数据表明,当Mg2+: PO43-: NH4+=1:1:1,pH值调节为8时,废水NH3-N去除率最高,达84.31% 。 实验二: 取4份配制好的氨氮溶液,每份100mL , 按Mg2+: NH4+=1:1,分别添加硫酸镁0.73941g,磷酸氢二钠按PO43-: NH4+=0.8、1、1.2、1.4分别添加,搅拌均匀,溶液出现浑浊; 用NaOH调节溶液pH值为8,待pH值稳定后,静置10min,沉淀完全分布烧杯底部,取上层澄清液,比较各溶液的NH3-N去除率如下:
数据表明,当Mg2+: NH4+=1:1,溶液pH值为8时,随着PO43-用量的增加,NH3-N去除率逐渐升高。 实验三: 取4份配制好的氨氮溶液,每份100mL; 按PO43-: NH4+=1:1,分别添加磷酸氢二钠1.074g,硫酸镁按Mg2+: NH4+=0.8、1、1.2、1.4分别添加,搅拌均匀,溶液出现浑浊; 用NaOH调节各溶液pH值为8,待pH值稳定后,静置10min,沉淀完全分布烧杯底部,取上层澄清液,比较各溶液的NH3-N去除率如下: 数据表明,当PO43-: NH4+=1:1,溶液pH值为8时,随着Mg2+用量的增加,NH3-N 去除率先升高后降低,当Mg2+: NH4+=1.2时,存在最佳值即Mg2+: NH4+=1.2:1。 结论: 综上实验表明,此反应的最佳pH值为8,往氨氮废水投加Mg2+、PO43-的最佳投加量确定为Mg2+: PO43-: NH4+=1.2:1.4:1。但根据实验二,实际处理废水时可适当减少磷酸氢二钠的用量,如Mg2+: PO43-: NH4+=1.2:1.2:1 。
CN201010180400C 一种磷酸镁铵缓释肥及其制备方法 1-8
(10)授权公告号 CN 102249769 B (45)授权公告日 2013.02.13C N 102249769 B *CN102249769B* (21)申请号 201010180400.7 (22)申请日 2010.05.18 C05G 1/00(2006.01) C05B 17/00(2006.01) (73)专利权人北京有色金属研究总院 地址100088 北京市新街口外大街2号 专利权人有研稀土新材料股份有限公司 (72)发明人黄小卫 刘向生 张赫 龙志奇 赵娜 伍艳平 韩学伟 赵凤红 (74)专利代理机构北京众合诚成知识产权代理 有限公司 11246 代理人童晓琳 CN 101190809 A,2008.06.04, CN 101172891 A,2008.05.07, CN 101100398 A,2008.01.09, CN 1397530 A,2003.02.19, CN 1850740 A,2006.10.25,许延辉等.利用稀土冶炼氨氮废水制备磷酸铵镁的研究.《稀土》.2006,第27卷(第6期),56-58.刘金良等.磷酸铵镁法回收稀土分离废水中镁及氨氮的研究.《中国稀土学报》.2010,第28卷(第1期 ),48-52.(54)发明名称 一种磷酸镁铵缓释肥及其制备方法 (57)摘要 本发明公开了属于废水处理及肥料制备技 术领域的一种磷酸镁铵缓释肥及其制备方法,一 种磷酸镁铵缓释肥,所述磷酸镁铵缓释肥中含有 钾、铁、钙、锌、钛、硫中的至少一种和稀土,所述稀 土以稀土氧化物(REO)的重量计,钾、铁、钙、锌、 钛、硫中的至少一种与REO 含量之和为0.01~ 10wt %,P 2O 5含量为15~49wt %,N 含量为3~ 10wt %,MgO 含量为16~26wt %。本发明以废水为 原料,提供一种磷酸镁铵缓释肥,使废水中氮、磷、 稀土、镁等有价资源得到有效低成本回收利用,不 仅解决了废水的污染问题,而且废水中氮、磷、稀 土、镁等有价资源得到有效低成本回收利用。(51)Int.Cl.(56)对比文件 审查员 徐静 权利要求书1页 说明书5页 附图1页 (19)中华人民共和国国家知识产权局(12)发明专利 权利要求书 1 页 说明书 5 页 附图 1 页
