皂化反应速率常数及其活化能的测定数据作图

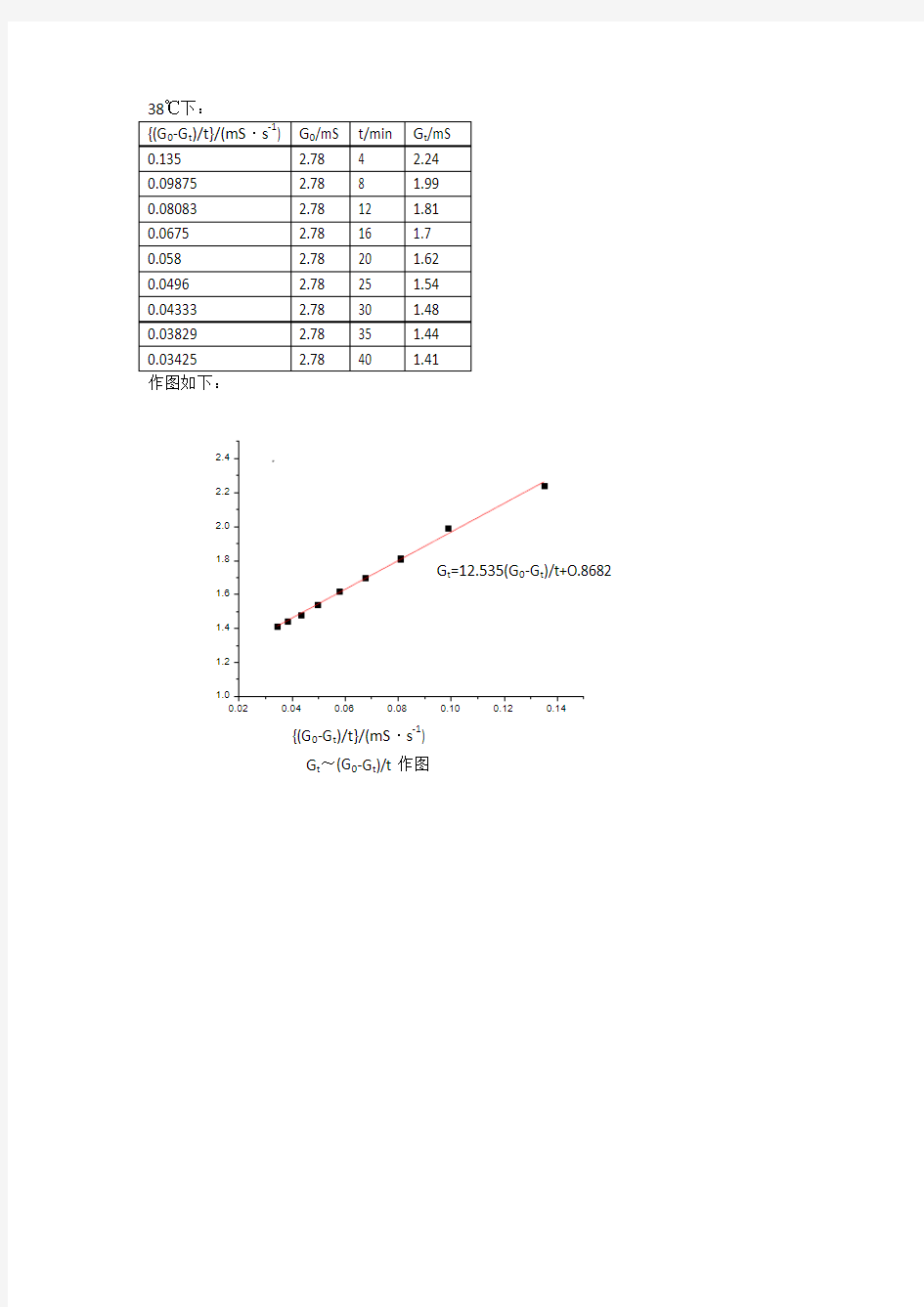
皂化反应速率常数及其活化能的测定数据作图:
0.030.040.050.060.070.080.090.100.11
G t /(m S )
作图如下: G t /m S
反应速率常数与活化能教案资料
反应速率常数与活化 能
大学化学结课论文反应速率常数与活化能 院(系) 专业 学生 学号 班号 指导教师 日期 哈尔滨工业大学 2014年12月
反应速率常数与活化能 摘要:反应速率常数与活化能是大学化学的一个重要部分,反应速率常数与活化能的测定的实验通过对和酸性KI的反应的研究与计算,得到了反应的反应速率常数和活化能。本文主要对此实验进行分析,并对反应速率常数和活化能进行简要介绍。 关键词:活化能;反应速率;实验。 Determination of the reaction rate constant and activation energy Abstract: the reaction rate constant and activation energy is an important part of college chemistry, and the determination of reaction rate constant and activation energy of experiment through reaction of H_2 0 _2 and acidic KI research and calculation, get the reaction rate constant and activation energy of the reaction. In this paper, this experiment is analyzed, and the reaction rate constant and activation energy are briefly introduced. Key words: activation energy; The reaction rate. The experiment. 反应速率常数与活化能的测定的实验,利用和酸性KI的反应,通过一系列的实验观察与计算,研究了反应速率的影响因素,计算得到了反应速率常数与活化能。 一、实验简介 1、实验目的: 1)学会测定化学反应速率常数和活化能; 2)了解温度对反应速率的影响。
乙酸乙酯皂化反应速率常数的测定
宁波工程学院 物理化学实验报告 专业班级化本092姓名周培实验日期2011年5月19日 同组姓名郑志浩,王镇指导老师王婷婷,刘旭峰 实验名称实验九、乙酸乙酯皂化反应速率常数的测定 一、实验目的 1、了解用电导法测定乙酸乙酯皂化反应的速率系数和活化能。 2、了解二级反应的特点,学会用图解法求二级反应的速率系数。 3、掌握电导率仪的使用方法。 二、实验原理 1、二级反应的动力学方程 A+B→产物 t=0a a t=t a-x a-x -dc A/dt=-d(a-x)/dt=dx/dt=k(a-x)2 定积分得:k=x/[ta(a-x)]① 以x/(a-x)~t作图若所得为直线,证明是二级反应,并从直线的斜率求k。 如果知道不同温度下的速率常数k(T1)和k(T2),按阿仑乌斯方程计算出该反应的活化能Ea Ea=ln k(T1)/k(T2)*R[T1T2/(T2-T1)]② 2、乙酸乙酯皂化反应是二级反应,反应式: CH3COOC2H5+NaOH→CH3COONa+C2H5OH t=0a a00 t=t a-x a-x x x t=∞00a a 反应前后CH3COOC2H5和C2H5OH对电导率的影响不大,可忽略,故反应前只考虑NaOH的电大率κ,反应后只考虑CH3COONa的电导率κ。对稀溶液而言,强电解质的电导率κ与其浓度成正比,而且溶液的总电导率就等于组成该溶液的电解质电导率之和。 有一下关系: κ0=A1*aκ∞=A2*aκt=A1*(a-x)+A2*x 有三式得:x=[(κ0-κt)/(κ0-κ∞)]*a,将其代入①中 得k=[(κ0-κt)/(κ0-κ∞)ta] 重新排列得:κt=(κ0-κt)/kta+κ∞ 因此,以κt~(κ0-κt)/t作图为一直线即为二级反应,并从直线的斜率求出κ
速率常数与化学平衡常数综合分析
速率常数与化学平衡常数综合分析 1.T 1温度时在容积为2 L 的恒容密闭容器中发生反应:2NO(g)+O 2(g) 2NO 2(g) ΔH <0。 实验测得:v 正=v (NO)消耗=2v (O 2)消耗=k 正c 2(NO)·c (O 2),v 逆=v (NO 2) 消耗=k 逆c 2(NO 2),k 正、k 逆 为速率常数,只受温度影响。不同时刻测得容器中n (NO)、n (O 2)如表: 时间/s 0 1 2 3 4 5 n (NO)/mol 1 0.6 0.4 0.2 0.2 0.2 n (O 2)/mol 0.6 0.4 0.3 0.2 0.2 0.2 (1)T 1温度时,k 正 k 逆 =______________。 (2)若将容器的温度改变为T 2时,其k 正=k 逆,则T 2_______(填“>”“<”或“=”)T 1。 答案 (1)160 (2)> 解析 (1)根据v 正=v (NO)消耗=2v (O 2)消耗=k 正c 2(NO)·c (O 2),得出k 正=v (NO )消耗 c 2(NO )·c (O 2),根据v 逆 =v (NO 2)消耗=k 逆 ·c 2(NO 2),得出k 逆 = v (NO 2)消耗c 2(NO 2),因为v (NO)消耗=v (NO 2 )消耗,所以k 正 k 逆 =c 2(NO 2) c 2(NO )·c (O 2)=K ,表格中初始物质的量:n (NO)=1 mol ,n (O 2)=0.6 mol ,体积为2 L ,则列 出三段式如下: 2NO(g)+O 2(g) 2NO 2(g) 始/mol·L - 1 0.5 0.3 0 转/mol·L - 1 0.4 0. 2 0.4 平/mol·L -1 0.1 0.1 0.4 K =c 2(NO 2)c 2(NO )·c (O 2)=0.420.12×0.1 =160。 (2)若将容器的温度改变为T 2时,其k 正=k 逆,则K =1<160,因反应:2NO(g)+O 2(g)2NO 2(g) ΔH <0,K 值减小,则对应的温度增大,即T 2>T 1。 2.顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如下转化: 该反应的速率方程可表示为v (正)=k (正)c (顺)和v (逆)=k (逆)c (反),k (正)和k (逆)在一定温度时为常数,分别称作正、逆反应速率常数。回答下列问题:
蔗糖水解反应速率常数的测定实验报告记录
蔗糖水解反应速率常数的测定实验报告记录
————————————————————————————————作者:————————————————————————————————日期:
序号: 6 物理化学实验报告 姓名:××× 院系:化学化工学院 班级:××× 学号:××××××× 指导老师:××× 同组者:×××××××××××
实验项目名称:蔗糖水解反应速率常数的测定 一、实验目的 (1)根据物质的旋光性质研究蔗糖水解反应,测定其反应的速率常数和半衰期; (2)了解旋光仪的基本原理,掌握其使用方法。 二、实验原理 蔗糖在水中转化成葡萄糖与果糖,其反应方程式为 C 12H 22O 11 + H 2O === C 6H 12O 6 + C 6H 12O 6 为使水解反应加速,反应常常以H+为催化剂,故在酸性介质中进行。由于在较稀的蔗糖溶液中,水是大量的,反应达到终点时,虽有部分水分子参加反应,但可认为其没有改变。因此,在一定的酸度下,反应速度只与蔗糖的浓度有关,所有本反应可视为一级反应。该反应的速度方程为: -dt dc =KC 积分后: ln C C O =Kt 或 ㏑C=-k t+㏑C 。 式中,C 。为反应开始时蔗糖的浓度;C 为时间t 时的蔗糖浓度,K 为水解反应的速率常数。 从上式中可以看出,在不同的时间测定反应物的浓度,并以㏑C t 对t 作图,可得一条直线,由直线斜率即可求出反应速率常数K 。然而反应是不断进行的,要快速分析出某一时刻反应物的浓度比较困
难。但根据反应物蔗糖及生成物都具有旋光性,且他们的旋光性不同,可利用体系在反应过程中旋光度的改变来量度反应的进程。 旋光度与浓度呈正比,且溶液的旋光度为各组分的旋光度之和(加和性)。若以α0,αt,α∞分别为时间0,t,∞时溶液的旋光度,则可导出: C0∝(α0-α∞),C t∝(αt-α∞) 所以可以得出: ㏑(α0-α∞)/(αt-α∞)=k t 即:㏑(αt-α∞)=-k t﹢㏑(α0-α∞) 上式中㏑(αt-α∞)对t作图,从所得直线的斜率即可求得反应速度常数K。 一级反应的半衰期则用下式求取: t=㏑2/k=0.693/k 2/1 三、仪器和试剂 仪器:自动指示旋光仪一台;移液管(25 mL)2支;超级恒温槽1台;烧杯(150 mL)2个;恒温水浴锅1台;吸耳球1个;秒表1块;容量瓶(50mL)1个;锥形瓶(100 mL)2个; 试剂:蔗糖(AR);2 mol/L的盐酸溶液。 四、实验操作 1、温度设定与准备
乙酸乙酯皂化反应速率常数测定
乙酸乙酯皂化反应速率系数测定 :腾 学号:2012011864 班级:化21 同组人:田雨禾 实验日期:2014年10月23日 提交报告日期:2014年10月30日 指导教师: 麻英 1 引言 1.1 实验目的 (1)学习测定化学反应动力学参数的一种物理化学分析方法——电导法。 (2)了解二级反应的特点,学习反应动力学参数的求解方法,加深理解反应动力学特征。 (3)进一步认识电导测定的应用,熟练掌握电导率仪的使用方法。 1.2 实验原理 反应速率与反应物浓度的二次方成正比的反应为二级反应,其速率方程式可以表示为 22dc -=k c dt (1) 将(1)积分可得动力学方程: c t 22c 0dc - =k dt c ? ? (2) 20 11 -=k t c c (3) 式中: 为反应物的初始浓度;c 为t 时刻反应物的浓度; 为二级反应的反应速率常数。 将1/c 对t 作图应得到一条直线,直线的斜率即为 。 对于大多数反应,反应速率与温度的关系可以用阿累经验方程式来表示: a E ln k=lnA-RT (4) 式中: 乌斯活化能或反应活化能;A 指前因子;k 为速率常数。 实验中若测得两个不同温度下的速率常数,就很容易得到 21 T a 21T 12k E T -T ln = k R T T ?? ??? (5) 由(5)就可以求出活化能。
乙酸乙酯皂化反应是一个典型的二级反应, 325325CH COOC H +NaOH CH COONa+C H OH → t=0时, 0c 0c 0 0 t=t 时, 0c -x 0c -x x x t=∞时, 0 0 0x c → 0x c → 设在时间t 生成物的浓度为x ,则反应的动力学方程为 220dx =k (c -x)dt (6) 2001x k = t c (c -x) (7) 本实验使用电导法测量皂化反应进程中电导率随时间的变化。设 、 和 分别代表时间为0、t 和∞(反应完毕)时溶液的电导率,则在稀溶液中有: 010=A c κ 20=A c κ∞ t 102=A (c -x)+A x κ 式中A 1和A 2是与温度、溶剂和电解质的性质有关的比例常数,由上面的三式可得 0t 00-x= -c -κκκκ∞ (8) 将(8)式代入(7)式得:
电导法测定乙酸乙酯皂化反应的速率常数数据处理
【数据处理】 ① 25℃的反应速率常数k T 1,将实验数据及计算结果填入下表: 恒温温度=24.9℃ 0κ=1.994m s ·cm -1 V 乙酸乙酯=10.00mL [乙酸乙酯]=0.0200mol/L V NaOH =10.00mL [NaOH]=0.0200mol/L c 0=0.5×0.0200=0.01mol/L t/min t κ/ms ·cm -1 t t 0κκ-/ms ·cm -1·min -1 2 1.835 0.159 0.079500 4 1.759 0.235 0.058750 6 1.675 0.319 0.053167 8 1.602 0.392 0.049000 10 1.542 0.452 0.045200 12 1.49 0.504 0.042000 14 1.444 0.55 0.039286 16 1.404 0.59 0.036875 18 1.368 0.626 0.034778 20 1.335 0.659 0.032950 22 1.306 0.688 0.03127 3 2 4 1.281 0.713 0.029708 26 1.259 0.73 5 0.028269 28 1.237 0.757 0.02703 6 30 1.217 0.777 0.025900 图1:25℃t κ- t t 0κκ- 由于第一个数据偏离其它数据太多,有明显的误差,所以舍去。
数据处理: t κ对 t t 0κκ-作图,求出斜率m ,并由 0kc 1 m = 求出速率常数. 直线公式:y=16.616x + 0.7888 R 2=0.9998 m=16.616,k T 1=1/(mc 0)=1/(16.616*0.01)mol ·L -1·min= 6.02L/(mol ·min) 文献参考值:k (298.2K )=(6±1)L/(mol ·min) ② 用同样的方法求37℃的反应速率常数k T 2,计算反应的表观活化能Ea : 恒温温度=35.0℃ 0κ=2.27ms ·cm -1 V 乙酸乙酯=10.00mL [乙酸乙酯]=0.0200mol/L V NaOH =10.00mL [NaOH]=0.0200mol/L c 0=0.5×0.0200=0.0100mol/L 实验数据记录及处理表2:
实验五化学反应速率和速率常数的测定
实验五化学反应速率和速率常数的测定 一、预习要点 ①化学反应速率基本概念以及浓度、温度和催化剂对反应速率的影响。 ②本实验测定反应速率及速率常数的基本原理、实验方法。 二、目的要求 ①了解浓度、温度和催化剂对反应速率的影响。 ②测定过二硫酸俊与碘化钾反应的平均反应速率,并计算不同温度下的反应速率常数。 三、实验原理 在水溶液中,过二硫酸俊与碘化钾发生如下反应: (NH 4)2 S2O8+3KI ——(NH 4)2SO4 + K2SO4 + KI 3 它的离子反应方程式为: S2O8+3I-——2SO4+I3- 因为化学反应速率是以单位时间内反应物或生成物浓度的改变值来表示的,所以上述反 应的平均速率为: 2 2 2 、 C(S2O8 )1 C(S2O8 )2 C(S2O8 ) tT^1 t 式中,△ C(S2O82-)为S2O82-在At时间内浓度的改变值。为了测定出△ C(S2O82-),在混合(NH 4)2 S2O8和KI溶液时,用淀粉溶液作指示剂,同时加入一定体积的已知浓度的N32S2O3,这样 溶液在反应(1)进行的同时,也进行着如下反应: S2O32-+I3-——S4O62-+3I- 反应(2)进行得非常快,几乎瞬间完成,而反应(1)却慢得多,于是由反应(1)生成的碘立 刻与S2O32-反应,生成了无色的S4O62-和I-,因此在开始一段时间内,看不到碘与淀粉作用 而显示出来的特有的蓝色,但是,一旦Na2S2O3耗尽,则继续游离出来的碘,即使是微量的,也能使淀粉指示剂变蓝。所以蓝色的出现就标志着反应(2)的完成。 从反应方程式⑴和⑵的关系可以看出,S2O82-浓度的减少量等于S2O32-减少量的一半, 2 c(S2O8 )c(S2O;) 2 因为S2O32-在溶液显蓝色时几乎完全耗掉,故^ C(S2O32-)实际上就等于反应开始时 Na2S2O3的浓度,由于本实验中的每份混合溶液只改变(NH4)2S2O8和KI的浓度,而使用的Na2S2O3的起始浓度都是相同的,因此到蓝色出现时已耗去的S2O82-即^ C(S2O82-)也都是相同的。这样只要记下从反应开始到溶液出现蓝色所需要的时间(△ t),就可以求算在各种不同浓 2 度下的平均反应速率C(S 2°8) t 实验证明:过二硫酸俊与碘化钾的反应速率和反应的浓度的关系如下: 2 值。8 ) t kc(S2。;)C(I ) k式中的为反应速率常数,C(S2O82-)和C(I-)分别为两种离子的初始浓度(mol ? L-1),利用 (3)即可求算出反应速率常数k值。 四、实验用品 量筒(10mL),烧杯(50mL),秒表,温度计(0?100C)。
实验化学反应速率与活化能
实验化学反应速率与活 化能 集团文件版本号:(M928-T898-M248-WU2669-I2896-DQ586-M1988)
实验 化学反应速率与活化能 一、实验目的 1.了解浓度、温度和催化剂对反应速率的影响。 2.测定过二硫酸铵与碘化钾反应的速率,并计算反应级数、反应速率常数和反应的活化能。 二、实验原理: 在水溶液中过二硫酸铵与碘化钾反应为: (NH 4)2S 2O 8 + 3KI === (NH 4)2SO 4 + K 2SO 4 + KI 3 其离子反应为: S 2O 82- + 3I - === SO 42- + I 3- (1) 反应速率方程为: n I m O S c kc r - - ?=28 2 式中r 是瞬时速率。若-28 2O S c 、- I c 是起始浓度,则r 表示初速率(v 0)。在实验 中只能测定出在一段时间内反应的平均速率。 在此实验中近似地用平均速率代替初速率: 为了能测出反应在△t 时间内S 2O 82-浓度的改变量,需要在混合(NH 4)2S 2O 8 和KI 溶液的同时,加入一定体积已知浓度的Na 2S 2O 3溶液和淀粉溶液,这样在(1)进行的同时还进行着另一反应: 2S 2O 32- + I 3- === S 4O 62- + 3I - (2) 此反应几乎是瞬间完成,(1)反应比(2)反应慢得多。因此,反应(1)生成的I 3-立即与S 2O 32-反应,生成无色S 4O 62-和I -,而观察不到碘与淀粉呈现的特征蓝色。当S 2O 32-消耗尽,(2)反应不进行,(1)反应还在进行,则生成的I 3-遇淀粉呈蓝色。 从反应开始到溶液出现蓝色这一段时间△t 里,S 2O 32-浓度的改变值为:
乙酸乙酯皂化反应速率常数的测定
乙酸乙酯皂化反应速率常数的测定 一、实验目的 1.学习电导法测定乙酸乙酯皂化反应速率常数的原理和方法以及活化能的测定方法; 2.了解二级反应的特点,学会用图解计算法求二级反应的速率常数; 3.熟悉电导仪的使用。 二、实验原理 (1)速率常数的测定 乙酸乙酯皂化反应时典型的二级反应,其反应式为: CH 3COOC 2H 5+NaOH = CH 3OONa +C 2H 5OH t=0 C 0 C 0 0 0 t=t Ct Ct C 0 - Ct C 0 -Ct t=∞ 0 0 C 0 C 0 速率方程式 2kc dt dc =- ,积分并整理得速率常数k 的表达式为: t 0t 0c c c c t 1k -?= 假定此反应在稀溶液中进行,且CH 3COONa 全部电离。则参加导电离子有Na + 、OH -、CH 3COO -,而Na +反应前后不变,OH -的迁移率远远大于CH 3COO -,随着反 应的进行, OH - 不断减小,CH 3COO -不断增加,所以体系的电导率不断下降,且体系电导率(κ) 的下降和产物CH 3COO -的浓度成正比。 令0κ、t κ和∞κ分别为0、t 和∞时刻的电导率,则: t=t 时,C 0 –Ct=K (0κ-t κ) K 为比例常数 t→∞时,C 0= K (0κ-∞κ) 联立以上式子,整理得:
∞+-?= κκκκt kc 1t 00t 可见,即已知起始浓度C 0,在恒温条件下,测得0κ和t κ,并以t κ对t t 0κκ-作图,可得一直线,则直线斜率0 kc 1 m = ,从而求得此温度下的反应速率常数k 。 (2)活化能的测定原理: )11(k k ln 2 1a 12T T R E -= 因此只要测出两个不同温度对应的速率常数,就可以算出反应的表观活化能。 三、仪器与试剂 电导率仪 1台 铂黑电极 1支 大试管 5支 恒温槽 1台 移液管 3支 氢氧化钠溶液(0.02mol/L ) 乙酸乙酯溶液(0.02mol/L ) 四、实验步骤 1.标定NaOH 溶液及乙酸乙酯溶液的配制 计算标定0.023/dm mol NaOH 溶液所需的草酸二份,放入锥形瓶中,用少量去离子水溶解之,标定溶液。计算出配制与NaOH 等浓度的乙酸乙酯溶液100mL 所需化学纯乙酸乙酯的质量,根据不同温度下乙酸乙酯的密度计算其体积(乙酸乙酯的取样是通过量取一定量的体积),于ml 100容量瓶中加入约3/2容积的去离子水,然后用1mL 移液管吸取所需的乙酸乙酯加入容量瓶中,加水至刻度,摇匀。 2.调节恒温水浴调节恒温水浴温度为30℃1.0±℃。 3.电导率0K 的测定 用mL 20移液管量取去离子水及标定过的NaOH 溶液各mL 20,在干燥的100mL 烧杯中混匀,用少量稀释后的NaOH 溶液淋洗电导电极及电极管3次,装入适量的此NaOH 溶液于电极管中,浸入电导电极并置于恒温水浴中恒温。将
一级反应速率常数测量
一级反应速率常数测量 一、 实验原理 1. 蔗糖水解反应是典型的一级,是一个准一级反应而已。 C 12H 22O 11+H 2O (酸催化)= C 6H 12O 6(葡萄糖)+C 6H 12O 6(果糖) 本是二级反应,由于水是大量的, 成为准一级反应。 -dc/dt =k 1c 积分: lnc = k 1t + B 或 lnc 0/c = k 1t 2. 旋光度α与浓度的关系。 20℃时,蔗糖的比旋光度〔α〕=66.6°;葡萄糖比旋光度〔α〕=52.5°; 果糖的比旋光度〔α〕=-91.9° 蔗糖水解反应,开始体系是右旋的角度大,随反应进行,旋光角度减少,变成左旋。旋光角度α与浓度关系式:α=〔α〕Lc L 是旋光管长度,〔α〕仅与温度有关,当温度,旋光管长度一定,α与浓度c 成正比。可写成 α=Kc 3 .用α表示的一级反应动力学方程: A ――→ B + D t=0 C 0 α0=K A C 0 (1) t=t CA C B =C 0-C A ; C D =C 0-C A αt =αA +αB +αD =K A C A +(K B +K D ) (C B +C D ) (2) t=∞ 0 C 0 ; C 0 α∞=(K B +K D )C 0 (3) (1)-(3): α0-α∞=(K A -K B -K D )C 0 C0=(α0-α∞)/(K A -K B -K D ) (2)-(3):α0-αt =(K A -K B -K D )C A C A =(α0-αt )/(K A -K B -K D ) 代入一级反应动力学方程: ∝-∝-==ααααt A c c t k 001ln ln 或 B t k c +-=1ln 得到 ')ln(1B t k t +-=-∝αα 二、仪器药品(略)
电导法测定乙酸乙酯皂化反应的速率常数含思考题答案
电导法测定乙酸乙酯皂化反应的速率常数 07化四 20072401175 钟国莉 指导老师:李国良 小组成员:肖玉婵 黄婷 钟国莉 【实验目的】 ①学习电导法测定乙酸乙酯皂化反应速率常数的原理和方法以及活化能的测定方法; ②了解二级反应的特点,学会用图解计算法求二级反应的速率常数; ③熟悉电导仪的使用。 【实验原理】 (1)速率常数的测定 乙酸乙酯皂化反应时典型的二级反应,其反应式为: CH 3COOC 2H 5+NaOH = CH 3OONa +C 2H 5OH t=0 C 0 C 0 0 0 t=t Ct Ct C 0 - Ct C 0 -Ct t=∞ 0 0 C 0 C 0 速率方程式 2kc dt dc =-,积分并整理得速率常数k 的表达式为: t 0t 0c c c c t 1k -?= 假定此反应在稀溶液中进行,且CH 3COONa 全部电离。则参加导电离子有Na + 、OH - 、 CH 3COO -,而Na +反应前后不变,OH -的迁移率远远大于CH 3COO - ,随着反应的进行, OH - 不断减小,CH 3COO - 不断增加,所以体系的电导率不断下降,且体系电导率(κ) 的下降和产物CH 3COO - 的浓度成正比。 令0κ、t κ和∞κ分别为0、t 和∞时刻的电导率,则: t=t 时,C 0 –Ct=K (0κ-t κ) K 为比例常数 t →∞时,C 0= K (0κ-∞κ) 联立以上式子,整理得: ∞+-?= κκκκt kc 1t 00t 可见,即已知起始浓度C 0,在恒温条件下,测得0κ和t κ,并以t κ对 t t 0κκ-作图, 可得一直线,则直线斜率0 kc 1 m = ,从而求得此温度下的反应速率常数k 。
丙酮碘化反应速率常数的测定讲义
丙酮碘化反应速率常数的测定 一、实验目的 1、掌握利用分光光度法测定酸催化时丙酮碘化反应速度常数及活化能的实验方法。 2、加深对复杂反应特征的理解。 二、实验原理 酸溶液中丙酮碘化反应是一个复杂反应,反应方程为: CH 3H 3C O +I 2 H + CH 2I H 3C O +I -+H + H +是反应的催化剂,由于丙酮碘化反应本身生成H +,所以这是一个自动催化反应。 实验测定表明,反应速率在酸性溶液中随氢离子浓度的增大而增大。反应式中包含产物,其动力学方程式为: r q p A A H c I c kc dt I dc dt dc )()()(22+=-=- =υ (1) 式中υ为反应速率,A c 、)(2I c 、)(+ H c 分别为丙酮、碘、盐酸的浓度(mol/L ),κ为反应速率常数,p 、q 、r 分别为丙酮、碘和氢离子的反应级数。速率、速率常数和反应级数均可由实验测定。 实验证明丙酮碘化反应是一个复杂反应,一般认为可分成两步进行,即: H + 2 C CH 2 H 3C OH C CH 2 H 3C O ( i ) C H 3C O C CH 2 H 3C OH I 2 CH 2I I - k 3 (ii) 反应(i)是丙酮的烯醇化反应,反应可逆且进行的很慢。反应(ii)是烯醇的碘化反应,反应快速且能进行到底。因此,丙酮碘化反应的总速度可认为是由反应(i)所决定。丙酮碘化反应对碘的反应级数是零级,故碘的浓度对反应速率没有影响,即动力学方程中q 为零,原来的速率方程可写成: r p A I H c kc dt dc )(2+=- =υ (2)
由于反应并不停留在一元碘化丙酮上,还会继续反应下去,故采取初始速率法,因此丙酮和酸应大大过量,而用少量的碘来限制反应程度。这样在碘完全消耗之前,丙酮和酸的浓度基本保持不变。由于反应速率与碘浓度无关(除非在酸度很高的情况下),因而直到碘全部消耗前,反应速率是常数。即: 常数==- =+r p A I H c kc dt dc )(2υ (3) 因此,将)(2I c 对时间t 作图为一直线,直线斜率即为反应速率。 为了测定指数p ,需要进行两次实验。先固定氢离子的浓度不变,改变丙酮的浓度,若分别用I 、II 表示这两次实验,使)(II A c =u )(I A c ,)(+ II H c = )(+ I H c ,由式子(3)可得: p I p I p p I r I p II r II p I II u A C A C u H C A kC H C A kC ===++ ) ()()()()()(υυ (4) u p I II lg lg =υυ (5) u p I II lg /lg υυ= (6) 同样方法可以求指数r 。使)(II A c =)(I A c I ,)(+ II H c =w )(+ I H c ,可得出: w r I III lg /lg υυ= (7) 根据式子(2),由指数、反应速率和浓度数据就可以计算出速率常数κ。由两个温度下的速率常数,由阿累尼乌斯公式: 1 21221lg 303.2k k T T T T R E -= (8) 求得化学反应的活化能E 。 因碘溶液在可见区有宽的吸收带,而在此吸收带中,盐酸、丙酮、碘化丙酮和碘化钾溶液则没有明显的吸收,所以可采用分光光度法直接测量碘浓度的变化,以跟踪反应进程。在本实验中,通过测定溶液510nm 光的吸收来确定碘浓度。溶液的吸光度A 与浓度c 的关系为: A=Kcd (9) 其中A 为吸光度,K 为吸光系数,d 为溶液厚度,c 为溶液浓度(mol/L )。在一定的溶质、
实验六化学反应速率与活化能
实验六 化学反应速率与活化能 【实验目的】 1.了解浓度、温度和催化剂对反应速率的影响。 2.测定过二硫酸铵与碘化钾反应速率,并计算反应级数、反应速率常数和反应的活化能。 3.测定不同温度下的速率常数并计算反应的活化能; 4.学习数据处理的一般方法及作图法。 【实验原理】 对反应: 反应速率表示 一段时间内的浓度变化即为平均反应速率。 在水溶液中过二硫酸铵和碘化钾发生如下反应: 其反应的微分速率方程可表示为: ①S2O8 2 - +3 I - ==2 SO4 2- + I3 - (慢) (1) S 2O 8 2 - +3 I - ==2 SO 4 2- + I 3 - (慢) (1) pD qC bB aA +→+t p c t q c t b c t a c r D d d d d d d d d C B A ==-=-=n I m O S c kc r - -=28 2
m+n=反应级数 近似地用平均速率代替初速率: 2S2O3 2- + I3 - = S4 O6 2- + 3I - (快) ② 加入一定体积已知浓度的Na2S2O3 溶液和淀粉溶液,在反应(1)进行的同时 由①②式可得: 蓝色出现(淀粉与过量碘反应)标志着S2O3 2-全部耗尽,由S2O3 2-浓度的改变量可以得到S2O8 2 - 浓度的改变量。 因此两边取对数,得lgr= mlg[s2o82-] + nlg[I-] + lgk [ I-]不变,lgr对lg[s2o82-] 作图,可得一直线,斜率即为m. 同样,保持[s2o82-] 不变,作图可计算n,从而可得反应级数。 通过m和n以及速率计算公式,可以得到速率常数k. 利用阿仑尼乌斯方程: 求得不同温度下的k,以lgk对1/T作图,可以计算反应活化能。 1. 量筒的作用 2. 秒表的使用 3. 作图方法 【基本操作】 实验用品: 仪器:烧杯、大试管、量筒、秒表、温度计 液体药品:KI(0.20mol·L-1),Na2S2O3(0.010mol·L-1 )淀粉溶液(0.4%),(NH4)2S2O8(0.20mol·L-1)Cu(NO3)2(0.02mol.L-1),KNO3(0.20mol.L-1)(NH4)2SO4(0.20mol.L-1), 材料:冰 【实验内容】 1、浓度对化学反应速率的影响 用同样方法按表1的用量进行编号I、II、III、V、等的实验。 20.0mL 0.20mol·L-1 KI溶液8.0mL 0.010mol.L-1 Na2S2O3溶液 4.0mL 0.2%淀粉溶液20.0mL 0.20mol·L-1 (NH4)2S2O8 溶液 混合均匀立即计时不断搅动迅速 ①加20.0mL 0.20mol·dm-3 KI溶液 ②加8.0mL 0.010mol·dm-3 Na2S2O3溶液 ③加2.0mL 0.2%淀粉溶液 ④混合均匀 ⑤20.0mL 0.20mol·dm-3(NH4)2S2O8溶液迅速倒入上述混合液中 ⑥同时启动秒表,并不断搅动 ⑦当溶液刚出现蓝色时,立即按停秒表记录反应时间和温度 表5-1 浓度对反应速率的影响室温:
皂化反应速率常数的测定实验数据处理
五、实验记录和处理 1、将实验数据记录于下表一中。 室温:24℃ 大气压:100.42KPa k0(25℃)=2.510 k∞(25℃)=0.896 k0 2、以k t对(k0-k t)/t作图,根据直线斜率求速率常数值。拟合直线见图一、图二。
k t (k 0-k t )/t 图一25℃下k t ~(k 0-k t )/t 拟合直线 注:拟合度R 2=0.99089,说明直线拟合的很好,可以用于计算。 k t (k 0-k t )/t 图二35℃下k t ~(k 0-k t )/t 拟合直线
注:拟合度R 2=0.9694,说明直线拟合地较好,可以用于计算。 (1)由图一知,直线斜率为15.70158 NaOH (分析纯):0.0832g 定容体积:100mL NaOH 浓度:0.0208mol/L 稀释后NaOH 浓度:0.0104mol/L ,即a=0.0104mol/L 。 根据推导公式: k t = ∞+-?k t k k t 0ak 1 所以,25℃时反应速率常数k=6.1238L/(mol ·min) 查阅书籍:25℃时的反应速率常数标准值为:6.4254L/(mol ·min) 因此实验测量的相对误差为:4.69% (2)由图二知,直线斜率为8.23511, a=0.0104mol/L 。 根据推导, k t = ∞+-?k t k k t 0ak 1 所以,35℃时反应速率常数k=11.6761L/(mol ·min) 查阅书籍,35℃时的反应速率常数标准值为:11.9411L/(mol ·min) 因此实验测量的相对误差为:2.2% 3、计算反应活化能。 根据Arrhenius 公式: lnk 2/k 1=E(T 2-T 1)/(RT 1T 2) 所需物理量的相关数值见表二: 表二求活化能所需物理量的相关数值 将数值代入公式,求得:E=49.29kJ/mol 将反应速率常数标准值代入公式,求得反应活化能的标准值:E=47.34kJ/mol 因此实验测量的相对误差为:4.12%
实验化学反应速率与活化能
实验 化学反应速率与活化能 一、实验目的 1.了解浓度、温度和催化剂对反应速率的影响。 2.测定过二硫酸铵与碘化钾反应的速率,并计算反应级数、反应速率常数和反应的活化能。 二、实验原理: 在水溶液中过二硫酸铵与碘化钾反应为: (NH 4)2S 2O 8 + 3KI === (NH 4)2SO 4 + K 2SO 4 + KI 3 其离子反应为: S 2O 82- + 3I - === SO 42- + I 3- (1) 反应速率方程为: n I m O S c kc r - - ?=28 2 式中r 是瞬时速率。若-28 2O S c 、- I c 是起始浓度,则r 表示初速率(v 0)。在实验中 只能测定出在一段时间内反应的平均速率。 t c r O S ??-= - 28 2 在此实验中近似地用平均速率代替初速率: t c c kc r O S n I m O S ??-= =- - -28 2 28 20 为了能测出反应在△t 时间内S 2O 82-浓度的改变量,需要在混合(NH 4)2S 2O 8 和KI 溶液的同时,加入一定体积已知浓度的Na 2S 2O 3溶液和淀粉溶液,这样在(1)进行的同时还进行着另一反应: 2S 2O 32- + I 3- === S 4O 62- + 3I - (2) 此反应几乎是瞬间完成,(1)反应比(2)反应慢得多。因此,反应(1)生成的I 3-立即与S 2O 32-反应,生成无色S 4O 62-和I -,而观察不到碘与淀粉呈现的特征蓝
色。当S 2O 32-消耗尽,(2)反应不进行,(1)反应还在进行,则生成的I 3- 遇淀粉呈蓝色。 从反应开始到溶液出现蓝色这一段时间△t 里,S 2O 32- 浓度的改变值为: )O S )O S )O S O S c c c c 始始终(((23 223 223 223 2][----=--=? 再从(1)和(2)反应对比,则得: 2 (23 2 28 2 ) O S O S c c 始--= ? 通过改变S 2O 82- 和I -的初始浓度,测定消耗等量的S 2O 82- 的物质的量浓度- ?28 2O S c 所需的不同时间间隔,即计算出反应物不同初始浓度的初速率,确定出速率方程和反应速率常数。 三、实验步骤 1.浓度对化学反应速率的影响 在室温条件下进行编号Ⅰ的实验。用量筒分别量取 L KI 溶液, LNa2S2O3溶液和 %淀粉溶液,全部注入烧杯中,混合均匀。 然后用另一量筒取 L(NH4)2S2O8溶液,迅速倒入上述混合溶液中,同时开动秒表,并不断搅拌,仔细观察。 当溶液刚出现兰色时,立即按停秒表,记录反应时间和室温。 按下表各溶液用量进行实验。 室温 ℃
乙酸乙酯皂化反应速率常数的测定实验报告
学号:201114120222 基础物理化学实验报告 实验名称:乙酸乙酯皂化反应速率常数的测定应用化学二班班级 03 组号 实验人姓名: xx 同组人姓名:xxxx 指导老师:李旭老师 实验日期: 2013-10-29 湘南学院化学与生命科学系
一、实验目的: 1、了解测定化学反应速率常数的一种物理方法——电导法。 2、了解二级反应的特点,学会用图解法求二级反应的速率常数。 3、掌握DDS-11A 型数字电导率仪和控温仪使用方法。 二、实验原理: 1、对于二级反应:A+B →产物,如果A ,B 两物质起始浓度相同,均为a ,则反应速率的表示式为 2)(x a K dt dx -= (1) 式中x 为时间t 反应物消耗掉的摩尔数,上式定积分得: x a x ta K -= ·1 (2) 以 t x a x ~-作图若所得为直线,证明是二级反应。并可以从直线的斜率求出k 。 所以在反应进行过程中,只要能够测出反应物或产物的浓度,即可求得该反应的速率常数。 如果知道不同温度下的速率常数k (T 1)和k (T 2),按Arrhenius 公式计算出该反应的活化能E ??? ? ??-?=122112)() (ln T T T T R T K T K E a (3) 2、乙酸乙酯皂化反应是二级反应,其反应式为: OH -电导率大,CH 3COO -电导率小。因此,在反应进行过程中,电
导率大的OH -逐渐为电导率小的CH 3COO -所取代,溶液电导率有显著降低。对稀溶液而言,强电解质的电导率L 与其浓度成正比,而且溶液的总电导率就等于组成该溶液的电解质电导率之和。如果乙酸乙酯皂化在稀溶液下反应就存在如下关系式: a A L 10= (4) a A L 2=∞ (5) x A x a A L t 21)(+-= (6) A 1,A 2是与温度、电解质性质,溶剂等因素有关的比例常数,0L , ∞L 分别为反应开始和终了时溶液的总电导率。t L 为时间t 时溶液的总 电导率。由(4),(5),(6)三式可得: a L L L L x t ·0 0??? ? ??--=∞ 代入(2)式得: ??? ? ??--=∞ L L L L a t K t t 0·1 (7) 重新排列即得: ∞+-= L t L L k a L t t 0·1 三、实验仪器及试剂 DDS-11A 型数字电导率仪1台(附铂黑电极1支),恒温槽1台, 秒表1只,电导池3支,移液管3支;0.0200mol /L 乙酸乙酯(新配的),O.0200mol /L 氢氧化钠(新配的)
乙酸乙酯皂化反应速率常数的测定
工程学院物理化学实验报告— 实验名称乙酸乙酯皂化反应速率常数的测定 一、实验目的 1.了解用电导法测立乙酸乙酯皂化反应速率常数和活化能: 2.了解二级反应的特点,学会用图解法求二级反应的速率常数; 3.掌握电导率仪的使用方法。 二、实验原理 1.二级反应动力学方程 A 4? B->产物 t=0 a a t=t a-x a-x -dc A/dt=-d(a-x)/dt=dx/dt=k(a-x) (2.9.1) 定积分得:kt=x/a(a-x) (2.9.2) 以x/(a-x)对t作图,若所得为一直线,证明是二级反应,由斜率即可求出反应速率常数k值如果知道不同温度下的速率常数k(T】)和k(T2),按阿仑尼乌斯方程计算岀该反应的活化能Ea?Ea=ln( k(T2)/k(TJ) xRTi T2/ (T2-T J)(2.93) 2.乙酸乙酯皂化反应是二级反应,反应式为: CH3COOC2H5+NaOH T CH3COONa+ C2H5OH t=0a a00 t=t a-x a-x X X (Toe00a a iq)=Ara K QO=A2 * a K l=Ai(a-x)+A2x 由上三式得:x=(Ku-K()a/ (KO-K?)>代入式(2.9.2),得 K=(KO-Kl) /ta(Ki-Kx) (2.9.4) 重新排列得:Z N KO-K O/kat g (2.9.5) 因此,以z对(KO-K.) /t作图为一直线即为二级反应,由斜率即可求岀反应速率常数k值: 由两个不同温度下测得的速率常数k(「)和k(T2),按式(2.93)计算出该反应的活化能Ea.
三、仪器和试剂 1.仪器:数字电导率仪1台,恒温水槽1套,叉形电导管2只,移液管(10ml,胖肚)3根; 2.药品:乙酸乙酯标准溶液(0.0212 mol-dnr3), NaOH标准溶液(0.0212 mol dml。 四、实验步 1.调节恒温槽 调肖温度为25°C,同时电导率仪提前打开预热。 2.Ko的测定 分别取10ml蒸餾水和10ml NaOH标准溶液,加到洁净干燥的叉形管中充分混匀,然后将其置于 25°C恒温槽中,恒温5min,并接上电导率仪,测其电导率值心。 3.z的测定 在另一支叉形管的直支管中加10ml CH3COOC2H5标准溶液,侧支管中加10ml NaOH标准溶液,放入25°C恒温5min后,将其混合均匀并立即记时,同时用该溶液冲洗电极三次,开始测 量其电导率值(由于反应为吸热反应,开始时会有所降低,因此一般从第6min开始读数)当反 应进彳亍6min, 9min, 12min, 15min, 20min, 25min, 30min, 35min, 40min时各测电导率一次,记录电 导率M及时间t。 反应结束后,倾去反应液,洗净电导池及电极,将钳黑电极浸入蒸慵水中。 4.调节恒温槽温度为35°C,重复上述步骤测左其心和M ,但在测圮时是按照进行4min, 6min, 8min. 10min, 12min, 15min> 18min, 21 min, 24 min, 27min, 30min 时测其电导率。 五、数据记录与处理 室温:24.9C 大气压力:100.46 kPa 初始浓度:C CH3COOC2H5=0.0212 mol? dm' C Naon=0.0212mol dnr3 ,
反应速率常数和活化能的测定[8]
实验一氯化一氯五氨合钴水合反应速率常数和活化能的测定[8] 1.实验仪器与药品 分析天平、722型分光光度计、秒表、恒温水浴、烧杯、25ML容量瓶、量筒、微型过滤装置、烘箱 CoCl2·6H2O(固体)、30%H2O2、0.3mol /L HNO3、6.0 mol/L HNO3 、NH4Cl (固体)、浓氨水、6mol/L HCl、浓HCl 、五水乙醇、丙酮、水。 2. 实验过程与方法 (1)[CoCl(NH3)5]Cl2的制备 在小烧杯中加入3ML浓氨水,再加入0.5g氯化铵搅拌使其溶解。在不断搅拌下分数次加入1g 研细的CoCl2·6H2O,得到黄红色[Co(NH3)6]Cl2沉淀。在不断搅拌下慢慢滴入1ML 30%H2O2溶液,生成深红色[Co(NH3)5H2O]Cl3溶液。慢慢注入3ML浓盐酸,生成紫红色[CoCl(NH3)5]Cl2晶体。将次混合物在水浴上加热15min 后,冷却至室温,用微型过滤装置抽滤。用2ML冰冷水洗涤沉淀,然后用2ML冰冷的6mol/L 盐酸洗涤,再用少量乙醇洗涤一次,最后用丙酮洗涤一次,在烘箱中于100---110℃干燥1---2h 。 (2)[CoCl(NH3)5]Cl2水合速度率常数和活化能的测定 称取0.0750g放入小烧杯中,加入少量水,置于水浴中加热使其溶解,再转移至25ML容量瓶中。然后加入1.25ML 6mol/LHNO3,用水稀释至刻度。溶液中配合物浓度为1.2×10-2mol/L,HNO3浓度为0.3mol/L。 将溶液分成二份,分别放入60℃和80℃的恒温水浴中,每隔5min测一次吸光度,当吸光度变化缓慢时,每隔10min测定一次,直至吸光度无明显变化为止。测定时以0.3mol/LHNO3溶液为参比液,用1cm 比色皿在550nm波长下进行测定。 以-ln(A-A∞)对t作图,由直线斜率计算出水合反应速率常数k。由60℃的k60和80℃的k80计算出水合反应的活化能。 ⒊实验结果与讨论 (1)实验结果 A∞=εcl=21.0×1×(0.75÷250.5÷0.025)=0.25
- 乙酸乙酯皂化反应速率常数的测定实验报告
- 乙酸乙酯皂化反应速率常数的测定 实验报告(李晓鸿)
- 乙酸乙酯的皂化反应速率常数
- 乙酸乙酯皂化反应速率常数测定
- 乙酸乙酯皂化反应速率常数及活化能的测定
- 物理化学 皂化反应速率常数测定
- 不同温度下乙酸乙酯皂化反应速率常数文献值
- 乙酸乙酯皂化反应速率常数的测定10510
- 【清华】实验九-乙酸乙酯皂化反应速率常数的测定
- 乙酸乙酯皂化反应速率常数及活化能的测定
- 乙酸乙酯皂化反应速率常数的测定
- 电导法测定皂化反应速率常数的影响因素
- 乙酸乙酯皂化反应速率常数的测定
- 乙酸乙酯皂化反应速率常数的测定
- 乙酸乙酯皂化反应速率常数影响因素研究
- 皂化反应速率常数及其活化能的测定数据作图
- 乙酸乙酯皂化反应速率常数的测定
- 实验11乙酸乙酯皂化反应速率常数的测定
- 乙酸乙酯皂化反应速率常数的测定2
- 乙酸乙酯皂化反应速率常数的测定实验报告(李晓鸿)
