小鼠取血方法

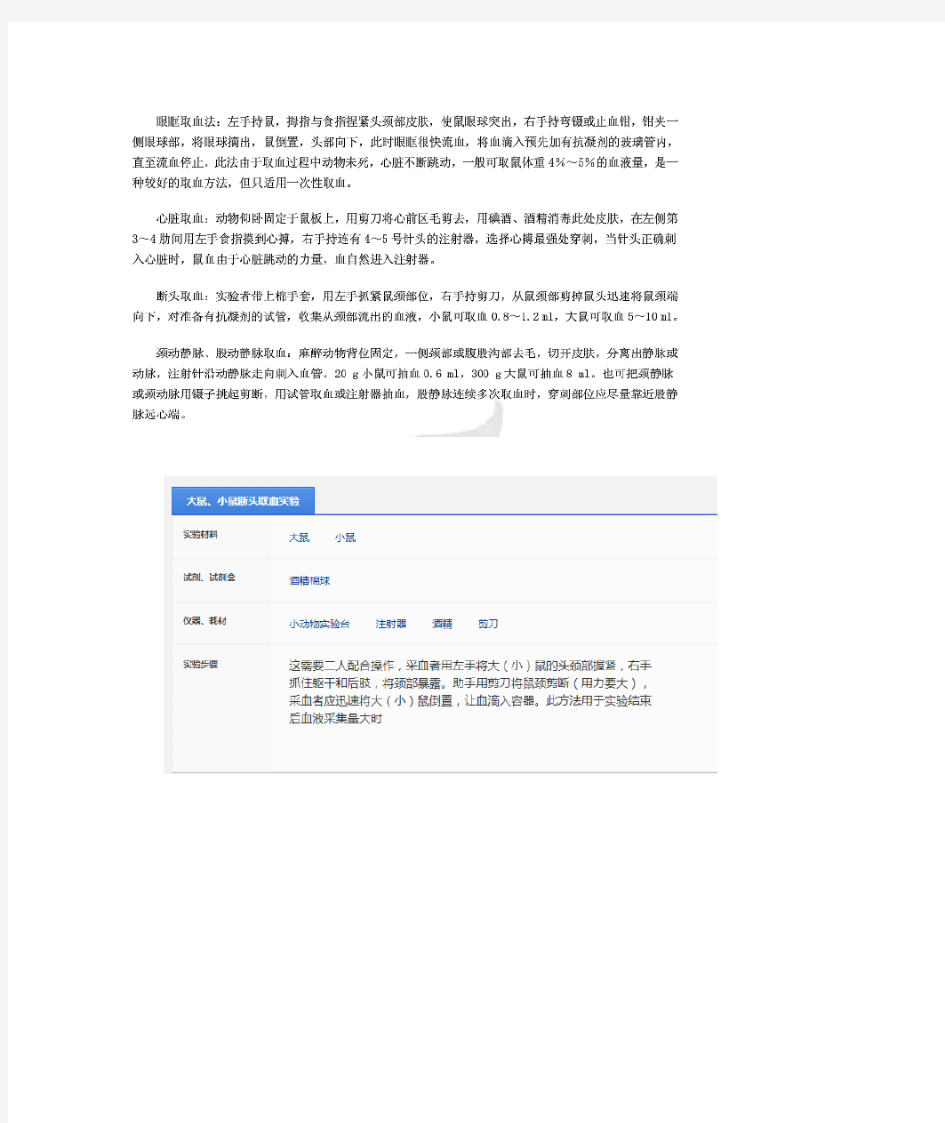
小鼠取血方法
主要有三类方法:
1、少量取血:鼠尾采血法——固定动物并露出鼠尾,将尾部侵入45-50度温水中数分钟,使静脉充血,擦干,再用酒精棉球擦拭消毒。剪掉尾尖约0.2-0.3cm。拭去第一滴血。然后用毛细管定量吸取尾血。采血完毕用棉球压迫止血
2、中等量取血:眼眶静脉丛采血——左手拇指及食指紧紧握住小鼠颈部,压迫颈部两侧使眶后静脉丛充血,但用力要恰当,防止动物窒息死亡。右手持玻璃毛细管从右眼或左眼内眦部以45度角刺入,刺入深度为2-3mm。若遇阻力稍后调整角度后再刺入,如穿刺恰当,血液能自然流入毛细管内。得到血厚,即除去颈部压力,拔出毛细管,用干棉球压迫止血
3、大量采血:断头采血——用于动物实验结束后。左手握住小鼠,右手持剪刀,快速剪掉头颈部,倒立动物让血液滴入容器。注意防止断毛落入
小鼠眼球取血.doc
小鼠摘除眼球采血及分离血清 一.器材 离心管,弯头镊子,离心机,移液器,剪毛剪,乙醚。 二.步骤 1.取血前准备 在相对封闭的空间内用棉花蘸取乙醚,对小鼠进行麻醉。用剪毛剪剪去胡子,防止发生溶血反应。 2 摘除眼球采血 (1)左手拇、食指抓取小鼠双耳及颈后皮肤,小指固定尾部; (2)中指将小鼠左侧前肢轻压在胸骨心脏部位,无名指按在腹部,捻动拇指,轻压取血侧眼部皮肤,使眼球充血突出; (3)用弯头镊夹取眼球; (4)根据需要捻动拇指与食指的方向,使血液从眼眶内以不同速度垂直流入离心管;(5)同时用左手中指轻按小鼠心脏部位,以加快心脏泵血速度; (6)当血液流尽时,用脱臼法处死小鼠。 3. 分离血清 (1)将离心管中的血置37℃温箱或水浴1小时,也可室温2小时; (2)再置4℃冰箱内3~4小时或过夜; (3)待血液凝固血块收缩后,4000rpm离心10分钟; (4)取上清于干净的离心管中,保存于-20℃,或加入防腐剂(0.01%硫柳汞或0.02%叠氮钠),置4℃冰箱中保存备用。 三.注意: 1. 采血前,可给小鼠喂点水; 2. 摘眼球采血取血量能达0.8~1.2ml,但老年和疾病小鼠血量会降低; 3. 采血场所有充足的光线;室温夏季保持在25~28℃,冬季,15~20℃为宜; 4. 防止血液浸入眼部周围毛发,否则会造成污染和溶血; 5. 按压心脏时,用力一定要适度,若用力过度,一是会造成动物采血中途死亡,使采血不完全,二是有可能引起溶血现象发生,影响实验结果; 6. 采血用的器材和试管必须保持清洁干燥; 7. 采血时要防止小鼠挣扎,否则会损失比较多的血样; 8. 血液凝固后不宜在4℃放置过久,否则会溶血。
实验大鼠取材方案
实验大鼠取材方案 [取材内容] 1.取大鼠静脉血,分离血浆、血清,-80℃保存。 2.取大鼠门静脉血,分离血清,-80℃保存。 3.取大鼠甲状腺组织,制备甲状腺电镜观察标本,其余组织液氮冰冻保存备用。 4.取大鼠胸腺组织,制备胸腺组织电镜观察标本、免疫组化观察标本,其余组织液氮冰冻 保存备用。 5.取大鼠肺组织,制备肺组织电镜观察标本、免疫组化观察标本,其余组织分装液氮冰冻 保存备用。 6.取大鼠肝脏组织,制备肝脏组织电镜观察标本、免疫组化观察标本,其余组织分装液氮 冰冻保存备用。 7.取大鼠胰腺组织,制备胰腺组织电镜观察标本、免疫组化观察标本,其余组织分装液氮 冰冻保存备用。 8.取大鼠肠系膜淋巴结组织,制备肠系膜淋巴结免疫组化观察标本,其余组织液氮冰冻保 存。 9.取大鼠胃部组织,制备胃粘膜组织电镜观察标本、免疫组化观察标本,其余组织分装液 氮冰冻保存备用。 10.取大鼠空肠组织,制备肠道粘膜组织电镜观察标本、免疫组化观察标本,其余组织分装 液氮冰冻保存备用。 11.取大鼠回肠组织,制备肠道粘膜组织电镜观察标本、免疫组化观察标本,其余组织分装 液氮冰冻保存备用。 12.取大鼠肾组织,制备左肾组织电镜观察标本、免疫组化观察标本,右肾组织液氮冰冻保 存备用。 13.取大鼠肾上腺组织,左侧制备肾上腺组织免疫组化观察标本,右侧肾上腺液氮冰冻保存 备用。 14.取大鼠睾丸组织,左侧制备电镜观察标本、免疫组化观察标本,右侧睾丸液氮冰冻保存 备有。 [试剂及药品] 戊巴比妥钠或10%水合氯醛、75%酒精、生理盐水、多聚甲醛或福尔马林液、3%戊二醛磷酸盐缓冲液(PBS0.01mol/LP pH7.4)或4%戊二醛、肝素钠、器械液(器械清洗消毒液) [器材] 备皮刀、解剖台、弯盘、组织剪、眼科剪、手术刀柄、刀片、小号弯式血管钳、蚊式血管钳、眼科镊、无损伤血管夹、聚乙烯管、三通管、丝线、培养皿、天平、一次性离心管(5ml、
常见小鼠给药和采血方法
小鼠灌胃 小鼠灌胃方法比较简单,需要关注的只有两点: 一是要保持小鼠的头部和颈部成一直线,方便灌胃针头进入; 二是动作要轻柔,从口角进入,防止损失食道。做的多了自然就熟练了。 具体操作过程如下: 1.准备灌胃针头。一般可以从市场上面买到,实在没有的话,可以用12号的针头,剪去针尖,用砂纸将头端磨平,也可以用。但是买的灌胃针头的头端用锡或者适宜的方法处理了针头的锐口,自己用砂纸不可能将所有的锐口都磨掉,用这样的针头灌胃,损失小鼠食道的可能性比较大。 2.抓住小鼠,使其头、颈和身体呈一直线。抓小鼠的动作很简单,左手的小指和无名指抓住小鼠的尾巴,另外三个手指抓住小鼠的颈部即可。因为小鼠始终在活动中,若一次抓的感觉不是很顺手,要放开重新抓,不要逞强进行下一步操作。 3.抓好小鼠就可以灌胃了,一般用1ml的注射器配灌胃针头。灌胃针头从小鼠的嘴角进入,压住舌头,抵住上颚,轻轻向内推进,进入食管后会有一个刺空感,进入食道后就可以推注药液了。(我认为,所谓的灌胃,不必要灌胃针头进入小鼠的胃部,进入食管后就可以推药了,这样对小鼠食道的损伤要小点,特别是要长期灌胃给药的情况下。)当然,灌胃针头也可以再往里面深入一点,防止药液从口中流出。 4.灌胃容积一般是0.1~0.2ml/10g,最大0.35ml/10g,每只小鼠的灌胃最大容积不超过0.8ml。 小鼠腹腔注射 腹腔注射是常见的给药方式,尤其是在麻醉时。常见的麻醉方法均是麻醉药物腹腔注射。 1.小鼠腹腔注射可以用1ml的注射器,配合4号针头。
2.腹腔注射时右手持注射器,左手的小指和无名指抓住小鼠的尾巴,另外三个手指抓住小鼠的颈部,使小鼠的头部向下。这样腹腔中的器官就会自然倒向胸部,防止注射器刺入时损伤大肠、小肠等器官。进针的动作要轻柔,防止刺伤腹部器官。 3.尤其是对于体重较小的小鼠,腹腔注射时针头可以在腹部皮下穿行一小段距离,最好是从腹部一侧进针,穿过腹中线后在腹部的另一侧进入腹腔,注射完药物后,缓缓拔出针头,并轻微旋转针头,防止漏液。 4.小鼠腹腔注射的给药容积一般为5~10ml/kg。 小鼠静脉注射 这也是常见的操作,稍微有点难度,没有指导的话,一开始可能会感觉有点手足无措。但是可以肯定的说,只要掌握了方法,小鼠的尾静脉注射还是很容易的。 操作步骤: 1.首先要固定小鼠,最简单的固定方法就是把小鼠放在盒子里面,让它的尾巴伸在盒盖的外面,用手抓住小鼠尾巴,轻轻往外拽,就可以固定好小鼠了。这种固定方法,小鼠可以在盒子里面活动,固定的也不是很牢固,但是只要你尾静脉注射的手法很熟练,就足以用来注射了。 还有的固定方法就是用一个小的圆筒,最好是金属做的,(可以在当地的铁匠铺,或者买白铁铺里面定做)首先是金属比较结实,而且可以用来固定在铁架台上,方便操作。圆筒的一段有个盖子可以拿下来,盖子中间有个小孔,可以让小鼠的尾巴伸出来(中间的小孔可以用胶布缠一下,防止锐利的边缘割伤小鼠尾巴)。另外一段可以用金属网的结构,网的形状可以做成子弹头的头端形状。网状结构可以让光线透近来,方便小鼠钻进圆筒里面。圆筒的长度约10cm,直径约3~4cm,可以做个系列长度和直径的圆筒,适合不同大小的小鼠。 2.固定好小鼠后就是注射了,一般用一次性的1ml的注射器就可以了,玻璃的1ml的注射器也可以用,针头用4号的就可以了。
小鼠、大鼠采血法介绍
小鼠、大鼠采血法 1.剪尾采血 当所需血量很少时采用本法。固定动物并露出鼠尾。将尾部毛剪去后消毒,然后浸在45℃左右的温水中数分钟,使尾部血管充盈。再将尾擦干,用锐器(刀或剪刀)割去尾尖0.3-0.5cm,让血液自由滴入盛器或用血红蛋白吸管吸取,采血结束,伤口消毒并压迫止血。也可在尾部作一横切口,割破尾动脉或静脉,收集血液的方法同上。每鼠一般可采血10余次以上。小鼠每次可取血0.1ml,大鼠0.3~0.5ml。 2.鼠尾刺血法 大鼠用血量不多时(仅做白细胞计数或血红蛋白检查),可采用本法。先将鼠尾用温水擦拭,再用酒精消毒和擦拭,使鼠尾充血。用7号或8号注射针头,刺入鼠尾静脉,拔出针头时即有血滴出,一次可采集10~50mm3。如果长期反复取血,应先靠近鼠尾末端穿刺,以后再逐渐向近心端穿刺。 3.眼眶静脉丛采血 采血者的左手拇食两指从背部较紧地握住小鼠或大鼠的颈部(大鼠采血需带上纱手套),应防止动物窒息。当取血时左手拇指及食指轻轻压迫动物的颈部两侧,使眶后静脉丛充血。右手持续接7号针头的1ml注射器或长颈(3~4cm)硬质玻璃滴管(毛细管内径0.5-1.0mm),使采血器与鼠面成45℃的夹角,由眼内角刺入,针头斜面先向眼球,刺入后再转180度使斜面对着眼眶后界。刺入浓度,小鼠约2~3mm,大鼠约4~5mm。当感到有阻力时即停止推进,同时,将针退出约0.1-0.5mm,边退边抽。若穿刺适当血液能自然流入毛细管中,当得到所需的血量后,即除去加于颈部的压力,同时,将采血器拔出,以防止术后穿刺孔出血。若技术熟练,用本法短期内可重复采血均无多大困难。左右两眼轮换更好。体重20-25g的小鼠每次可采血0.2-0.3ml;体重200-300g大鼠每次可采血0.5-1.0ml,可适用于某些生物化学项目的检验。 4.断头取血 采血者的左手拇指和食指以背部较紧地握住大(小)鼠的颈部皮肤,并作动物头朝下倾的姿势。右手用剪刀猛剪鼠颈,约1/2-4/5的颈部前剪断,让血自由滴入盛器。小鼠可采用约0.8~1.2ml;大鼠约5-10ml。 5.心脏采血 鼠类的心脏较小,且心率较快,心脏采血比较困难,故少用。活体采血方法与豚鼠相同。若做开胸一次死亡采血,先将动物作深麻醉,打开胸腔,暴露心脏,用针头刺入右心室,吸取血液。小鼠约0.5-0.6ml;大鼠约0.8-1.2ml。 6.颈动静脉采血 先将动物仰位固定,切开颈部皮肤,分离皮下结缔组织,使颈静脉充分暴露,可用注射器吸出血液。在气管两侧分离出颈动脉,离心端结扎,向心端剪口将血滴入试管内。 7.腹主动脉采血
大鼠取材方案
实验大鼠取材方案 [取材内容] 1. 取大歸脉血分离血衆血清-80 C保存。 2. 取大鼠门静脉血分离血清-80 C保存。 3. 取大鼠甲状腺组织.制备甲状腺电镜观察标本其余组织液氮冰冻保存备用〃 4. 取大鼠胸腺组织制备胸腺组织电镜观察标本、免疫组化孵标本其余组织液氮冰冻保存备用。 5. 取大鼠肺组织制备肺组织电镜观察标本,免疫组化观察标本其余组织分装液氮冰搽 保存备用。 6. 取大鼠肝脏组级制备肝脏组织电镜观察标本、免疫组化观察标本其余组织分装液氮冰冻保存备用。 7. 取大鼠觴组级制备康腺组织电镜观察标芯免疫组化观察标本其余组织分装液氮 冰冻保存备用。 8. 取大鼠肠系膜淋巴结组织制备肠系膜淋巴结免疫组化观察标本其余组织液氮冰冻保存。 9. 取鳩胃部组级制备胃粘膜组织电飙察标本免疫组化观察标本其余组织分装液氮冰冻保存备用。 10. 取大鼠空肠组级制备肠道粘膜组级电镜观察标本■免疫组化观集标本其余组级分装
液氮冰冻保存备用。 11. 取大鼠回肠组织制备肠道粘膜组织电镜观舉标技免疫组化观察标本其余组 织分装 液氮冰冻保存备用。 12. 取大關组织制备左肾组级电镜观察标本、免疫组化观察标本右肾组织液氮 冰探保 存备用。 13. 取大嵐肾上腺组织左侧制备肾上腺组级免疫组化观察标本右侧肾上腺液氮冰冻保 存 备用。 14. 取大鼠睾丸组级左侧制备电镜观察标本、免疫组化观察标本右侧睾丸液氮冰冻保存 备有。 [试剂及药品] 戊巴比妥钠或10%水合氯醛、75%酒精、生理盐水、多聚甲醛或福尔马林液、 3 应二醛 磷酸 盐缓冲液(PBS0.01mol/LP pH7.4)或 4 戍二肚肝素撤m器械清洗消毒液 [器材] 备皮刀、解剖台、弯盘、组织剪、眼科剪、手术刀柄、刀片、小号弯式血管钳、蚊式血管钳、 眼科镊、无损伤血管夹、聚乙烯管、三通管、丝线、培养皿、天平、一次性离2ml、1.5ml 、冻存氤肝麹真空采血管、微量移液議高速敲杠注射器10ml、5ml、
常见小鼠给药及采血方法
常见小鼠给药及采血方法 小鼠灌胃 小鼠灌胃方法比较简单,需要关注的只有两点: 一是要保持小鼠的头部和颈部成一直线,方便灌胃针头进入; 二是动作要轻柔,从口角进入,防止损失食道。做的多了自然就熟练了。 具体操作过程如下: 1. 准备灌胃针头。一般可以从市场上面买到,实在没有的话,可以用12号的针头,剪去针尖,用砂纸将头端磨平,也可以用。但是买的灌胃针头的头端用锡或者适宜的方法处理了针头的锐口,自己用砂纸不可能将所有的锐口都磨掉,用这样的针头灌胃,损失小鼠食道的可能性比较大。 2.抓住小鼠,使其头、颈和身体呈一直线。抓小鼠的动作很简单,左手的小指和无名指抓住小鼠的尾巴,另外三个手指抓住小鼠的颈部即可。因为小鼠始终在活动中,若一次抓的感觉不是很顺手,要放开重新抓,不要逞强进行下一步操作。 3. 抓好小鼠就可以灌胃了,一般用1ml的注射器配灌胃针头。灌胃针头从小鼠的嘴角进入,压住舌头,抵住上颚,轻轻向内推进,进入食管后会有一个刺空感,进入食道后就可以推注药液了。(我认为,所谓的灌胃,不必要灌胃针头进入小鼠的胃部,进入食管后就可以推药了,这样对小鼠食道的损伤要小点,特别是要长期灌胃给药的情况下。)当然,灌胃针头也可以再往里面深入一点,防止药液从口中流出。 4. 灌胃容积一般是0.1~0.2ml/10g,最大0.35ml/10g,每只小鼠的灌胃最大容积不超过0.8ml。 小鼠腹腔注射 腹腔注射是常见的给药方式,尤其是在麻醉时。常见的麻醉方法均是麻醉药物腹腔注射。 1. 小鼠腹腔注射可以用1ml的注射器,配合4号针头。 2. 腹腔注射时右手持注射器,左手的小指和无名指抓住小鼠的尾巴,另外三个手指抓住小鼠的颈部,使小鼠的头部向下。这样腹腔中的器官就会自然倒向胸部,防止注射器刺入时损伤大肠、小肠等器官。进针的动作要轻柔,防止刺伤腹部器官。 3. 尤其是对于体重较小的小鼠,腹腔注射时针头可以在腹部皮下穿行一小段距离,最好是从腹部一侧进针,穿过腹中线后在腹部的另一侧进入腹腔,注射完药物后,缓缓拔出针头,并轻微旋转针头,防止漏液。 4. 小鼠腹腔注射的给药容积一般为5~10ml/kg。 小鼠静脉注射
大鼠取血方法
大鼠取血方法 1. 割(剪)尾采血:当所需血量很少时采用本法。每鼠一般可采血10余次以上。小鼠每次可取 血0.1ml,大鼠0.3?0.5ml。 1.4見尖采血才法 将大杖囲進好?阳50乜左右SL水根池城部妁2 血骨 充血后?用球消黑、擦干BU匕用消澎手术旳的去尾尖3 ■ 10 mi叭魅后从用根那向尼尖檢忙血fl朋尖流岀。此法町采L5 -2 mL 2. 鼠尾刺血法:大鼠用血量不多时(仅做白细胞计数或血红蛋白检查),可采用本法。先将鼠尾用温水擦拭,再用酒精消毒和擦拭,使鼠尾充血。用7号或8号注射针头,刺入鼠尾静脉, 拔出针头时即有血滴出,一次可采集10?50mm3。如果长期反复取血,应先靠近鼠尾末端 穿刺,以后再逐渐向近心端穿刺。 3. 眼眶静脉丛采血:体重20-25g的小鼠每次可采血0.2-0.3ml ;体重200-300g大鼠每次可采血0.5-1.0ml,可适用于某些生物化学项目的检验。 将天M冊建庄实验台边Sfir左手抓囂大區拥那皮肤囿定头 部,井轻轻向下压迫用導先稚备好的io 号舍JM甘头顶蝎(怦尖斛閒朝内人垂氏插人内就并向眼底方向转动以便切开押体丛「血敕便会连缨不斷地溝人采血用此法大约可取?-3 取血宪毕?立刻用脱册郴压迫也 环境材料 0.9mm x 100mm,背牛人习櫃便用丫 经常骨—断.30mm晴、弁去屮阀段= EP 曲虻人0.1% IH-比钠< >150U/mgJ 0J mL-均匀涧湿? 50P减下I輻 适帀1mL伞血的抗甌效果肛人 取血则感须熒I R J衿住骨的质昂.杯号井汕. 邀当劣备. 1 Mi ■. ■■ iV ■■■. >■ -K> ■宽敬台曲*輕了F组多步驟同时操作] | ■ cm ■ ■ ■ ■ ■ ■ ■ ■■ ■琴 L9tt?EP &J
小鼠取血方法
1.割(剪)尾采血当所需血量很少时采用本法。固定动物并露出鼠尾。将尾部毛剪去后消毒,然后浸在45℃左右的温水中数分钟,使尾部血管充盈。再将尾擦干,用锐器(刀或剪刀)割去尾尖,让血液自由滴入盛器或用血红蛋白吸管吸取,采血结束,伤口消毒并压迫止血。也可在尾部作一横切口,割破尾动脉或静脉,收集血液的方法同上。每鼠一般可采血10余次以上。小鼠每次可取血,大鼠~。 2.鼠尾刺血法大鼠用血量不多时(仅做白细胞计数或血红蛋白检查),可采用本法。先将鼠尾用温水擦拭,再用酒精消毒和擦拭,使鼠尾充血。用7号或8号注射针头,刺入鼠尾静脉,拔出针头时即有血滴出,一次可采集10~50mm3。如果长期反复取血,应先靠近鼠尾末端穿刺,以后再逐渐向近心端穿刺。 3.眼眶静脉丛采血采血者的左手拇食两指从背部较紧地握住小鼠或大鼠的颈部(大鼠采血需带上纱手套),应防止动物窒息。当取血时左手拇指及食指轻轻压迫动物的颈部两侧,使眶后静脉丛充血。右手持续接7号针头的1ml注射器或长颈(3~4cm)硬质玻璃滴管(毛细管内径,使采血器与鼠面成45℃的夹角,由眼内角刺入,针头斜面先向眼球,刺入后再转180度使斜面对着眼眶后界。刺入浓度,小鼠约2~3mm,大鼠约4~5mm。当感到有阻力时即停止推进,同时,将针退出约,边退边抽。若穿刺适当血液能自然流入毛细管中,当得到所需的血量后,即除去加于颈部的压力,同时,将采血器拔出,以防止术后穿刺孔出血。若技术熟练,用本法短期内可重复采血均无多大困难。左右两眼轮换更好。体重20-25g的小鼠每次可采血;体重200-300g大鼠每次可采血,可适用于某些生物化学项目的检验。 4.断头取血采血者的左手拇指和食指以背部较紧地握住大(小)鼠的颈部皮肤,并作动物头朝下倾的姿势。右手用剪刀猛剪鼠颈,约1/2-4/5的颈部前剪断,让血自由滴入盛器。小鼠可采用约~;大鼠约5-10ml。 5.心脏采血鼠类的心脏较小,且心率较快,心脏采血比较困难,故少用。活体采血方法与豚鼠相同。若做开胸一次死亡采血,先将动物作深麻醉,打开胸腔,暴露心脏,用针头刺入右心室,吸取血液。小鼠约;大鼠约。 6.颈动静脉采血先将动物仰位固定,切开颈部皮肤,分离皮下结缔组织,使颈静脉充分暴露,可用注射器吸出血液。在气管两侧分离出颈动脉,离心端结扎,向心端剪口将血滴入试管内。 7.腹主动脉采血最好先将动物麻醉,仰卧固定在手术架上,从腹正中线皮肤切开腹腔,使腹主动脉清楚暴露。用注射器吸出血液,防止溶血。或用无齿镊子剥离结缔组织,夹住动脉近心端,用尖头手术剪刀,剪断动脉,使血液喷入盛器。 8.股动(静)脉采血先由助手握住动物,采血者左手拉直动物下肢,使静脉充盈。或者以搏动为指标,右手用注射器刺入血管。体重15-20g 小鼠采血约,大鼠约。
大鼠和小鼠的采血方法
大鼠和小鼠的采血方法(最全) 这里主要介绍几种大小鼠的采血方法,以帮助试验中需要用到相关技术的人员。 1)尾尖取血: 当所需血量很少时采用本法。固定动物并历出鼠尾,将鼠尾在 45 C温水中浸泡数分钟,也可用二甲苯等化学药物涂擦,使局新血管 扩张。将鼠尾擦干,剪去尾尖,血自尾尖流出,让血液滴入盛器或直接用移液器吸取。如需间隔一定时间,多次采取鼠尾尖部血液,每次采血时,将鼠尾剪去很小一段,取血后,先用棉球压迫止血并立即用6%液体火棉胶涂于尾巴伤口处,使伤口外结一层火棉胶薄膜,保护伤口。也可采用切割尾静脉的方法采血,三根尾势脉可交替切割,并自尾尖向尾根方向切割,每次可取0.2?0.3ml血,切割后用棉球压迫止血。这种采血方法在大鼠进行较好,可以较长的间隔时间连续取血,进行血常规检查。 (2)眼眶后静脉丛取血: 当需中等量的血液,而又需避免动物死亡时采用此法。用左手固定鼠,尽量捏紧头部皮肤,使头固定,并轻轻向下压迫颈部两侧,引起头部静脉血液回流困难,使眼球充分外突(示眼眶后静脉丛充血),右手持毛细玻璃管,沿内眦眼眶后壁向喉头方向旋转刺入。刺入深度小鼠2?3mm ,大鼠4?5mm。当感到有阻力时再稍后退,保持水平位,稍加吸引,由于血压的关系,血液即流人玻璃管中。得到所需的血量后,拨出毛细管。若手法恰当,小鼠约可采血0.2?0.3ml,大鼠约可采血0.4?
0.6ml。 (3)断头取血: 当需要较大量的血液,而又不需继续保存动物生命时采用此法。左手捉持动物,使其头略向下倾,右手持剪刀猛力剪掉鼠头,让血液滴入盛器。小鼠可采血0.8?1.0ml,大鼠可采用5?8ml。 (4)眶动脉和眶静脉取血: 此法既能采取较大量的血液,又可避免断头取血法中因组织液的混入导致溶血的现象,现常取代断头取血法。先使动物眼球突出充血后,以弯头眼科镊迅速钳取眼球,并将鼠倒置,头向下,眼眶内很快流出血液,让血液滴入盛器,直至不流为止。此法由于取血过程中动物未死,心脏不断在跳动,因此取血量比断头法多,一般可取鼠体重4?5 %的血液量,是一种较好的取血方法。 (5)心脏取血: 动物仰卧固定在固定板上,剪去心前区部位的被毛,用碘酒酒精消毒皮肤。在左侧第3?4肋间,用左手食指摸到心搏处,右手取连有4?5号针头的注射器,选择心搏最强处穿刺,当针刺入心脏时,血液由于心脏跳动的力量自动进人注射器。此法要求实验者掌握以下要点:要迅速而直接插入心脏,否则,心脏将从针尖处滑脱;如第一次没刺准,将针头抽出重刺,不要在心脏周围乱探,以免损伤心、肺; 要缓慢而稳定的抽吸,否则,太多的真空反而使心脏塌陷。若不需保留动物生命 时,也可麻*醉后切开动物胸部,将注射器直接刺人心脏抽吸血液。(6)大血管取血:
常用实验动物各种处死方法
常用实验动物各种处死方法 (一)大鼠和小鼠 1脊椎脱臼法:右手抓住尾巴将动物放在鼠笼盖或粗糙的表面上向后拉,用左手拇指和食指用力向下按住鼠头,使颈椎脱臼(脊髓与脑髓拉断),动物立即死亡。 2断头法:此法适用于鼠类小动物。用剪刀在颈部将鼠头剪断,并使颈部对准容器,以免血液四溅。由于脑脊髓离断且大量出血,动物立即死亡。 3击打法:此法适用于大鼠、家兔等。抓住动物尾部,提起,用力摔击头部,或用木捶用力捶其后脑部,动物痉挛后即处死。 4急性失血法: 常剪断动物的股动脉,放血致死。如果正在做手术性或解剖性实验,可剪断颈动脉,腹主动脉或剪破心脏放血。可采用摘眼球法,右手取一眼科弯镊,在鼠右或左侧眼球根部将眼球摘去,并将鼠倒置;头向下,大量失血而致死。 5化学药物致死法:在一密闭容器内,预先放有浸有全身麻醉作用的乙醚或氯仿的棉花,将动物投入容器内,使动物吸入麻醉药而致死。也可皮下注射士的宁(马钱子碱),注射量为小鼠0.76~2.0mg/kg,大鼠为3.0~3.5mg/kg。 (二)狗、猫、兔、豚鼠 1空气栓塞法 此法适用于较大动物的处死。向动物静脉内注射注入一定量的空气使之发生空气栓塞,形成严重的血液循环障碍而死。兔、猫用此法处死需注入20~40ml空气,犬致死的空气剂量为80~150ml。一般注如入后动物能很快死亡。本法的优点是处死方法简单、迅速。缺点是由于动物死于急性循环衰竭,各脏器淤血十分明显。 2急性失血法 先使动物麻醉、暴露股三角区或腹腔,再切断股动脉或腹主动脉,迅速放血。放血时可用湿纱布擦,或用少量自来水冲洗切口,以保持其畅通,动物在3~5分钟内即可死亡。采用此法动物十分安静,对脏器无损害,但器官贫血比较明显。 小鼠等小动物可采用颈总动脉大量失血而致死的方法。犬等大型动物要先麻醉后放血,要使放血的切口保持通畅,一般在股三角区横切约lOcm的切口,切断股动、静脉,便大量失血而死。 3破坏延脑法 对家兔可用木捶用力捶其后脑部,损坏延脑,动物痉挛后死亡。 4化学药物致死法 (1)静脉注射10%氯化钾(kCl)溶液,使动物心肌松弛,失去收缩能力,心脏发生急性扩大致心跳停止而死亡。成年兔由兔耳缘静脉注入10%氯化钾(kCl)溶液5~10ml /只,狗由狗前肢或后肢皮下静脉注入20~30ml/只,即可致死。 (2)静脉注射10%福尔马林溶液,使血液内蛋白凝固,动物由于全身血液循环严重障碍和缺氧而死。狗用20ml/只,即可致死。 (3)皮下注射的士宁致死:用量为:豚鼠为3.0~4.4mg/kg,家兔为0.5~1.Omg/kg,犬为0/3~0.42mg/kg。猫1.0~2.0mg/kg,大白鼠3.0~3.5mg/kg,小白鼠0.76~2.0mg/kg。 如果动物或其组织要送检,必须注明处死方法。 (三)蛙类 常用金属探针插入枕骨大孔,破坏脑脊髓的方法处死。将蛙用湿布包住,露出头部,左手执蛙,并用食指按压其头部前端,拇指按压背部,使头前俯;右手持探针由凹陷处垂直刺入,刺破皮肤即入枕骨大孔。这时将探针尖端转向头方,向前深入颅腔,然后向各方搅动,以捣
关于动物取血问题
1、关于小鼠血液量的问题: 小鼠循环血量占体重的6%,或50-70ml/kg,采血占全血量的10%不会对机体造成严重的不良影响。3-4周后可以重新采集一次。特别注意的是:老年小鼠血量降低。疾病会加重不良反应,所以必须考虑这些影响因素。采血后应补充响应体积的液体,如果需要很短时间反复采血,比如每天一次,每次的采血量不应超过全血的1%。 2、关于取血方法的问题: (1)尾尖取血:当所需血量很少时采用本法。固定动物并历出鼠尾,将鼠尾在45℃温水中浸泡数分钟,也可用二甲苯等化学药物涂擦,使局新血管扩张。将鼠尾擦干,剪去尾尖,血自尾尖流出,让血液滴入盛器或直接用移液器吸取。如需间隔一定时间,多次采取鼠尾尖部血液,每次采血时,将鼠尾剪去很小一段,取血后,先用棉球压迫止血并立即用6%液体火棉胶涂于尾巴伤口处,使伤口外结一层火棉胶薄膜,保护伤口。也可采用切割尾静脉的方法采血,三根尾势脉可交替切割,并自尾尖向尾根方向切割,每次可取0.2~0.3ml血,切割后用棉球压迫止血。这种采血方法在大鼠进行较好,可以较长的间隔时间连续取血,进行血常规检查。 (2)眼眶后静脉丛取血:当需中等量的血液,而又需避免动物死亡时采用此法。用左手固定鼠,尽量捏紧头部皮肤,使头固定,并轻轻向下压迫颈部两侧,引起头部静脉血液回流困难,使眼球充分外突(示眼眶后静脉丛充血),右手持毛细玻璃管,沿内眦眼眶后壁向喉头方向旋转刺入。刺入深度小鼠2~3mm,大鼠4~5mm。当感到有阻力时再稍后退,保持水平位,稍加吸引,由于血压的关系,血液即流人玻璃管中。得到所需的血量后,拨出毛细管。若手法恰当,小鼠约可采血0.2~0.3ml,大鼠约可采血0.4~0.6ml。 (3)断头取血:当需要较大量的血液,而又不需继续保存动物生命时采用此法。左手捉持动物,使其头略向下倾,右手持剪刀猛力剪掉鼠头,让血液滴入盛器。小鼠可采血0.8~1.0ml,大鼠可采用5~8ml。 (4)眶动脉和眶静脉取血:此法既能采取较大量的血液,又可避免断头取血法中因组织液的混入导致溶血的现象,现常取代断头取血法。先使动物眼球突出充血后,以弯头眼科镊迅速钳取眼球,并将鼠倒置,头向下,眼眶内很快流出血液,让血液滴入盛器,直至不流为止。此法由于取血过程中动物未死,心脏不断在跳动,因此取血量比断头法多,一般可取鼠体重4~5%的血液量,是一种较好的取血方法。 (5)心脏取血:动物仰卧固定在固定板上,剪去心前区部位的被毛,用碘酒酒精消毒皮肤。在左侧第3~4肋间,用左手食指摸到心搏处,右手取连有4~5号针头的注射器,选择心搏最强处穿刺,当针刺入心脏时,血液由于心脏跳动的力量自动进人注射器。此法要求实验者掌握以下要点:要迅速而直接插入心脏,否则,心脏将从针尖处滑脱;如第一次没刺准,将针头抽出重刺,不要在心脏周围乱探,以免损伤心、肺;要缓慢而稳定的抽吸,否则,太多的真空反而使心脏塌陷。若不需保留动物生命时,也可麻醉后切开动物胸部,将注射器直接刺人心脏抽吸血液。 (6)大血管取血:大、小鼠还可从颈动、静脉,股动、静脉和腋下动、静脉取血,在这些部位取血均需麻醉后固定动物,然后作动、静脉分离手术,使其暴露清楚后,用注射器沿大血管平行刺入(或直接用剪刀剪断大血管),抽取所需血量。切断动脉时,要防止血液喷溅。
采血方法
查看文章 实验动物的取血方法 2007-11-10 11:01 采血方法 (1)小鼠和大鼠 ①尾尖取血 将动物装在固定筒内,露出尾巴。将尾共剪掉1~2mm(小鼠)或5cm(大鼠),然后自尾根向尖端按摩,血自尾尖流出。亦可先将鼠尾泡于500C热水中,揩干后剪去尾尖,取血后用棉球压迫止血。此法可反复多次取血,小每次可取血0.1ml,大鼠0.3~0.5ml。 ②眶动脉和眶静脉取血 将动物头部按住并压迫眼球使突出充血后,以止血钳迅速钳取眼球后。眼眶内很快流出血液,将血滴入玻璃器皿内,达到所需采用量后用棉球压迫眼眶止血。此法所取血量较多,小鼠每次可采血0.2~0.3ml,大鼠每次可采血0.5~lml,动物可存活。间隔数日后可自另一侧眼眶取血。 ③眼眶后静脉丛取血 用一长约7~lOcm的玻璃毛细管(内径约1mm),另端渐扩大呈喇叭形,将其尖端折断。折断端锋利,预先将玻璃管浸入l%肝素溶液,取出干燥。取血时左手抓住鼠两耳间头部皮肤,使头固定,并轻轻向下压迫颈部两侧,使眼球充分外突,眼眶后静脉丛充血。右手持毛细管,将其尖端插入眼睑与眼球之间并向眼底方向移动,稍加吸引,血液即流入玻璃管中。取血完毕拔出毛细管,左手放松出血即停止。毛细管就叫“玻璃毛细管”,是硬质中性玻璃,内径:0.9--1.1mm, 壁厚0.1--0.15mm 管长120mm。 ④股静脉(或股动脉)取血 麻醉动物背位固定,切开左或右腹股沟的皮肤,作股静脉或股动脉分离手术。注射针穿刺股动脉或股静脉抽血,也可在颈静脉或颈动脉处穿刺取血。此法小鼠可采血0.2~0.8ml,大鼠约0.4~0.6ml。 ⑤断头取血 用剪刀剪掉鼠头,立即将鼠头向下,提起动物,将血滴入容器内。小鼠可采用0.8~1.2ml,大鼠5~lOml。 (2)豚鼠
动物取血方法
生理学实验动物的取血方法 (一)大鼠、小鼠 1、尾静脉 使鼠尾静脉充分充血后,用剪刀剪去尾尖,尾静脉知即可流出,用手轻轻从尾根部向尾尖部挤几下,可以取到数滴血。 2.眼眶动脉和静脉 用左手抓住鼠,拇指和食指尽量将鼠头部皮肤捏紧,使鼠眼球突出。右手取一无钩弯小镊,在鼠右侧眼球根部将眼球摘去,关将鼠倒置,头向下,此法由于取过程动物未死,心脏不断在跳动,因此取血量比断头法多,一般约可取出4-5%鼠体重的血液量。 1-27 切破鼠尾静脉方法
1-28 鼠尾静脉取血方法 3.后眼眶静脉丛连续穿刺 穿刺部位是在眼球和眼眶后界之间的后眼眶静脉丛。采用特制的硬玻璃吸管,管长15厘米,前端拉成毛细管。 取血时,用手从背部捉住动物,同时用食指和拇指握住颈部,利用对颈部所加的轻压力,使头部静脉淤血,将消毒的吸管用抗凝剂湿润其内壁,从内侧眼角将吸管转向前,并轻压刺入,深约4-5mm就达到后眼眶静脉丛,血液自然进入吸管内。
在得到所需血量后,除去加于颈部的压力,同时抽出吸管。 1-29 小鼠后眼眶静脉丛取血方法 1-30 大鼠后眼眶静脉丛取血方法 4.断头 用大鼠断头器或粗剪刀在鼠颈部将鼠头剪掉,实验者立即将鼠颈向下,提起动物,对准准备好的容器,鼠血即可从颈部滴入容器内。 如图1-31
5.心脏 左手固定鼠,在左侧第3-4肋间,用左手食指摸到心搏,右手取注射器选择心搏最强处穿刺。如图1-32 1-31 小鼠断头取血方法 1-32 小鼠心脏取血方法 6. 颈静脉 作一般颈外静脉分离手术。颈静脉暴露楚后,用注射器针头沿静脉平行方向刺入,抽取所需血量,采用此法取血,体重20克的小鼠可取0.6ml左右,体重300克的大鼠可取血8ml左右。
大鼠腹主动脉取血方法
●将大鼠腹腔注射 1 0 %水合氯醛以0。03 m L/kg麻醉,也可用3%戊巴比妥纳, 0.2ml/100g体重,注射麻醉剂后,直到身体全身变软,方可把大鼠仰卧固定在手术台 上,背部可以放置一粗试管以充分暴露腹主动脉,常规消毒后用手术剪刀沿腹正中线剪开腹腔,用小镊子轻轻扒开血管周围脂肪,再用棉球把覆盖在血管的多余脂肪擦静,直达清昕看清血管为止(用棉球可以尽量减少小血管破裂出血,影响接下来进针时的视线)。找腹主动脉在脊柱上面,腹腔静脉血管(比腹主动脉粗,黑)旁,找到后,术者先固定血管,尽可避免血管移位,左手拇指和食指固定住血管两旁的脂肪及其它脏器,无名指按住血管进针点的上端,降低血压,可以避免喷血,右手持穿刺针,针尖斜面朝下,人针角度约 30度左右,朝向心端方向刺人,深度以5 mm左右为宜,进针后可以用止血夹夹住针头,可以避免麻醉不够挣扎导致血管被针头戳破。可以反复采集多管的血样进行不同项目的测试,一般体重 2 0 0~ 3 0 0 g 的大鼠 用真空管采血可采血液 8~1 0 m L ,同周龄的老鼠,雄鼠可采的血量多余雌鼠。此方法特点是采血量多,但是只能采一次血,需要点技巧,需多次练习方可熟练。 ●图中粉红色为腹主动脉,粗、且黑为静脉 准备材料:需要一次性采血针和真空采血管 (是不是抗凝的由你自己决定) 取血方法:你应该见过护士给病人取血吧,原理是一样的,打开腹腔后,用镊子将腹腔脏器翻转到右侧(大鼠的左侧),即可见腹主动脉和后腔静脉,其中后腔静脉为暗红色,腹主动脉颜色发白.用小镊子剥离开腹主动脉旁边的筋膜组织(如果你技术熟练可以省略此步)然后用采血管做腹主动脉穿刺见回血后,另一端插入真空管之中,就会有血喷出,直到压力变小后再换一根真空管.
常见小鼠给药及采血方法
常见小鼠给药及采血方法 点击次数:2003 发表于:2008-06-19 06:29转载请注明来自丁香园 来源:互联网 小鼠灌胃 小鼠灌胃方法比较简单,需要关注的只有两点: 一是要保持小鼠的头部和颈部成一直线,方便灌胃针头进入; 二是动作要轻柔,从口角进入,防止损失食道。做的多了自然就熟练了。 具体操作过程如下: 1. 准备灌胃针头。一般可以从市场上面买到,实在没有的话,可以用12号的针头,剪去针尖,用砂纸将头端磨平,也可以用。但是买的灌胃针头的头端用锡或者适宜的方法处理了针头的锐口,自己用砂纸不可能将所有的锐口都磨掉,用这样的针头灌胃,损失小鼠食道的可能性比较大。 2.抓住小鼠,使其头、颈和身体呈一直线。抓小鼠的动作很简单,左手的小指和无名指抓住小鼠的尾巴,另外三个手指抓住小鼠的颈部即可。因为小鼠始终在活动中,若一次抓的感觉不是很顺手,要放开重新抓,不要逞强进行下一步操作。 3. 抓好小鼠就可以灌胃了,一般用1ml的注射器配灌胃针头。灌胃针头从小鼠的嘴角进入,压住舌头,抵住上颚,轻轻向内推进,进入食管后会有一个刺空感,进入食道后就可以推注药液了。(我认为,所谓的灌胃,不必要灌胃针头进入小鼠的胃部,进入食管后就可以推药了,这样对小鼠食道的损伤要小点,特别是要长期灌胃给药的情况下。)当然,灌胃针头也可以再往里面深入一点,防止药液从口中流出。 4. 灌胃容积一般是0.1~0.2ml/10g,最大0.35ml/10g,每只小鼠的灌胃最大容积不超过0.8ml。 小鼠腹腔注射 腹腔注射是常见的给药方式,尤其是在麻醉时。常见的麻醉方法均是麻醉药物腹腔注射。
1. 小鼠腹腔注射可以用1ml的注射器,配合4号针头。 2. 腹腔注射时右手持注射器,左手的小指和无名指抓住小鼠的尾巴,另外三个手指抓住小鼠的颈部,使小鼠的头部向下。这样腹腔中的器官就会自然倒向胸部,防止注射器刺入时损伤大肠、小肠等器官。进针的动作要轻柔,防止刺伤腹部器官。 3. 尤其是对于体重较小的小鼠,腹腔注射时针头可以在腹部皮下穿行一小段距离,最好是从腹部一侧进针,穿过腹中线后在腹部的另一侧进入腹腔,注射完药物后,缓缓拔出针头,并轻微旋转针头,防止漏液。 4. 小鼠腹腔注射的给药容积一般为5~10ml/kg。 小鼠静脉注射 这也是常见的操作,稍微有点难度,没有指导的话,一开始可能会感觉有点手足无措。但是可以肯定的说,只要掌握了方法,小鼠的尾静脉注射还是很容易的。 操作步骤: 1. 首先要固定小鼠,最简单的固定方法就是把小鼠放在盒子里面,让它的尾巴伸在盒盖的外面,用手抓住小鼠尾巴,轻轻往外拽,就可以固定好小鼠了。这种固定方法,小鼠可以在盒子里面活动,固定的也不是很牢固,但是只要你尾静脉注射的手法很熟练,就足以用来注射了。 还有的固定方法就是用一个小的圆筒,最好是金属做的,(可以在当地的铁匠铺,或者买白铁铺里面定做)首先是金属比较结实,而且可以用来固定在铁架台上,方便操作。圆筒的一段有个盖子可以拿下来,盖子中间有个小孔,可以让小鼠的尾巴伸出来(中间的小孔可以用胶布缠一下,防止锐利的边缘割伤小鼠尾巴)。另外一段可以用金属网的结构,网的形状可以做成子弹头的头端形状。网状结构可以让光线透近来,方便小鼠钻进圆筒里面。圆筒的长度约10cm,直径约3~4cm,可以做个系列长度和直径的圆筒,适合不同大小的小鼠。 2. 固定好小鼠后就是注射了,一般用一次性的1ml的注射器就可以了,玻璃的1ml 的注射器也可以用,针头用4号的就可以了。 3. 注射前首先要让小鼠的血管充盈。可以采用75%的酒精棉球擦拭的方法或者采用温水浸泡的方法。若小鼠的血管很不清楚,推荐采用温水浸泡的方法,水温以不烫手为宜。温水浸泡2~3分钟后,取出小鼠尾巴,用干棉球擦拭。等一会儿,待血管充盈后,酒精棉球
腹主动脉瘤模型制备
1.知识背景: 腹主动脉瘤(abdominal aortic aneurysm,AAA)是一类死亡率极高的主动脉疾病,其确切发病机制尚未明确。为探索AAA的发生机制和治疗方法,必须建立AAA的动物模型。 2.研究目的: 建立更为简便、稳定的AAA动物模型,为AAA疾病病机及治疗方法的研究提供与临床病例更为贴切的动物模型。 3.解剖学基础——腹主动脉及其分支:(参考人腹主动脉及其分支局部解剖)3.1脏支 不成对(奇数)脏支包括腹腔干、肠系膜上动脉和肠系膜下动脉。成对脏支包括肾上腺中动脉、肾动脉和睾丸(卵巢)动脉。 (一)肾上腺中动脉middlesuprarenal artery平第1腰椎高度发自腹主动脉侧壁,在胰后方行向外上至肾上腺。 (二)肾动脉renal artery在平第2腰椎高度发自腹主动脉,横行向外,在肾静脉后方经肾门入肾,在进入肾窦前分为前、后两干。右肾动脉从下腔静脉、胰头和12指肠降部的后方横过;左肾动脉则经胰体、脾静脉和肠系膜下静脉的后方。肾动脉在入肾前发出肾上腺下动脉。有时一侧可有两条或两条以上的肾动脉,不经肾门直接空入肾的上极或下极,叫做肾副动脉。 (三)睾丸(卵巢)动脉testicular(ovarian) artery在第二腰椎高度起自腹主动脉前壁,细而长,沿腰大肌前面行向外下,依次跨过输尿管和髂外动、静脉的前方,睾丸动脉至腹股沟管腹环处和输精管伴行入腹股沟管,参加精索的构成,并迂曲下行至睾丸后缘上端处,分支至睾丸和附睾。在精索内睾丸动脉前方有蔓状静脉丛,后方为输精管。行程中还发出细支至输尿管和提睾肌。卵巢动脉在小骨盆上缘进入卵巢悬韧带内,继续下行于子宫阔韧带内,分支至卵巢、输卵管和输尿管。 3.2壁支 (一)膈下动脉inferior phrenic artery在主动脉裂孔稍下起于腹主动脉,右侧者在下腔静脉后方,左侧者位于食管末段的后方,至中心腱处分为前、后支,分布于膈。膈下动脉还发出肾上腺上动脉
大鼠和小鼠的采血方法(最全)
大鼠和小鼠的采血方法(最全)这里主要介绍几种大小鼠的采血方法,以帮助试验中需要用到相关技术的人员。 1)尾尖取血: 当所需血量很少时采用本法。固定动物并历出鼠尾,将鼠尾在45℃温水中浸泡数分钟,也可用二甲苯等化学药物涂擦,使局新血管扩张。将鼠尾擦干,剪去尾尖,血自尾尖流出,让血液滴入盛器或直接用移液器吸取。如需间隔一定时间,多次采取鼠尾尖部血液,每次采血时,将鼠尾剪去很小一段,取血后,先用棉球压迫止血并立即用6%液体火棉胶涂于尾巴伤口处,使伤口外结一层火棉胶薄膜,保护伤口。也可采用切割尾静脉的方法采血,三根尾势脉可交替切割,并自尾尖向尾根方向切割,每次可取0.2~0.3ml血,切割后用棉球压迫止血。这种采血方法在大鼠进行较好,可以较长的间隔时间连续取血,进行血常规检查。 (2)眼眶后静脉丛取血: 当需中等量的血液,而又需避免动物死亡时采用此法。用左手固定鼠,尽量捏紧头部皮肤,使头固定,并轻轻向下压迫颈部两侧,引起头部静脉血液回流困难,使眼球充分外突(示眼眶后静脉丛充血),右手持毛细玻璃管,沿内眦眼眶后壁向喉头方向旋转刺入。刺入深度小鼠2~3mm,大鼠4~5mm。当感到有阻力时再稍后退,保持水平位,稍加吸引,由于血压的关系,血液即流人玻璃管中。得到所需的血量后,拨出毛细管。若手法恰当,小鼠约可采血0.2~0.3ml,大鼠
约可采血0.4~0.6ml。 (3)断头取血: 当需要较大量的血液,而又不需继续保存动物生命时采用此法。左手捉持动物,使其头略向下倾,右手持剪刀猛力剪掉鼠头,让血液滴入盛器。小鼠可采血0.8~1.0ml,大鼠可采用5~8ml。 (4)眶动脉和眶静脉取血: 此法既能采取较大量的血液,又可避免断头取血法中因组织液的混入导致溶血的现象,现常取代断头取血法。先使动物眼球突出充血后,以弯头眼科镊迅速钳取眼球,并将鼠倒置,头向下,眼眶内很快流出血液,让血液滴入盛器,直至不流为止。此法由于取血过程中动物未死,心脏不断在跳动,因此取血量比断头法多,一般可取鼠体重4~5%的血液量,是一种较好的取血方法。 (5)心脏取血: 动物仰卧固定在固定板上,剪去心前区部位的被毛,用碘酒酒精消毒皮肤。在左侧第3~4肋间,用左手食指摸到心搏处,右手取连有4~5号针头的注射器,选择心搏最强处穿刺,当针刺入心脏时,血液由于心脏跳动的力量自动进人注射器。此法要求实验者掌握以下要点:要迅速而直接插入心脏,否则,心脏将从针尖处滑脱;如第一次没刺准,将针头抽出重刺,不要在心脏周围乱探,以免损伤心、肺;要缓慢而稳定的抽吸,否则,太多的真空反而使心脏塌陷。若不需保留动物生命时,也可麻*醉后切开动物胸部,将注射器直接刺人心脏抽吸血液。
大鼠腹主动脉真空采血管采血法
万方数据
大鼠腹主动脉真空采血管采血法 作者:李研, 于峰 作者单位:国家沈阳新药安全评价研究中心, 刊名: 卫生毒理学杂志 英文刊名:JOURNAL OF HEALTH TOXICOLOGY 年,卷(期):2001,15(4) 被引用次数:2次 本文读者也读过(10条) 1.安丽.鲍清大鼠颈静脉采血新方法[期刊论文]-中国比较医学杂志2003,13(4) 2.邹洪.闫洪涛.李军.伍松.唐均成.汤礼军.Zou Hong.Yan Hongtao.Li Jun.Wu Song.Tang Juncheng.Tang Lijun 大鼠实验研究中三种采血方法的应用[期刊论文]-西南军医2011,13(5) 3.张颖.望文桢大鼠心脏采血的几点体会[期刊论文]-实验动物科学2008,25(1) 4.金玮.杨安怀.邢怡桥.Jin Wei.Yang Anhuai.Xing Yiqiao大鼠心脏穿刺采血方法的改进[期刊论文]-微循环学杂志2006,16(2) 5.罗卫国.张伟大鼠两种采血方法介绍[期刊论文]-第四军医大学吉林军医学院学报2000,22(1) 6.李卫国.罗艳蕊.翟心慧.张文学大鼠连续定时采血新方法--股动脉插管法[期刊论文]-生物学杂志2001,18(6) 7.王晶晶.焦昆.李兵.殷召雪.孟霞.乔欣.肖迎秋.卢静.WANG Jing-jing.JIAO Kun.LI Bing.YIN Zhao-xue.MENG Xia.QIAO Xin.XIAO Ying-qiu.LU Jing介绍一种新的大鼠颈外静脉插管方法[期刊论文]-实验动物科学2008,25(2) 8.吴清洪.顾为望.林继红.张嘉宁一种大鼠采血方法介绍[期刊论文]-动物医学进展2004,25(1) 9.张海燕.姬凤彩.马新.唐婧.李世东.郭莉丹.张慧洁不同间隔采血对大鼠血常规的影响[期刊论文]-实验动物与比较医学2010,30(4) 10.金玮.金化民.盛晖.姚颐.程帆剑突下入路的大鼠心脏穿刺采血法[期刊论文]-中华实验外科杂志2005,22(12)引证文献(2条) 1.邹洪.闫洪涛.李军.伍松.唐均成.汤礼军大鼠实验研究中三种采血方法的应用[期刊论文]-西南军医 2011(5) 2.谢兴文.许伟.李宁羌活鱼研粉物、水提及酸提物含药血清对骨髓间充质干细胞增殖及向成骨分化的影响[期刊论文]-中国组织工程研究与临床康复 2011(36) 本文链接:https://www.wendangku.net/doc/c616626877.html,/Periodical_wsdlxzz200104028.aspx
