测定植物遮阴效果

实验一:测定植物的遮阴效果
目的:
1. 加深对树种遮荫效果有关概念的理解,比较不同树种遮荫效果的差异。
2. 掌握常用测温仪的使用方法和遮荫效果的测定方法。
实验原理:
衡量树种遮阴效果的标准:荫质与遮阴面积;树冠的阴影质量称为荫质,单位:荫度,用n表示。决定荫质的主要因素为遮光率和降温率,其中全光照下的光照度和树荫中心部位光照度之差与全光照下光照度的百分比成为遮光率;全光照下的温度和树荫中心部分的温度之差与全光照下温度的百分比称为降温率;(树种遮阴效果也在一定程度上与冠长有关)上述概念可表表示为:
遮光率=全光照下的光照度—树荫中心部位的光照读×100%
全光照下的光照度
降温率=全光照下的温度—树荫中心部位的温度×100%
全光照下的温度
荫质=遮光率×降温率
遮阴面积={(南北冠幅+东西冠幅)/4}2π
遮荫效果=荫质×遮荫面积
即P值越高,相应树种的遮荫效果越好
方法和步骤:
选择方法:
1. 选择晴朗的中午,用时控制在较少时间内;
2. 选择生长情况相同并生长良好的树种;
3. 尽量选择单株生长不受外界环境影响的植物;
4. 每种树种至少选择三株测量冠幅:用皮尺分别测量南北冠幅和东西冠幅
测量冠长:目测
记录指标,分析绘制表格
综合上述指标,比较遮阴效果
结果与分析:
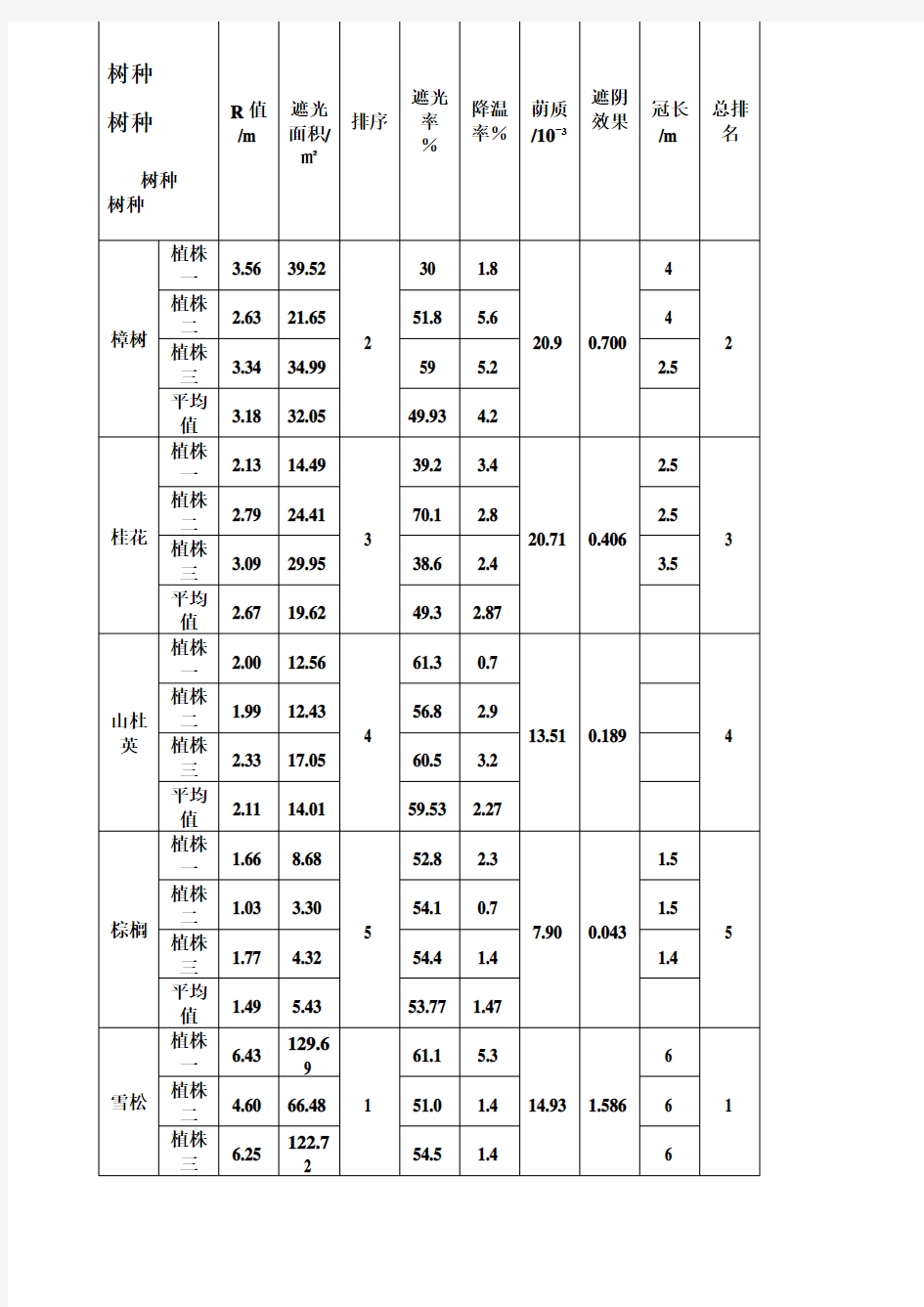
树种
树种
树种树种R值
/m
遮光
面积/
㎡
排序
遮光
率
%
降温
率%
荫质
/10ˉ3
遮阴
效果
冠长
/m
总排
名
樟树植株
一
3.56 39.52
2
30 1.8
20.9 0.700
4
2 植株
二
2.63 21.65 51.8 5.6 4
植株
三
3.34 3
4.99 59
5.2 2.5
平均
值
3.18 32.05 49.93
4.2
桂花植株
一
2.13 14.49
3
39.2 3.4
20.71 0.406
2.5
3 植株
二
2.79 24.41 70.1 2.8 2.5
植株
三
3.09 29.95 38.6 2.4 3.5
平均
值
2.67 19.62 49.3 2.87
山杜英植株
一
2.00 12.56
4
61.3 0.7
13.51 0.189 4 植株
二
1.99 1
2.43 56.8 2.9
植株
三
2.33 17.05 60.5
3.2
平均
值
2.11 14.01 59.53 2.27
棕榈植株
一
1.66 8.68
5
52.8 2.3
7.90 0.043
1.5
5 植株
二
1.03 3.30 54.1 0.7 1.5
植株
三
1.77 4.32 54.4 1.4 1.4
平均
值
1.49 5.43 53.77 1.47
雪松植株
一
6.43
129.6
9
1
61.1 5.3
14.93 1.586
6
1 植株
二
4.60 66.48 51.0 1.4 6
植株
三
6.25
122.7
2
54.5 1.4 6
入选《行道树种规划》的15种乔木分别是:落叶树种(10个):法桐、重阳木、栾树、无患子、珊瑚朴、臭椿、银杏、三角枫、枫香、水杉;常绿树种(5个):樟树、独干女贞、银木、广玉兰、黄心夜合。选择重点行道树遵循四个原则,一是能适宜本地生长环境,移植时成活率高;二是能适应管理粗放,对土壤、水分、肥料要求不高,抗性强;三是树干端直、树形端正、树冠优美、遮荫效果好;四是适应城市生态环境、对烟尘、风害等抗性强。 就遮阴效果而言雪松>樟树>桂花>山杜英>棕榈; 荫质排名:樟树>桂花>雪松>山杜英>棕榈; 遮阴面积排序:雪松>樟树>桂花>山杜英>棕榈
雪松与桂花的遮阴效果突出,但枝下高很低,不太适宜作为行道树,但雪松形体大,可以形成较大的阴影;
山杜英冠幅不大,枝叶较细腻,导致遮阴效果不佳;
樟树的降温率与遮光率都较高,成年的樟树仍可以形成较大的冠幅,故为适宜的行道树; 棕榈虽然枝叶较大,但不能形成冠大荫浓的效果。
从遮阴效果考虑武汉地区不适宜的行道树有棕榈、意杨、毛白杨、山杜英、松树、柳树、玉兰、银杏
适宜的行道树有悬铃木、樟树、栾树、广玉兰、复羽叶栾树、无患子 从遮光效果考虑不适宜的庭荫树有:合欢、旱柳、
适宜的庭荫树有:鹅掌楸、樟树、玉兰、枫杨、广玉兰、重阳木、乌桕、朴树、苦楝、泡桐、枫杨、女贞
平均值 5.76 106.2 55.53 2.7
植物组织水势的测定实验报告.doc
植物组织水势的测定实验报告 一、实验目的和要求 了解植物组织中水分状况的另一种表示方法及用于测定的方 法和它们的优缺点。 二、实验原理 小液流法测定新鲜白萝卜的组织水势。植物细胞是一个渗透系统。当组织水势低于溶液渗透势,组织吸水,溶液变浓,比重增加,小液流下沉。当组织水势高于溶液渗透势,组织失水,溶液变稀,比重下降,小液流上浮。当组织水势等于溶液渗透势,组织与溶液达到水分进出动态平衡,溶液浓度和比重不变,小液流不动。 压力室法测定海桐叶片组织水势,植物叶片通过蒸腾作用产生蒸腾拉力。导管中的水分由于内聚力的作用而形成连续的水柱。因此,对于蒸腾着的植物,其导管中的水柱由于蒸腾拉力的作用,使水分连贯地向上运输。当叶片或枝条被切断时,木质部中的液流由于张力解除迅速缩回木质部。将叶片装入压力室钢筒,切口朝外,逐渐加压,直到导管中的液流恰好在切口处显露时,所施加的压力正好抵偿了完整植株导管中的原始负压。 三、主要仪器设备 小液流法:白萝卜、打孔器、10ml离心管、小刀、镊子、注射器、1mol/L蔗糖溶液、甲基橙压力室法:压力室 四、操作方法和实验步骤
小液流法: 1、用1mol/l的蔗糖溶液配制0.05、0.10、0.20、0.30、0.40、0.50M一系列不同浓度的蔗糖溶液(10mL),用力混匀。 2、分别取4ml不同浓度的溶液到另一组相应的试管中。每管加入厚度约为1mm的萝卜圆片,加塞放置30min。期间晃动(3-4次)。 3、用针蘸取少量甲基橙放入每支试管,混匀。 4、用注射器取少许黄色溶液,伸入对应浓度的蔗糖溶液中部,缓慢挤出一滴小液滴,观察小液滴移动方向并记录。 Ψw(Mpa) = -iCRT = -0.0083×(273+toC) ×浓度 压力室法: 根据植物材料选取枝条(或叶片)型的压力室盖→将试样装入压力室盖的孔(或槽)中夹紧,压入压力室并顺时针旋转紧固。打开钢瓶阀门,使控制阀朝向加压,缓慢打开测定阀,使加压速率达0.1bar,仔细观察伸出压力室盖的植物样品,一发现木质部转湿润液体溢出,立即关闭测定阀,记录压力表读数。 组织Ψw(Mpa) = -0.1×压力室压力表读数 五、实验数据记录和处理 小液流法测定结果: 其他两个小组的实验结果: 根据公式计算得到萝卜组织液浓度 Ψw(Mpa) = -iCRT = -0.0083×(273+t℃) ×浓度= -0.0083×(273+16 ) ×0.1=-0.240Mpa
果胶含量的测定方法二
果胶的测定(方案一): 黄晓钰,刘邻渭等.食品化学综合实验[M].中国农业大学出版社. 2002.158~159 实验原理:果胶经水解,其产物——半乳糖醛酸可在强酸环境中与咔唑试剂产生缩合反应,生成紫红色化合物,其呈色深浅与半乳糖醛酸含量成正比,由此可进行比色定量 测定果胶。 实验试剂:1.化学纯无水乙醇或95%乙醇。 2.精制乙醇:取无水乙醇或95%乙醇1000ml,加入锌粉4g,硫酸(1:1)4ml, 至于衡温水浴中回流10h,用全玻璃仪器蒸馏,馏出液每1000ml加锌粉和氢 氧化钾各4g,并进行蒸馏。 3. 0.15%咔唑乙醇溶液:称取咔唑g,溶于精制乙醇并定容至100ml。 4.半乳糖醛酸标准溶液:先用水配置成浓度1 g/L的溶液,再配制成浓度分别为 (0、10mg/L、20 mg/L、30 mg/L、40 mg/L、50 mg/L、60 mg/L、70mg/L)的 系列半乳糖醛酸标准溶液。 5.优级纯浓硫酸。 操作方法:1样品处理: 总果胶提取:(鲜样)研磨新鲜样品50g,放入1000ml烧杯中,加入L HCl 400mL,放置沸水浴中加热1h,加热时应随时补充蒸发损失的水分。冷却后, 移入500ml容量瓶,定容摇匀,过滤,滤液待用。(干样)磨细的干燥样品 5g,置于250ml三角烧瓶,加入L HCL 150ml,装上冷凝器,与沸水浴中加热 回流1h,取出冷却甚至室温,用水定容至200ml,摇匀,过滤,滤液待用。 水溶性果胶提取:新鲜样品应尽量研磨碎,干燥的样品应磨细后过60目筛。 样品中存在有果胶酶时,为了顿化酶的活性,可以加入适量热的95%乙醇, 是样品溶液的乙醇最终浓度约为70%,然后于沸水浴中沸腾回流15min,使果 胶酶钝化,冷却过滤后,以95%乙醇洗涤多次,再用乙醚洗涤,以除去全部 糖类、脂类及色素,最后风干除去乙醚。 2果胶提取:水溶性果胶的提取:将样品研碎,新鲜样品标准称取30~50g,干 燥样品准确称取5~10g至于250ml烧杯,加入150ml水。加热至沸腾,并保 持此状态1h。加热过程随时填补蒸发损失的水分。取出冷却,将杯中物质移 入250ml容量瓶,用水洗涤烧杯,洗液并入容量瓶,最终定容至刻度,摇匀 过滤,记录滤液体积。 3标准曲线制作:取试管8支,各加入12ml浓硫酸,置冰水浴中冷却后,分别 将各种浓度的半乳糖醛酸2ml 徐徐各加入试管中,充分混匀后,再置冰水浴 中冷却,然后置沸水浴中加热10min,迅速冷却至室温,各加入1ml %咔唑试 剂,摇匀,与室温下静置30min,用0好使观众的溶液调仪器零点,在530nm 波长下测定各管溶液的A530nm值,以A为横坐标,半乳糖醛酸浓度为纵坐标 绘制标准曲线。 4测定:取果胶提取液用水稀释至适量浓度(含半乳糖醛酸10~70mg/L)。移 取12ml 冰水冷却的浓硫酸加入试管中,然后加入2ml 样品稀释液,充分混 合后,至于冰水冷却。取出后在沸水浴中加热10min,冷却至室温,加入1mL % 咔唑试剂,摇匀,于室温下静置30min,用空白试剂调零,在530nm波长下 测定A530nm值,与标样对照,求出样品果胶含量。 计算:
植物组织水势的测定实验报告
植物组织水势的测定(小液流法) 实验目的: 1. 了解测定植物组织水势的方法及其优缺点 2. 学习用小液流法测定植物组织水势的方法 实验原理: 实验原理 1、当植物组织与外液接触时发生水分交换: 植物组织的水势低于外液的渗透势(溶质势),组织吸水,外液浓度变大;ψ植物<ψS 植物组织的水势高于外液的渗透势(溶质势),组织失水,外液浓度变小;ψ植物> ψS 若两者相等,则水分交换保持动态平衡,外液浓度保持不变;ψ植物=ψS 2、同一种物质浓度不同时其比重不一样,浓度大的比重大,把高浓度的溶液一小液滴放到低浓度溶液中时,液滴下沉;反之则上升。 3、根据外液浓度的变化情况即可确定与植物组织相同水势的溶液浓度 实验仪器与试剂 试管架试管打孔器毛细管镊子青霉素瓶蔗糖溶液甲烯蓝粉末 操作步骤 1. 配制不同浓度的蔗糖溶液
2.用打孔器在绣球花的不同部位打100-200片,混匀,每个青霉素瓶各放入15-20片,(打孔要迅速,避开叶脉,选边缘整齐无破损的叶片) 3.从配制好的试管中各取2ml(量准确?)到相应的青霉素瓶或称量瓶中(用一只移液管由低高,不要润洗)。放置20—30min,期间摇动数次,以加速水分平衡。 4. 染色:用接种针沾入微量甲烯蓝粉末加入青霉素瓶中,摇匀,溶液变蓝。(干燥针头先用蒸馏水湿润,加入的甲烯蓝量一定少,使各瓶中颜色基本一致) 5.观察液滴升降: 用毛细吸管取青霉素瓶有色液插入相应试管中部缓慢从毛细吸管尖端横向放出一滴蓝色溶液,轻轻取出滴管,观察蓝色液滴的移动方向并记录。(用白纸划一直线置于试管背面,方便观察)6.分别测定不同浓度中有色液滴的升降,找出与组织水分势相当的浓度,根据原理公式计算出组织的水势。 实验结果
试验5植物组织水势的测定小液流法
实验5 植物组织水势的测定(小液流法) 一、原理 当植物组织与外液接触时,如果植物组织的水势低于外液的渗透势(溶质势),组织吸水、重量增大而使外液浓度变大;反之,则组织失水、重量减小而外液浓度变小;若两者相等,则水分交换保持动态平衡,组织重量及外液浓度保持不变。根据组织重量或外液浓度的变化情况即可确定与植物组织相同水势的溶液浓度,然后根据公式计算出溶液的渗透势,即为植物组织的水势。溶液渗透势的计算: Ψs = - iCRT ( 6 – 1 ) 式中:Ψs ——溶液的渗透势,以 MPa 为单位。 R ——气体常数,为0.008314 MPa · L/ (mol · K )。 T ——绝对温度,即273 + t ℃。 C ——溶液的质量摩尔浓度,以 mol/kg 为单位。 i ——为解离系数, CaCl 2 为 2.6 。 二、实验材料、试剂与仪器设备 (一)实验材料 植物叶片或洋葱鳞茎。 (二)试剂 1 .甲烯蓝粉末。 2 . CaCl 2 溶液:包括 0.10 、 0.15 、 0.20 、 0.25 、 0.30 、 0.35 、 0.40 、 0.45 mol/kg 8 种不同质量摩尔浓度的溶液。 (三)仪器设备 大试管 8 支 , 小试管 8 支,青霉素小瓶 8 支,移液管( 5mL ),毛细吸管 8 支,培养皿,打孔器,剪刀 l 把,镊子 1 把,解剖针 1 支。 三、实验步骤
1. 编号贴标签取干燥洁净的大试管 8 支,小试管 8 支,青霉素小瓶 8 支,毛细吸管 8 支,编号贴标签,按序号排好。 2. 打取、浸泡叶片取待测样品的功能叶数片,用打孔器打取小圆片约 60 片,放在培养皿中,混合均匀。用镊子分别把 5 ~ 8 个小圆片放到盛有 4 mL 不同质量摩尔浓度 CaCl 2 溶液的青霉素小瓶中,浸没叶片,盖紧瓶塞,放置 30 min ,并不断轻摇小瓶,以加速水分平衡(如温度低时可延长放置时间)。 3. 染色到预定时间后,用解剖针尖蘸取微量甲烯蓝粉末,加入各青霉素小瓶中,并摇动,使溶液染色均匀。 4. 测定把试管中的不同浓度的系列标准液分别倒入相同编号的小试管中,用毛细吸管吸取相同编号青霉素小瓶内的有色溶液少许,插入相同编号的小试管溶液中部,轻轻挤出有色溶液一小滴,小心取出毛细管(勿搅动有色液滴),观察有色液滴的升降情况,并记录于表 6 –1 中。若有色溶滴上升,表示浸过叶片的溶液浓度变小(即植物叶片组织中有水排出),说明叶片组织的水势大于该浓度溶液的溶质势;若有色液滴下降,则说明叶片组织的水势小于该浓度的溶质势;若有色小液滴静止不动,说明叶片组织的水势等于该浓度溶液的溶质势。若在前一浓度溶液中下降,而在后一浓度中上升,则植物组织的水势可取二种浓度溶液的溶质势的平均值。 分别测定不同浓度中有色液滴的升降,找出与组织水势相当的浓度。记录实验时的温度,根据原理中公式( 6 – 1 )计算出组织的水势。 表 6-1 小液流法现象观察记载表 [ 注意事项 ] 1. 所取材料在植株上的部位要一致,打取叶圆片要避开主脉和伤口。 2. 取材以及打取叶圆片的过程操作要迅速,以免失水。 3. 带结晶水的甲烯蓝不易溶于 CaCl 2 溶液,可在100 ℃下烘干成无水甲烯蓝粉末使用。 4. 毛吸管尖端弯成直角,以保证从中出来的液滴不受向下力的影响。 [ 思考题 ] 用小液流法测定植物组织水势时,为什么应强调所用试管、毛吸管应保持干燥,打取小圆片并投入试管中时动作应迅速,加入甲烯蓝不能太多?
果胶的提取与果胶含量的测定
果胶的提取与果胶含量 的测定 Document number:NOCG-YUNOO-BUYTT-UU986-1986UT
果胶的提取与果胶含量的测定 一、引言 果胶广泛存在于水果和蔬菜中,如苹果中含量为—%(以湿品计),在蔬菜中以南瓜含量最多(达7%-17%)。果胶的基本结构是以α-1,4苷键连接的聚半乳糖醛酸,其中部分羧基被甲酯化,其余的羧基与钾、钠、铵离子结合成盐。在果蔬中,尤其是未成熟的水果和皮中,果胶多数以原果胶存在,原果胶通过金属离子桥(比如Ca2+)与多聚半乳糖醛酸中的游离羧基相结合。原果胶不溶于水,故用酸水解,生成可溶性的果胶,再进行提取、脱色、沉淀、干燥,即为商品果胶。从柑橘皮中提取的果胶是高酯化度的果胶(酯化度在70%以上)。在食品工业中常利用果胶制作果酱、果冻和糖果,在汁液类食品中作增稠剂、乳化剂。 二、实验材料、试剂与仪器 材料:桔皮,苹果等; 试剂:%HCL,95%乙醇(AR),精制乙醇,乙醚,LHCl,%咔唑乙醇溶液,半乳糖醛酸标准液,浓硫酸(优级纯) 仪器:分光光度计,50mL比色管,分析天平,水浴锅,回流冷凝器,烘箱等三、实验步骤 (一)果胶的提取 1、原料预处理:称取新鲜柑橘皮20g(或干样8g),用清水洗净后,放入250mL容量瓶中,加水120mL,加热至90℃保持5-10min,使酶失活。用水冲洗后切成3~5mm的颗粒,用50℃左右的热水漂洗,直至水为无色、果皮无异味为止(每次漂洗必须把果皮用尼龙布挤干,在进行下一次的漂洗)。 2、酸水解提取:将预处理过的果皮粒放入烧杯中,加约%HCL溶液,以浸没果皮为宜,调pH至~,加热至90℃煮45min,趁热用100目尼龙布或四层纱布过滤。 3、脱色:在滤液中加入~%的活性炭,于80℃加热20min,进行脱色和除异味,趁热抽滤(如抽滤困难可加入2%~4%的硅藻土作为助滤剂)。如果柑橘皮漂洗干净萃取液为清澈透明则不用脱色。
原果胶含量试剂盒说明书
货号:MS3113 规格:100管/48样 原果胶含量试剂盒说明书 微量法 注意:正式测定之前选择2-3个预期差异大的样本做预测定。 测定意义: 果胶是植物细胞壁主要组成成分之一,分为水溶性果胶和不溶性果胶,即原果胶。因其具有良好的乳化、增稠和凝胶作用,在食品、纺织、印染、烟草、冶金等领域具有较广泛的应用。 测定原理: 原果胶在稀酸中水解为可溶性果胶,并进一步转化为半乳糖醛酸,产物在强酸中与咔唑缩合生成紫红色化合物,在530 nm处有特征吸收峰。 自备实验用品及仪器: 天平、研钵、常温离心机、水浴锅、可见分光光度计/酶标仪、微量石英比色皿/96孔板、浓硫酸和蒸馏水。 试剂的组成和配制: 提取液一:液体100mL×2瓶,4℃保存。 提取液二:液体100mL×1瓶,4℃保存。 标准品:液体1mL×1支,4℃保存。 试剂一:浓硫酸,自备。 试剂二:液体2mL×1支,4℃保存。 试剂三:液体3mL×1瓶,4℃避光保存。 样品处理: 将组织样品捣碎,按照样品质量(g)和提取液一体积(mL)为1: 20的比列(建议取约0.05g样品,加入1mL提取液一),置于90℃恒温水浴锅中浸提30min,取出冷却后于5000g、 25℃离心10min,去掉上清,沉淀中再加入1mL提取液一重复操作一次,离心后去上清,沉淀中加入1mL提取液二,置于90℃恒温水浴锅中水解1h,取出冷却后于8000g、25℃离心15min,取上清液待测。 第1页,共2页
注意:空白管和标准管只需测定一次。 计算公式: a.用微量石英比色皿测定的计算公式如下 原果胶含量(mg /g 鲜重)= (C标准×V标) ×△A2÷△A1÷(W×V样÷V样总) = 0.25×△A2÷ △A1÷W C标准:标准品浓度,0.25mg/mL;V标:反应体系中加入标准品体积,0.02mL;V样:反应体系中加入样本体积,0.02mL;V样总:加入提取液体积,1mL;W:样本鲜重,g。 b.用96孔板测定的计算公式如下 原果胶含量(mg /g 鲜重)= (C标准×V标) ×△A2÷△A1÷(W×V样÷V样总) =0.25×△A2÷ △A1÷W C标准:标准品浓度,0.25mg/mL;V标:反应体系中加入标准品体积,0.02mL;V样:反应体系中加入样本体积,0.02mL;V样总:加入提取液体积,1mL; W:样本鲜重,g。 注意事项: 1.浓硫酸具有强腐蚀性,操作时需特别注意,90℃加热取出后冷却再打开盖子,以防液体飞 溅烧伤。 2.若吸光值超过1,可将样本提取液进行适当稀释再进行测定,并在计算公式中乘以稀释倍 数。 3.最低检出限为10μg/g。 第2页,共2页
实验一 植物组织水势的测定
实验一植物组织水势的测定(小液流法) 1、实验目的 了解植物组织中水分状况的一种表示方法及用于测定的方法及其优缺点。 2、实验原理 植物组织的水分状况可用水势来表示。植物体细胞之间、组织之间以及植物体与环境之间的水分移动方向都由水势差决定。将植物组织放在已知水势的一系列溶液中,如果植物组织的水势(Ψcell)小于某一溶液的水势(Ψout),则组织吸水,反之组织失水。若两者相等,水分交换保持动态平衡。组织的吸水或失水会使溶液的浓度、密度、电导率以及组织本身的体积与质量发生变化。根据这些参数的变化情况可确定与植物组织等水势的溶液。 液体交换法测定水势的方法有很多种,本实验练习用小液流法测定植物组织的水势,并初步观察其变化情况。 小液流法测定水势的原理 判据 △Ψ=Ψout-Ψcell 组织的 水分得失 外液的密度变化 △Ψ>0吸水升高 △Ψ<0失水降低 △Ψ=0平衡不变 使用器材用滴管测定外液的密度变化 适用的材料叶片或碎的组织 3、仪器和试剂 试管,试管架,移液管,滴管,打孔机或单面刀片,镊子,解剖针,棉花,吸水纸; 0.05-0.4mol/L CaCl2溶液,甲烯蓝; 土豆 4、实验步骤 ①将16支试管清洗干净,分为两组(实验组和对照组)按编号顺序倒置于试管架上,控净水分。 ②配制一系列不同浓度的氯化钙溶液(0.05、0.1、0.15、0.2、0.25、0.3、0.35、0.4mol/L),分别注入八支实验组试管中,各10ml左右(体积约为试管的2/3处)。再将实验组各试管溶液的2/3倒入对应编号的对照组试管中。两组试管均加盖棉塞。 ③将土豆用单面刀片切成0.5cm见方的小块。将植物组织混匀,分成八份,放入实验组各试管中。放置20min以上,期间多次摇动实验组试管,以促进水分平衡。 ④用解剖针沾取甲烯蓝粉末给实验组各试管染色,摇匀,用滴管由低浓度向高难度顺序
离子结合型果胶含量试剂盒说明书(分光光度法
离子结合型果胶(ISP)含量试剂盒说明书 分光光度法50管/24样 正式测定前取2-3个预期差异较大的样本做预测定 测定意义: 果胶是构成细胞初生壁和中胶层的主要成分,主要由原果胶、果胶酸甲酯和果胶酸组成。果胶中含有半乳糖醛酸、乳糖、阿拉伯糖、葡萄糖醛酸等,是许多高等植物细胞壁中含量最丰富的多糖成分,其独特的物理、化学性质影响着植物源食品的口感和品质。果胶间以Ca2+桥及其他离子键、氢键、糖苷键、酯键和苯环偶联的方式交联,通过不同的抽提方法可以提取各种形式的果胶,如水溶性果胶(WSP)、离子结合型果胶(ISP)和共价结合果胶(CSP)。测定原理: 利用带有螯合剂的酸溶液提取离子结合型果胶(ISP),采用咔唑比色法测定果胶含量。果胶水解成半乳糖醛酸,在硫酸溶液中与咔唑试剂进行缩合反应,生成物质在530 nm处有最大吸收峰。 需自备的仪器和用品: 可见分光光度计、水浴锅、可调式移液器、1mL玻璃比色皿、80%乙醇、丙酮、浓硫酸(不允许快递)、研钵和蒸馏水。 试剂的组成和配制: 试剂一:液体50mL× 1瓶,4℃保存。 试剂二:液体50mL× 1瓶,4℃保存。 试剂三:标准液1mL× 1支,4℃保存。 试剂四:液体5 mL× 1瓶,4℃保存; 样品的前处理: 1、细胞壁的提取:取约0.3g样本,加入1mL 80%乙醇,室温快速匀浆,95℃水浴20min, 冷却至室温,4000g 25℃离心10min,弃上清。沉淀加入1.5mL80%乙醇和丙酮各洗一遍(涡旋振荡2min左右,4000g 25℃离心10min,弃上清即可),沉淀即为粗细胞壁,加入1mL试剂一(去除淀粉)浸泡15小时,4000g 25℃离心10min,弃上清,将沉淀干燥,称重得细胞壁物质(CWM)。 2、ISP的提取:称取烘干的CWM 3mg,加入1mL试剂二,充分匀浆。8000g 4℃离心10min, 取上清液待测。 测定步骤: 1、分光光度计预热30min以上,调节波长至530nm处,蒸馏水调零;试剂三和试剂四37℃预热10min以上; 别记为A1、A2、A3和A4。若A大于2,需将待测样本用蒸馏水稀释(可稀释10倍或20
果胶的测定
韩雅珊.1992(2002)?.食品化学实验指导[M].中国农业大学出版社 果胶的测定: 一、实验原理 本实验采用钙离子螯合剂和果胶酶提取水果中的总果胶物质,然后用分光光度法测定总果胶物质,先用乙醇处理样品,使果胶沉淀,再用乙醇溶液洗涤沉淀,除去可溶性糖类、脂肪、色素等物质,从残渣中提得果胶物质。采用NaOH溶液将果胶物质皂化,生成果胶酸钠,再经乙酸酸化使之生成果胶酸,再加入果胶酶使之水解。 分光光度法测定是以果胶分子的基本结构单位——半乳糖醛酸和咔唑的反应为基础的。果胶经水解生成半乳糖醛酸,在强酸中与咔唑发生缩合反应,生成紫红色化合物,其呈色强度与半乳糖醛酸含量成正比,测定的结果可用脱水半乳糖醛酸(AUA)。 二、实验仪器与试剂 仪器:玻璃器皿烧杯、试管、玻棒、胶头滴管、容量瓶、PH计、分光光度计 试剂:①果胶酶提取液:1份果胶酶试剂和10份水在一起搅拌1h,然后离心除去沉淀,上清液即为果胶酶提取液;②1%EDTA溶液(乙二胺四乙酸);③醋酸溶液(1份醋酸+2份水);④浓硫酸;⑤95%乙醇;⑥精制乙醇:在1L 95%乙醇中,加入4g锌粉和4ml硫酸(1+1),在水浴中回流24h,然后蒸馏,在馏出液中加入4g锌粉和4gKOH后再蒸馏一次;⑦一水半乳糖醛酸。 三、实验步骤 1、果胶物质的提取 将10g新鲜橘皮和125ml95%乙醇一起捣碎,抽滤后保留沉淀,用50ml75%乙醇洗涤沉淀两次,将沉淀转移到250ml烧杯中,加入100ml 1%EDTA溶液,用1mol/LNaOH 将PH调节至11.5,保持30min后,再用醋酸溶液将果胶溶液酸化到PH5.0,然后加入10ml 果胶酶提取液,搅拌0.5h后,定容至250ml,用脱脂棉过滤,弃去沉淀和前20ml滤液,
果胶的检测技术
3 果胶的检测技术 在对果胶的研究中,通常以含量、酯化度、相对分子质量、凝胶度等作为评价指标。3.1 果胶含量的测定 目前,测定果胶含量的方法主要有:质量法、咔唑比色法、果胶酸钙滴定法和蒸馏滴定法。果胶酸钙滴定法较适于纯果胶的测定,对于例如柑橘果皮这种有色样品,不易确定滴定终点;而蒸馏滴定法在蒸馏的时候部分糠醛会发生分解,影响回收率,故而运用较少。所以,果胶含量的测定一般采用质量法和咔唑比色法。近年来新的果胶含量检测方法——离子交换色谱法(Ion ex-change chromatogram,IEC)引起了人们的关注,其常用的色谱柱和检测器见表3。 吴玉萍等[1]研究了用高效液相色谱法测定烟草中果胶含量。烟草中的果胶先采用盐酸水解,水解产生的半乳糖醛酸以Waters Sugar-Pak1钙型阳离子交换柱为固定相,0.05g/L EDTA钙钠水溶液为流动相,示差折光仪为检测器测定半乳糖醛酸含量,由半乳糖醛酸含量换算为果胶含量。B.M. Yapo等[2]以高效阴离子色谱-脉冲安培检测(HPAEC-PAD)技术测定果胶含量。采用脉冲安培检测器,离子色谱以CarboPacPA-100柱(250mm×4 mm i.d.)为固定相,流动相为0.1 mol/L NaOH 和0.17 M NaOAc,流速为1 mL/min;柱温30℃,测 表3:检测果胶含量的离子交换色谱法 3.2 果胶酯化度的测定 自然界果实中天然存在的果胶都是高酯果胶,经酸或碱处理高酯果胶降低酯化度后可获得低酯果胶。果胶中含甲氧基的最大理论值为16.3%,若该值以酯化度来表示是100%,则甲氧基含量与酯化度的转换计算式应是: 酯化度= 甲氧基含量/16.3%。 果胶酯化度的检测技术由最早的比色法、滴定法发展到80年代的高效液相和气相、90年代的核磁共振和红外光谱等方法。而近几年,拉曼光谱分析果胶的酯化度的方法也有报导。Synytya等[4]用拉曼谱不仅可测定甲酯化程度,而且还可测定乙酰化程度。果胶钾盐的甲酯和乙酰化化合物在拉曼谱中有特征吸收,它在857 cm-1处的强吸收对果胶的甲酯和乙酰化程度十分敏感。甲酯化程度增加波数减少(最小值:850 cm-1);乙酰化程度增加波数增加(最大值:862 cm-1)。
咔唑比色法测定果胶含量
咔唑比色法测定果胶含量-标准曲线的制作 1方法原理 方法基于果胶物质水解,生成半乳糖醛酸在强酸中与咔唑的缩合反应。然后,对其紫红色呈色溶液进行比色定量。 2试剂 (1)乙醇(化学纯):无水乙醇和950mL·L-1乙醇。 (2)精制乙醇:取无水乙醇(化学纯)或950mL·L-1乙醇1000mL,加入Zn粉4g和硫酸(1∶1)4mL,置恒温水浴中回流10h后,用全玻璃仪器蒸馏。馏出液每1000mL加入Zn粉和KOH各4g,进行重蒸馏。 (3) 1.5g·L-1咔唑乙醇溶液:称取化学纯咔唑0.150g,溶解于精制乙醇,并定容至100mL。 (4)标准半乳糖醛酸:以医药公司上海化学试剂采购供应站分装的L.Light出品α-D水解半乳糖醛酸作为标准半乳糖醛酸。 (5)浓硫酸(优级纯)(注2)。 (6)0.05mol·L-1HCl溶液。 3 操作步骤 (1)半乳糖醛酸标准曲线的制作:准确称取α-D-水解半乳糖醛酸100mg,溶解于蒸馏水,并定容至100mL,混合后得1mg·mL-1的半乳糖醛酸原液。移取上述原液1.0、2.0、3.0、4.0、5.0、6.0、7.0mL,分别注入100mL容量瓶中,稀释至刻度,即得一系列浓度为10、20、30、40、50、60、70μg·mL-1的半乳糖醛酸标准溶液。 取30mm×200mm的硬质大试管7支,用吸管注入浓H2SO4各12mL。置冰水浴中冷却,边冷却边分别沿壁徐徐加入上述不同浓度的半乳糖醛酸标准溶液各2mL,充分混合后,再置冰水浴中冷却。然后,在沸水浴中加热10min,冷却至室温后,加入1.5g·L-1咔唑溶液各1mL,充分混和。另以蒸馏水代替半乳糖醛酸标准溶液,依上法同样处理,作为试剂空白。室温下放置30min后,用721型分光光度计,在波长530nm下,分别测定其吸光度(A),以测得的吸光度(A)为纵座标,每mL标准溶液中半乳糖醛酸的含量为横座标,制作标准曲线。 2、根据标准曲线计算未知浓度的样品含量。
果胶的提取与果胶含量的测定
果胶的提取与果胶含量的测定 一、引言 果胶广泛存在于水果和蔬菜中,如苹果中含量为—%(以湿品计),在蔬菜中以南瓜含量最多(达7%-17%)。果胶的基本结构是以α-1,4苷键连接的聚半乳糖醛酸,其中部分羧基被甲酯化,其余的羧基与钾、钠、铵离子结合成盐。 在果蔬中,尤其是未成熟的水果和皮中,果胶多数以原果胶存在,原果胶通过金属离子桥(比如Ca2+)与多聚半乳糖醛酸中的游离羧基相结合。原果胶不溶于水,故用酸水解,生成可溶性的果胶,再进行提取、脱色、沉淀、干燥,即为商品果胶。从柑橘皮中提取的果胶是高酯化度的果胶(酯化度在70%以上)。在食品工业中常利用果胶制作果酱、果冻和糖果,在汁液类食品中作增稠剂、乳化剂。 二、实验材料、试剂与仪器 材料:桔皮,苹果等; 试剂:% HCL,95%乙醇(AR),精制乙醇,乙醚,L HCl,%咔唑乙醇溶液,半乳糖醛酸标准液,浓硫酸(优级纯) 仪器:分光光度计,50mL比色管,分析天平,水浴锅,回流冷凝器,烘箱等三、实验步骤 (一)果胶的提取 1、原料预处理:称取新鲜柑橘皮20g(或干样8g),用清水洗净后,放入250mL 容量瓶中,加水120mL,加热至90℃保持5-10min,使酶失活。用水冲洗后切成3~5mm的颗粒,用50℃左右的热水漂洗,直至水为无色、果皮无异味为止(每次漂洗必须把果皮用尼龙布挤干,在进行下一次的漂洗)。 2、酸水解提取:将预处理过的果皮粒放入烧杯中,加约60mL % HCL溶液,以浸没果皮为宜,调pH至~,加热至90℃煮45min,趁热用100目尼龙布或四层纱布过滤。 3、脱色:在滤液中加入~%的活性炭,于80℃加热20min,进行脱色和除异味,趁热抽滤(如抽滤困难可加入2%~4%的硅藻土作为助滤剂)。如果柑橘皮漂洗。干净萃取液为清澈透明则不用脱色. 4、沉淀:待提取液冷却后,用稀氨水调pH至3~4。在不断搅拌下加入95%乙醇溶液,加入乙醇的量约为原体积的倍,使酒精浓度达到50%~65%。 5、过滤、洗涤、烘干:用尼龙布过滤(滤液可用蒸馏法回收酒精),收集果胶,并用95%乙醇洗涤果胶2~3次,再于60~70℃干燥果胶,即为果胶产品。(二)果胶含量的测定 果胶含量的测定包括重量测定法和咔唑比色法。 # 1、重量法测定果胶含量 原理:原料先用乙醇回流加热以除去非果胶成分(可溶性糖、脂肪、色素等),并用乙醇、乙醚洗涤数次,风干乙醚后的样品,再提取果胶,以相应的沉淀剂使果胶物质沉淀析出,干燥,即得到果胶产品。 果胶沉淀剂可分为电解质沉淀剂(如氯化钠、氯化钙等)和有机溶剂沉淀剂(如酒精、丙酮等)两类。前者适用于低酯化度(20%~50%)果胶的沉淀,沉淀前还需以L NaOH溶液对果胶进行皂化;后者适用于高酯化度(50%以上)果胶的沉淀,并随着酯化度升高,所需有机溶剂的浓度加大(如上以柑橘皮为原料
植物组织水势的测定
实验四植物组织水势的测定 植物体内的生理生化活动与其水分状况密切相关,而植物组织的水势是表示植物水分状况的一个重要生理指标。目前,植物组织水势的测定主要有几种方法:小液流法、折射仪法、压力室法、露点法、热电偶法。前两种方法虽然简便,但精确性差。压力室法较适于测定枝条或叶柄导管的水势。露点法、热电偶法较适宜测定柔软叶片的水势,且精确度高,可在一定范围内重复测定叶片的水势,是较好的水势测定方法。植物的水势可作为制定灌溉的生理指标。 Ⅰ、小液流法 一、目的 通过实验,掌握用小液流法测定植物组织水势的原理和方法。 二、原理 水势代表水的能量水平,水总是从水势高处流向低处。水进入植物体内并分布到各组织器官中的快慢或难易由水势差来决定,水势越高,植物组织的吸水能力越差,而供给水能力越强。当植物组织与一系列浓度递增的溶液接触后,如果植物组织水势大于(或小于)外液的水势,则组织失水(或吸水),使外液浓度变低(或变高),密度变小(或变大)。如果植物组织的水势等于外液的水势时,植物组织既不失水也不吸水,外液浓度不变。当取浸泡过植物组织的溶液的小滴(亦称小液流,为便于观察应先染色),分别放入原来浓度相同而未浸泡植物组织的溶液中部时,小液流就会因密度不同而发生上升或下沉或不动的情况。小液流在其中不动的溶液的水势(该溶液为等渗浓度),即等于植物组织的水势。 三、材料、设备及试剂 1.材料:植物叶片;马铃薯块茎等。 2.仪器设备:试管;小瓶;小塞子;打孔器(直径0.5㎝);尖头镊子;移液管(1ml、5ml、10ml);注射针钩头滴管;刀片。 3.试剂:1mol·L-1蔗糖液;甲烯蓝粉。 四、实验步骤 1.系列糖浓度配制 1.1取干燥洁净试管6支,贴上标签,编号,用1mol·L-1蔗糖母液配成0.05、0.1、0.15、0.2、0.25、0.30 mol·L-1浓度的糖液,各管总量为10ml,并塞上塞子(防止浓度改变),作为甲组。 1.2另取干燥洁净的小瓶6个,标明0.05、0.10、0.15、0.20、0.25、0.30mol·L-1浓度,分别从甲组取相应浓度糖液1ml盛于小瓶中,随即塞上塞子,作为乙组。 2.取样及测定 2.1选取生长一致的叶片,用直径为0.5cm的打孔器钻取圆片,在玻璃皿内混匀,然后用镊子把圆片放进乙组小瓶中,每瓶放15~20片,(若采用植物块茎如马铃薯,先用打孔器钻取圆条,然后切成约1mm厚圆片,每瓶放5片),立即塞紧塞子,放置40min左右,其间轻轻摇动几次,以加速平衡。 2.2到预定时间后,各小瓶加入几粒甲烯蓝粉染色,摇匀,取6支干燥洁净的注射针钩头滴管,分别从乙组中取出溶液,插入甲组原相应浓度蔗糖溶液的中部,轻轻挤出钩头滴管内
共价结合型果胶含量试剂盒说明书(分光光度法)
共价结合型果胶(CSP)含量试剂盒说明书 分光光度法50管/24样 正式测定前取2-3个预期差异较大的样本做预测定 测定意义: 果胶是构成细胞初生壁和中胶层的主要成分,主要由原果胶、果胶酸甲酯和果胶酸组成。果胶中含有半乳糖醛酸、乳糖、阿拉伯糖、葡萄糖醛酸等,是许多高等植物细胞壁中含量最丰富的多糖成分,其独特的物理、化学性质影响着植物源食品的口感和品质。果胶间以Ca2+桥及其他离子键、氢键、糖苷键、酯键和苯环偶联的方式交联,通过不同的抽提方法可以提取各种形式的果胶,如水溶性果胶(WSP)、离子结合型果胶(ISP)和共价结合果胶(CSP)。测定原理: 利用带有螯合剂的碱溶液提取共价结合型果胶(CSP),采用咔唑比色法测定果胶含量。果胶水解成半乳糖醛酸,在硫酸溶液中与咔唑试剂进行缩合反应,生成物质在530 nm处有最大吸收峰。 需自备的仪器和用品: 可见分光光度计、水浴锅、可调式移液器、1mL玻璃比色皿、80%乙醇、丙酮、浓硫酸(不允许快递)、研钵和蒸馏水。 试剂的组成和配制: 试剂一:液体50mL× 1瓶,4℃保存。 试剂二:液体50mL× 1瓶,4℃保存。 试剂三:标准液1mL× 1支,4℃保存。 试剂四:液体5 mL× 1瓶,4℃保存; 样品的前处理: 1、细胞壁的提取:取约0.3g样本,加入1mL 80%乙醇,室温快速匀浆,95℃水浴20min, 冷却至室温,4000g 25℃离心10min,弃上清。沉淀加入1.5mL80%乙醇和丙酮各洗一遍(涡旋振荡2min左右,4000g 25℃离心10min,弃上清即可),沉淀即为粗细胞壁,加入1mL试剂一(去除淀粉)浸泡15小时,4000g 25℃离心10min,弃上清,将沉淀干燥,称重得细胞壁物质(CWM)。 2、CSP的提取:称取烘干的CWM 3mg,加入1mL试剂二,充分匀浆。8000g 4℃离心10min, 取上清液待测。 测定步骤: 1、分光光度计预热30min以上,调节波长至530nm处,蒸馏水调零;试剂三和试剂四37℃预热10min以上; 别记为A1、A2、A3和A4。若A大于2,需将待测样本用蒸馏水稀释(可稀释10倍或20
植物生理学实验汇总
一植物组织中ETH(乙烯)释放量的测定 测定原理:ACC是乙烯合成的直接前体,为了更好地了解乙烯对植物的调节作用,有必要测定植物中ACC的含量,在冷却的Hg+存在下,NaClO专一地使ACC转化成乙烯。 ACC:1-氨基环丙烷-1-羧酸 测定中气相色谱仪用的是氢火焰检测器FID。 色谱仪包括固定相和流动相。由于固定相和流动相对各种物质的吸附或溶解能力不同,因此各物质的分配系数不一样。当待测样(含ETH混合气体)加入固定相以后,不断通以流动相(通常为氮气、氢气)待测物不断再分配,最后按照分配系数大小顺序依次被分离,并进入检测系统被检测,检测信号的大小,反映出物质含量的多少,在记录仪上呈现色谱图。 判断气相色谱仪氢火焰检测器是否点燃的3种方法?如何判断检测器已工作? 1、将不锈钢镊子接触到检测器的喷扣处,若镊子上有水珠证明氢气已被点燃; 2、根据记录笔的位置来判断; 3、微电流放大器的“引燃开关”切换“引燃”时,检测器如发出扑声火焰已被点燃。 结果分析:经冷冻的苹果ETH释放速率低于常温的乙烯释放速率。经低温处理ACC合成酶的形成受到损伤和影响,从而降低乙烯的合成与释放。 3大温度3大气流量:基线成一直线表明稳定了 柱温80度进样器温度120度检测器温度140度 N2 流量35微升每分钟400 H2 流量45 微升每分钟55千帕空气流量350 微升每分钟 40 千帕 二植物组织中脂肪氧化酶活力测定 原理根据基质浓度一定,反应体系中溶解氧浓度的变化与酶活力大小呈线性相关原理进行测定。LOX氧化多元不饱和脂肪酸生成具有共轭双键的过氧化物时消耗氧气,溶液中氧浓度的减少速率与酶活力大小成正比,用氧电极可精确的测定酶活力。 结果:经过干旱处理的小麦组织中LOX活力低(受干旱条件的诱导LOX基因的表达) 注意事项:1测定时,维持温度恒定,氧电极对温度变化非常敏感; 2 反应杯中不应有气泡,否则会造成信号不稳 3 进行试验时要保持磁转子的转动,以平衡氧气浓度 4 电极使用一段时间后,在阳极上形成一层氧化膜,使电极的灵敏度下降,需要用清洁剂清洁阳极。 三半伤害温度的求算 1 以伤害度为纵坐标,温度为横坐标,制作曲线,50%伤害对应的温度即半伤害温度; -BT) 生长曲线方程拟合LogisticY=K/(1+Ae2 以Y 伤害度(相当于胁变)K 最大外渗量 T 温度(相当于胁强)A,B 常数 据Logistic方程,以Ln((K/Y)-1)为纵坐标,以T为横坐标作图,的一直线,直线与横轴交点即半伤害温度。 半伤害温度的生理意义,半伤害温度通常可用来表示植物对高温或低温抗性的大小。在高温伤害情况下,若半伤害温度高,说明对高温伤害抗性强;在低温伤害时,则半伤害温度越低,植物对低温伤害抗性强。对于其他逆境,具有相应的生理意义。 但是对于高温伤害,同样以Ln((K/Y)-1)为纵坐标,以T为横坐标作图,发现做出的不是直线而是S型曲线。 四蒸汽压渗透压计测植物组织渗透势蒸汽压渗透压计的工作原理 1 原理对于一种溶液来说,溶质颗粒数的增加改变了溶剂分子的自由度,导致溶剂分子主所以称他们为这些溶液特征的相对变化与溶液中粒子的增加量呈线性相关,要特征的改变。.
植物组织水势的测定 ( 小液流法 )
植物组织水势的测定( 小液流法) 一、目的学会用小液流法来测定植物组织水势。 二、原理当植物组织浸入外界溶液中时,若植物的水势小于外液的水势,则细胞吸水, 使外液浓度变大;反之, 植物细胞失水,外液浓度变小,若细胞和外液的浓度相等,则外液浓度不发生变化。溶液浓度不同其比重也不同,不同浓度的两溶液相遇,稀溶液比重小而会上升,浓溶液比重大而会下降。根据此理, 把浸过植物组织的各浓度液滴滴回原相应浓度的各溶液中,液滴会发生上升、下降或基本不动的现象。如果液滴不动,说明外液在浸过组织后浓度未变,那么就可根据该溶液的浓度计算出其水势。此水势值也就是待测植物组织水势。小液流法就根据这个原理,把植物组织浸人一系列不同浓度的煎糖液中, 由于比重发生了变化,通过观察滴出小液滴在原相应浓度中的反应而找出等渗浓度,从而就可算出溶液的水势。 三、材料指管木架、指形管( 带软木塞)、弯头毛细吸管( 带橡皮头)、小镊子、移液管、温度计、打孔器、不同浓度的蔗糖液(0.2~ 0.6mol/L)、甲烯蓝( 亚甲基蓝)、叶片。 四、方法与步骤 1、配制一系列不同浓度的蔗糖溶液0.05、0.1、0. 2、0. 3、0. 4、0. 5、0.6 mol/l 各10ml 注入7支试管编号按顺序排列作为对照组。2、另取7支试管 编号按顺序排列作为试验组。然后从对照组的各试管中分别取溶液5ml移入相同编号的试验组试管中。 3、用打孔器在马铃薯上打孔 然后用刀片将马铃薯切成厚薄相等的
小块若干片。向试验组的每一试管中加20片马铃薯小块,摇动数次放置30分钟,后向每一试管中各加甲烯蓝粉末少许并振荡此时溶液变成蓝色。 4、用毛细滴管从试验组的各试管中依次吸取蓝色的液体少许,然后伸入对照组相同编号试管的液体中部。缓慢从毛细管尖端横向放出一滴蓝色试验溶液 观察小液滴移动的方向。如果小液滴向上移动说明溶液从细胞液中吸出水分而被冲淡,比重比原来小了。如果有色液滴向下移动则说明细胞从溶液中吸了,水溶液变浓比重变大。如果液滴不动(扩散均匀) 则说明试验溶液的密度等于对照溶液,即植物组织的水势等于溶液的渗透势。 5、记录每一试管中蓝色小液滴移动的方向 并记录液滴不动的试管中蔗糖溶液的浓度 6、按-ψw=RTiC 计算水势: 其中ψw为细胞水势 R(气体常数)= 8300L*Pa/mol*K。T 为绝对温度 单位K 即273℃+t t 为实验温度 记为25℃ 。i 为解离系数 蔗糖为1。 C 为等渗溶液的浓度 单位为mol/L。 五注意事项 1、准确配制蔗糖梯度溶液 正确使用移液管。 2、土豆块大小厚薄均一 每管个数相同。 3、实验中多次摇动试管 使反应充分进行。 4、甲烯蓝放少许 否则会影响溶液浓度。
果胶的提取与果胶含量的测定
果胶得提取与果胶含量得测定 一、引言 果胶广泛存在于水果与蔬菜中,如苹果中含量为0、7—1、5%(以湿品计),在蔬菜中以南瓜含量最多(达7%-17%)。果胶得基本结构就是以α-1,4苷键连接得聚半乳糖醛酸,其中部分羧基被甲酯化,其余得羧基与钾、钠、铵离子结合成盐. 在果蔬中,尤其就是未成熟得水果与皮中,果胶多数以原果胶存在,原果胶通过金属离子桥(比如Ca2+)与多聚半乳糖醛酸中得游离羧基相结合。原果胶不溶于水,故用酸水解,生成可溶性得果胶,再进行提取、脱色、沉淀、干燥,即为商品果胶.从柑橘皮中提取得果胶就是高酯化度得果胶(酯化度在70%以上).在食品工业中常利用果胶制作果酱、果冻与糖果,在汁液类食品中作增稠剂、乳化剂. 二、实验材料、试剂与仪器 材料:桔皮,苹果等; 试剂:0、25% HCL,95%乙醇(AR),精制乙醇,乙醚,0、05mol/L HCl,0、15%咔唑乙醇溶液,半乳糖醛酸标准液,浓硫酸(优级纯) 仪器:分光光度计,50mL比色管,分析天平,水浴锅,回流冷凝器,烘箱等三、实验步骤 (一)果胶得提取 1、原料预处理:称取新鲜柑橘皮20g(或干样8g),用清水洗净后,放入250mL容量瓶中,加水120mL,加热至90℃保持5-10min,使酶失活。用水冲洗后切成3~5mm得颗粒,用50℃左右得热水漂洗,直至水为无色、果皮无异味为止(每次漂洗必须把果皮用尼龙布挤干,在进行下一次得漂洗). 2、酸水解提取:将预处理过得果皮粒放入烧杯中,加约60mL0、25% HCL 溶液,以浸没果皮为宜,调pH至2、0~2、5,加热至90℃煮45min,趁热用100目尼龙布或四层纱布过滤。 3、脱色:在滤液中加入0、5~1、0%得活性炭,于80℃加热20min,进行脱色与除异味,趁热抽滤(如抽滤困难可加入2%~4%得硅藻土作为助滤剂)。
水果中果胶物质的提取和测定
水果中果胶物质的提取和测定 一、实验目的 1、温水基本操作,如PH计的使用、抽滤,分光光度计的使用,标准曲线的 绘制 2、初步了解和掌握食品中某些成分的提取技术、分离技术以及测定方法,为 灵活运用食品化学的研究方法奠定基础。 二、实验原理 本实验采用钙离子螯合剂和果胶酶提取水果中的总果胶物质,然后用分光光度法测定总果胶物质,先用乙醇处理样品,使果胶沉淀,再用乙醇溶液洗涤沉淀,除去可溶性糖类、脂肪、色素等物质,从残渣中提得果胶物质。采用NaOH溶液将果胶物质皂化,生成果胶酸钠,再经乙酸酸化使之生成果胶酸,再加入果胶酶使之水解。 分光光度法测定是以果胶分子的基本结构单位——半乳糖醛酸和咔唑的反应为基础的。果胶经水解生成半乳糖醛酸,在强酸中与咔唑发生缩合反应,生成紫红色化合物,其呈色强度与半乳糖醛酸含量成正比,测定的结果可用脱水半乳糖醛酸(AUA)。 三、实验步骤 1、果胶物质的提取 将10g新鲜橘皮和125ml95%乙醇一起捣碎,抽滤后保留沉淀,用50ml75%乙醇洗涤沉淀两次,将沉淀转移到250ml烧杯中,加入100ml 1%EDTA溶液,用1mol/LNaOH将PH调节至11.5,保持30min后,再用醋酸溶液将果胶溶液酸化到PH5.0,然后加入10ml果胶酶提取液,搅拌0.5h后,定容至250ml,
用脱脂棉过滤,弃去沉淀和前20ml滤液,吸取部分滤液稀释10倍,作为测定果胶含量的样品。 2、半乳糖醛酸的比色测定 在20Ⅹ200mm试管中准确加入12ml浓硫酸,用冰浴将试管及内容物冷却到3℃,吸入1.00ml待测溶液,每毫升溶液中含5~40μg果胶物质。将试管中的内容物振荡均匀后,在冰浴中冷却至5℃以下,然后将试管在100℃水浴中加热10min,冷却至20℃,吸入1.00ml0.15%咔唑试剂,充分混匀,在室温下放置25min,在520nm波长下测定溶液的吸光度,从加入咔唑试剂到测定溶液吸光度的时间和温度在各次测定中应保持一致。 3、标准曲线的绘制 准确称量0.1205g一水半乳糖醛酸(相对分子质量为212),加入10ml0.05mol/LNaOH使之溶解,然后用水定容到1L,放置过夜。1ml上述溶液中含AUA100μg,将此标准溶液分别稀释到每ml含10、20、30、40、50、60μgAUA。然后按前述方法测定每个溶液中咔唑试剂反应后的吸光度,以吸光度为纵坐标,脱水半乳糖醛酸的质量为横坐标绘制标准曲线。 四、实验仪器与试剂 仪器:玻璃器皿烧杯、试管、玻棒、胶头滴管、容量瓶、PH计、分光光度计试剂:①果胶酶提取液:1份果胶酶试剂和10份水在一起搅拌1h,然后离心除去沉淀,上清液即为果胶酶提取液;②1%EDTA溶液(乙二胺四乙酸);③醋酸溶液(1份醋酸+2份水);④浓硫酸;⑤95%乙醇;⑥精制乙醇:在1L95%乙醇中,加入4g锌粉和4ml硫酸(1+1),在水浴中回流24h,然后蒸馏,在馏出液中加入4g锌粉和4gKOH后再蒸馏一次;⑦一水半乳糖醛酸。
