实验八 凝固点降低法测定摩尔质量

实验八凝固点降低法测定摩尔质量
一、实验目的
1. 用凝固点降低法测定萘的摩尔质量。
2. 掌握溶液凝固点的测量技术,加深对稀溶液依数性质的理解。
二、实验原理
当稀溶液凝固析出纯固体溶剂时,则溶液的凝固点低于纯溶剂的凝固点,其降低值与溶液的质量摩尔浓度成正比。即
ΔT=T f* -T f = K f m B(1)
式中,M B为溶质的分子量。将该式代入(1)式,整理得:
(2)
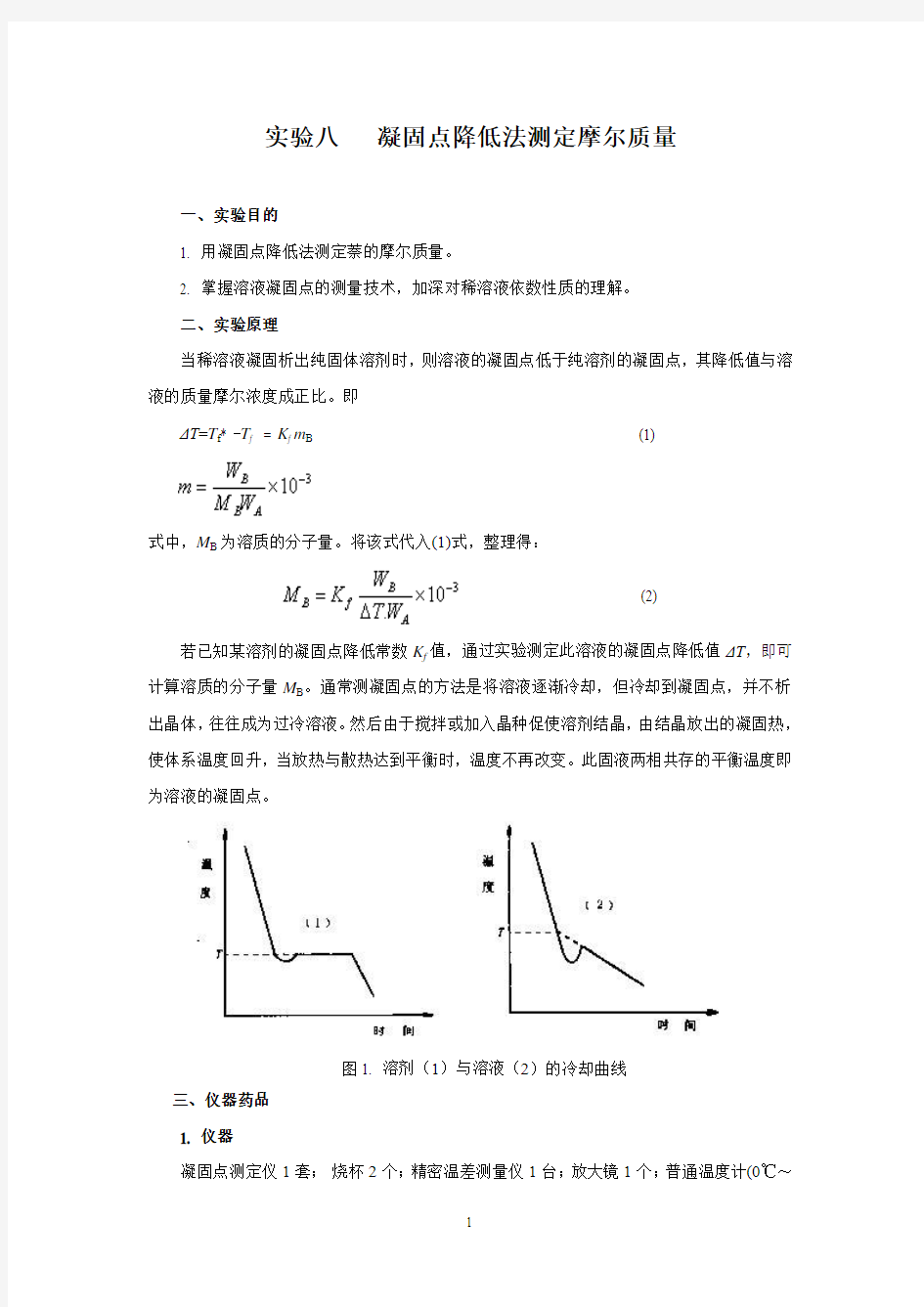
若已知某溶剂的凝固点降低常数K f值,通过实验测定此溶液的凝固点降低值ΔT,即可计算溶质的分子量M B。通常测凝固点的方法是将溶液逐渐冷却,但冷却到凝固点,并不析出晶体,往往成为过冷溶液。然后由于搅拌或加入晶种促使溶剂结晶,由结晶放出的凝固热,使体系温度回升,当放热与散热达到平衡时,温度不再改变。此固液两相共存的平衡温度即为溶液的凝固点。
图1. 溶剂(1)与溶液(2)的冷却曲线
三、仪器药品
1. 仪器
凝固点测定仪1套;烧杯2个;精密温差测量仪1台;放大镜1个;普通温度计(0℃~
50℃)1支;压片机1台;移液管(25mL)1
支。
2. 药品
环已烷(或苯),萘,粗盐,冰。 四、实验步骤
1. 按图2所示安装凝固点测定仪,注意测定管、搅拌棒都须清洁、干燥,温差测量仪的探头,温度计都须与搅拌棒有一定空隙。防止搅拌时发生摩擦。
2. 调节寒剂的温度,使其低于溶剂凝固点温度2~3℃,并应经常搅拌,不断加入碎冰,使冰浴温度保持基本不变。
3. 调节温差测量仪,使探头在测量管中时,数字显示为“0”左右。
4. 准确移取2
5.00mL 溶剂,小心加入测定管中,塞紧软木塞,防止溶剂挥发,记下溶剂的温度值。取出测定管,直接放入冰浴中,不断移动搅拌棒,使溶剂逐步冷却。当刚有固体析出时,迅速取出测定管,擦干管外冰水,插入空气套管中,缓慢均匀搅拌,观察精密温差测量仪的数显值,直至温度稳定,即为苯的凝固点参考温度。取出测定管,用手温热,同时搅拌,使管中固体完全熔化,再将测定管直接插入冰浴中,缓慢搅拌,使溶剂迅速冷却,当温度降至高于凝固点参考温度0.5℃时,迅速取出测定管,擦干,放入空气套管中,每秒搅拌一次,使溶剂温度均匀下降,当温度低于凝固点参考温度时,应迅速搅拌(防止过冷超过0.5℃),促使固体析出,温度开始上升,搅拌减慢,注意观察温差测量仪的数字变化,直至稳定,此即为溶剂的凝固点。重复测量三次。要求溶剂凝固点的绝对平均误差小于±0.003℃。
5. 溶液凝固点的测定,取出测定管,使管中的溶剂熔化,从测定管的支管中加入事先压成片状的0.2~0.3g 的萘,待溶解后,用上述方法测定溶液的凝固点。先测凝固点的参考温度,再精确测之。溶液凝固点是取过冷后温度回升所达到的最高温度,重复三次,要求凝固点的绝对平均误差小于±0.003℃。 五、注意事项
1. 搅拌速度的控制是做好本实验的关键,每次测定应按要求的速度搅拌,并且测溶剂与溶液凝固点时搅拌条件要完全一致。
2. 寒剂温度对实验结果也有很大影响,过高会导致冷却太慢,过低则易出现过冷现象而测不出正确的凝固点。
3. 测定凝固点温度时,注意防止过冷温度超过0.5℃,为了减少过冷度,可加入少量溶剂的微小晶种,前后加入晶种大小应尽量一致。 六、数据记录及处理
表1. 凝固点降低法测定摩尔质量的实验数据 溶剂温度t=21.06℃
物 质
凝固点T f /K
凝固点
降低值
ΔT /K
溶剂密度 g ·cm -3
溶剂质量
W A /g
参 考 温 度
1 2
3
平均值
溶剂(环已烷)
V A =25.00mL 6.77
5.078 5.079 5.079 5.081
1.701
0.7784
19.46
溶液(萘)
W B =0.2084g
5.07
5.078 5.079 5.079 5.079
萘的摩尔质量 M B /g ·mol -1
ρ环已烷(g ·cm -3)=0.7971-0.8879×10-3t=0.7971-0.8879×10-3×21.06=0.7784g ·cm -3 W A =ρA V A =25.00×0.7784=19.46g
萘的摩尔质量M B :128.17 g ·mol -1(理论值)
相对误差:
表1. 凝固点降低法测定摩尔质量的实验数据 溶剂温度t=26.96℃
物 质
凝固点T f /K
凝固点
降低值
ΔT /K
溶剂密度 g ·cm -3
溶剂质量
W A /g
参 考 温 度
1 2
3
平均值
溶剂(苯)
V A =25.00mL 5.51
5.508
5.507
5.505
5.507
0.404
0.8714 21.78
溶液(萘)
W B =0.2252g
5.10
5.102
5.103
5.103
5.103
萘的摩尔质量 M B /g ·mol -1
13
35.1261046
.19701.12084.01.2010---?=???
=??=mol
g TW
W K
M
A
B f
B
%289.0%10017.12817
.1288.127-=?-=η1
3
3
2.12810
78
.21404.02252
.012.510
---?=???
=??=mol
g TW
W K
M
A
B
f
B
ρ苯(g ·cm -3)=0.90005-1.0638×10-3t=0.90005-1.0638×10-3×26.96=0.8714g ·cm -3 W A =ρA V A =25.00×0.8714=21.78g
萘的摩尔质量M B :128.17 g ·mol -1(理论值)
相对误差:
七、思考题
1. 为什么要先测近似凝固点?
答:主要是为了控制过冷程度。当温度冷却至凝固点时要通过急速搅拌,防止过冷超过要求,促使晶体析出。
2. 根据什么原则考虑加入溶质的量?太多或太少影响如何?
答:溶质的加入量应控制在凝固点降低0.3℃左右。过多,溶液的凝固点降低太多,析出溶剂晶体后,溶液的浓度变化大,凝固点也随之降低,不易准确测定其凝固点。过少,溶液的凝固点降低少,相对测定误差也大。
3. 为什么测定溶剂的凝固点时,过冷程度大一些对测定结果影响不大,而测定溶液凝固点时却必须尽量减少过冷现象?
答:对于纯溶剂,过冷现象存在时,析出大量晶体并不改变溶剂浓度,所以其凝固点不变。对于溶液,过冷现象存在时,析出大量晶体会改变溶液浓度,而溶液的凝固点随浓度增大而下降,所以溶液要尽量减少过冷现象,保持溶液浓度基本不变。
%023.0%10017.12817
.1282.128=?-=η
凝固点降低法测定摩尔质量的思考题与答案
实验七十三凝固点降低法测定摩尔质量 1、简述凝固点降低法测定摩尔质量的基本原理 2、在凝固点降低法测定摩尔质量实验中,当溶质在溶液中有离解,缔合和生成络合物的情况下,对摩尔质量的测定值各有什么影响? 3、在凝固点降低法测定摩尔质量实验中,根据什么原则考虑加入溶质的量,太多太少影响如何? 4、凝固点降低的公式在什么条件下才适用?它能否用于电解质溶液? 5、在凝固点降低法测定摩尔质量实验中,为什么会产生过冷现象?过冷太甚对结果有何影响?如何控制过冷程度? 6、在凝固点降低法测定摩尔质量实验中,为了提高实验的准确度,是否可用增加溶液浓度的办法来增加ΔT值?为什么? 7、什么是稀溶液依数性质?稀溶液依数性质和哪些因素有关? 8、测定溶液凝固点时若过冷程度太大对结果有何影响?两相共存时溶液系统和纯溶剂系统的自由度各为多少? 9、什么叫凝固点?凝固点降低的公式在什么条件下才适用?它能否用于电解质溶液? 10、在凝固点降低法测定摩尔质量实验中,为什么要使用空气夹套?过冷太甚有何弊病? 11、在凝固点降低法测定摩尔质量实验中,实验测量成败的关键是什么? 12、在凝固点降低法测定摩尔质量实验中,加入萘的时候,不小心将萘附着在内管壁上,对实验结果有何影响? 13、在凝固点降低法测定摩尔质量实验中,为什么要先测近似凝固点? 14、当溶质在溶液中有解离、缔合、溶剂化和形成配合物时,测定的结果有何意义? 15、在凝固点降低法测定摩尔质量实验中,测定环已烷和萘丸质量时,精密度要求是否相同?为什么? 16、用凝固点降低法测定摩尔质量在选择溶剂时应考虑哪些因素? 17、为什么纯溶剂和稀溶液的的凝固曲线不同? 18、在凝固点降低法测定摩尔质量实验中,寒剂温度的温度应控制在什么范围?为什么? 19、在凝固点降低法测定摩尔质量实验中,为什么实验所用的内套管必须洁净、干燥? 20、在凝固点降低法测定摩尔质量实验中,搅拌速度的控制是做好本实验的关键,在实验过程中怎样控制搅拌速度?
高中化学气体摩尔体积的练习题和答案
高中化学气体摩尔体积的练习题和答案 一、选择题(本题包括8小题,每小题6分,共48分) 1.(2010南充高一检测)在标准状况下,与12 g H2的体积相等的N2的( ) A.质量为12 g B.物质的量为6 mol C.体积为22.4 L D.物质的量为12 mol 解析:n(H2)=12 g2 g/mol=6 mol,则标准状况下n(N2)也应为6 mol,6 mol N2的质量为6 mol×28 g/mol=168 g,在标准状况下的体积为6×22.4 L. 答案:B 2.(2011广东韶关市高一检测)NA代表阿伏加德罗常数,下列说法正确的是( ) A.在同温同压下,相同体积的任何气体单质所含的分子数目相同 B.17 g氨气所含电子数目为10NA C.在常温常压下,11.2 L氮气所含的原子数目为NA D.2 g氢气所含原子数目为NA 解析:在同温同压下,相同体积的任何气体单质所含的分子数目相同,故A 正确;在标准状况下,11.2 L氮气所含的原子数目为NA,常温常压下,气体摩尔体积增大,所含的原子数目小于NA,故C不正确;2 g氢气所含原子数目为2NA,故D不正确. 答案:AB 3.(2011徐州师大附中检测)用NA表示阿伏加德罗常数的值,下列叙述正确的是( ) A.含有NA个氦原子的氦气在标准状况下的体积约为11.2 L B.25℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA C.在常温常压下,11.2 L Cl2含有的分子数为0.5 NA
D.标准状况下,11.2 L H2O含有的分子数为0.5 NA 解析:A项,He为单原子分子,NA个He在标准状况下的体积均为22.4 L.B 项,64 g SO2的物质的量为1 mol,原子数为3 NA,与气体所处状况无关,B项正确.C项条件应为标准状况,D项,标准状况下,H2O不是气体. 答案:B[ 4.(2010曲靖高一检测)标准状况下,下列物质占体积的是( ) A.98 g H2SO4 B.6.02×1023个CO2 C.44.8 L HCl D.6 g H2 解析:A中H2SO4为液态,体积较小;B中n(CO2)=1 mol,体积为22.4 L;D 中n(H2)=3 mol,体积为3×22.4 L. 答案:D 5.(2011运城高一检测)常温常压下,用等质量的CH4、CO2、O2、SO2分别吹出四个气球,其中气体为CH4的是( ) 解析:等质量时,摩尔质量最小的CH4的物质的量,同温同压下气体体积. 答案:D 6.(2010芜湖高一检测)如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( ) A.所含原子数相等 B.气体密度相等 C.气体质量相等 D.摩尔质量相等 解析:同温同压时,体积相等的两气体,具有相同的分子数,因为都是双原子分子,故所含原子数相等,由于N2和O2的比例不固定,故两瓶气体的质量不一定相等,密度和摩尔质量也不一定相等. 答案:A 7.如果a g某气体中含有该气体的分子数为b,则c g该气体在标准状况下的
摩尔质量的计算公式
摩尔质量的计算公式 (1)物质的量浓度就是单位体积内物质的摩尔数,公式:c=n/v,单位:mol/L (2)气体摩尔体积就是1摩尔气体在标准状况下的体积(标准状况的定义:温度为0摄氏度,一个标准大气压)。所有气体在标准状况下的气体摩尔体积均为22.4L/mol。 (3)摩尔质量即1摩尔物质的质量,在数值上等于其相对分子质量,例如:O2的摩尔质量为32g/mol。 1.物质的量是国际单位制中七个基本物理量之一 用物质的量可以衡量组成该物质的基本单元(即微观粒子群)的数目的多少,符号n,单位摩尔(mol),即一个微观粒子群为1mol。如果该物质含有2个微观粒子群,那么该物质的物质的量为2mol。对于物质的量,它只是把计量微观粒子的单位做了一下改变,即将“个”换成“群或堆”。看一定质量的物质中有几群或几堆微观粒子,当然群或堆的大小应该固定。现实生活中也有同样的例子,啤酒可以论“瓶”,也可以论“打”,一打就是12瓶,这里的打就类似于上面的微观粒子群或微观粒子堆。 2.摩尔是物质的量的单位 摩尔是国际单位制中七个基本单位之一,它的符号是mol。“物质的量”是以摩尔为单位来计量物质所含结构微粒数的物理量。 使用摩尔这个单位要注意: ①.量度对象是构成物质的基本微粒(如分子、原子、离子、质子、中子、电子等)或它们的特定组合。如1molCaCl2可以说含1molCa2+,2molCl-或3mol阴阳离子,或含54mol质子,54mol 电子。摩尔不能量度宏观物质,如“中国有多少摩人”的说法是错误的。 ②.使用摩尔时必须指明物质微粒的种类。如“1mol氢”的说法就不对,因氢是元素名称,而氢元素可以是氢原子(H)也可以是氢离子(H+)或氢分子(H2),不知所指。种类可用汉字名称或其对应的符号、化学式等表示:如1molH表示1mol氢原子,1molH2表示1mol氢分子(或氢气),1molH+表示1mol氢离子。 ③.多少摩尔物质指的是多少摩尔组成该物质的基本微粒。如1mol磷酸表示1mol磷酸分子。
高一化学气体摩尔体积练习题及答案A
高一化学气体摩尔体积练习题及答案A 一、气体摩尔体积〔引入〕前面我们学习了物质的量的有关知识,请同学们回忆物质的量与质量、粒子数目之间有什么关系?物质的量是怎样把宏观质量与微观粒子数联系起来的?〔思考〕 1、物质的量(n)、微粒数(N)和阿伏加德罗常数(NA)之间有什么关系? 2、物质的量(n)、质量(m)和摩尔质量(M)之间有什么关系?(学生回答)〔讨论+计算〕在0℃、1、01105Pa时1mol 下列物质的体积为多少? 〔讨论〕由体积数据结合物质状态可得出什么结论?结论: 1、在相同条件下,1mol气体所占的体积比1mol固体或液体所占的体积大得多 2、在相同条件下,1mol固体或液体的体积各不相同,而 1mol气体的体积却几乎完全相同〔思考〕从微观角度分析,物质的体积由哪些因素决定? (一)决定物质的体积(V)的微观因素:〔思考〕 1、固体、液体体积的主要决定因素有哪些?〔思考〕 2、气体体积的主要决定因素有哪些?些?[实验启示] 气体分子间的平均距离要比固体和液体中粒子之间的平均距离大得多。〔思考〕分子间的平均距离受哪些条件影响?是怎样影响
的?〔讨论〕为什么在标准状况下1mol任何气体所占的体积都相同呢?其他的相同条件下,1mol任何气体所占的体积是否都相同呢? (二)气体摩尔体积定义:单位物质的量的气体所占的体积。符号:Vm单位:L/mol或m3/mol等公式:N对象:任何气体(纯净或混合气体)标准状况:温度:0℃、压强 1、01105Pa标准状况:Vm约 22、4L/mol思考:1mol气体在任何状况下所占的体积是不是都相等? 是不是都约为22 、4L?几点注意: 1、状态:气体 2、状况:一定温度和压强下,一般指标准状况 3、定量:1mol 4、数值:约为22 、4L 5、通常状况:20℃、1atm(与标准状况比较) 6、气体体积与微粒数目有关,与种类无关。 7、结论:在标准状况下,1mol任何气体所占的体积都约为22 、4L。 8、有关计算:(标准状况下) V=n 22、4L/mol(n—气体的物质的量) 二、例题 (一)、选择题:
凝固点降低法测定相对分子质量
西安交通大学实验报告 课程:物理化学实验 系别: 专业班号: 组别:第二大组 实验日期:2015年4月3日 姓名: 学号: 交报告日期:2015年4月10日 同组者: 实验名称:凝固点降低法测定相对分子质量 一、实验目的 1.用凝固点降低法测定萘的相对分子量。 2.掌握步冷曲线法测定液体凝固点的方法。 3.掌握数字贝克曼温度计的使用方法。 二、实验原理 稀溶液中溶剂的蒸气压下降、凝固点降低(析出固态纯溶剂)、沸点升高(溶质不挥发)和渗透压的数值,仅与一定量溶液中溶质的质点数有关,而与溶质的本性无关,故称这些性质为稀溶液的依数性。 固体物质和它的液体成平衡时的温度称为凝固点。加一溶质于纯溶剂中,其溶液的凝固点必然较纯溶剂的凝固点低,其降低的数值与溶液中溶质的质量摩尔浓度成正比。 对于在溶液中不离解、不缔合的溶质的稀溶液有如下关系式: 0T T T kc ?=-= ① 式中:0T —纯溶剂的凝固点; T —浓度为C 的溶液的凝固点; k —比例常数。 如果C 以质量摩尔浓度(B m :每千克溶剂所含溶质的物质的量)来表示,k 则为溶剂的摩尔凝固点降低常数,今以f K 表示这个常数,于是①示可改写为: 0f B T T T K m ?=-= ② 若取一定量的溶质()B W 和溶剂()A W 配制成稀溶液,则此溶液的质量摩尔浓度B m 为: /1000B B B A W M m W = ? ③
式中:B m 为溶质的相对分子质量。 如果已知溶剂的f K 值,则测定此溶液的凝固点降低值即可按下式计算溶质的相对分子质量。 01000f B B A K W M T T W = ? - ④ 纯溶剂的凝固点是它的液相和固相共存的平衡温度。若将纯溶剂逐步冷却,其冷却曲 线如图1中Ⅰ的曲线图形。但实际过程中往往发生过冷现象,即在过冷时开始析出固体后,温度才回升到稳定的平衡温度,当液体全部凝固后,温度再逐渐下降,其冷却曲线呈现如图1中Ⅱ的形状。 溶液的凝固点是该溶液的液相与溶剂的固相共存的平衡温度。若将溶液逐步冷却,其冷却曲线与纯溶剂不同,见图9中Ⅲ、Ⅳ。由于部分溶剂凝固而析出,使剩余溶液的浓度逐渐增大,因而剩余溶液与溶剂固相的平衡温度也逐渐下降。本实验所要测定的是浓度已知的溶液的凝固点。因此,所析出的溶剂固相的量不能太多,否则要影响原溶液的浓度。如稍有过冷现象如图9中Ⅳ所示,对相对分子质量的测定,无显著影响;如过冷严重,则冷却曲线如图9中Ⅴ所示,测得之凝固点将偏低,影响相对分子质量的测定结果。因此在测定过程中必须设法控制适当的过冷程度,一般可控制寒剂的温度、搅拌速度等方法来达到。 由于稀溶液的凝固点降低值不大,因此温度的测量需要用较精密的仪器,在本实验中采用精密温差测量仪。 做好本实验的关键:一个是控制搅拌速度,每次测量时的搅拌条件和速度尽量一致。二是寒剂的温度,过高则冷却太慢,过低则测不准凝固点,一般要求较溶剂的凝固点低3~4℃,因此本实验中采用冰—水混合物作冰浴。 图1冷却曲线
物质的量气体摩尔体积练习题及答案
物质的量气体摩尔体积 练习题及答案 Document number:PBGCG-0857-BTDO-0089-PTT1998
1.下列关于物质的量和摩尔质量的叙述,正确的是() A.水的摩尔质量是18 g B.0.012 kg 12C中含有×1023个碳原子 C.1 mol水中含有2 mol氢和1 mol氧 D.1 mol任何物质都含有×1023个分子 解析:选B。A选项,摩尔质量的单位是g·mol-1,A选项错误;B选项,碳是由原子构成的,根据规定,0.012 kg 12C中所含的碳原子数即为阿伏加德罗常数,近似为×1023mol-1,B选项正确;在使用“摩尔”作为物质的量的单位时,应该用化学式指明粒子的种类,而不使用该粒子的中文名称,而且选项C中表示水的组成时,氢、氧的含义也不具体,C选项错误;D选项,构成物质的基本粒子有分子、原子和离子,并非任何物质都是由分子构成的,D 选项错误。 2.下列关于阿伏加德罗常数的说法中正确的是() A.×1023叫做阿伏加德罗常数 B.12 g碳-12含有的碳原子数就是阿伏加德罗常数 C.含有阿伏加德罗常数个微粒的物质是1摩尔 D.1摩尔氯含有×1023个氯分子 解析:选BC。摩尔的基准是0.012 kg 12C所含碳原子数,每摩尔物质含有阿伏加德罗常数个微粒。阿伏加德罗常数为×1023mol-1,而不是×1023。用摩尔来表示粒子时应指明具体微粒。如1 mol Fe、1 mol H+、1 mol e-等,不能说1摩尔氯。 3.(2010年南充高一检测)在标准状况下,与12 g H2的体积相等的N2的() A.质量为12 g B.物质的量为6 mol C.体积为22.4 L D.物质的量为12 mol 解析:选B。12 g H2的物质的量为6 mol,因二者体积相等,所
凝固点降低法测定物质的相对分子质量_纯萘、环己烷
华南师范大学实验报告 【实验目的】 ①测定环己烷的凝固点降低值,计算萘的分子量。 ②掌握溶液凝固点的测定技术。 ③技能要求:掌握冰点降低测定管、数字温差仪的使 用方法,实验数据的作图处理方法。 【实验原理】 1、凝固点降低法测分子量的原理 化合物的分子量是一个重要的物理化学参数。用凝固点降低法测定物质的分子量是一种简单而又比较准确的方法。稀溶液有依数性,凝固点降低是依数性的一种表现。稀溶液的凝固点降低(对析出物是纯溶剂的体系)与溶液中物质的摩尔分数的关系式为: ΔT f = T f * - T f = K f m B (1) *式中,T f * 为纯溶剂的凝固点,T f 为溶液的凝固点,m B 为溶液中溶质B 的质量摩尔浓度,K f 为溶剂的质量摩尔凝固点降低常数,它的数值仅与溶剂的性质有关。 已知某溶剂的凝固点降低常数K f,并测得溶液的凝固点降低值ΔT ,若称取一定量的溶质W B (g)和溶剂 W A (g),配成稀溶液,则此溶液的质量摩尔浓度m B 为: 3A B B B 10W M W m ?= mol/kg (2) 将(2)式代入(1)式,则: 3A f B f B 10W T W K M ??= g/mol (3) 表1 几种溶剂的凝固点降低常数值 因此,只要称得一定量的溶质(WB )和溶剂(WA )配成一稀溶液,分别测纯溶剂和稀溶液的凝固点,求得ΔT f ,再查得溶剂的凝固点降低常数,代入(3)式即可求得溶质的摩尔质量。 * 当溶质在溶液里有解离、缔合、溶剂化或形成配合物等情况时,不适用上式计算,一般只适用于强电解质稀溶液。 2、凝固点测量原理 纯溶剂的凝固点是它的液相和固相共存时的平衡温度。若将纯溶剂缓慢冷却,理论上得到它的步冷曲线如图中的 A , 但但实际的过程往往会发生过冷现象,液体的温度会下降到凝固点以下,待固体析出后
有关气体摩尔体积的计算
有关气体摩尔体积的计算 学习误区 学习有关气体摩尔体积计算时,要注意综合地运用各有关概念,把概念、公式吃透,有些题目有意把具体的数值抽象化,增大难度,以便更好地考查学生对概念的理解深度,这时就要准确把握概念,审题时,可以把抽象的符号想象为具体的数值,以利于分析和理解题意。 学习点拨: 有关气体摩尔体积的计算,一般是把摩尔的概念、气体的摩尔体积,摩尔质量以及阿佛加德罗定律、溶液的物质的量浓度综合起来,有时还要用到化学式和式量等概念。 例1,(99年全国高考题)用惰性电极电解M(NO3)x的水溶液,当阴极上增重ag时,在阳极上同时产生bL氧的气(标况下),从而可知M的原子量为.() A. B. C. D. 分析:此题综合性很强,解答此题需用到的知识概念较多,其中有电解知识,电子守恒原理;气体摩尔体积,物质的量以及物质的化学式和式量等。 解答此题的关键是电子守恒原理,即析出氧气时O-2失电子总数等于金属离子得电子总数。即氧气物质的量的4倍等于析出金属的物质的量的x倍。 设M的原子量为m 则有:×x=×4 m= 答案:C 例2:某物质A在一定条件下加热分解,产物都是气体,反应方程式可以如下表示:2A B+2C+2D,测得生成的混和气体对氢气的相对密度为d,则A的式量为() A.7d B.5d C.2.5d D.2d 分析:2molA物质完全分解生成气体:1molB,2molC,2molD。而生成物的平均式量是氢气的d倍,即平均式量为2d,根据质量守恒原理,设A的式量为x则: 2x=2d×5=10d x=d=5d 答案:B 习题: 1.设N A表示阿佛加德常数,下列说法正确的是() A.标准状况下,如果5.6L O2含有n个氧分子,则N A约为4n B.常温常压下,1mol氦气含有的原子数为N A C.1L0.1mol/L的H2S溶液中所含H+数为0.2N A D.常温下1mol Cl2与足量NaOH溶液反应,转移的电子数为2N A(H2S在水溶液中只小部分电离) 2.某氯原子质量为ag,12C原子质量为bg,用N A表示阿佛加德罗常数,下列说法错误的是:() A.氯元素的相对原子质量一定是12a/b
高中化学-1mol气体体积的测定(学生版)
一、相关知识回顾 1.气体摩尔体积 在标准状况(指_____℃,__________kPa ,符号S.T.P.)下,1mol 任何气体所占的体积都约是22.4L ,这个体积叫做气体摩尔体积。符号是V m ,单位为L/mol 。22.4L/mol 是在标准状况下气体摩尔体积的物理常数。 Vm = n V 单位:L/mol 2.气体体积与其他物理量之间的转换 【练习】如果ag 某气体中含有分子数为b ,则cg 该气体在标准状况下的体积是 ( ) A .22.4bc/aN A L B .22.4ab/cN A L C .22.4ac/bN A L D .22.4b/cN A L 二、测定1mol 气体体积的实验 1.实验原理 以1摩尔H 2体积的测定为例,用一定量的镁跟足量稀硫酸反应产生氢气,并测定其摩尔体积。 1mol 气体体积的测定 知识梳理 /M 物质的量 气体体积 (标况下) 微粒数 质量 ×V m /V m ×N A / N A × M
Mg + H2SO4 → MgSO4 + H2↑ 则Vm=_________________________________________ ___________________________________________ 2.实验装置 气体摩尔体积测定装置由三部分组成,A是________________,B 是________________,C是__________________。 3.实验步骤 (1)装配好化学反应气体体积测定仪,做__________________。 (2)用砂皮擦去镁带表面的氧化物,然后称取0.100~0.110g镁带(精确至0.001g),把数值记录于表格。 (3)在A瓶出气口处拆下胶管,使A瓶倾斜,取下A瓶加料口橡皮塞,用小烧杯加入约20mL 水于A瓶中(目的是________________________),再把已称量的镁带加到A瓶底部,用橡皮塞塞紧加料口。 (4)用注射器在A瓶加料口抽气,使B瓶导管内液面和导管外液面持平。注射器拔出时要注意捏住针头拔出。 (5)用注射器吸取10mL 3mol/L硫酸,用针头扎进A瓶加料口橡皮塞慢慢注入硫酸。观察现象,记录气体温度。 (6)当镁带完全反应后,读出C瓶中液体的体积,读数估计至0.2~0.3mL(最小刻度值0.5mL 的一半),记录于表格。 (7)用注射器在A瓶加料口抽气,使B瓶中导管内外液面持平。记录抽出气体的体积,把数据记录于表格。 (8)将计算后的氢气体积填入表格。 (9)重复上述操作进行第二次实验。 【思考1】如何进行装置气密性的检查? 【思考2】镁带表面的氧化膜为什么要擦去?
高一化学气体摩尔体积练习题及答案A
一、气体摩尔体积 〔引入〕前面我们学习了物质的量的有关知识,请同学们回忆物质的量与质量、粒子数目之间有什么关系?物质的量是怎样把宏观质量与微观粒子数联系起来的? 〔思考〕 1. 物质的量(n )、微粒数(N )和阿伏加德罗常数(N A )之间有什么关系? 2. 物质的量(n )、质量(m )和摩尔质量(M )之间有什么关系? (学生回答) 〔展示〕 粒子数 宏观 微观 体积 粒子数 〔讨论+计算〕在0℃、1.01×105 Pa 时1mol 下列物质的体积为多少? 〔讨论〕由体积数据结合物质状态可得出什么结论? 结论: 1. 在相同条件下,1mol 气体所占的体积比1mol 固体或液体所占的体积大得多 2. 在相同条件下,1mol 固体或液体的体积各不相同,而1mol 气体的体积却几乎完全相同 〔思考〕从微观角度分析,物质的体积由哪些因素决定? (一)决定物质的体积(V )的微观因素: 1. 粒子数目 2. 粒子大小 3. 粒子间距离
〔思考〕1. 固体、液体体积的主要决定因素有哪些? 粒子数目 固、液体体积 粒子大小 取决于 〔思考〕2. 气体体积的主要决定因素有哪些? [实验启示]气体分子间的平均距离要比固体和液体中粒子之间的平均距离大得多。 粒子数目 气体体积 粒子间平均距离(d) 取决于 〔思考〕分子间的平均距离受哪些条件影响?是怎样影响的? 〔讨论〕为什么在标准状况下1mol任何气体所占的体积都相同呢?其他的相同条件下,1mol 任何气体所占的体积是否都相同呢? (二)气体摩尔体积 定义:单位物质的量的气体所占的体积。 符号:V m 单位:L/mol或m3/mol等 公式:n V V m 对象:任何气体(纯净或混合气体) 标准状况:温度:0℃、压强1.01×105Pa 标准状况:Vm约22.4L/mol 思考:1mol气体在任何状况下所占的体积是不是都相等? 是不是都约为22 .4L? 几点注意: 1、状态:气体 2、状况:一定温度和压强下,一般指标准状况 3、定量:1mol
实验八凝固点降低法测定摩尔质量
实验八凝固点降低法测定摩尔质量 一、实验目的 1. 用凝固点降低法测定萘的摩尔质量。 2. 掌握溶液凝固点的测量技术,加深对稀溶液依数性质的理解。 二、实验原理 当稀溶液凝固析出纯固体溶剂时,则溶液的凝固点低于纯溶剂的凝固点,其降低值与溶液的质量摩尔浓度成正比。即 ΔT=T f* -T f = K f m B(1) 式中,M B为溶质的分子量。将该式代入(1)式,整理得: (2) 若已知某溶剂的凝固点降低常数K f值,通过实验测定此溶液的凝固点降低值ΔT,即可计算溶质的分子量M B。通常测凝固点的方法是将溶液逐渐冷却,但冷却到凝固点,并不析出晶体,往往成为过冷溶液。然后由于搅拌或加入晶种促使溶剂结晶,由结晶放出的凝固热,使体系温度回升,当放热与散热达到平衡时,温度不再改变。此固液两相共存的平衡温度即为溶液的凝固点。 图1. 溶剂(1)与溶液(2)的冷却曲线 三、仪器药品 1. 仪器 凝固点测定仪1套;烧杯2个;精密温差测量仪1台;放大镜1个;普通温度计(0℃~
50℃)1支;压片机1台;移液管(25mL)1支。 2. 药品 环已烷(或苯),萘,粗盐,冰。 四、实验步骤 1.按图2所示安装凝固点测定仪,注意 测定管、搅拌棒都须清洁、干燥,温差测量 仪的探头,温度计都须与搅拌棒有一定空 隙。防止搅拌时发生摩擦。 2. 调节寒剂的温度,使其低于溶剂凝固 点温度2~3℃,并应经常搅拌,不断加入碎 冰,使冰浴温度保持基本不变。 3. 调节温差测量仪,使探头在测量管中 时,数字显示为“0”左右。 4. 准确移取2 5.00mL溶剂,小心加入测定管中,塞紧软木塞,防止溶剂挥发,记下溶剂的温度值。取出测定管,直接放入冰浴中,不断移动搅拌棒,使溶剂逐步冷却。当刚有固体析出时,迅速取出测定管,擦干管外冰水,插入空气套管中,缓慢均匀搅拌,观察精密温差测量仪的数显值,直至温度稳定,即为苯的凝固点参考温度。取出测定管,用手温热,同时搅拌,使管中固体完全熔化,再将测定管直接插入冰浴中,缓慢搅拌,使溶剂迅速冷却,当温度降至高于凝固点参考温度0.5℃时,迅速取出测定管,擦干,放入空气套管中,每秒搅拌一次,使溶剂温度均匀下降,当温度低于凝固点参考温度时,应迅速搅拌(防止过冷超过0.5℃),促使固体析出,温度开始上升,搅拌减慢,注意观察温差测量仪的数字变化,直至稳定,此即为溶剂的凝固点。重复测量三次。要求溶剂凝固点的绝对平均误差小于±0.003℃。 5. 溶液凝固点的测定,取出测定管,使管中的溶剂熔化,从测定管的支管中加入事先压成片状的0.2~0.3g的萘,待溶解后,用上述方法测定溶液的凝固点。先测凝固点的参考温度,再精确测之。溶液凝固点是取过冷后温度回升所达到的最高温度,重复三次,要求凝固点的绝对平均误差小于±0.003℃。 五、注意事项 1. 搅拌速度的控制是做好本实验的关键,每次测定应按要求的速度搅拌,并且测溶剂与溶液凝固点时搅拌条件要完全一致。
化学计算专题——物质的量气体摩尔体积燃烧及关于方程式的计算解读
化学计算专题 ——物质的量、气体摩尔体积、燃烧及关于方程式的计算 [考点扫描] 1.有关物质的量的计算 2.有关气体摩尔体积的计算 3.利用化学方程式的计算 4.有关燃烧热的简单计算 [知识指津] 1.本章知识网络 2.摩尔质量的计算 (1)物质的量(n)、物质的质量(m)和物质的摩尔质量(M)之间的关系为:
(2)已知阿伏加德罗常数(N A)和摩尔质量,则一个某粒子的质量(m a)为: 同理,若已知m a、N A,则M=m a·N A。 3.标准状况下气体体积的计算 (1)体积(V)与物质的量(n)的关系 n(mol)= (2)体积(V)与气体质量(m)的关系 = (3)体积(V)与粒子数(N)的关系 = 总之: 4.阿伏加德罗定律的推论: 根据理想气体状态方程pV=nRT及n=、可得出下列结论:①同温同压下,气体的分子数与其体积成正比:T、p相同=
②温度、体积相同的气体,压强与其分子数成正比:T、V相同= ③分子数相等,压强相同的气体,体积与其温度成正比:n、p相同= ④分子数相等,温度相同的气体,压强与其体积成反比:n、T相同= ⑤同温同压下,气体的密度与其相对分子质量(实际是摩尔质量)成正比:T、p相同= ⑥同温同压下,体积相同的气体,相对分子质量与其质量成正比:T、P、V相同= ⑦同温同压下,等质量的气体相对分子质量与其体积成反比:T、P、m相同= 5.气体摩尔体积的计算 (标准状况下V m=22.4L/mol) 6.关于物质的量浓度的计算 (1)基本关系式的计算公式:c B=,c B物质的量浓度,n B溶质的物质的量,V溶液的体积(L) (2)与溶液质量分数的换算:c= c表示物质的量浓度,表示溶液的密度,W表示溶液的质量分数,M表示溶质的摩尔质量。 (3)溶液稀释(浓缩)的计算:c1V1=c2V2(稀释定律) 稀释前后溶质的物质的量不变,用于物质的量浓度溶液稀释。 (4)气体溶于水的物质的量浓度的计算:
平均摩尔质量有关的计算
平均摩尔质量有关的计算 1.适用范围:混合物 【例】空气中有氧气和氮气,氧气的质量分数为21%,求空气的平均摩尔质量。 3.平均摩尔质量的求法: (1)定义法: 【例】现有NaOH和CaCO3两者组成的混合物,其中NaOH的质量分数为40%,求该混合物的平均摩尔质量。 (2)相对密度法: 【例】在相同条件下,某混合物气体对氢气的相对密度为16,求该混合气体的平均摩尔质量。 (3)标况密度法: 【例】某混合气在标准状况下的密度是1.2g/cm3,求此气体的平均摩尔质量。 练习: 1.氮气、二氧化碳以物质的量比2:3混合,求混合气体的平均摩尔质量。 2.氮气、二氧化碳以体积比2:3(相同条件)混合,求混合气体的平均摩尔质量。 3.二氧化碳、氢气、氯气按体积比1:2:3混合,求混合气体的平均摩尔质量。 4.将氧气与氮气按质量比8:7混合,求混合气体的平均摩尔质量。 5.已知CH4、H2的混合气体中CH4的质量分数为80%,求混合气体的平均相对分子质量。 6.某混合气体密度是同温同压下氢气密度的17倍,求此混合气体的平均摩尔质量。 7.在一定温度和压强下,某混合气质量是相同体积N2质量的1.5倍,求此混合气的平均摩尔质量。 8.已知氯化铵受热可分解为氨气和氯化氢,求其完全分解后所得气体的平均相对分子质量。 9.将甲烷与氧气按体积比1:2混合后点燃,充分反应后所得气体(120℃,101kPa)的平均相对分子质量。 10.氮气与氧气的平均摩尔质量为32,求两种气体的物质的量之比。 11.氮气与氧气混合气体的密度是相同条件下氢气密度的15.5倍,求两种气体的体积比(相同条件)。 12.氧气与甲烷混合气体在标准状况下的密度为1.25g/L,求两种气体的质量比。 13.氧气、甲烷和氮气混合气密度与相同条件下一氧化碳密度相等,求三种气体的物质的量比。 14、150摄氏度时NH4HCO3完全分解产生的气态混合物,其密度是相同条件下H2密度的多少倍? 15.已知反应:2A(s)=B(g)+2C(g)+2D(g),所得混合气的密度和同温同压下氧气的密度相同,则A 的摩尔质量是多少?
凝固点降低法测定分子量
凝固点降低法测定分子量 一、实验目的及要求 1)用凝固点降低法测定物质的摩尔质量。 2) 掌握自冷式凝固点测定仪的使用方法。 二、实验原理 非挥发性溶质二组分溶液,其稀溶液具有依数性,凝固点降低就是依数性的一种表现。根据凝固点降低的数值,可以求溶质的摩尔质量。对于稀溶液,如果溶质和溶剂不生成固溶体,固态是纯的溶剂,在一定压力下,固体溶剂与溶液成平衡的温度叫做溶液的凝固点。溶剂中加入溶质时,溶液的凝固点比纯溶剂的凝固点低。那么其凝固点降低值ΔT f 与溶质的质量摩尔浓度b 成正比。 ?T f = T f 0-T f =K f b 式中:T f 0纯溶剂的凝固点、T f 浓度为b 的溶液的凝固、K f 溶剂的凝固点降低常数。 若已知某种溶剂的凝固点降低常数K f ,并测得溶剂和溶质的质量分别为m A , m B 的稀溶液 的凝固点降低值?T f ,则可通过下式计算溶质的摩尔质量M B 。 A f B f B m T m K M ?= 式中K f 的单位为K · kg ·mol -1 纯溶剂的凝固点为其液相和固相共存的平衡温度。若将液态的纯溶剂逐步冷却,在未凝固前温度将随时间均匀下降,开始凝固后因放出凝固热而补偿了热损失,体系将保持液一固两相共存的平衡温度而不变,直至全部凝固,温度再继续下降。其冷却曲线如图1中1所示。但实际过程中,当液体温度达到或稍低于其凝固点时,晶体并不析出,这就是所谓的过冷现象。此时若加以搅拌或加入晶种,促使晶核产生,则大量晶体会迅速形成,并放出凝固热,使体或加入晶种,促使晶核产生,则大量晶体会迅速形成,并放出凝固热,使体系温度迅速回升到稳定的平衡温度;待液体全部凝固后温度再逐渐下降。冷却曲线如图1中2。
凝固点降低法测相对分子质量
凝固点降低法测相对分子质量;实验注意事项;1、将已调好并擦干的贝克曼温度计插入冷冻管时;再;晶全部溶化时;把萘加入体系并使其溶解时;请注意:;2、每组(三次)数据测定时过冷程度要一致;3、使用贝克曼温度计时请先阅读教材P44的注意事;4、量取苯时应先读室温;思考题;1、凝固点降低法测相对分子质量的公式,在什么条件;2、在冷却过程中,冷冻管内固液相之间和寒剂之 凝固点降低法测相对分子质量 实验注意事项 1、将已调好并擦干的贝克曼温度计插入冷冻管时;再次测量之前将体系温热、搅拌而使苯结 晶全部溶化时;把萘加入体系并使其溶解时;请注意:绝不能让温度计中的水银柱与贮槽中的水银相接! 2、每组(三次)数据测定时过冷程度要一致。搅拌应无摩擦。 3、使用贝克曼温度计时请先阅读教材P44的注意事项,一定要小心! 4、量取苯时应先读室温。 思考题 1、凝固点降低法测相对分子质量的公式,在什么条件下才能适用?答:非挥发性溶质的稀溶液,适用于稳定的大分子化合物,浓度不能太大也不能太小。 2、在冷却过程中,冷冻管内固液相之间和寒剂之间有哪些热交换?它们对凝固点的测定有何影响? 答:凝固点测定管内液体与空气套管、测定管的管壁、搅拌棒以及温差测量仪的传感器等存在热交换。因此,如果搅拌棒与温度传感器摩擦会导致测定的凝固点偏高。测定管的外壁上粘有水会导致凝固点的测定偏低。 3、当溶质在溶液中有离解,缔合和生成络合物的情况时,对相对分子质量测定值的影响如何?答:溶质在溶液中有解离、缔合、溶剂化和形成配合物时,凝固点降低法测定的相对分子质量为溶质的解离、缔合、溶剂化或者形成的配合物相对分子质量,因此凝固点降低法测定出的结果反应了物质在溶剂中的实际存在形式。 4、影响凝固点精确测量的因素有哪些? 答:影响测定结果的主要因素有控制过冷的程度和搅拌速度、寒剂的温度等。本实验测定凝固点需要过冷出现,过冷太甚会造成凝固点测定结果偏低,因此需要控制过冷程度,只有固液两相的接触面相当大时,固液才能达到平衡。实验过程中就是采取突然搅拌的方式和改变搅拌速度来达到控制过冷程度的目的;寒剂的温度,寒剂温度过高过低都不利于实验的完成。 5、.根据什么原则考虑加入溶质的量?太多或太少影响如何? 答:溶质的加入量应该根据它在溶剂中的溶解度来确定,因为凝固点降低是稀溶液的依数性,所以应当保证溶质的量既能使溶液的凝固点降低值不是太小,容易测定,又要保证是稀溶液这个前提。如果加入量过多,一方面会导致凝固点下降过多,不利于溶液凝固点的测定,另一方面有可能超出了稀溶液的范围而不具有依数性。过少则会使凝固点下降不明显,也不易测定并且实验误差增大。 6.空气套筒的作用是什么?本实验应注意哪些问题?答:使降温速度缓慢,有利于相平衡 7.为什么要先测近似凝固点? 答:为了控制过冷深度。过冷太小,温度回升不明显,不易测量。过冷太大,测量值偏低。
气体摩尔体积的概念及计算【含答案-习题-2015】
【基础过关】 1、等质量的下列物质在常温常压下体积最大的是(B) A、浓硫酸 B、CO2 C、铁粉 D、冰水混合物 2、同温同压下,下列关于氢气和氧气的叙述正确的是(B) ①等体积的氢气和氧气所含的分子数相等; ②氢分子间的平均距离和氧分子间的平均距离几乎是相等的; ③氢分子和氧分子大小相同; ④氢分子和氧分子本身的大小对气体体积的影响可以忽略不计。 A、①②③ B、①②④ C、①④ D、②③ 3、下列有关气体体积的叙述正确的是(B) A、一定温度和压强下,气体体积的大小由构成气体的分子大小决定 B、一定温度和压强下,气体体积的大小由气体的分子数决定 C、不同的气体,若体积不同,则他们所含的分子数也不同 D、1 mol 任何气体所占的体积都约为22.4 L 4、标准状况是气体所处的一种特殊条件,指的是(C) A、20 ℃、101 kPa B、20 ℃ C、0 ℃、101 kPa D、101 kPa 5、下列说法正确的是(B) A、1 mol 任何气体的气体摩尔体积都约为22.4 L/mol B、0℃、101 kPa 下,相同体积的H2和O2具有相同的分子数 C、1 mol 气体的体积为22.4 L ,则该气体一定处于标准状况下 D、2 mol CO2的体积约为44.8 L 6、(双选题)下列说法正确的是(A、D) A、标准状况下,1 mol CO2 的体积是22.4 L B、1 mol H2所占的体积一定是22.4 L C、标准状况下,6. 02 × 10 23 个Cu 原子所占的体积约是22.4 L D、标准状况下,28 g N2与CO 的混合气体的体积为22.4 L 7、下列说法正确的是(D)
气体摩尔体积习题及答案详解
气体摩尔体积 1.四种因素:①温度和压强 ②所含微粒数 ③微粒本身大小 ④微粒间的距离,其中对气态物质体积有显著影响的是 ( ) A .②③④ B .②④ C .①③④ D .①②④ 2.下列有关气体体积的叙述中,正确的是 ( ) A .一定温度和压强下,各种气态物质体积的大小由构成气体的分子大小决定 B .一定温度和压强下,各种气态物质体积的大小由构成气体的质量大小决定 C .不同的气体,若体积不同,则它们所含的分子数也不同 D .一定的温度和压强下,各种气体的物质的量决定它们的体积 3.当温度和压强一定时,决定气体体积大小的主要因素是( ) A .分子直径的大小 B .分子间距离的大小 C .分子间引力的大小 D .分子数目的多少 4.在标准状况下,与12 g H 2的体积相等的N 2( ) A .质量为12 g B .物质的量为6 mol C .体积为22.4 L D .分子数为6.02×1023 5.如果a g 某气体中含有的分子数为b ,则c g 该气体在标准状况下的体积是(式中N A 为阿伏加德罗常数的值)( ) A.22.4ab cN A L B.22.4bc aN A L C.22.4ac bN A L D.22.4b acN A L
6.在标准状况下,由0.5 g H2、11 g CO2和4 g O2组成的混合气体,其体积约为() A.8.4 L B.11.2 L C.14.0 L D.16.8 L 7.同温同压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为CH4的是() 8.在一定条件下,1体积气体A2和3体积气体B2完全反应生成了2体积气体X(体积在相同条件下测定),则X的化学式是() A.AB2B.A2B3 C.AB3D.AB2 9.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是() A.甲的分子数比乙的分子数多 B.甲的物质的量比乙的物质的量少 C.甲的摩尔体积比乙的摩尔体积小 D.甲的相对分子质量比乙的相对分子质量小 10.下列两种气体的分子数一定相等的是() A.质量相等的N2和CO B.体积相等的CO和C2H4 C.等温、等体积的O2和N2 D.等压、等体积的N2和CO2 11.标准状况下的甲烷和一氧化碳的混合气体8.96 L,其质量为7.60 g,则混合气体平均相对分子质量为________;混合气体中甲烷的体积为________;一氧化碳的质量为________。
实验 凝固点降低法测定分子量
1 实验9 凝固点降低法测分子量 一、实验目的及要求 1、用凝固点降低法测定环己烷的摩尔质量。 2、正确使用数字贝克曼(Beckmann )温度计,掌握溶液凝固点的测量技术。 3、通过本实验加深对稀溶液依数性的理解。 二、实验原理 化合物的分子量是一个重要的物理化学参数。用凝固点降低法测定物质的分子量是一种简单又比较准确的方法。 固体溶剂与溶液成平衡的温度称为溶液的凝固点。含非挥发性溶质的双组分稀溶液的凝固点低于纯溶剂的凝固点。凝固点降低是稀溶液依数性质的一种表现。当确定了溶剂的种类和数量后,溶剂凝固点降低值仅取决于所含溶质分子数目。对于理想溶液,根据相平衡条件,稀溶液的凝固点降低与溶液成分关系由范霍夫(van’t Hoff )凝固点降低公式给出 B A A m f f f n n n A H T R T +? = ) ()(2 *?? (2.1) 式中,△T f 为凝固点降低值;T f *为纯溶剂的凝固点;△f H m (A )为摩尔凝固点热;n A 和n B 分别为溶剂和溶质的物质的量。当溶液浓度很稀时,n B ≤n A ,则 B f B A m f f A B m f f f m K m M A H T R n n A H T R T ≡?=?=) ()()()(2*2 *??? (2.2) 式中,M A 为溶剂的摩尔质量;m B 为溶质的质量摩尔浓度;K f 即称为质量摩尔凝固点降低常数。 如果已知溶剂的凝固点降低常数K f ,并测得此溶液的凝固点降低值△T f ,以及溶剂和溶质的质量W A 、W B ,则溶质的摩尔质量由下式求得 f B K m =A f B W T W ? (2.3) 应该注意,如溶质在溶液中有解离、缔合、溶剂化和配合物形成等情况时,不能简单地运用公式(2.3)计算溶质的摩尔质量。显然,溶液凝固点降低法可用于溶液热力学性质的研究,例如电解质的电离度、溶质的缔合度、溶剂的渗透系数和活度系数等。 凝固点测定方法是将已知浓度的溶液逐步冷却成过冷溶液,然后促使溶液结晶;当晶体生成时,放出的凝固热使体系温度回升,当放热与散热达成平衡时,温度不再改变,此固液两相达成平衡的温度,即为溶液的凝固点。本实验测定纯溶剂和溶液的凝固点之差。 纯溶剂的凝固点是它的液相和固相共存的平衡温度。若将纯溶剂逐步冷却,理论上其冷却曲线(或称步冷曲线)应如图2—1(Ⅰ)所示。但是实际过程中往往发生过冷现象,即在过冷而开始析出固体时,放出的凝固热才使体系的温度回升到平衡温度,待液体全部凝固后,温度再逐步下降,其步冷曲线呈图2—1(Ⅱ)形状。过冷太甚,会出现如图2—1(Ⅲ)的形状。 溶液凝固点的精确测量,难度较大。当将溶液逐步冷却时,其步冷曲线与纯溶剂不同,见图2—1(Ⅳ)、(Ⅴ)、(Ⅵ)。由于溶液冷却时有部分溶剂凝固而析出,使剩余溶液的浓度逐渐增大,因而剩余溶液与溶剂固相的平衡温度也在逐渐下降,出现如图2—1(Ⅳ)的形状。通常发生稍有过冷现象,则出现如图2—1(Ⅴ)的形状,此时可将温度 回升的最高值 t 图2—1 步冷曲线示意图
高二化学测定气体的体积的方法
资源信息表 第十章说明 本章主要介绍了三个定量实验的原理、装置、操作步骤、数据处理、误差分析等知识与方法。这些内容是高中化学教学的重点,是帮助学生形成化学定量测定科学方法、态度、技能的重要载体。定量实验的原理与方法是本章教学的重点,误差分析是本章教学的难点。 本章教材内容是在学生学习了物质的量、气体摩尔体积、物质的两浓度,电解质溶液,卤素、氮硫、金属等化合物知识,掌握了一些探究物质性质与变化的
常见方法的基础上,引导学生学习定量测定实验的基本方法,为今后深入学习化学知识以及认识现代化工生产中,定量测定的应用做准备。 通过本章的学习,帮助学生体会定性实验与定量实验区别,认识定量实验的原理与方法,形成严谨思维品质和科学素养。通过测定1摩尔气体体积、结晶水含量测定、中和滴定三个原理和方法的学习,以及实验方案讨论与设计,掌握相关仪器的使用方法与操作技能,了解定量实验设计的关键,理解间接测定的方法,掌握定量实验的基本原理与一般方法,以及从具体到抽象的思维方法;体验定量测定中转化的思想方法对人类科学活动的影响与作用,初步形成严谨的科学态度和习惯,以及环境保护意识;感悟实事求是、严肃认真、一丝不苟的科学态度对个人和社会发展的重要作用。
10.1 测定1mol气体的体积(共3+1课时)第1课时测定1mol气体体积的方法 [设计思想] 测定1摩尔气体体积的定量实验是教材的重点,也是学生学习的难点。它是帮助学生体会定性实验与定量实验区别,认识定量实验设计的方法,形成严谨思维品质和科学素养的重要载体。教学设计着重于学生自己对实验的设计、改进、完善。通过测定1摩尔气体体积的实验方案讨论与设计,了解定量实验设计的关键,概括出定量实验的基本原理与一般方法,掌握从具体到抽象的思维方法,以及间接测定的方法,体验定量测定中转化的思想方法对人类科学活动的影响与作用,初步形成严谨的科学态度和习惯。 一.教学目标 1.知识与技能 (1)气体摩尔体积与温度和压强的关系(B)。 (2)定性实验与定量实验的区别,定量实验中的直接测量与间接测量及其相互关系(A)。(3)测定1摩尔气体体积的实验设计技能(B)。 2.过程与方法 (1)综合已学过的知识,通过类比、迁移、分析,明白实验原理。 (2)通过测定1摩尔气体体积的实验设计,认识定量测定中转化的思想方法。 (3)初步学会间接测定的方法,提高分析、转化、归纳、总结的能力。
- 凝固点降低法测定分子量
- 凝固点降低法测定相对分子质量
- 凝固点降低法测相对分子量
- 实验 凝固点降低法测定分子量教学提纲
- 凝固点降低法测定摩尔质量的思考题与答案
- 试验四凝固点降低法测定分子量
- 实验一凝固点降低法测分子量
- 凝固点降低法测分子量
- 凝固点降低法测定物质的相对分子质量实验报告
- 凝固点降低法测定相对分子高质量
- 实验八凝固点降低法测定摩尔质量
- (完整版)凝固点降低法测定摩尔质量的思考题及答案
- 凝固点降低法测物质分子量
- 实验凝固点降低法测分子量
- 凝固点降低法测分子量
- 实验 凝固点降低法测定分子量
- 凝固点降低法测定相对分子质量
- 试验四凝固点降低法测定分子量
- 凝固点降低法测定物质的相对分子质量实验报告
- 凝固点降低法测定物质的相对分子质量_纯萘、环己烷
