肠球菌、溶血性链球菌和粪链球菌检验培养基
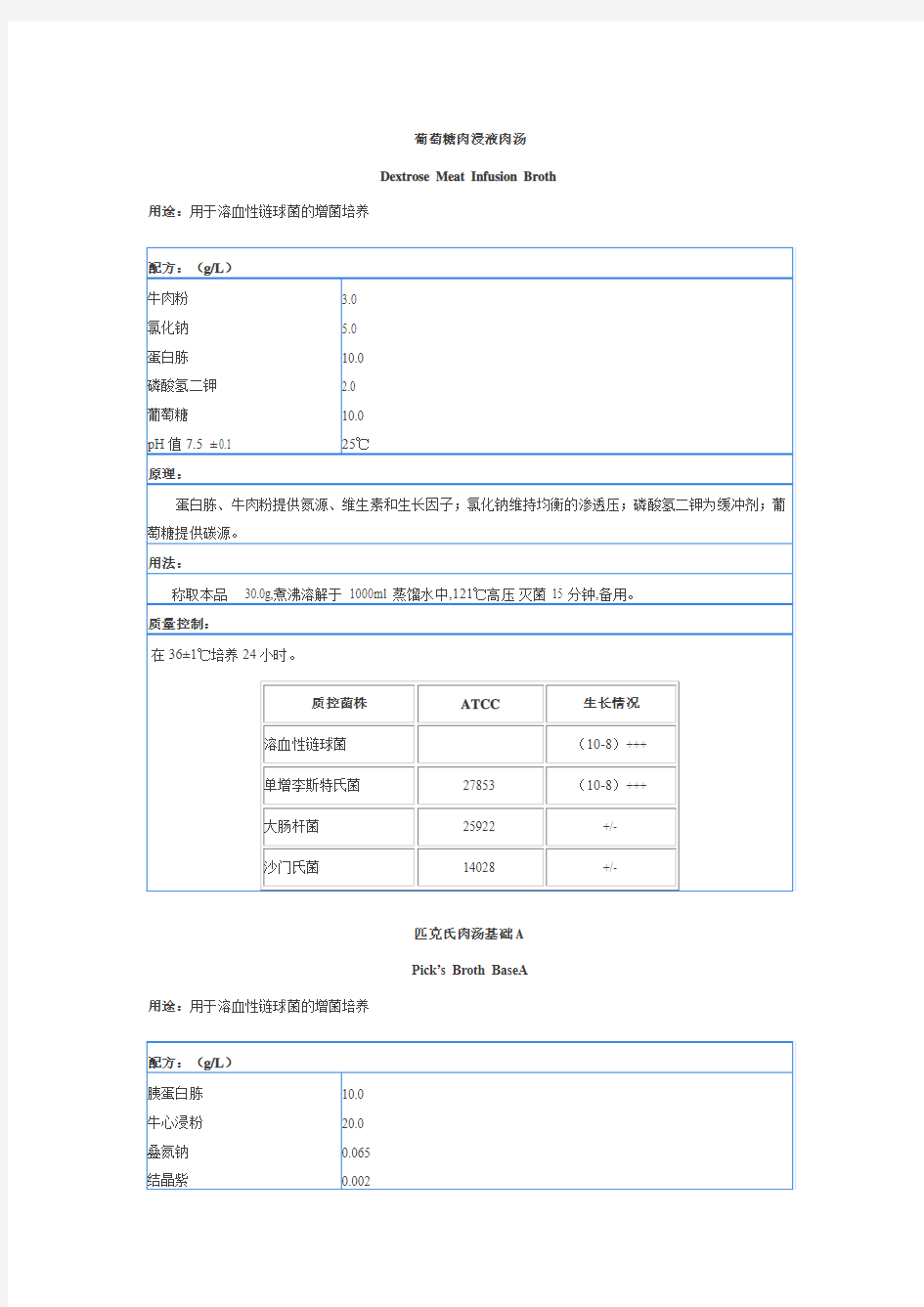
葡萄糖肉浸液肉汤
Dextrose Meat Infusion Broth 用途:用于溶血性链球菌的增菌培养
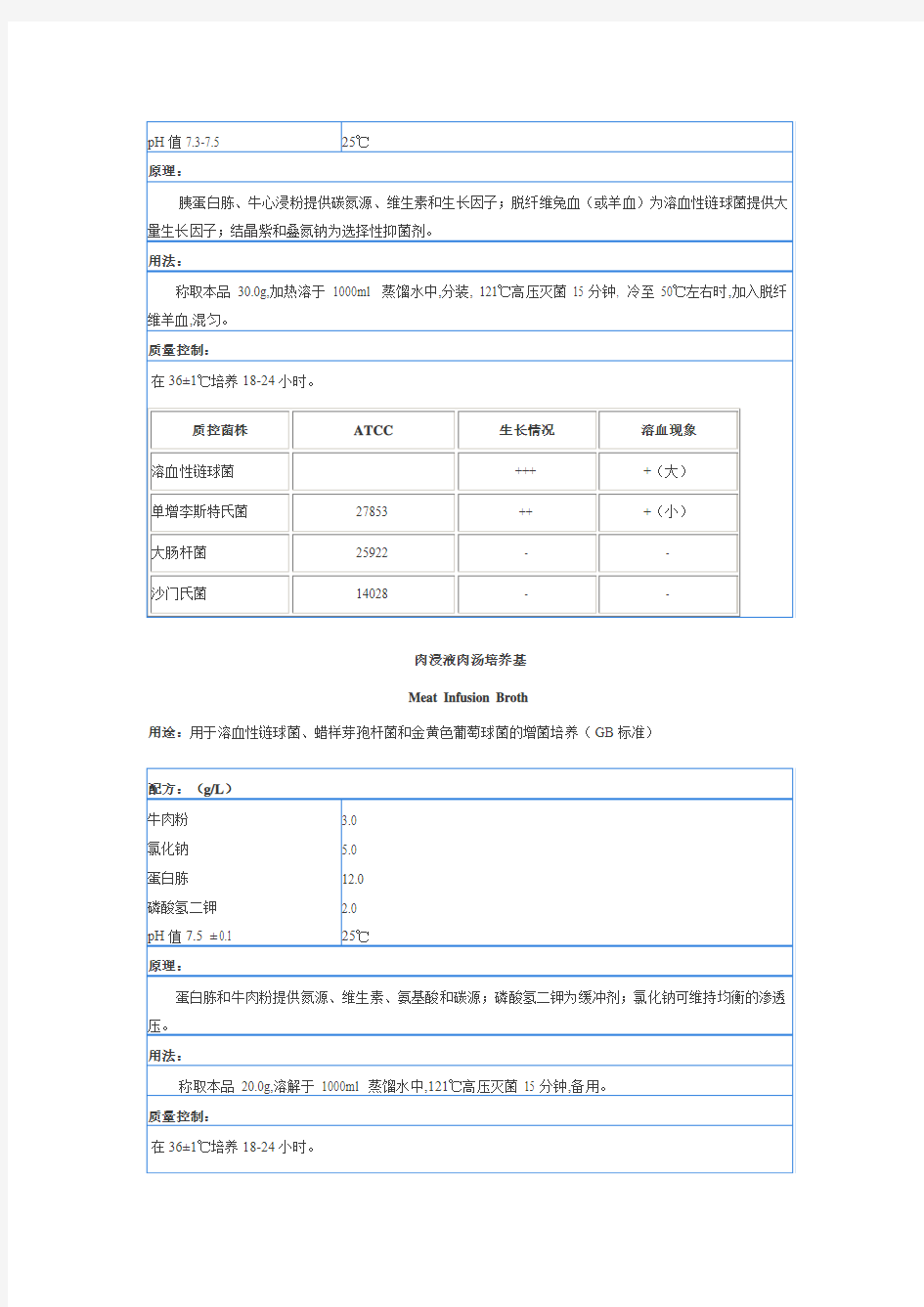
匹克氏肉汤基础A
Pick’s Broth BaseA
用途:用于溶血性链球菌的增菌培养
肉浸液肉汤培养基
Meat Infusion Broth
用途:用于溶血性链球菌、蜡样芽孢杆菌和金黄色葡萄球菌的增菌培养(GB标准)
叠氮钠葡萄糖肉汤
Azide Dextrose Broth 用途:用于链球菌的增菌培养
乙基紫叠氮钠肉汤用途:用于链球菌的增菌培养
KF链球菌琼脂
KF Streptococcus Agar 用途:用于链球菌的选择性分离及计数(GB、SN标准)
肠球菌琼脂(胆盐-七叶苷-叠氮钠琼脂)
Enterococcus Agar(Bile Esculin Azide Agar) 用途:用于食品和水中肠球菌的计数
CATC琼脂
CATC Agar
用途:用于食品和饮料肠球菌的分离培养
胆盐七叶苷琼脂
Bile Esculin Agar 用途:用于肠球菌和肠道致病菌的分离培养
哥伦比亚血琼脂基础
Columbia Blood Agar Base 用途:营养非常丰富,用于各种细菌的基础培养基
LIM培养基
LIM Medium 用途:用于链球菌的分离培养(Japan方法)
BETA-SSA琼脂
BETA-SSA Agar
用途:用于链球菌的选择性分离培养
粪肠球菌琼脂
Enterococcus faecalis Agar 用途:用于粪肠球菌的选择性分离
配方:(g/L)
月示胨
麦芽糖
酵母浸粉
甘油磷酸钠
氯化钠
乳糖
溴甲酚紫
叠氮钠
TTC
琼脂
pH值7.2 ± 0.2 10.0 20.0 10.0 10.0 5.0 1.0 0.015 0.4 0.1 13.0
缓冲蛋白胨水
Buffered Peptone Water 用途:用于阪崎杆菌前增菌培养(GB2008标准)
胆汁液态培养基
Bile broth
用途:用于粪链球菌的胆汁耐受试验。
M-肠道菌琼脂
M-Enterococcus Agar
用途:用于水中或其它物质中肠球菌分离培养和计数(滤膜法或划线法)
THB培养基
THB Medium
用途:用于链球菌增菌培养
PS琼脂
PS Agar 用途:用于消化球菌的培养
配方:(g/L)
蛋白胨
牛肉浸粉
酵母浸粉
葡萄糖
半胱氨酸盐酸盐氯化钙
硫酸镁
磷酸氢二钾
磷酸二氢钾
碳酸氢钠
氯化钠
吐温80
琼脂10.0 3.0 3.0 2.0 0.5 0.008 0.008 0.04 0.04 0.4
0.08
1.0 13.0
原理:
肠球菌肉汤
Enterococcus Broth 用途:用于肠球菌增菌培养
脑心浸液肉汤(BHI)
Brain Heart Infusion Broth 用途:用于细菌的增菌培养
脑心浸萃液肉汤
Brain Heart Infusion Broth 用途:用于营养苛求细菌的增菌培养
脑心浸液琼脂(BHIA)
Brain Heart infusion Agar 用途:用于营养苛求细菌的增菌培养
Pfizer肠球菌选择性琼脂(PSE琼脂)
Pfizer Enterococcus Selective Agar 用途:用于粪链球菌的选择性分离和计数(SN标准)
MEI培养基
MEI Medium 用途:用于一步滤膜法显色检测或计数水中的肠球菌
检验方法验证标准操作规程
标准操作规程 STANDARD OPERATING PROCEDURE 目的:建立检验方法验证标准操作规程,规范验证操作。 适用范围:所有检验方法的验证。 责任者:质量保证部、质量控制部 程序: 1、检验方法验证的基本内容 检验方法验证的基本内容包括方案的起草及审批,检测仪器的确认.适用性验证(包括准确度试验、精密度测定.线性范围试验、专属性试验等)和结果评价及批准四个欠的方面。它的基本内容可以用下图表示。 2、检验方法验证的基本步骤 首先是制定验证方案,然后对大型精密仪器进行确认,最关键的一步是检验方法的适用性试验,最后是检验方法评价及批准。 2.1验证方案的制定 检验方法的验证方案通常由质量验证小组提出。根据产品的工艺条件、原辅料化学结构、中间体、分解产物查阅有关资料,提出规格标准,确定检查项目,规定杂质限度,即为质量标准草案。根据质量标准草案确定检查和试验范围,对检验方法拟定具体操作步骤,最后经有关人员审批方可实施。 2.2大型精密仪器的确认 分析测试中所用的检测仪器一般可分为三类 (1)普通仪器:崩解仪,折光仪、分析天平、酸度计、溶点测定仪、电导仪等: (2)较精密仪器:旋光仪、永停滴定仪、费休氏水分测定仪、自动滴定仪、药物溶出度仪、可
见分光光度计、电泳仪等; (3)大型精密仪器:紫外分光光度计、红外分光光度计、气相色谱仪、高效液相色谱仪、薄层扫描仪等。 为了保证分析测试数据准确可靠,每台检测仪器在投入正式使用之前都应进行确认。检测仪器的确认是检验方法验证的基础,应在其它验证试验开始之前首先完成。检测仪器确认工作内容应根据仪器类型。技术性能而定,通常包括:安装确认、校正、适用性预试验和再确认。2.2.1安装确认 同工艺验证中机械设备一样,仪器安装确认的土要内容包括如下各点: (1)要登记仪器名称.型号。生产厂商的编号、生产日期.生产厂商名称,企业内部的固定资产设备登记号及安装地点; (2)收集汇编和翻译仪器使用说明书和维修保养手册; (3)检查并记录所验收的仪器是否符合厂方规定的规格标准: (4)检查并确保有该仪器的使用说明书。维修保养手册和备件清单: (5)检查安装是否恰当,气、电及管路连接是否符合要求; (6)制定仪器标准操作规程(SOP)和维修保养制度,建立使用记录和维修记录; (7)制定清洗规程;. (8)明确仪器设备技术资抖(图纸,手册,备件清单、各种指南及该机器设备有关的其它文件)的专管人员及存放地点。 除上面提到的内容外,在安装确认方案中对仪器的性能用途应有一概述并记录维修服务单位名称。联系人、电话号码、传真号、银行帐号等,以利于日后的维修保养活动,这对大型精密仪器尤为重要。对于仪器来说,安装确认中的一项重要内容是功能试验。这项工作在安装结束,检查合格后即可着手进行。仪器功能试验足在不使用样品的前提下,确认仪器达到设计要求,也可认为是空载试验。例如气相色谱仪的程序升温设定后能否按设定程序执行,溶出仪转速能否达到规定的性能要求。紫外分光光度计的吸收度与透光率的转换是否符合要求。高效液相色谱仪高压泵过压保护是否起作用等,这是检查仪器安装后能达到规定的性能指标。对普通仪器进行的功能试验比较简单,有的除仪器校正外,没有其它特殊的功能试验要做,如酸度计,电导仪,折光仪等。不同的仪器有不同的技术标准,应根据仪器使用说明书的要求进行试验。 2.2.2校正 校正是仪器确认及检验方法验证中的一个重要环节,应当在验证试验以前进行校正。紫外分光光度计校正包括波长校正、吸收度测试、准确度测试、杂散光检查。 气相色谱仪与高效液相色谱仪均要求做系统适用性试验。在规定的色谱条件下测定色谱柱的最小理论塔板数。分离度和拖尾因子,并规定变异系数应不大于2%。 对于化学检验中使用的计量仪器包括容量瓶、移液管、滴定管、分析天平亦均应校正。
肠球菌、溶血性链球菌和粪链球菌检验培养基
葡萄糖肉浸液肉汤 Dextrose Meat Infusion Broth 用途:用于溶血性链球菌的增菌培养 配方:(g/L) 牛肉粉 氯化钠 蛋白胨 磷酸氢二钾 葡萄糖 pH值7.5 ± 0.1 3.0 5.0 10.0 2.0 10.0 25℃ 原理: 蛋白胨、牛肉粉提供氮源、维生素和生长因子;氯化钠维持均衡的渗透压;磷酸氢二钾为缓冲剂;葡萄糖提供碳源。 用法: 称取本品 30.0g,煮沸溶解于 1000ml 蒸馏水中,121℃高压灭菌 15 分钟,备用。 质量控制: 在36±1℃培养24小时。 质控菌株ATCC生长情况 溶血性链球菌(10-8)+++ 单增李斯特氏菌27853 (10-8)+++ 大肠杆菌25922 +/- 沙门氏菌14028 +/- 匹克氏肉汤基础A Pick’s Broth BaseA 用途:用于溶血性链球菌的增菌培养 配方:(g/L) 胰蛋白胨 牛心浸粉 叠氮钠 结晶紫 pH值7.3-7.5 10.0 20.0 0.065 0.002 25℃
原理: 胰蛋白胨、牛心浸粉提供碳氮源、维生素和生长因子;脱纤维兔血(或羊血)为溶血性链球菌提供大量生长因子;结晶紫和叠氮钠为选择性抑菌剂。 用法: 称取本品 30.0g,加热溶于1000ml 蒸馏水中,分装, 121℃高压灭菌 15 分钟, 冷至 50℃左右时,加入脱纤维羊血,混匀。 质量控制: 在36±1℃培养18-24小时。 质控菌株ATCC生长情况溶血现象 溶血性链球菌+++ +(大) 单增李斯特氏菌27853 ++ +(小) 大肠杆菌25922 - - 沙门氏菌14028 - - 肉浸液肉汤培养基 Meat Infusion Broth 用途:用于溶血性链球菌、蜡样芽孢杆菌和金黄色葡萄球菌的增菌培养(GB标准) 配方:(g/L) 牛肉粉 氯化钠 蛋白胨 磷酸氢二钾 pH值7.5 ± 0.1 3.0 5.0 12.0 2.0 25℃ 原理: 蛋白胨和牛肉粉提供氮源、维生素、氨基酸和碳源;磷酸氢二钾为缓冲剂;氯化钠可维持均衡的渗透压。 用法: 称取本品 20.0g,溶解于 1000ml 蒸馏水中,121℃高压灭菌 15 分钟,备用。 质量控制: 在36±1℃培养18-24小时。 质控菌株菌株编号生长情况其它特征 溶血性链球菌ATCC32210 +++ 浑浊
溶血性链球菌
1.溶血性链球菌 ①GB4789.11-2014 《食品安全国家标准食品微生物学检验β型溶血性链球菌检验》于 2015年05月01日实施,代替GB/T 4789.11-2003 《食品卫生微生物学检验溶血性链球菌检验》。 注:根据链球菌在血液培养基上生长繁殖后是否溶血及其溶血性质分为三类,α-溶血性链球菌,也称甲型溶血,此类细菌致病力不强,多为条件致病菌。在人类呼吸道及肠道中有α型溶血链球菌正常寄生,但有时也可引起亚急性心内膜炎等症。β-溶血性链球菌,这类菌亦称为溶血性链球菌,该菌的致病力强,常引起人类和动物的多种疾病。具体用途是用于研究和质量控制。γ-溶血链球菌也称为丙型或不溶血性链球菌,该菌无致病性,常存在于乳类和粪便中,偶尔也引起感染。 ②选作项目:链激酶试验:搜索了广东环凯/青岛海博/北京陆桥均没有发现“草酸钾血浆”或者链激酶实验套装在售。 ③生化鉴定:搜索了广东环凯/青岛海博/北京陆桥仅在北京陆桥发现“溶血性链球菌荧光定量PCR检测试剂盒“ 2.根据GB4789.35-2010《食品安全国家标准食品微生物学检验乳酸菌检验》可进行双歧杆菌计数嗜热链球菌鉴别乳杆菌鉴别如果对标准理解没有错误的情况下,应该问题不大。 3.若根据GB4789.34-2012 进行双歧杆菌的鉴定,需要气相色谱,这个仪器是微生物检验科所不具备的。 4.总之,从实验条件上,药品检验实验室是否可以用于保健食品的检测,尚不明确;从人员看,微生物检验科实验人员均没有上述检验项目的检验经验。从检测标准看,除自学外,微生物检验科检验人员均没有相关标准的学习经历。从仪器设备材料看,溶血性链球菌检验缺少相关试剂及仪器。
实验室检验方法的验证和确认
实验室检验方法的验证和确认 1、检验方法验证的基本内容 检验方法验证的基本内容包括方案的起草及审批,检测仪器的确认,适用性验证(包括准确度试验、精密度测定、线性范围试验、专属性试验等)和结果评价及批准四个方面。 2、检验方法验证的基本步骤 首先是制定验证方案,然后对大型精密仪器进行确认,最关键的一步是检验方法的适用性试验,最后是检验方法评价及批准。 1)验证方案的制定 检验方法的验证方案通常由质量验证小组提出。根据产品的工艺条件、原辅料化学结构、中间体、分解产物查阅有关资料,提出规格标准,确定检查项目,规定杂质限度,即为质量标准草案。根据质量标准草案确定检查和试验范围,对检验方法拟定具体操作步骤,最后经有关人员审批方可实施。 2)大型精密仪器的确认 分析测试中所用的检测仪器一般可分为三类 (1)普通仪器:崩解仪,折光仪、分析天平、酸度计、溶点测定仪、电导仪等: (2)较精密仪器:旋光仪、永停滴定仪、费休氏水分测定仪、自动滴定仪、药物溶出度仪、可见分光光度计、电泳仪等; (3)大型精密仪器:紫外分光光度计、红外分光光度计、气相色谱仪、高效液相色谱仪、薄层扫描仪等。 为了保证分析测试数据准确可靠,每台检测仪器在投入正式使用之前都应进行确认。检测仪器的确认是检验方法验证的基础,应在其它验证试验开始之前首先完成。检测
仪器确认工作内容应根据仪器类型。技术性能而定,通常包括:安装确认、校正、适用性预试验和再确认。 校正 校正是仪器确认及检验方法验证中的一个重要环节,应当在验证试验以前进行校正。紫外分光光度计校正包括波长校正、吸收度测试、准确度测试、杂散光检查。 气相色谱仪与高效液相色谱仪均要求做系统适用性试验。在规定的色谱条件下测定色谱柱的最小理论塔板数。分离度和拖尾因子,并规定变异系数应不大于2%。 对于化学检验中使用的计量仪器包括容量瓶、移液管、滴定管、分析天平亦均应校正。适用性预试验 仪器的安装确认完成以后,在其功能试验符合要求的情况下,应用标准品或对照品对其进行适用性检查,以确认仪器是否符合使用要求。例如对熔点测定仪的适用性预试验是采用已知溶点的甲硝唑做试验,测试结果与已知熔点比较。紫外分光光度计可用已知含量的某标准品试验,测得结果与已知数值对比,确定仪器是否符合使用要求。在完成上述各项试验工作的同时,应做好相应的文件记录等资料归档工作,每一台仪器均应有一套完整的档案资料。 再确认 为了确保仪器处于良好的使用状态,对于一台新购买的仪器在确认工作结束以后,应根据仪器的类别。确认的经验制定再确认的计划。再确认的时间间隔和内容要根据仪器类别和使用情况决定,一般是3个月、6个月或1年。仪器再确认的内容通常包括线路连接、附件备品消耗品检查、清洁工作、功能试验、工作日记等,其中重点是安装确认中的功能试验。 3、检验方法的适用性验证
β溶血性链球菌
化脓性链球菌: 抗生素选择:A青霉素阿莫西林B第一代头孢菌素红霉素克林霉素 β溶血性链球菌: 抗生素选择:A青霉素B打环内酯类C头孢第一代或第二代类菌素 B组链球菌: 抗生素选择:A氨苄西林B头孢曲松或头孢噻肟 草绿色链球菌: 抗生素选择:A青霉素+氨基糖苷类B头孢噻吩或头孢唑林+氨基糖苷类 肺炎链球菌: 抗生素选择:青霉素敏感:A青霉素B阿莫西林(或+克拉维酸)C头孢第一代或第二代类菌素 青霉素耐药:A头孢第三代B喹诺酮类 流感嗜血杆菌: 抗生素选择:A氨苄西林(或+舒巴坦) 阿莫西林(或+克拉维酸) B头孢第一代或第二代类菌素喹诺酮类卡他莫拉菌: 抗生素选择:A头孢第一代或第二代类菌素B喹诺酮类氨苄西林+舒巴坦阿莫西林+克拉维酸 军团菌: 抗生素选择:A大环内酯类B喹诺酮类 肺炎支原体: 抗生素选择:A大环内酯类B喹诺酮类多西环素 肺炎衣原体: 抗生素选择: A大环内酯类B喹诺酮类多西环素 金葡菌: 抗生素选择:甲氧西林敏感:A苯唑西林氯唑西林B头孢第一代或第二代类菌素克林霉素林可霉素甲氧西林耐药:A万古霉素B磷霉素利福平复方磺胺甲恶唑+万古霉素 腐生葡萄球菌: 抗生素选择:A头孢氨苄头孢拉定头孢唑林B呋喃妥因磷霉素头孢呋辛 肠球菌属: 抗生素选择:A阿莫西林氨苄西林氨基糖苷类B呋喃妥因万古霉素 革兰氏阴性杆菌: 抗生素选择:A头孢第二代或第三代类菌素B喹诺酮类β内酰胺类+β内酰胺酶抑制剂 肠杆菌科细菌: 抗生素选择: A头孢第二代或第三代类菌素(或联用氨基糖苷类) B喹诺酮类β内酰胺酶抑制剂复方 炭青霉烯类 大肠埃希菌: 抗生素选择: A呋喃妥因磷霉素B头孢氨苄头孢拉定喹诺酮类 肺炎克雷伯菌: 抗生素选择: A头孢第二代或第三代类菌素B喹诺酮类头孢第四代菌素 志贺菌属: 抗生素选择: A喹诺酮B阿莫西林、呋喃唑酮、磷霉素、头孢第一代或第二代类菌素 沙门菌属: 抗生素选择: A喹诺酮B氨苄西林、磷霉素 耶尔森菌属: 抗生素选择:A喹诺酮类B氨基糖苷类 变形杆菌属: 抗生素选择:A派拉西林氨苄西林+舒巴坦阿莫西林+克拉维酸 B头孢第二代或第三代类菌素喹诺酮类氨基糖苷类
检测方法的验证及确认
检测方法的验证及确认
加标回收率的测定可以反映测试结果的准确度。当按照平行加标进行回收率测定时,所得结果既可以反映测试结果的准确度,也可以判断其精密度。在实际测定过程中,有的将标准溶液加入到经过处理后的待测样品中,这不够合理,尤其是测定有机成分而试样须经预处理时,或者测定易挥发物等需要蒸馏预处理的成分时,不能反映预处理过程中的沾污或损失情况,虽然回收率较好,但不能完全说明数据准确。进行加标回收率测定时,还应注意以下几点: 1)加标物的形态应该和待测物的形态相同。 2)加标量和加标回收率测量的精密度应予以控制,一般情况下作如下规定: ①加标量应尽量与样品中待测物含量相等或相近,并应注意对样品容积的影响; ②当样品中待测物含量接近方法检出限时,加标量应控制在校准曲线的低浓度范围; ③加标量尽量不大于待测物含量的3倍; ④加标后的测定值不应超出方法的测量上限的90%; ⑤当样品中待测物浓度高于校准曲线的中间浓度时,加标量应控制在待测物浓度的半量。 3)由于加标样和样品的分析条件完全相同,其中干扰物质和不正确操作等因素所导致的效果相等。当以其测定结果的差值计算回收串时,常不能确切反映样品测定结果的实际差错。
国家标准 GB/T 27404-2008 《实验室质量控制规范食品理化检测》中对回收率试验做了如下规定: 对于食品中的禁用物质,回收率应在方法测定低限、两倍方法测定低限和十倍方法测定低限进行三水平试验;对于已制定最高残留限量(MRL)的,回收率应在方法测定低限、MRL、选一合适点进行三水平试验;对于未制定MRL的,回收率应在方法测定低限、常见限量指标、选一合适点进行三水平试验。回收率的参考范围见表F.1.
溶血性链球菌检验
【GB/T 4789.11—1994】 食品卫生微生物学检验溶血性链球菌检验 1 主题内容与适用范围 本标准规定了食品中溶血性链球菌的检验方法。 本标准适用于食品和食物中毒样品中溶血性链球菌的检验。 2 引用标准 GB 4789.28 食品卫生微生物学检验染色法、培养基和试剂 3 设备和材料 3.1 温箱:36±1℃。 3.2 水浴:36±1℃。 3.3 显微镜。 3.4 离心机。 3.5 试管架。 3.6 灭菌平皿。 3.7 灭菌小试管。 3.8 载玻片。 3.9 灭菌吸管:1mL、10mL。 3.10 灭菌镊子。 3.11 均质器。 3.12 酒精灯。 3.13 接种环。 4 培养基和试剂 4.1 葡萄糖肉浸液肉汤:按GB 4789.28中4.1规定,在肉浸液肉汤内加入1%葡萄糖。 4.2 肉浸液肉汤:按GB 4789.28中4.1规定。 4.3 匹克氏肉汤:按GB 4789.28中4.62规定。 4.4 血琼脂平板:按GB 4789.28中4.6规定。 4.5 人血浆。 4.6 0.25%氯化钙。 4.7 灭菌生理盐水。 4.8 杆菌肽药敏纸片(含0.04单位)。 5 检验程序 (图略) 6 操作步骤 6.1 样品处理 称取25g固体检样;称取25mL液体检样,加入225mL灭菌生理盐水,研成匀浆制成混悬液。 6.2 一般培养 将上述混悬液吸取5mL,接种于50mL葡萄糖肉浸液肉汤;或直接划线接种
于血平板,如检样污染严重,可同时按上述量接种匹克氏肉汤,经36±1℃培养24h,接种血平板,置36±1℃培养24h,挑起乙型溶血圆形突起的细小菌落,在血平板上分纯,然后观察溶血情况及革兰氏染色,并进行链激酶试验及杆菌肽敏感试验。 6.3 形态与染色 本菌呈球形或卵圆形,直径0.5~1μm,链状排列,链长短不一,短者4~8个细胞组成,长者20~30个,链的长短常与细菌的种类及生长环境有关;液体培养中易呈长链;在固体培养基中常呈短链,不形成芽孢,无鞭毛,不能运动。 6.4 培养特性 该菌营养要求较高,在普通培养基上生长不良,在加有血液、血清培养基中生长较好。溶血性链球菌在血清肉汤中生长时管底呈絮状或颗粒状沉淀。血平板上菌落为灰白色,半透明或不透明,表面光滑,有乳光,直径约0.5~0.75mm,为圆形突起的细小菌落,乙型溶血链球菌周围有2~4mm界限分明、无色透明的溶血圈。 6.5 链激酶试验 致病性乙型溶血性链球菌能产生链激酶(即溶纤维蛋白酶),此酶能激活正常人体血液中的血浆蛋白酶原,使成血浆蛋白酶,而后溶解纤维蛋白。 吸取草酸钾血浆0.2mL,加0.8mL灭菌生理盐水,混匀,再加入18~ 24h36±1℃培养的链球菌培养物0.5mL及0.25%氯化钙0.25mL(如氯化钙已潮解,可适当加大至0.3%~0.35%),振荡摇匀,置于36±1℃水浴中10min,血浆混合物自行凝固(凝固程度至试管倒置,内容物不流动)。然后观察凝块重新完全溶解的时间,完全溶解为阳性,如24h后不溶解即为阴性。 草酸钾人血浆配制:草酸钾0.01g放入灭菌小试管中,再加入5mL人血,混匀,经离心沉淀,吸取上清液即为草酸钾人血浆。 6.6 杆菌肤敏感试验 挑取乙型溶血性链球菌液,涂布于血平板上,用灭菌镊子夹取每片含有0.04单位的杆菌肽纸片,放于上述平板上,于36±1℃培养18~24h,如有抑菌带出现即为阳性。同时用已知阳性菌株作为对照。
方法验证和方法确认的区别与联系资料精修订
方法验证和方法确认的区别与联系资料 标准化管理部编码-[99968T-6889628-J68568-1689N]
方法验证和方法确认的区别与联系 任何分析的目的都是为了获得稳定、可靠和准确的数据,方法验证在其中起着极为重要的作用。方法验证的结果可以用于判断分析结果的质量、可靠性和一致性,这是所有质量管理体系不可分割的一部分。一般在下列情况下,要求对分析方法进行验证、确认(或称证实)或重新验证:1)首次用于常规检测前;2)转到另一个时;3)对于验证过的方法,其条件或方法参数发生变化时(例如,仪器性能参数发生改变或样品基质不同时),并且这种变化超出了方法的原适用范围。 对实验室有影响的法规和质量管理一般都要求进行方法验证。有的法规中直接使用“验证或确认”一词,并列出特定参数,也有的法规用这样的陈述暗示验证要求——“检测方法应适合于预期用途。” 1. 国内主要法规标准 国内第三方检测机构一般均非标准制修订机构,方法验证或确认的来源基本来自资质认定或实验室认可的要求,主要依据如下: 2.1 CNAS-CL01:2006 2.2 实验室资质认定评审准则 l 5.3.2 实验室应确认能否正确使用所选用的新方法。如果方法发生了变化,应重新进行确认。实验室应确保使用标准的最新有效版本。 l 5.3.5 实验室自行制订的非标方法,经确认后,可以作为资质认定项目,但仅限特定委托方的检测。 2.3 司法鉴定机构资质认定评审准则 2.4 CNAS-CL02:2013 2.5 CNAS-CL08:2013 2.6 其他 CNAS-CL10:2012《检测和校准实验室能力认可准则在化学检测领域的应用说明》:5.4.2 方法的选择:b) 实验室应对首次采用的检测方法进行技术能力的验证,如检出限、回收率、正确度和精密度等。如果在验证过程中发现标准方法中未能详述但影响检测结果的环节,应将详细操作步骤编制成作业指导书,作为标准方法的补充。当检测标准发生变更涉及到检测方法原理、仪器设施、操作方法时,需要通过技术验证重新证明正确运用新标准的能力。 5.4.5 方法确认: a) 任何对标准方法的偏离,都必须进行实验室确认,即使所采用的替代技术可能具有更好的分析性能。 b) 实验室应通过试验方法的检出限、精密度、回收率、适用的浓度范围和样品基体等特性来对检测方法进行确认。 CNAS-CL09:2013要求:标准方法引入检测之前,实验室应证实能够正确地运用这些方法,并未清晰说明如何证实,而对非标方法的确认提供的参考资料,比如SN/T 3266-2012《食品微生物检验方法确认技术规范》;CNAS-CL18:2013规定标准方法必要时才进行技术验证;CNAS-CL44:2013和CNAS-CL56:2014仅规定非标准方法(包括
(完整版)检验方法验证和确认管理规程
页次:共11 页第1 页 文件名称:检验方法验证和确认管理规程编码:03SMP01200 起草审核批准颁发部门质量保证部 日期日期日期实施日期 分发部门及份数:质量管理部1份 目的:明确检验方法的验证和确认的管理规程,确保所采用的检验方法科学、合理,符合检验要求并能有效控制药品的内在质量。 范围:仅适用于本公司对物料、产品的理化检验方法的验证和确认;清洁验证方法的验证。 职责:质量管理部QC、QA人员、质量管理部负责人对本规程的实施负责。 内容: 1. 方法验证及确认工作职责分工 1.1 质量控制部QC负责验证或确认方案的起草、验证或确认工作具体实施以及报告的填写。 1.2质量控制部负责人或其指定人员负责验证或确认方案、报告的审核,组织验证或确认工作的实施,对验证或确认工作中出现的问题及时纠正。 1.3 质量保证部QA负责验证或确认方案、报告的审核,监督确认工作实施,对确认工作中出现的问题提出改进意见并监督落实。确保检验方法验证或确认程序达到符合性要求,程序被遵照执行,并且方法的预定用途被有效的且以文件记录的数据所支持。 1.4 质量管理部负责人负责验证或确认方案及报告的审核批准。 2 方法验证 2.1定义:方法验证就是根据检验项目的要求,预先设置一定的验证内容和验证标准要求,并通过设计合理的实验来验证所采用的分析方法是否符合检验项目的要求。 2.2 目的:方法验证是证明采用的方法适合于相应检测要求。 2.3 适用范围:符合下列情形之一的,应当对检验方法进行验证: (1)采用新的检验方法; (2)检验方法需变更的; (3)采用《中华人民共和国药典》及其他法定标准未收载的检验方法; (4)法规规定的其他需要验证的检验方法。
中华人民共和国国家标准食品卫生微生物学检验溶血性链球菌检验.
中华人民共和国国家标准食品卫生微生物学检验溶血性链球菌检验1 主题内容与适用范围 本标准规定了食品中溶血性链球菌的检验方法。 本标准适用于食品和食物中毒样品中溶血性链球的检验。 2 引用标准 GB 4789.28 食品卫生微生物学检验染色法、培养基和试剂 3 设备和材料 3.1 温箱:36±1℃。 3.2 水浴:36±1℃。 3.3 显微镜。 3.4 离心机。 3.5 试管架。 3.6 灭菌平皿。 3.7 灭菌小试管。 3.8 载玻片。 3.9 灭菌吸管:1 mL、10 mL。 3.10 灭菌镊子。 3.11 均质器。 3.12 酒精灯。 3.13 接种环。 4 培养基和试剂 4.1 葡萄糖肉浸液肉汤:按GB 4789.28 中4.1 规定,在肉浸液肉汤内加入1%葡萄糖。4.2 肉浸液肉汤:按GB 4789.28 中4.1 规定。 4.3 匹克氏肉汤:按GB 4789.28 中4.62 规定。 4.4 血琼脂平板:按GB 4789.28 中4.6 规定。 4.5 人血浆。 4.6 0.25%氯化钙。 4.7 灭菌生理盐水。 4.8 杆菌肽药敏纸片(含 0.04 单位)。 5 检验程序 6 操作步骤 6.1 样品处理 称取 25 g 固体检样;称取25 mL 液体检样,加入 225 mL 灭菌生理盐水, 研成匀浆制成混悬液。 6.2 一般培养 将上述混悬液吸取 5 mL,接种于 50 mL 葡萄糖肉浸液肉汤;或直接划线接 种于血平板,如检样污染严重,可同时按上述量接种匹克氏肉汤,经 36±1℃培 养 24 h,挑起乙型溶血圆形突起的细小菌落,在血平板上分纯,然后观察溶血 情况及革兰氏染色,并进行链激酶试验及杆菌肽敏感试验。 6.3 形态与染色 本菌呈球形或卵圆形,直径 0.5~1 μm,链状排列,链长短不一,短者4~8 个细胞组成,长者 20~30 个,链的长短常与细菌的种类及生长环境有关;液体 培养中易呈长链;在固体培养基中常呈短链,不形成芽孢,无鞭毛,不能运动。 6.4 培养特性
链球菌感染后的症状
链球菌感染后的症状 链球菌感染后的症状有哪些呢?链球菌属是链球菌科的成员之一,链球菌是圆形或卵圆形的革兰氏阳性细菌。那么,链球菌感染后的症状有哪些呢? 文章目录 一、链球菌感染后的症状 二、链球菌感染的治疗 三、链球菌感染的原因 链球菌感染后的症状 1、链球菌感染后的症状 1.1、病前2-3周有上呼吸道或皮肤感染史,如咽炎、扁桃体炎; 1.2、全身表现如乏力、厌食、恶心、呕吐、腰痛及头痛; 1.3、血尿及蛋白尿:尿色深如洗肉水样,轻至中等量蛋白尿; 1.4、少尿及水肿;
1.5、高血压:一过性的轻中度高血压; 1.6、严重病例早期可出现急性左心衰竭、脑病及急性肾功能衰竭等表现。 2、什么是链球菌感染 链球菌感染是链球菌属细菌侵入人体引起的疾病,出现血尿、水肿及消化道症状等。分为感染性疾病,如急性扁桃体炎、脓皮病、肺炎等和变态反应性疾病,如急性肾小球肾炎。
3、链球菌感染的分类 3.1、A族乙型溶血性链球菌经呼吸道侵入人体,致扁桃体炎、急性咽炎或喉炎。婴幼儿及年老体弱者约半数可并发支气管炎、肺炎。若侵入咽部的链球菌能产生红疹毒素,或原不产生红疹毒素的A族乙型溶血性链球菌经产生红疹毒素的A族链球菌的噬菌体作用后,变为能产生红疹毒素者,便可引起猩红热。 3.2、B族乙型溶血性链球菌为人类泌尿生殖道及鼻咽部的寄生菌,主要引起肾盂肾炎、肺炎、子宫内膜炎;此菌亦已成为产褥热、新生儿感染的主要病原菌。若产妇带菌,分娩过程中羊膜破裂后,胎儿可被污染的羊水经呼吸道感染,亦可在经过产道时被感染;新生儿还可因吸入医护人员及产妇呼吸道带菌者的飞沫而被感染。新生儿的B族乙型溶血性链球菌感染的临床表现分早发型(败血症型)和迟发型(脑膜炎型)。 链球菌感染的治疗 1、链球菌感染的治疗概述 就诊科室:传染科;
检测方法验证和确认程序
1 目的PURPOSE 2 本规程规定了XXXXXXX 药业有限公司检测方法验证和确认程序、 格式和要求。 3 范围SCOPE 3.1 本规程适用于XXXXXXXX 药业有限公司QC 实验室的检测方法的确认。 3.2 本规程适用于美国药典/国家处方集、欧洲药典或其它药典中记载的检测方法, 和来自于公司内部或外部的已经验证的检测方法。 3.3 本规程注重在鉴别、纯度和含量的检测方法。 3.4 本规程将作为提及的检测方法验证的常规指引,也适用于最常用的检测方法的验 证,如: 3.4.1 鉴别测试 3.4.2 有关物质和降解产物的含量的定量测试。 3.4.3 控制有关物质和降解产物的限度测试。 3.4.4 原料药、起始物料、中间体及其他物料的含量测定。 3.5 微生物和生物检测方法不在本规程范围内。 4 参考REFERENCE 4.1 ICH Q2(R1)分析方法验证的文本及方法学 4.2 现行美国药典<1225>药典方法的验证 4.3 现行美国药典<1226>药典方法的确认 4.4 ICHQ7 原料药的良好质量管理规范(2000年11月) 4.5 FDA 行业指南“分析方法和方法验证” (2000年8月) 5 职责RESPONSIBILITIES 5.1 QC 负责人或指定人员负责参与本规程的起草、审阅、修订和更新。 5.2 QA 负责人或指定人员负责本规程的审核和保证其被正确地、准确地执行 5.3 QC 负责市售产品的检测方法验证,确认这些方法在实际条件下适用于本实验 室的测试。 5.4 QC 负责人或指定人员负责审核确认方案和确认报告
5.5 QC 负责正确地记录实验数据。 5.6 QC负责归纳数据、撰写报告并递交给QC负责人或指定人员审阅。 5.7 QC、QA 负责人或其指定人员负责审核并审计所有实验室相关文件及规程以确 保其准确和有效。 5.8 质量部负责批准本规程及验证、确认方案和验证、确认报告。 6 定义DEFINITION 6.1 检测方法使用者 6.2 使用检测方法的部门、实验室或人员。 6.3 系统适用性 6.4 它是用来验证系统能满足预期分析的测试。当适用时,系统适用性应在方法用于 检测或分析样品之前执行。指定的数据,比如响应值和保留时间的相对标准偏差 (RSD)、拖尾因子、分离度和理论塔板等,将从重复进样得到。 6.5 检测方法 6.6 指进行检测的方式,应详细描述进行每个检测实验所必需的步骤。它可以包括: 试剂、对照品及样品溶液的配制,仪器的参数、标准曲线的绘制、计算公式的运 用、可接受标准等。 6.7 检测方法验证 6.8 为了证明所使用的检测方法(新的或改进过的)与其预期目的相适应而进行的一 系列实验。 6.9 对照品和样品溶液稳定性 6.10 用来评价对照品和供试品的稳定性而进行的检测。 6.11 原料药 6.12 任何用于药品生产的物质或混合物,并在药品生产的过程中成为药物的活性成 分。这类物质提供药物活性或其他的直接效应应用于诊断、治疗、缓和、处理或 预防疾病、或影响身体的机结构或功能。 6.13 鉴别测试
溶血性链球菌药物治疗
溶血性链球菌药物治疗 1.青霉素:为首选药物,早期应用可缩短病程,减少并发症。 2.无条件注射者可选用先锋霉素Ⅵ、先锋毒素Ⅳ、羟氨苄青霉素、氨苄青霉素等口服。 3.对青霉素过敏者可选用红霉素、交沙霉素、螺旋霉素等口服。或红霉素、洁霉素静脉滴注。 (一)A组溶血性链球菌药物治疗: A组链球菌即化脓性链球菌是人类细菌感染中最重要的病原菌之一,只要引起急性咽峡炎、急性扁桃体炎、丹毒、猩红热、肺部感染、皮肤软组织感染以及全身性感染,也是变态反应性疾病风湿热和急性肾小球肾炎的间接病因。今年来,严重的A组链球菌感染又逐渐增多,大多数患者为健康成人和儿童,感染呈急进性,常发生败血症、深部软组织感染、休克和多脏器功能障碍综合征,病死率高达30%以上。 【病原治疗】 (1)首选青霉素。 (2)肺炎球菌脑膜炎或败血症者,青霉素的剂量可加大,也可联合用药即青霉素或氨苄西林与阿米卡星联用;或头孢曲松或头孢噻肟,分次静脉滴注。疗程均为2周以上。 (3)若为对青霉素中度耐药的菌株,可增加青霉素的剂量即可达到满意的疗效;若为高浓度耐药者,则对其他β-内酰胺类抗生素和许多其他抗生素也会出现耐药,应首选万古霉素、替考拉宁等。 (4)对青霉素过敏者,可选用第一、二代、三代头孢菌素静脉滴注或红霉素静脉滴注,疗程7-10天。一般不选用四环素及喹诺酮类抗生素。 【参考文献】 北京协和医院主编《感染性疾病诊疗常规》,人民卫生出版社,2004,P156; 化脓性链球菌药物治疗 首选药物:青霉素; 可选药物:大环内酯类如红霉素、交沙霉素、螺旋霉素等、林可霉素类、复方磺胺甲基异噁唑。
【参考文献】 刘锡光主编《现代诊断微生物学》人民卫生出版社,2002;(二)B组溶血性链球菌药物治疗 首选药物:青霉素;可选药物:大环内酯类、林可霉素类。【参考文献】 刘锡光主编《现代诊断微生物学》人民卫生出版社,2002;
什么是乙型溶血性链球菌
什么是乙型溶血性链球菌 你知道什么是乙型溶血性链球菌吗,其实这种链球菌,是属于致病性比较强的一种病菌,对我们健康,自然而然会带来很多的影响和威胁,因此大家必须了解他的各种常识以及致病类型,这样在生活当中才可以有效地预防,下面就为大家具体分析,到底什么是乙型溶血性链球菌。 乙型溶血性链球菌,是链球菌属中的一种,具有致病性强的特点。菌落周围形成一个2-4mm宽、界限分明、完全透明的无色溶血环,也称乙型溶血,因而这类菌亦称为溶血性链球菌,该菌的致病力强,常引起人类和动物的多种疾病。 乙型溶血性链球菌又称A群溶血性链球菌,是链球菌属中的一种,具有致病性强的特点。菌落周围形成一个2-4mm宽、界限分明、完全透明的无色溶血环,也称乙型溶血,因而这类菌亦称为溶血性链球菌,该菌的致病力强,常引起人类和动物的多种疾病。
疾病危害: 溶血性链球菌常可引起皮肤、皮下组织的化脓性炎症、呼吸道感染、流行性咽炎的爆发性流行以及新生儿败血症、细菌性心内膜炎、猩红热和风湿热、肾小球肾炎等变态反应。 病理分类: 溶血性链球菌的致病性与其产生的毒素及其侵袭性酶有关。 主要有以下几种: 1、链球菌溶血素:溶血素有O和S两种,O为含有-SH的蛋白质,具有抗原性,S为小分子多肽,分子量较小,故无抗原性。 2、致热外毒素:曾称红疹毒素或猩红热毒素,是人类猩红热的主要毒性物质,会引起局部或全身红疹、发热、疼痛、恶心、呕吐、周身不适。
3、透明质酸酶:又称扩散因子,能分解细胞间质的透明质酸,故能增加细菌的侵袭力,使病菌易在组织中扩散。 4、链激酶:又称链球菌纤维蛋白溶酶,能使血液中纤维蛋白酶原变成纤维蛋白酶,具有增强细菌在组织中的扩散作用,该酶耐热,100℃50分钟仍可保持活性。 只有我们在了解了这些常识介绍之后,才可以有效地避免更多的疾病影响和危害,尤其是在现在的生活当中,关注这些常识,才可以保证我们的健康,因为你越是忽视健康问题,就越容易让一些疾病有机可乘。
分析方法验证与确认管理规程完整
3 定义 3.1 检验方法验证:证明采用的方法适用于相应检测要求。 3.2 检验方法确认:证明使用法定方法在目前实验室条件下是否能获得可靠结果,是否适用于相应的检测工作。在本质上和验证一样,但不一定是验证项目的全部。 3.3 药典方法:经过国家药监部门批准的药典收载的质量标准和检验方法 3.4 法定方法:法定方法包括药典方法、国标方法等。 3.5 准确度:是指用该方法测定的结果与真实值或参考值接近的程度,一般用回收率表示。 3.6 精密度:是指在规定的测试条件下同一个均匀供试品经多次取样测定所得结果之间的接近程度。 3.7 重复性:在相同条件下,由同一个分析人员测定所得结果的精密度称为重复性。 3.8 中间精密度:在同一个试验室,不同时间由不同分析人员用不同设备测定结果之间的精密度称为中间精密度。 3.9 重现性:在不同实验室由不同分析人员测定结果之间的精密度称为重现性。 3.10 专属性:是指在其他成分(如杂质、降解产物、辅料等)可能存在下,采用的方法能正确测定出被测物质的特性。 3.11 检测限:是指供试品中被测物能被检出的最低量。 3.12 定量限:是指供试品中被测物能被定量测定的最低量。 3.13 线性:是指在设计围,测试结果与试样中被测物浓度直接成正比关系的程度。3.14 围:是指能达到一定精密度、准确度和线性,测试方法适用的高低浓度或量的区间。 3.15 耐用性:是指在测定条件有小的变动时,测定结果不受影响的承受程度。 4 职责 4.1 标准验证岗 4.1.1 提升现行质量标准工作时,对研究后确定的标准草案进行检验方法验证工作,以确保检验方法的适用性、科学性。 4.1.2 对技术部移交的新品质量标准草案进行确认,以确保检验方法适用性、科学性。 4.1.3 对技术部移交的新品应研究建立设备清洁验证残留物检验方法,并进行方法学验
检验分析方法的验证和确认
检验分析方法的验证和确认 一、法规要求二、分析方法验证三、分析方法确认四、分析方法验证和确认总结一、法规要求:新版GMP(2010年修订)第二百二十三条物料和不同生产阶段产品的检验应当至少符合以下要求:(一)企业应当确保药品按照注册批准的方法进行全项检验。(二)符合下列情形之一的,应当对检验方法进行验证。1. 采用新的检验方法;2. 检验方法需变更的;3. 采用《中华人民国药典》及其他法定标准未收载的检验方法;4. 法规规定的其他需要验证的检验方法。(三)对不需要进行验证的检验方法,企业应当对检验方法进行确认,以确保检验数据准确、可靠。法规要求:中国药典(2010年版)凡例1. 检验方法和限度。2. 二十三、本版药典正文收载的所有品种,均应按规定的方法进行检验。如采用其他方法,应将该方法与规定的方法做比较试验,根据试验结果掌握使用,但在仲裁时仍以本版药典规定的方法为准。法规要求:分析方法确认或验证相关指南二、分析方法验证 1. 分析方法验证的定义 2. 分析方法验证的目的 3. 分析方 法验证围4. 分析方法验证的时机5. 需验证的分析方法类型6. 分析方法验证的具体容7. 验证检测项目小结8. 分析方 法验证的方式和步骤9. 分析方法验证常见问题1. 分析方法
验证的定义是根据检测项目的要求,预先设置一定的验证容,并通过设计合理的试验来验证所采用的分析方法能否符合检测项目的要求。 2. 分析方法验证的目的(1)证明采用的分析方法是科学、合理。(2)证明分析方法能有效控制药品的在质量。? 验证过程和结果均应记载在标准起草或修订说明中。 3. 分析方法验证围(1)适用围:化学药品的理化分析方法和仪器分析方法的验证与确认;清洁验证方法的验证。(2)不适用:化学药品的微生物方法;生物制品分析方法验证。 4. 分析方法验证的时机(1)建立新的药品质量标准;(2)药品生产工艺变更;(3)制剂的组分变更;(4)对原分析方法进行修订时。方法验证理由、过程和结果均应记载在药品标准起草说明或修订说明中。 5. 需验证的分析方法类型(1)鉴别试验(2)杂质定量或限度检查(仪器或非仪器检测方法)(3)原料药或制剂中活性成分以及制剂中选定组分(如防腐剂等)的定量测定含量测定(4)化学药品/中药制剂中其他需控制成分(如残留物、添加剂等)的测定(5)制剂溶出度、释放度等检查(6)原料药粒度检测 6. 分析方法验证的具体容(1)专属性(2)线性(3)围(4)准确性(5)精密度(6)检测限(7)定量限(8)耐用性(9)系统适用性根据检测的类型,采用的技术检测方法,确定具体方法拟订验证的容。专属性1. 鉴别、杂质和含量测定的方法学验证中应
溶血性链球菌实验活动生物安全危害风险评估报告
溶血性链球菌实验活动生物安全危害风险评估报告 溶血性链球菌所有的实验活动均应在BSL-2实验室操作 一、评估对象及分类等级 1 溶血性链球菌(Streptococcus hemolyticus)细菌又称乙型溶血性链球菌(β- hemolyticus Streptococcus)和化脓性链球菌(Streptococcus pyogrnes),是链球菌按照是否产生溶血和溶血性质分类,在血平板上产生2~4mm宽的透明溶血环的一类链球菌,可引起人类及灵长类动物多种疾病。 2 根据《中华人民共和国传染病防治法》,由溶血性链球菌引起的传染病列为乙类传染病。 3 在卫生部公布的《人间传染的病原微生物名录》中溶血性链球菌被列为第三类病原微生物。 二、背景资料 1 一般生物学特性 1.1 形态染色 链球菌呈球形或椭圆形,直径0.6-1.0μm,呈链状排列,长短不一,从4-8个至20-30个菌细胞组成不等,链的长短与细菌的种类及生长环境有关。在液体培养基中易呈长链,固体培养基中常呈短链,由于链球菌能产生脱链酶,所以正常情况下链球菌的链不能无限制的延长。多数菌株在血清肉汤中培养2-4h易形成透明质酸的荚膜,继续培养后消失。该菌不形成芽胞,无鞭毛,易被普通的碱性染料着色,革兰氏阳性,老龄培养或被中性粒细胞吞噬后,转为革兰氏阴性。 1.2 培养特性 需氧或兼性厌氧菌,营养要求较高,普通培养基上生长不良,需补充血清、血液、腹水,大多数菌株需核黄素、维生素B6、烟酸等生长因子。最适生长温度为37℃,在20-42℃能生长,最适pH为7.4-7.6。在血清肉汤中易成长链,管底呈絮状或颗粒状沉淀生长。在血平板上形成灰白色、半透明、表
风湿是由溶血性链球菌感染引起的感染性疾病
风湿是由溶血性链球菌感染引起的感染性疾病,而类风湿是属于自身免疫性疾病主要由变性的IGM沉积引起,两者的发病机制不一样治疗上也不一样前者主要是抗微生物治疗后都是免疫疗法 风湿病即风湿热是一种与A组乙型溶血性链球菌感染有关的变态反应性疾病,属于结缔组织病,也称胶原病。病变主要累及全身结缔组织,最常侵犯心脏、关节和血管等处,以心脏病变最为严重。风湿病的急性期有发热、心脏和关节损害、环形红斑、皮下节结等症状和体征。可以血液检查:抗链球菌溶血素抗体O滴度增高,血沉加快,白细胞增高,心电图示P-R捡起延长等表现可诊断。一般发病年龄是5-15岁,6-9岁为高峰期,出现心瓣膜变形常在20-40岁之间。 风湿性疾病是一组以内科治疗为主的肌肉骨骼系统疾病,包括弥漫性结缔组织病及各种病因引起的关节和关节周围软组织,包括肌肉、肌腱、韧带等的疾病。常用的治疗方法: 1.风湿病常常侵犯关节、肌肉、骨骼以及软组织,疼痛、肿胀、关节功能障碍、发热这些症状比较突出,解热镇痛消炎,缓解症状是治疗这组疾病的首要目的,因此往往选用非甾体抗炎药,如扶他林、莫比可、乐松、天新利德、西乐葆、万洛等,而且新型的非甾体类抗炎药作用好、疗效高,使得副作用明显减少。 2.如果风湿性疾病得不到正确合理的治疗,关节,肌肉,骨骼等病变会导致功能障碍和畸形,留下终身残疾,影响生活和劳动,给个人和社会带来经济损失。从风湿性疾病侵犯的组织看,以往称之结缔组织病的系统性红斑狼疮,类风湿性关节炎,硬皮病,多发性肌炎,坏死性血管炎、强直性脊柱炎都有自身免疫的紊乱,属于自身免疫紊乱的一组疾病。痛风性关节炎已明确是嘌呤代谢紊乱而导致尿酸盐结晶在关节内沉积,往往有关节腔,骨骼,韧带受累。因此风湿病的治疗除了对症治疗缓解症状外,还需进行病因治疗,自身免疫紊乱性的疾病需要免疫调节,例如使用皮质激素以及免疫抑制剂,免疫抑制疗法有了很大的进步,新药物不断发现,用于临床,如骁息、爱诺华、帕夫林,新疗法不断发现,如①对轻型的系统性红斑狼疮采用小剂量强的松、氯喹、MTX的联合治疗,可以明显减轻副作用; ②类风湿性关节炎采用联合治疗,一线药与二线药的联合治疗,二线药之间的联合治疗。③大剂量丙种球蛋白治疗重症风湿病。 3.生物治疗及骨髓移植治疗也已试用于临床。 4.对于关节病变还可以采用关节镜治疗,大大提高疗效,改观了疾病的预后,致残率明显下降,患者的生活质量得到了改善。
(完整版)检验方法验证标准操作规程.
标准操作规程STANDARD OPERATING PROCEDURE 目的:建立检验方法验证标准操作规程,规范验证操作。 适用范围:所有检验方法的验证。 责任者:质量保证部、质量控制部 程序: 1、检验方法验证的基本内容 检验方法验证的基本内容包括方案的起草及审批,检测仪器的确认.适用性验证(包括准确度试验、精密度测定.线性范围试验、专属性试验等)和结果评价及批准四个欠的方面。它的基本内容可以用下图表示。 2、检验方法验证的基本步骤 首先是制定验证方案,然后对大型精密仪器进行确认,最关键的一步是检验方法的适用性试验,最后是检验方法评价及批准。 2.1验证方案的制定 检验方法的验证方案通常由质量验证小组提出。根据产品的工艺条件、原辅料化学结构、中间体、分解产物查阅有关资料,提出规格标准,确定检查项目,规定杂质限度,即为质量标准草案。根据质量标准草案确定检查和试验范围,对检验方法拟定具体操作步骤,最后经有关标题检验方法验证标准操作规程共7页第1页 制定人颁发部门GMP办公室编号: SOP--F—004 分发部门质量验证小组、质量保证部新订√替代 审核人批准人生效日期年月日
人员审批方可实施。 2.2大型精密仪器的确认 分析测试中所用的检测仪器一般可分为三类 (1)普通仪器:崩解仪,折光仪、分析天平、酸度计、溶点测定仪、电导仪等: (2)较精密仪器:旋光仪、永停滴定仪、费休氏水分测定仪、自动滴定仪、药物溶出度仪、可 共7页第2页见分光光度计、电泳仪等; (3)大型精密仪器:紫外分光光度计、红外分光光度计、气相色谱仪、高效液相色谱仪、薄层扫描仪等。 为了保证分析测试数据准确可靠,每台检测仪器在投入正式使用之前都应进行确认。检测仪器的确认是检验方法验证的基础,应在其它验证试验开始之前首先完成。检测仪器确认工作内容应根据仪器类型。技术性能而定,通常包括:安装确认、校正、适用性预试验和再确认。2.2.1安装确认 同工艺验证中机械设备一样,仪器安装确认的土要内容包括如下各点: (1)要登记仪器名称.型号。生产厂商的编号、生产日期.生产厂商名称,企业内部的固定资产设备登记号及安装地点; (2)收集汇编和翻译仪器使用说明书和维修保养手册; (3)检查并记录所验收的仪器是否符合厂方规定的规格标准: (4)检查并确保有该仪器的使用说明书。维修保养手册和备件清单: (5)检查安装是否恰当,气、电及管路连接是否符合要求; (6)制定仪器标准操作规程(SOP)和维修保养制度,建立使用记录和维修记录; (7)制定清洗规程;. (8)明确仪器设备技术资抖(图纸,手册,备件清单、各种指南及该机器设备有关的其它文件)的专管人员及存放地点。 除上面提到的内容外,在安装确认方案中对仪器的性能用途应有一概述并记录维修服务单位名称。联系人、电话号码、传真号、银行帐号等,以利于日后的维修保养活动,这对大型精密仪器尤为重要。对于仪器来说,安装确认中的一项重要内容是功能试验。这项工作在安装结
