结构化学课后答案第一章

01.量子力学基础知识
【1.1】将锂在火焰上燃烧,放出红光,波长λ=670.8nm ,这是Li 原子由电子组态 (1s)2(2p)1→(1s)2(2s)1跃迁时产生的,试计算该红光的频率、波数以及以k J ·mol -1
为单位的能量。
解:81
141
2.99810m s 4.46910s 670.8m c
νλ--??===? 41
7
11 1.49110cm 670.810cm νλ--===??
34141
23-1 -16.62610J s 4.46910 6.602310mol 178.4kJ mol A E h N s
ν--==??????=?
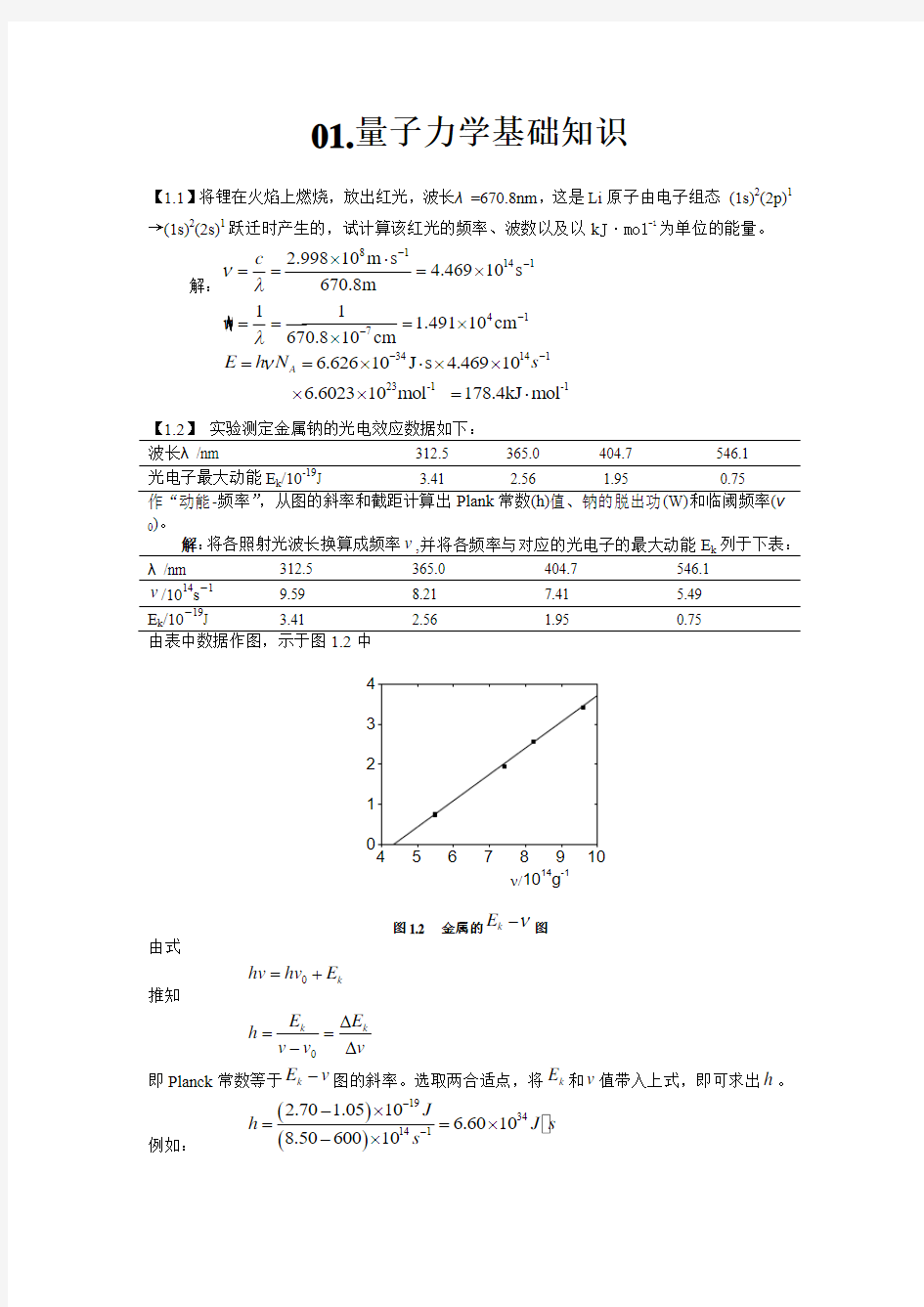
【1.2】 实验测定金属钠的光电效应数据如下:
波长λ/nm
312.5 365.0
404.7
546.1
光电子最大动能E k /10-19J
3.41 2.56 1.95 0.75 作“动能-频率”,从图的斜率和截距计算出Plank 常数(h)值、钠的脱出功(W)和临阈频率(ν0)。
解:将各照射光波长换算成频率v ,并将各频率与对应的光电子的最大动能E k 列于下表:
λ/nm
312.5 365.0 404.7 546.1 v /1014s -1
9.59 8.21 7.41 5.49 E k /10-
19J
3.41 2.56
1.95
0.75
由表中数据作图,示于图1.2中
E k /10-19
J
ν/1014g
-1
图1.2 金属的
k E ν
-图
由式 0k hv hv E =+ 推知
0k k
E E h v v v ?=
=-?
即Planck 常数等于k E v -图的斜率。选取两合适点,将k E 和v 值带入上式,即可求出h 。
例如:
()()1934
141
2.70 1.0510 6.60108.5060010J h J s
s ---?==?-?
图中直线与横坐标的交点所代表的v 即金属的临界频率0v ,由图可知,141
0 4.3610v s -=?。
因此,金属钠的脱出功为:
34141
0196.6010 4.36102.8810W hv J s s J
---==???=?
【1.3】金属钾的临阈频率为5.464×10-14s -1
,如用它作为光电极的阴极当用波长为300nm 的紫外光照射该电池时,发射光电子的最大速度是多少?
解:2
01
2hv hv mv =+
()1
2
018
1
2
341419
312 2.998102 6.62610 5.46410300109.10910h v v m m s J s s m kg
υ------??
=??
??
???????-??? ??????
=??????
?
1
34
141
2
31512 6.62610 4.529109.109108.1210J s s kg m s ----??????=?????=?
【1.4】计算下列粒子的德布罗意波的波长:
(a ) 质量为10-10kg ,运动速度为0.01
m ·s -1
的尘埃;
(b
) 动能为0.1eV 的中子; (c ) 动能为300eV 的自由电子。
解:根据关系式:
(1)3422
101
6.62610J s 6.62610m 10kg 0.01m s h mv λ----??===???
34-11 (2) 9.40310m h p λ-==
=
=?
3411(3) 7.0810m
h p λ--==
=
=?
【1.5】用透射电子显微镜摄取某化合物的选区电子衍射图,加速电压为200kV ,计算电子加速后运动时的波长。
解:根据de Broglie 关系式:
34122.74210h h p m m
λυ--=
===
=
?
【1.6】对一个运动速度c υ
(光速)的自由粒子,有人进行了如下推导:
1v v
v v 2h h E m p m νλ=====①②③④⑤
结果得出
1
2m m υυ=
的结论。上述推导错在何处?请说明理由。
解:微观粒子具有波性和粒性,两者的对立统一和相互制约可由下列关系式表达:
/E hv p h λ==
式中,等号左边的物理量体现了粒性,等号右边的物理量体现了波性,而联系波性和粒性的纽带是Planck 常数。根据上述两式及早为人们所熟知的力学公式:
p m υ=
知 ①,②,④和⑤四步都是正确的。 微粒波的波长λ服从下式:
/u v λ=
式中,u 是微粒的传播速度,它不等于微粒的运动速度υ ,但③中用了/u v λ=,显然是错的。
在④中,E hv =无疑是正确的,这里的E 是微粒的总能量。若计及E 中的势能,则⑤也不正确。
【1.7】子弹(质量0.01kg ,速度1000m ·s -1
),尘埃(质量10-9kg ,速度10m ·s -1
)、作布郎
运动的花粉(质量10-13kg ,速度1m ·s -1)、原子中电子(速度1000 m ·s -1)等,其速度的不确定度均为原速度的10%,判断在确定这些质点位置时,不确定度关系是否有实际意义?
解:按测不准关系,诸粒子的坐标的不确定度分别为:
子弹:3434
1
6.2610 6.63100.01100010%h J s x m m v kg m s ---???===?????? 尘埃:342591
6.62610 6.6310101010%h J s x m m v kg m s ----???===??????
花粉:3420131
6.62610 6.631010110%h J s
x m m v kg m s ----???===??????
电子:346
311
6.62610
7.27109.10910100010%h J s x m m v kg m s ----???===???????
【1.8】电视机显象管中运动的电子,假定加速电压为1000V ,电子运动速度的不确定度υ?为υ的10%,判断电子的波性对荧光屏上成像有无影响?
解:在给定加速电压下,由不确定度关系所决定的电子坐标的不确定度为
:
34
102/10%3.8810h x m m eV m m
υ
--==
?=
=?
这坐标不确定度对于电视机(即使目前世界上最小尺寸最小的袖珍电视机)荧光屏的大小来说,完全可以忽略。人的眼睛分辨不出电子运动中的波性。因此,电子的波性对电视机荧光屏上成像无影响。
【1.9】用不确定度关系说明光学光栅(周期约6
10m -)观察不到电子衍射(用100000V 电
压加速电子)。
解:解法一:根据不确定度关系,电子位置的不确定度为:
9911 1.22610/1.2261010000
1.22610x h h x m p h V
m
m λ---=
==?=?=? 这不确定度约为光学光栅周期的10-5
倍,即在此加速电压条件下电子波的波长约为光
学光栅周期的10
-5
倍,用光学光栅观察不到电子衍射。
解法二:若电子位置的不确定度为10-
6m ,则由不确定关系决定的动量不确定度为:
3462816.62610106.62610x h J s
p x m J s m ----??==
?=?
在104V 的加速电压下,电子的动量为:
231
5.40210x x p m J s m υ--====?
由Δp x 和p x 估算出现第一衍射极小值的偏离角为:
2812315arcsin arcsin
6.62610arcsin 5.40210arcsin100x x
o
p p J s m J s m θθ-
----?==??? ?
???≈
这说明电子通过光栅狭缝后沿直线前进,落到同一个点上。因此,用光学光栅观察不到电子
衍射。
【1.10】请指出下列算符中的线性算符和线性自轭算符:
2
2,,d d d x i
dx dx
dx
解:由线性算符的定义:
i j i j ???A()A A ψψψψ+=+
22d d ,,d x d x x 为线性算符;而d i
dx 为线性自轭算符.
【1.11】2
ax xe ?-=是算符22224d a x dx ??- ??
?的本征函数,求其本征值。 解:应用量子力学基本假设Ⅱ(算符)和Ⅲ(本征函数,本征值和本征方程)得:
2
2222222244ax d d a x a x xe dx dx ψ-????-=- ? ????? ()
222
2224ax ax
d
xe a x xe dx --=-
()
2
222222
2232323242444ax ax ax ax ax ax ax d e ax e a x e dx
axe axe a x e a x e -------=--=--+-
2
66ax
axe a ψ
-=-=-
因此,本征值为6a -。
【1.12】下列函数中,哪几个是算符22
d dx 的本征函数?若是,求出本征值。
3,sin ,2cos ,,sin cos x e x x x x x + 解:2x
2d e d x =,x e 是22
d d x 的本征函数,本征值为1。
22
d sin x 1sin x,d x
=?sin x 是2
2d d x 的本征函数,本征值为1。 2
2d (2cos x )2cos x d x =
【1.13】im e φ
和cos m φ对算符d
i
d φ是否为本征函数?若是,求出本征值。
解:im im d i e ie d φφ
φ=,im im me φ
=-
所以,im e φ
是算符d
i
d φ的本征函数,本征值为m -。
而()cos sin sin cos d i m i m m im m c m d φφφφφ=-=-≠
所以cos m φ不是算符d
i
d φ的本征函数。
【1.14】证明在一维势箱中运动的粒子的各个波函数互相正交。
证:在长度为l 的一维势箱中运动的粒子的波函数为:
(
)n x ψ=
01x << n =1,2,3,……
令n 和n’表示不同的量子数,积分:
()(
)()()()()()()()()()()()()'
'0
'0''''0''''
'''
'
2sin 2sin sin sin sin 222sin
sin sin sin l l
n
n l
l
l
n x
n x
x x d dx l l l
n x n x
dx l l l
n n n n x x l l l n n n n l l n n n n x x l l n n n n n n n n n n n n ππψψτπππππππππππ
π
ππ
==??-+????=-??-+????
????-+????=-??-+????-+=
-
-+??
n 和'
n 皆为正整数,因而()'
n n -和()'
n n +皆为正整数,所以积分:
()()'
l
n
n x x d ψψτ=?
根据定义,()n x ψ和()'n x
ψ互相正交。
【1.15】已知在一维势箱中粒子的归一化波函数为
(
)n n x x l π?=
1,2,3n =??? 式中l 是势箱的长度,x 是粒子的坐标)x l <,求粒子的能量,以及坐标、动量的平均
值。
解:(1)将能量算符直接作用于波函数,所得常数即为粒子的能量:
222
n 222h d n πx h d n πx ?H ψ(x )-)-)8πm d x l 8πm d x l ==
(sin )n n n x
l l l πππ=?-
2
2222222
()88n h n n x n h x m l l ml ππψπ=-?= 即:
2228n h E ml =
(2)由于??x
()(),x n n x c x ψψ≠无本征值,只能求粒子坐标的平均值: ()()x l x n sin l x l x n sin l x x ?x x l *
l
n l
*n
d 22d x 000???????
?????? ??==ππψψ
()
x l x n cos x l dx l x n sin x l l l d 22122002??????? ??-=??
? ??=ππ
2000122sin sin d 222l l l x l n x l n x x x l n l n l ππππ????=-+?? ?????? 2l =
(3)由于()
()??p ,p x n n x x c x ψψ≠无本征值。按下式计算p x
的平均值
: ()()1
*
?d x n x n p x p
x x ψψ=?
0d 2n x ih d n x x l dx l πππ?=- ??
20sin cos d 0
l nih n x n x x l l l ππ=-=?
【1.16】求一维势箱中粒子在1?和2?状态时,在箱中0.49~0.51l l 范围内出现的概率,并与图1.3.2(b )相比较,讨论所得结果是否合理。
解:(a )
(
)1x x l πψ= ()2212sin x
x l l πψ=
(
)22x x l πψ=
()2
2222sin x x l l πψ= 由上述表达式计算()21x ψ和
()22x ψ,并列表如下:
/x l 0 1/8 1/4 1/3 3/8 1/2 ()21
1/x l ψ- 0
0.293 1.000 1.500 1.726 2.000 ()212/x l ψ- 0
1.000
2.000
1.500
1.000
/x l
5/8 2/3 3/4 7/8
1 ()211/x l ψ-
1.726 1.500 1.000 0.293 0 ()212/x l ψ-
1.000
1.500
2.000
1.000
根据表中所列数据作()2
n x x ψ-图示于图1.16中。
图1.16
(b )粒子在1ψ状态时,出现在0.49l 和0.51l 间的概率为:
()0.512110.49l
l
P x dx
ψ=
?
2
0.510.49l
l x dx l π?
=????
0.51
20.49
0.51
0.49
2s i n 22sin 24l l l l x dx
l l x l x l l πππ=??=-?????
()
0.510.4912sin
21
0.02sin1.02sin 0.9820.0399l
l
x x l l πππππ
??=-????=--=
粒子在ψ2状态时,出现在0.49l 和0.51l 见的概率为:
x / l
ψ2
1 (x )/l
-1
ψ2
2x /l
-1
x / l
(
)0.512220.492
0.510.490.5120.490.510.490.510.49222sin 24sin 2814sin
40.511
40.510.49140.49sin sin 440.0l
l
l
l l
l
l
l
l
l
P x dx
x dx l x
dx l l x l x l l x x l l l l l l l l l l ψππππππππππ=
?
=???=
??=-??????=-??????????=--- ? ?
????
≈?
??001
(c )计算结果与图形符合。
【1.17】链型共轭分子22CH CHCHCHCHCHCHCH 在长波方向160nm 处出现第一个强吸收峰,试按一维势箱模型估算其长度。
解:该分子共有4对π电子,形成8
n π离域π键。当分子处于基态时,8个π电子占据能级最低的前4个分子轨道。当分子受到激发时,π电子由能级最高的被占轨道(n=4)跃迁到能级最低的空轨道(n=5),激发所需要的最低能量为ΔE =E 5-E 4,而与此能量对应的吸收峰即长波方向460nm 处的第一个强吸收峰。按一维势箱粒子模型,可得:
()
2
2218hc
h E n ml λ?==+ 因此:
()()1
2
1
34
9
2
3181
218241 6.626104601089.10910 2.988101120n h l mc J s m kg m s pm λ----+??
=??
??
???+????=????????
=
计算结果与按分子构型参数估算所得结果吻合。
【1.18】一个粒子处在a b c ==的三维势箱中,试求能级最低的前5个能量值[以h 2/(8ma 2)为单位],计算每个能级的简并度。
解:质量为m 的粒子在边长为a 的立方箱中运动,其能级公式为:
()2222,,28x y z
n n n x y z h E n n n ma =++
E 222
E 113=E 131=E 311E 122=E 212=E 221
1113E =
1121212116E E E ===
E 122=E 212=E 221=9 E 113=E 131=E 311=11 E 222=12
【1.19】若在下一离子中运动的π电子可用一维势箱近似表示其运动特征:
估计这一势箱的长度 1.3l nm =,根据能级公式222
/8n E n h ml =估算π电子跃迁时所吸收
的光的波长,并与实验值510.0nm 比较。
H 3C
N C C C
C C
C C
N
CH 3
CH 3
H H
H
H
H H
H CH 3
解:该离子共有10个π电子,当离子处于基态时,这些电子填充在能级最低的前5个
π型分子轨道上。离子受到光的照射,π电子将从低能级跃迁到高能级,跃迁所需要的最
低能量即第5和第6两个分子轨道的的能级差。此能级差对应于棘手光谱的最大波长。应用一维势箱粒子的能级表达式即可求出该波长:
22222
652226511888hc
h h h E E E ml ml ml λ?==-=-=
()
22
31
8
1
9
3481189.109510 2.997910 1.31011 6.626210506.6mcl h
kg m s m J s
nm
λ----=
??????=
??=
实验值为510.0nm ,计算值与实验值的相对误差为-0.67%。
【1.20】已知封闭的圆环中粒子的能级为:
22
22
8n n h E mR π= 0,1,2,3,n =±±±
??? 式中n 为量子数,R 是圆环的半径,若将此能级公式近似地用于苯分子中6
6π离域π键,取R=140pm ,试求其电子从基态跃迁到第一激发态所吸收的光的波长。
解:由量子数n
可知,n=0为非简并态,|n|≥1都为二重简并态,6个π电子填入n=0,1,1-等3个轨道,如图1.20所示:
图1.20苯分子
66π能级和电子排布
()221
22
418h hc
E E E mR πλ-?=-==
()()()
()
222
23110813498389.1110 1.4010 2.998103 6.6261021210212mR c
h kg m m s J s m nm
πλπ-----=
??????=
??=?=
实验表明,苯的紫外光谱中出现β,Γ和α共3个吸收带,它们的吸收位置分别为184.0nm ,208.0nm 和263.0nm ,前两者为强吸收,后面一个是弱吸收。由于最低反键轨道能级分裂为三种激发态,这3个吸收带皆源于π电子在最高成键轨道和最低反键之间的跃迁。计算结果和实验测定值符合较好。
【1.21】函数(
)/)/)x x a x a ?ππ=-是否是一维势箱中粒子的一种可能状态?若是,其能量有无确定值?若有,其值为多少?若无,求其平均值。
解
数是长度为a 的
中粒子的一种可能状态。因为函数
()1s i n (/)x x a ψπ=和()2/)x x a ψπ=都是一维势箱中粒子的可能状态
(本征态),根据量子力学基本假设Ⅳ(态叠加原理),它们的线性组合也是该体系的一种可能状态。 因为
()()()1223H x H x x ψψψ∧
∧
=-????
()()1223H x H x ψψ∧
∧
=-
()()
22
122242388h h x x ma ma ψψ=?-? ≠ 常数()x ψ?
所以,()x ψ不是H ∧
的本征函数,即其能量无确定值,可按下述步骤计算其平均值。
将()x ψ归一化:设()'x ψ=
()c x ψ,即:
(
)()()2
2
'22
a
a
a
x dx c x dx c x dx ψψψ==???
2
202a
x x c dx a a ππ??
=- ? ???? 2131c ==
2113c =
()x ψ所代表的状态的能量平均值为:
()()'
'
0a
E x H x dx
ψψ∧
=?
222202238a
m x x h d a a dx πππ????=-- ? ?
??
????
22s i n s i n x x dx a a ππ??- ? ??? 2222222233200015292sin sin sin sin 2a a a c h x c h x x c h x dx dx dx ma a ma a a ma a ππππ=-+???
2222
25513c h h ma ma ==
也可先将()1x ψ和()2x ψ归一化,求出相应的能量,再利用式
2
i i E c E =∑求出()x ψ所代表的状态的能量平均值:
222222
222224049888h h c h E c c ma ma ma =?+?=22401813h ma =?22513h ma =
结构化学课后答案第四章
04分子的对称性 【4.1】HCN 和2CS 都是直线型分子,写出该分子的对称元素。 解:HCN :(),C υσ∞∞; CS 2:()()2,,,,h C C i υσσ∞∞∞ 【4.2】写出3H CCl 分子中的对称元素。 解:()3,3C υσ 【4.3】写出三重映轴3S 和三重反轴3I 的全部对称操作。 解:依据三重映轴S 3所进行的全部对称操作为: 1133h S C σ=,2233S C =, 33h S σ= 4133S C =,52 33h S C σ=,63S E = 依据三重反轴3I 进行的全部对称操作为: 1133I iC =,2233I C =,3 3I i = 4133I C =,5233I iC =,63I E = 【4.4】写出四重映轴4S 和四重反轴4I 的全部对称操作。 解:依据S 4进行的全部对称操作为: 1121334 4442444,,,h h S C S C S C S E σσ==== 依据4I 进行的全部对称操作为: 11213344442444,,,I iC I C I iC I E ==== 【4.5】写出xz σ和通过原点并与χ轴重合的2C 轴的对称操作12C 的表示矩阵。 解: 100010001xz σ????=-??????, ()1 2100010001x C ?? ??=-?? ??-?? 【4.6】用对称操作的表示矩阵证明: (a ) ()2xy C z i σ= (b ) ()()()222C x C y C z = (c ) ()2yz xz C z σσ= 解: (a ) ()()11 2 2xy z z x x x C y C y y z z z σ-?????? ??????==-?????? ??????--??????, x x i y y z z -????????=-????????-????
结构化学答案 chapter1
第一章 量子理论 1. 说明??????-=) (2cos ),(0t x a t x a νλπ及??? ???-=) (2sin ),(0t x a t x a νλπ都是波动方程 2 22 22) ,(1),(t t x a c x t x a ??=??的解。 提示:将),(t x a 代入方程式两端,经过运算后,视其是否相同。 解:利用三角函数的微分公式 )cos()sin(ax a ax x =??和)sin()cos(ax a ax x -=?? ,将 ?? ????-=) (2c o s ),(0t x a t x a νλπ代入方程: ? ?? ???-??? ??-=??? ? ????????--??=??? ?????????-????=??????-??=) (2cos 2 ) (2sin 2 ) (2cos ) (2cos 2 00 0022t x a t x x a t x x x a t x a x νλπλπνλπλπνλπνλπ左边 ()??????--=???? ????????-??= ?? ? ?????????-????=??????-??=) (2cos 2 ) (2sin 2 ) (2cos ) (2cos 122020200222t x c a t x x c a t x t t c a t x a t c νλππννλππννλπνλπ右边 对于电磁波νλ=c ,所以?? ? ???-=) (2cos ),(0t x a t x a νλπ是波动方程的一个解。 对于?? ? ???-=) (2sin ),(0t x a t x a νλπ,可以通过类似的计算而加以证明: ?? ? ???-??? ??-=??????-??=) (2sin 2) (2sin 2 0022t x a t x a x νλπλπνλπ左边 ()?? ? ???--=??????-??=) (2sin 2) (2sin 12200222t x c a t x a t c νλππννλπ右边 2. 试根据Planck 黑体辐射公式,推证Stefan 定律:4 T I σ=,给出σ的表示式,并计算它的数值。 提示:?∞ =0)(ννd E E , I =cE /4 解:将ννπνννd e c h d E kT h ? ?? ???-= 118)(3 3 代入上式,?∞? ?? ???-=033118ννπνd e c h E kT h 作变量代换kT h x /ν=后,上式变为,
结构化学课后答案第二章
02 原子的结构和性质 【】氢原子光谱可见波段相邻4条谱线的波长分别为、、和,试通过数学处理将谱线的波数归纳成为下式表示,并求出常数R 及整数n 1、n 2的数值。 2 21211 ( )R n n ν=- 解:将各波长换算成波数: 1656.47nm λ= 1115233v cm - -= 2486.27nm λ= 1220565v cm - -= 3434.17nm λ= 1323032v cm - -= 4410.29nm λ= 1424373v cm - -= 由于这些谱线相邻,可令1n m =,21,2,n m m =++……。列出下列4式: ()2 2152331R R m m = - + ()22205652R R m m =- + ()2 2230323R R m m = - + ()2 2243734R R m m =- + (1)÷(2)得: ()()()2 3212152330.7407252056541m m m ++==+ 用尝试法得m=2(任意两式计算,结果皆同)。将m=2带入上列4式中任意一式,得: 1109678R cm -= 因而,氢原子可见光谱(Balmer 线系)各谱线的波数可归纳为下式: 221211v R n n - ??=- ? ?? 式中, 1 12109678,2,3,4,5,6R cm n n -===。 【】按Bohr 模型计算氢原子处于基态时电子绕核运动的半径(分别用原子的折合质量和电子的质量计算并精确到5位有效数字)和线速度。 解:根据Bohr 提出的氢原子结构模型,当电子稳定地绕核做圆周运动时,其向心力与核和电子间的库仑引力大小相等,即:
结构化学第一章习题
第一章习题 一、选择题 1. 任一自由的实物粒子,其波长为λ,今欲求其能量,须用下列哪个公式---------------( ) (A) λc h E = (B) 22 2λm h E = (C) 2) 25.12 (λe E = (D) A ,B ,C 都可以 2. 下列哪些算符是线性算符---------------------------------------------------------------- ( ) (A) dx d (B) ?2 (C) 用常数乘 (D) (E) 积分 3. 一个在一维势箱中运动的粒子, (1) 其能量随着量子数n 的增大:------------------------ ( ) (A) 越来越小 (B) 越来越大 (C) 不变 (2) 其能级差 E n +1-E n 随着势箱长度的增大:-------------------( ) (A) 越来越小 (B) 越来越大 (C) 不变 4. 关于光电效应,下列叙述正确的是:(可多选) ---------------------------------( ) (A)光电流大小与入射光子能量成正比 (B)光电流大小与入射光子频率成正比 (C)光电流大小与入射光强度成正比 (D)入射光子能量越大,则光电子的动能越大 5. 下列哪几点是属于量子力学的基本假设(多重选择):-------------------------( ) (A)电子自旋(保里原理) (B)微观粒子运动的可测量的物理量可用线性厄米算符表征 (C)描写微观粒子运动的波函数必须是正交归一化的 (D)微观体系的力学量总是测不准的,所以满足测不准原理 6. 描述微观粒子体系运动的薛定谔方程是:--------------------------------------( ) (A) 由经典的驻波方程推得 (B) 由光的电磁波方程推得 (C) 由经典的弦振动方程导出 (D) 量子力学的一个基本假设 二、填空题 1. 光波粒二象性的关系式为_______________________________________。 2. 在电子衍射实验中,│ψ│2对一个电子来说,代表___________________。 3. 质量为 m 的一个粒子在长为l 的一维势箱中运动, (1) 体系哈密顿算符的本征函数集为_______________________________ ; (2) 体系的本征值谱为____________________,最低能量为____________ ; (3) 体系处于基态时, 粒子出现在0 ─ l /2间的概率为_______________ ; (4) 势箱越长, 其电子从基态向激发态跃迁时吸收光谱波长__________; 三、问答题 1. 写出一个合格的波函数所应具有的条件。 2. 指出下列论述是哪个科学家的功绩: (1)证明了光具有波粒二象性; (2)提出了实物微粒具有波粒二象性; (3)提出了微观粒子受测不准关系的限制; (4)提出了实物微粒的运动规律-Schr?dinger 方程; (5)提出实物微粒波是物质波、概率波。 四、计算题 1. 一子弹运动速率为300 m·s -1,假设其位置的不确定度为 4.4×10-31 m ,速率不确定度为 0.01%×300 m·s -1 ,根据测不准关系式,求该子弹的质量。 2. 计算德布罗意波长为70.8 pm 的电子所具有的动量。
(完整版)结构化学课后答案第二章
02 原子的结构和性质 【2.1】氢原子光谱可见波段相邻4条谱线的波长分别为656.47、486.27、434.17和410.29nm ,试通过数学处理将谱线的波数归纳成为下式表示,并求出常数R 及整数n 1、n 2的数值。 2212 11 ( )R n n ν=-% 解:将各波长换算成波数: 1656.47nm λ= 1115233v cm - -= 2486.27nm λ= 1220565v cm - -= 3434.17nm λ= 1323032v cm - -= 4410.29nm λ= 1424373v cm - -= 由于这些谱线相邻,可令1n m =,21,2,n m m =++……。列出下列4式: ()2 2152331R R m m = - + ()22205652R R m m =- + ()2 2230323R R m m = - + ()2 2243734R R m m =- + (1)÷(2)得: ()()()2 3212152330.7407252056541m m m ++==+ 用尝试法得m=2(任意两式计算,结果皆同)。将m=2带入上列4式中任意一式,得: 1109678R cm -= 因而,氢原子可见光谱(Balmer 线系)各谱线的波数可归纳为下式: 221211v R n n - ??=- ? ?? 式中, 1 12109678,2,3,4,5,6R cm n n -===。 【2.2】按Bohr 模型计算氢原子处于基态时电子绕核运动的半径(分别用原子的折合质量和电子的质量计算并精确到5位有效数字)和线速度。 解:根据Bohr 提出的氢原子结构模型,当电子稳定地绕核做圆周运动时,其向心力与核和电子间的库仑引力大小相等,即:
结构化学第一章习题教学文案
结构化学第一章习题
《结构化学》第一章习题 1001 首先提出能量量子化假定的科学家是:---------------------------( ) (A) Einstein (B) Bohr (C) Schrodinger (D) Planck 1002 光波粒二象性的关系式为_______________________________________。 1003 德布罗意关系式为____________________;宏观物体的λ值比微观物体的λ值_______________。 1004 在电子衍射实验中,│ψ│2 对一个电子来说,代表___________________。 1005 求德布罗意波长为0.1 nm 的电子的动量和动能。 1006 波长λ=400 nm 的光照射到金属铯上,计算金属铯所放出的光电子的速率。已知铯的临阈波长为600 nm 。 1007 光电池阴极钾表面的功函数是2.26 eV 。当波长为350 nm 的光照到电池时,发射的电子最大速率是多 少? (1 eV=1.602×10-19J , 电子质量m e =9.109×10-31 kg) 1008 计算电子在10 kV 电压加速下运动的波长。 1009 任一自由的实物粒子,其波长为λ,今欲求其能量,须用下列哪个公式---------------( ) (A) λc h E = (B) 2 2 2λm h E = (C) 2) 25.12 (λ e E = (D) A ,B ,C 都可以 1010 对一个运动速率v< 《结构化学》第一章习题 1001 首先提出能量量子化假定得科学家就是:---------------------------( ) (A) Einstein (B) Bohr (C) Schrodinger (D) Planck 1002 光波粒二象性得关系式为_______________________________________。 1003 德布罗意关系式为____________________;宏观物体得λ值比微观物体得λ值_______________。 1004 在电子衍射实验中,││2对一个电子来说,代表___________________。 1005 求德布罗意波长为0、1 nm得电子得动量与动能。 1006 波长λ=400 nm得光照射到金属铯上,计算金属铯所放出得光电子得速率。已知铯得临阈波长为600 nm。1007 光电池阴极钾表面得功函数就是2、26 eV。当波长为350 nm得光照到电池时,发射得电子最大速率就是多少? (1 eV=1、602×10-19J, 电子质量m e=9、109×10-31 kg) 1008 计算电子在10 kV电压加速下运动得波长。 1009 任一自由得实物粒子,其波长为λ,今欲求其能量,须用下列哪个公式---------------( ) (A) (B) (C) (D) A,B,C都可以 1010 对一个运动速率v< 结构化学基础习题和答案 01.量子力学基础知识 【1.1】将锂在火焰上燃烧,放出红光,波长λ=670.8nm ,这是Li 原子由电子组态 (1s)2(2p)1→(1s)2(2s)1跃迁时产生的,试计算该红光的频率、波数以及以k J ·mol -1 为单位的能量。 解:81 141 2.99810m s 4.46910s 670.8m c νλ--??===? 41 71 1 1.49110cm 670.810cm νλ --= = =?? 3414123-1 -16.62610J s 4.46910 6.602310mol 178.4kJ mol A E h N s ν--==??????=? 【1.2】 实验测定金属钠的光电效应数据如下: 波长λ/nm 312.5 365.0 404.7 546.1 光电子最大动能E k /10-19J 3.41 2.56 1.95 0.75 作“动能-频率”,从图的斜率和截距计算出Plank 常数(h)值、钠的脱出功(W)和临阈频率(ν 0)。 解:将各照射光波长换算成频率v ,并将各频率与对应的光电子的最大动能E k 列于下表: λ/nm 312.5 365.0 404.7 546.1 v /1014s -1 9.59 8.21 7.41 5.49 E k /10 -19 J 3.41 2.56 1.95 0.75 由表中数据作图,示于图1.2中 E k /10-19 J ν/1014g -1 图1.2 金属的 k E ν -图 由式 0k hv hv E =+ 推知 0k k E E h v v v ?= =-? 即Planck 常数等于k E v -图的斜率。选取两合适点,将k E 和v 值带入上式,即可求出h 。 例如: ()()1934141 2.70 1.0510 6.60108.5060010J h J s s ---?==?-? 图中直线与横坐标的交点所代表的v 即金属的临界频率0v ,由图可知, 141 0 4.3610v s -=?。因此,金属钠的脱出功为: 341410196.6010 4.36102.8810W hv J s s J ---==???=? 【1.3】金属钾的临阈频率为5.464×10-14s -1 ,如用它作为光电极的阴极当用波长为300nm 的紫外光照射该电池时,发射光电子的最大速度是多少? 解:2 01 2hv hv mv =+ ()1 2 018 1 2 341419 312 2.998102 6.62610 5.46410300109.10910h v v m m s J s s m kg υ------??=? ??? ???????-??? ?????? =?????? ? 1 34 141 2 31512 6.62610 4.529109.109108.1210J s s kg m s ----??????=?????=? 【1.4】计算下列粒子的德布罗意波的波长: (a ) 质量为10-10kg ,运动速度为0.01m ·s -1 的尘埃; (b ) 动能为0.1eV 的中子; (c ) 动能为300eV 的自由电子。 解:根据关系式: (1)3422101 6.62610J s 6.62610m 10kg 0.01m s h mv λ----??===??? 结构化学复习题 一、选择填空题 第一章量子力学基础知识 1.实物微粒和光一样,既有性,又有性,这种性质称为性。 2.光的微粒性由实验证实,电子波动性由实验证实。 3.电子具有波动性,其波长与下列哪种电磁波同数量级? ( A)X 射线(B)紫外线(C)可见光(D)红外线 4.电子自旋的假设是被下列何人的实验证明的? ( A) Zeeman ( B) Gouy(C)Stark(D)Stern-Gerlach 5. 如果 f 和 g 是算符,则(f+g)(f-g)等于下列的哪一个? (A)f 2-g 2;(B)f2-g2-fg+gf;(C)f2+g2;(D)(f-g)(f+g) 6.在能量的本征态下,下列哪种说法是正确的? ( A)只有能量有确定值;(B)所有力学量都有确定值; ( C)动量一定有确定值;(D)几个力学量可同时有确定值; 7. 试将指数函数e±ix表示成三角函数的形式------ 8.微观粒子的任何一个状态都可以用 概率密度。 9.Planck常数h的值为下列的哪一个? ( A) 1.38 × 10-30 J/s(B)1.38× 10-16J/s 10.一维势箱中粒子的零点能是 答案 : 1.略. 2.略. 3.A 4.D 5.B 6.D 7. 来描述;表示粒子出现的(C) 6.02 × 10-27J· s(D)6.62×10-34J· s 略8.略9.D10.略 第二章原子的结构性质 1. 用来表示核外某电子的运动状态的下列各组量子数(n, 1, m, m s)中,哪一组是合理的? (A)2 ,1, -1,-1/2;(B)0 , 0,0, 1/2 ;(C)3 ,1, 2, 1/2 ;(D)2 , 1, 0, 0。 2.若氢原子中的电子处于主量子数n=100 的能级上,其能量是下列的哪一个: (A)13.6Ev ;(B)13.6/10000eV;(C)-13.6/100eV;(D)-13.6/10000eV; 3.氢原子的 p x状态,其磁量子数为下列的哪一个? (A)m=+1;(B)m=-1;(C)|m|=1;(D)m=0; 4.若将 N 原子的基电子组态写成 1s 22s22p x22p y1违背了下列哪一条? (A)Pauli 原理;( B) Hund 规则;(C)对称性一致的原则;( D)Bohr 理论 5.B 原子的基态为1s22s2p1, 其光谱项为下列的哪一个? (A) 2 P;(B)1S;(C)2D;(D)3P; 6.p 2组态的光谱基项是下列的哪一个? ( A)3F;(B)1D;(C)3P;(D)1S; 7.p 电子的角动量大小为下列的哪一个? ( A) h/2 π;( B) 31/2 h/4 π;( C) 21/2 h/2 π;( D) 2h/2 π; 《结构化学》第一章习题 1、设原子中电子的速度为1×106 m·s -1,试计算电子波的波长。若设子弹的质量为0.02g,速度为500 m·s-1,子弹波的波长为多少?从上述计算中,可得出何种结论? 2、设子弹的m =50g,v =300m/s, Δv =0.01%, 求子弹位置的测不准值Δx为多少?如电子的m =9.1x10-28g,v =300m/s, Δv =0.01%, 试求电子的Δx。从上述计算中,可得出何种结论? 3、原子中运动的电子,其速度约为106m/s,设Δv =0.1%,试计算Δx值,并可得出何种结论? 4、若氢原子基态到第一激发态跃迁时,吸收光的波数为8.22×104 cm-1,求跃迁时所需能量。 5、一质量为m的粒子,在长为l的一维势箱中运动,根据其几率密度分布图,当粒子处于Ψ4时(),出现在l/8≤x≤3l/8内的概率是多少? 7、对于一个在特定的一维势箱中的电子,观察到的最低跃迁频率为4.0×1014s-1, 求箱子的长度。 8、一维势箱中电子两运动状态分别为:和,证明它们为薛定谔方程的独立解。 9、质量为m的粒子在边长为a的立方势箱中运动,当分别等于12、14、27时,试写出其对应的简并轨道、简并态和简并度。 10、质量为m的粒子在边长为l的立方势箱中运动,计算其第四个能级和第六个能级的能量和简并度。 11、如图所示的直链共轭多烯中,π电子可 视为在一维势箱中运动的粒子,实际测得π电子由最高填充能级向最低空能级跃迁时吸收光谱波长为30.16×104 pm,试求该一维势箱的长度。 12、维生素A的结构如图所示,已知它在332nm处有一强吸收峰,这也是长波方向的第一个峰,试估计一维势箱的长度l。 13、2、下列函数中(A) cos kx (B) e -bx (C) e-ikx (D) ,问(1)哪些是的本征函数;(2)哪些是的本征函数;(3) 哪些是和的共同本征函数。 14、下列函数中:⑴sinx cosx ;⑵cos2x;⑶sin2x-cos2x,哪些是d/dx的本征函数,本征值是多少,哪些是d2/dx2的本征函数,本征值是多少? 15、请写出“定核近似”条件下单电子原子的薛定谔方程,需说明算符化过程并需注明方程中各项含义。 16、试写出角动量的算符表示式。 17、证明是方程()的解[l = 1,m =±1,k =l(l+1)]。 18、证明是算符的本征函数,并求其本征值。 19、证明在三维空间中运动的粒子,当处于本征态时,角动量大小具有确定值,并求角动量。已知角动量平方算符为: 。 20、为什么只有5个d轨道?试写出5个d轨道实数解的角度部分?以n=3为例写出5个d 轨道实数解与复数解间的关系。 21、氢原子中电子的一个状态函数为: Ψ2Pz = 1/4(z3/2πa03)1/2(zr/ a0)exp(-zr /2 a0)cosθ 求:(1)它的能量是多少(ev)?(2)角动量是多少? (3)角动量在Z方向的分量是多少?(4)电子云的节面数? 《结构化学》第三章习题答案 3001 ( A, C ) 3002 H ab =∫ψa [-21?2- a r 1 - b r 1 +R 1 ] ψb d τ =E H S ab + R 1 S ab - ∫a r 1ψa ψb d τ = E H S ab + K 因 E H = -13.6e V , S ab 为正值,故第一项为负值; 在分子的核间距条件下, K 为负值。 所以 H ab 为负值。 3003 ∫ψg ψu d τ=(4 - 4S 2)-1/2∫(ψa s 1+ψ b s 1)((ψa s 1-ψb s 1)d τ = (4 - 4S 2)-1/2∫[ψa s 12 -ψb s 12 ] d τ = (4 - 4S 2)-1/2 [ 1 - 1 ] = 0 故相互正交。 3004 ( C ) 3006 描述分子中单个电子空间运动状态的波函数叫分子轨道。 两个近似 (1) 波恩 - 奥本海默近似 ( 核质量 >> 电子质量 ) (2) 单电子近似 (定态) 3007 单个电子 3008 (B) 3009 (1) 能级高低相近 (2) 对称性匹配 (3) 轨道最大重叠 3010 不正确 3011 (B) 3012 ψ= (0.8)1/2φA + (0.2)1/2φB 3013 能量相近, 对称性匹配, 最大重叠 > , < 或 < , > 3014 正确 3015 不正确 3016 σ π π δ 3017 3018 z 3019 (C) 3020 π 3021 σ轨道: s -s , s -p z , s -d z , p z –p z , p z -2z d , 2z d -2z d , π轨道p x –p x ,p x –d xz ,p y –p y ,p y –d yz ,d yz –d yz ,d xz –d xz δ轨道:d xy -d xy , d 22y x -- d 22y x - 3022 σ δ π 不能 不能 3023 (B) 3024 原子轨道对 分子轨道 p z -d xy × p x -d xz π d 22y x -- d 22y x - δ 2z d -2z d σ p x –p x π 3025 1σ22σ21π43σ2 , 3 , 反磁 3026 d xy , δ 3027 p y , d xy 3028 C 2 ( 1σg )2( 1σu )2( 1πu )2+2 s -p 混杂显著. 因1σu 为弱反键,而1σg 和1πu 均为强成键,故键级在2-3之间. 3029 N 2: (1σg )2(1σu )2(1πu )4(2σg )2 O 2: σ2s 2σ2s σ2pz 2π2px 2π2py 2π2px *π2py *1 或 ( 1σg )2(1σu )22σg 2(1πu )4(1πg )2 3030 ( 1σg )2( 1σu )2( 1πu )4( 2σg )2 的三重键为 1 个σ键 (1σg )2,2个π键 (1πu )4,键级为 3 ( 1σu )2和(2σg )2分别具有弱反键和弱成键性质, 实际上成为参加成键作用很小的两对 孤对电子,可记为 :N ≡N: 。因此N 2的键长特别短,键能特别大, 是惰性较大的分子。 3031 O 2[KK (σg s 2) 2 (σu s 2*) 2 (σg2p *)2 (πu s 2)4 (πg2x p *)1 (πg2y p *)1 ] 顺磁性 C 2 [KK (σg s 2) 2 (σu s 2*) 2(πg2x p )2 (πg2y p )2] 反磁性 3032 KK ( 1σg )2(1σu )2 (1πu )3 约 3/2 [1σ22σ23σ21π44σ2]5σ22π4 1 3033 (1) 1σ22σ23σ21π4 1 反 (2) σ1s 2σ1s 2 σ2s 2σ2s 2σ2pz 2π2py 2π2pz 2π2py *2π2px *1 1.5 顺 3034 π3py , π3pz ; π3px 3035 CN -( 1σ)2(2σ) 2(1π)2+2(3σ)2 键级: 3 3036 CF KK -( 1σ)2(2σ) 2(3σ)2 (1π)4(2π)1 不论 s -p 混杂是否明显, 最高占据的 MO 为(2π)1 , 它是反键轨道。故(C-F)+键强些, 短些。 3037 Cl 2: σ3s 2σ3s *σ3px 2π3py 2π3pz 2π3py *2π2pz *2 反磁性 一、填空题 1.量子力学用Ψ(r,t)来描述 ,它在数学上要满足三个条件,分别是 ,∣Ψ∣2表示 。 2. 测不准关系是 ,它说明 3. 汤姆逊实验证明了 。 4. 一维势箱中的粒子的活动范围扩大时, 相应的能量值会 。 5. 导致“量子”概念引入的三个著名试验分别为 、 和 。 6. 方程?φ=a φ中,a 称为力学量算符?的 。 7. 如果某一个微观体系有多种可能状态,则由他们线性组合所得的状态也是体系的可能状态,这叫做 。 二、选择题 1. 几率密度不随时间改变的状态被称为( B ) A. 物质波 B. 定态 C. 本征态 D. 基态 2. 函数()x e x f =(0x -≤≤∞) 的归一化常数是( B ) A. 1/2 B. 1 C. 0 D. 2 3. 对于任意实物粒子,物质波波长为λ,欲求其动能可用( A ) A. hc/λ B. h 2/2m λ2 C. eV D. mc 2 4. 公式0*=? τψψd n m (n m ≠) 称为波函数的( D ) A. 单值性 B. 连续性 C. 归一性 D. 正交性 5. 下列算符为线性算符的是 ( D ) A. log B. d/dx C. D. ln 6. 下列算符为线性算符的是( B ) A. sinex B. d 2/dx 2 C. D. cos2x 7. 下列算符中,哪些不是线性算符( C ) A. ?2 B. d dx C. 3 D. xy 8. 下列函数中不是22 dx d 的本征函数的是( B ) A. x e B.2x C.x cos 3 D.x x cos sin + 9. 算符22 dx d 作用于函数x cos 5上,则本征值为( C ) A. –5 B. 5 C. – 1 D. 1 01.量子力学基础知识 1.1】将锂在火焰上燃烧,放出红光,波长λ=670.8nm,这是Li 原子由电子组态(1s)2(2p)1 →(1s)2(2s)1跃迁时产生的,试计算该红光的频率、波数以及以 1 4 1 7 1.491 104cm 1 670.8 10 7cm h N A6.626 10 34 J s 4.469 1014s 1 6.6023 1023mol-1 178.4kJ mol 波长λ /nm312.5365.0404.7546.1 光电子最大动能E k/10-19J 3.41 2.56 1.950.75 作“动能-频率” ,从图的斜率和截距计算出Plank 常数(h) 值、 钠的脱出功(W) 和临阈频率(ν 0)。 解:将各照射光波长换算成频率v,并将各频率与对应的光电子的最大动能E k 列于下表:λ/nm312.5365.0404.7546.1 v /1014s-19.598.217.41 5.49 E k/10 -19J 3.41 2.56 1.950.75 由表中数据作图,示于图中 由式 hv hv0 E k 推知 h E k E k v v0 v 即Planck 常数等于E k v图的斜率。选取两合适点,将E k 和v值带入上式,即可求出h。 2.70 1.05 10 19 J 34 h 14 16.60 1034 Jgs 8.50 600 1014 s 1 kJ· mol-1为单位的能量。 解: 8 2.998 108m s 670.8m 14 1 4.469 1014s 1 图 1.2 金属的E k 图 31 9.109 10 31 kg 1 2 6.626 10 34 Jgs 4.529 1014s 1 2 9.109 10 31kg 8.12 105mgs 1 1.4】计算下列粒子的德布罗意波的波长: -1 a) 质量为 10-10kg ,运动速度为 0.01m · s 的尘埃; b) 动能为 0.1eV 的中子; c) 动能为 300eV 的自由电子。 解:根据关系式: h 6.626 10 34 J s mv 10 10 kg 0.01m s 6.626 10 34 J s 2 1.675 10 27kg 0.1eV 1.602 10 19J eV 9.40 3 10-11m (3) h h p 2meV 6.626 10 34 J s 2 9.109 10 31kg 1.602 10 19C 300V 7.08 10 11m 【1.5】用透射电子显微镜摄取某化合物的选区电子衍射图,加速电压为 加速后运动时的波长。 图中直线与横坐标的交点所代表的 v 即金属的临界频率 v 0 ,由图可知, v 0 4.36 因此,金属钠的脱出功为: W hv 0 6.60 10 34Jgs 4.36 1014s 1 19 2.88 10 19 J 14 1 1014s 1 1.3】金属钾的临阈频率为 5.464×10-14 s -1,如用它作为光电极的阴极当用波长为 300nm 的 紫外光照射该电池时,发射光电子的最大速度是多少? hv hv 0 解: 1 2h v v 0 2 m 12 mv 2 34 2 6.626 10 34 Jgs 2.998 108 mgs 300 10 9m 14 1 5.464 1014 s 1 (1) (2) 22 6.626 10 22 m 200kV ,计算电子 习 题 1. 用VSEPR 理论简要说明下列分子和离子中价电子空间分布情况以及分子和离子的几何构型。 (1) AsH 3; (2)ClF 3; (3) SO 3; (4) SO 32-; (5) CH 3+ ; (6) CH 3- 2. 用VSEPR 理论推测下列分子或离子的形状。 (1) AlF 63-; (2) TaI 4-; (3) CaBr 4; (4) NO 3-; (5) NCO -; (6) ClNO 3. 指出下列每种分子的中心原子价轨道的杂化类型和分子构型。 (1) CS 2; (2) NO 2+ ; (3) SO 3; (4) BF 3; (5) CBr 4; (6) SiH 4; (7) MnO 4-; (8) SeF 6; (9) AlF 63-; (10) PF 4+ ; (11) IF 6+ ; (12) (CH 3)2SnF 2 4. 根据图示的各轨道的位向关系,遵循杂化原则求出dsp 2 等性杂化轨道的表达式。 5. 写出下列分子的休克尔行列式: CH CH 2 123 4 56781 2 34 6. 某富烯的久期行列式如下,试画出分子骨架,并给碳原子编号。 0100001100101100001100 001101001 x x x x x x 7. 用HMO 法计算烯丙基自由基的正离子和负离子的π能级和π分子轨道,讨论它们的稳定性,并与烯丙基自由基相比较。 8. 用HMO法讨论环丙烯基自由基C3H3·的离域π分子轨道并画出图形,观察轨道节面数目和分布特点;计算各碳原子的π电荷密度,键级和自由价,画出分子图。 9. 判断下列分子中的离域π键类型: (1) CO2 (2) BF3 (3) C6H6 (4) CH2=CH-CH=O (5) NO3- (6) C6H5COO- (7) O3 (8) C6H5NO2 (9) CH2=CH-O-CH=CH2 (10) CH2=C=CH2 10. 比较CO2, CO和丙酮中C—O键的相对长度,并说明理由。 11. 试分析下列分子中的成键情况,比较氯的活泼性并说明理由: CH3CH2Cl, CH2=CHCl, CH2=CH-CH2Cl, C6H5Cl, C6H5CH2Cl, (C6H5)2CHCl, (C6H5)3CCl 12. 苯胺的紫外可见光谱和苯差别很大,但其盐酸盐的光谱却和苯很接近,试解释此现象。 13. 试分析下列分子中的成键情况,比较其碱性的强弱,说明理由。 NH3, N(CH3)2, C6H5NH2, CH3CONH2 14. 用前线分子轨道理论乙烯环加成变为环丁烷的反应条件及轨道叠加情况。 15. 分别用前线分子轨道理论和分子轨道对称性守恒原理讨论己三烯衍生物的电环化反应 在加热或者光照的条件下的环合方式,以及产物的立体构型。 参考文献: 1. 周公度,段连运. 结构化学基础(第三版). 北京:北京大学出版社,2002 2. 张季爽,申成. 基础结构化学(第二版). 北京:科学出版社,2006 3. 李炳瑞.结构化学(多媒体版).北京:高等教育出版社,2004 4. 林梦海,林银中. 结构化学. 北京:科学出版社,2004 5. 邓存,刘怡春. 结构化学基础(第二版). 北京:高等教育出版社,1995 6.王荣顺. 结构化学(第二版). 北京:高等教育出版社,2003 7. 夏少武. 简明结构化学教程(第二版). 北京:化学工业出版社,2001 8. 麦松威,周公度,李伟基. 高等无机结构化学. 北京:北京大学出版社,2001 9. 潘道皑. 物质结构(第二版). 北京:高等教育出版社,1989 10. 谢有畅,邵美成. 结构化学. 北京:高等教育出版社,1979 11. 周公度,段连运. 结构化学基础习题解析(第三版). 北京:北京大学出版社,2002 12. 倪行,高剑南. 物质结构学习指导. 北京:科学出版社,1999 13. 夏树伟,夏少武. 简明结构化学学习指导. 北京:化学工业出版社,2004 14. 徐光宪,王祥云. 物质结构(第二版). 北京:科学出版社, 1987 15. 周公度. 结构和物性:化学原理的应用(第二版). 北京:高等教育出版社, 2000 16. 曹阳. 结构与材料. 北京:高等教育出版社, 2003 17. 江元生. 结构化学. 北京:高等教育出版社, 1997 18. 马树人. 结构化学. 北京:化学工业出版社, 2001 19. 孙墨珑. 结构化学. 哈尔滨:东北林业大学出版社, 2003 《结构化学》第三章习题 3001 H 2+的H ?= 212 - a r 1 - b r 1 +R 1, 此种形式已采用了下列哪几种方法: ------------------------------ ( ) (A) 波恩-奥本海默近似 (B) 单电子近似 (C) 原子单位制 (D) 中心力场近似 3002 分析 H 2+的交换积分(积分) H ab 为负值的根据。 3003 证明波函数 ()()() ()b a b a ψψψψψψS S s 1s 121u s 1s 121g 221221--=++= 是相互正交的。 3004 通过变分法计算得到的微观体系的能量总是:----------------- ( ) (A) 等于真实基态能量 (B) 大于真实基态能量 (C) 不小于真实基态能量 (D) 小于真实基态能量 3006 什么叫分子轨道?按量子力学基本原理做了哪些近似以后才有分子轨道的概念? 这些近似的根据是什么? 3007 描述分子中 _______________ 空间运动状态的波函数称为分子轨道。 3008 对于"分子轨道"的定义,下列叙述中正确的是:----------------- ( ) (A) 分子中电子在空间运动的波函数 (B) 分子中单个电子空间运动的波函数 (C) 分子中单电子完全波函数(包括空间运动和自旋运动) (D) 原子轨道线性组合成的新轨道 3009 试述由原子轨道有效地形成分子轨道的条件。 3010 在 LCAO-MO 中,所谓对称性匹配就是指两个原子轨道的位相相同。这种说法是否 正确? 3011 在LCAO-MO 方法中,各原子轨道对分子轨道的贡献可由哪个决定: ----------------- ( ) (A) 组合系数 c ij (B) (c ij )2 习题 1. CO 是一个极性较小的分子还是极性较大的分子?其偶极矩的方向如何?为什么? 2. 下列AB型分子:N2,NO,O2,C2,F2,CN,CO,XeF中,哪几个是得电子变为AB–后比原来中性分子键能大?哪几个是失电子变为AB+ 后比原来中性分子键能大? 3. 按分子轨道理论说明Cl2的键比Cl2+ 的键强还是弱?为什么? 4. 下列分子中,键能比其正离子的键能小的是____________________ 。键能比其负离子的键能小的是________________________ 。 O2,NO,CN,C2,F2 5. 比较下列各对分子和离子的键能大小: N2,N2+( ) O2,O2+( ) OF,OF–( ) CF,CF+( ) Cl2,Cl2+( ) 6. 写出O2+,O2,O2–和O22–的键级、键长长短次序及磁性。 7. 按分子轨道理论写出NF,NF+ 和NF–基态时的电子组态,说明它们的键级、不成对电子数和磁性。 8. 判断NO 和CO 哪一个的第一电离能小,原因是什么? 9. HF分子以何种键结合?写出这个键的完全波函数。 10.试用分子轨道理论讨论SO分子的电子结构,说明基态时有几个不成对电子。 11.下列AB型分子:N2,NO,O2,C2,F2,CN,CO,XeF中,哪几个是得电子变为AB–后比原来中性分子键能大?哪几个是失电子变为AB+ 后比原来中性分子键能大? 12.OH分子于1964年在星际空间被发现。 (a)试按分子轨道理论只用O原子的2 p轨道和H原子的1 s轨道叠加,写出其电子组态。 (b)在哪个分子轨道中有不成对电子? (c)此轨道是由O和H的原子轨道叠加形成,还是基本上定域于某个原子上? (d)已知OH的第一电离能为13.2eV,HF的第一电离能为16.05eV,它们的差值几乎与O原子和F原子的第一电离能(15.8eV和18.6eV)的差值相同,为什么? (e)写出它的基态光谱项。 13.试写出在价键理论中描述H2运动状态的、符合Pauli 原理的波函数,并区分其单态和三重态。结构化学第一章习题
结构化学基础习题及答案(结构化学总复习)
结构化学练习题带答案
结构化学第一章题目
《结构化学》第三章习题答案
结构化学第一章答案
(完整版)结构化学课后答案第一章
结构化学-第五章习题及答案
结构化学习题答案
结构化学 第三章习题及答案
