醋酸、酒精、乙醛等主要物化常数

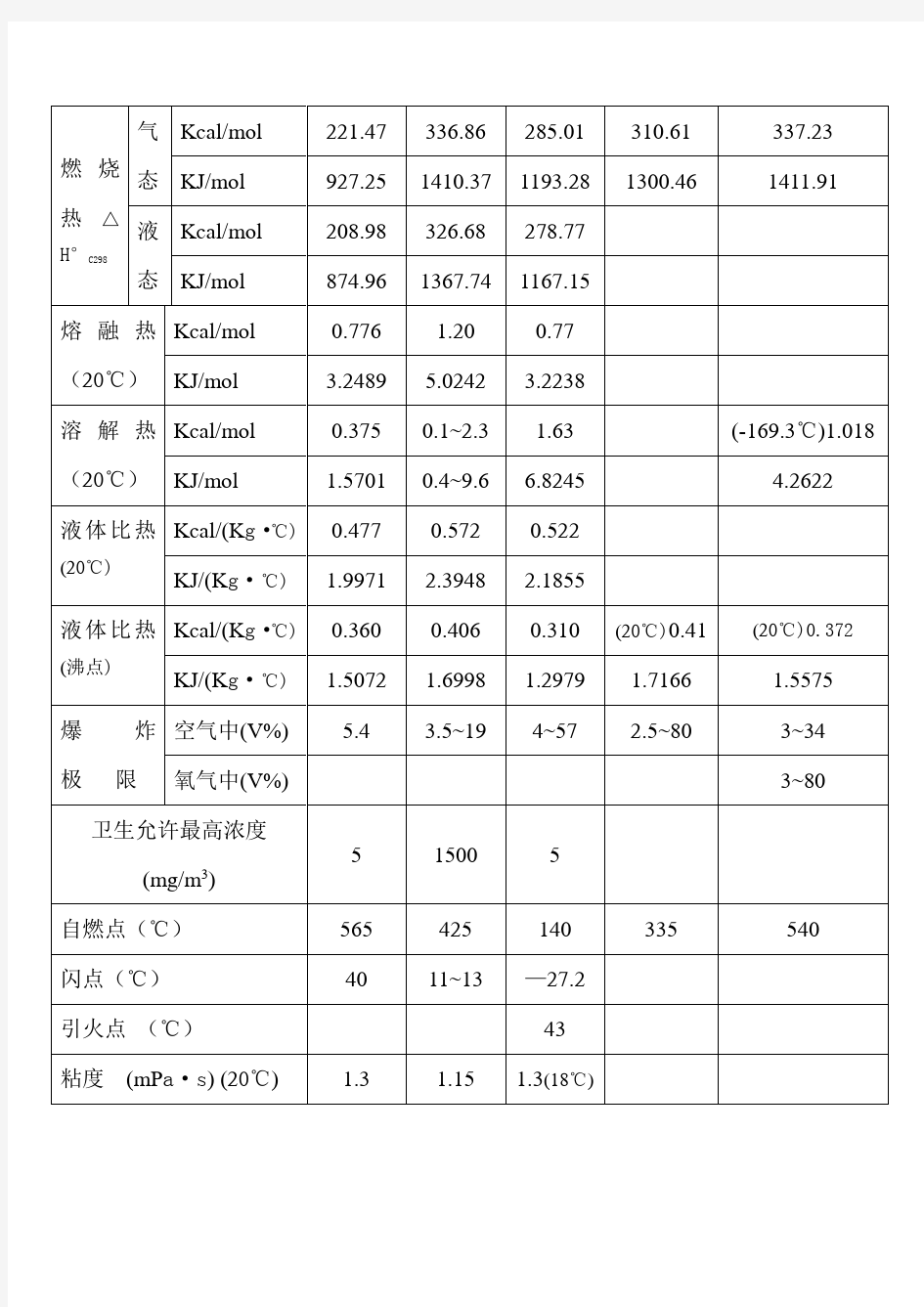
醋酸、酒精、乙醛、乙炔、乙烯的主要物化常数
空气密度(标准态):1.29kg/m3平均分子量:29 氧气密度(标准态):1.429kg/m3
某些液体的汽化焓
化工总控工培训《乙醛氧化制醋酸工艺仿真软件氧化》指导书
茂名职业技术学院 化学工程系 实习(实训)指导书 (乙醛氧化制醋酸氧化工段仿真部分) 专业班级:15精化班 实习名称:化工总控工实训 实习时间:2016-2017-1 第16周至第17周 实习人数:51人 指导教师:陈颖峰、车文成、张燕、王丹菊、胡鑫鑫系主任:董利 审核日期: 2016.12.05
目录 第一章概述 (1) 第二章生产方法及工艺路线 (1) 2.1生产方法及反应机理 (1) 2.2工艺流程简述 (3) 2.2.1 装置流程简述 (3) 2.2.2 氧化系统流程简述 (3) 第三章工艺技术指标 (3) 3.1控制指标 (3) 3.2分析项目 (5) 第四章岗位操作法 (5) 4.1冷态开车/装置开工 (5) 4.1.1 开工应具备的条件 (5) 4.1.2 引公用工程 (5) 4.1.3 N2吹扫、置换气密 (5) 4.1.4 系统水运试车 (5) 4.1.5 酸洗反应系统 (5) 4.1.6 全系统大循环和精馏系统闭路循环 (6) 4.1.7 第一氧化塔配制氧化液 (6) 4.1.8 第一氧化塔投氧开车 (6) 4.1.9 第二氧化塔投氧 (7) 4.1.10 吸收塔投用 (8) 4.1.11氧化塔出料 (8) 4.2正常停车 (8) 4.2.1 氧化系统停车 (8) 4.3紧急停车 (8) 4.3.1 事故停车 (8) 4.3.2 紧急停车 (9) 4.4岗位操作法 (9) 4.4.1 第一氧化塔 (9) 4.4.2 第二氧化塔(T102) (10) 4.4.3 洗涤液罐 (10) 4.5联锁停车 (10)
第一章 概述 乙酸又名醋酸,英文名称为acetic acid ,是具有刺激气味的无色透明液体,无水乙酸在低温时凝固成冰状,俗称冰醋酸。在16.7℃以下时,纯乙酸呈无色结晶,其沸点是118℃。乙酸蒸气刺激呼吸道及粘膜(特别是对眼睛的粘膜),浓乙酸可灼烧皮肤。乙酸是重要的有机酸之一。其结构式是: 乙酸是稳定的化合物;但在一定的条件下,能引起一系列的化学反应。如:在强酸(H2SO4或HCl )存在下,乙酸与醇共热,发生酯化反应: 乙酸是许多有机物的良好溶剂,能与水、醇、酯和氯仿等溶剂以任意比例相混合。乙酸除用作溶剂外,还有广泛的用途,在化学工业中占有重要的位置,其用途遍及醋酸乙烯、醋酸纤维素、醋酸酯类等多种领域。乙酸是重要的化工原料,可制备多种乙酸衍生物如乙酸酐、氯乙酸、乙酸纤维素等,适用于生产对苯二甲酸、纺织印染、发酵制氨基酸,也作为杀菌剂。在食品工业中,乙酸作为防腐剂;在有机化工中,乙酸裂解可制得乙酸酐,而乙酸酐是制取乙酸纤维的原料。另外,由乙酸制得聚酯类,可作为油漆的溶剂和增塑剂;某些酯类可作为进一步合成的原料。在制药工业中,乙酸是制取阿司匹林的原料。利用乙酸的酸性,可作为天然橡胶制造工业中的胶乳凝胶济,照相的显像停止剂等。 乙酸的生产具有悠久的历史,早期乙酸是由植物原料加工而获得或者通过乙醇发酵的方法制得,也有通过木材干馏而获得的。目前,国内外已经开发出了乙酸的多种合成工艺,包括烷烃、烯烃及其酯类的氧化,其中应用最广的是乙醛氧化法制备乙酸。下面主要介绍乙醛氧化法制备乙酸。 第二章 生产方法及工艺路线 2.1 生产方法及反应机理 乙醛首先与空气或氧气氧化成过氧醋酸,而过氧醋酸很不稳定,在醋酸锰的催化下发生分解,同时使另一分子的乙醛氧化,生成二分子乙酸。氧化反应是放热反应。 CH 3CHO+O 2→CH 3COOOH CH 3COOOH+CH 3CHO →2CH3COOH 总的化学反应方程式为: C H 3C OH O
实验醋酸解离度和解离常数的测定
实验 醋酸解离度和解离常数的测定 一、实验目的 1、了解电导率法测定醋酸解离度和解离常数的原理和方法; 2、加深对弱电解质解离平衡的理解; 3、学习电导率仪的使用方法,进一步学习滴定管、移液管的基本操作。 二、提 要 醋酸CH 3COOH 即HA C ,在水中是弱电解质,存在着下列解离平衡: 或简写为 其解离常数为 {}{ } { } θ θ -θ+= αc )c HA (c c )c A (c c )H (c )c HA (K eq eq eq (2.1) 如果HAc 的起始溶度为c o ,其解离度为α,由于,)()(0a c Ac c H c eq eq ==-+代入式(2.1)得: θ θ αα-α =α-α=c )1(c c )c c ()c ()HAc (K 2 00020 (2.2) 某一弱电解质的解离常数K a 仅与温度有关,而与该弱电解质溶液的浓度无关;其解离度α则随溶液浓度的降低而增大 。可以有多种方法用来测定弱电解质的α和K a ,本实验采用的方法是用电导率测定HAc 的α和K a 。 电解质溶液是离子电导体,在一定温度时,电解质溶液的电导(电阻的倒数)λ为 l kA =λ (2.3) 式中,k 为电导率...(电阻率的倒数),表示长度l 为1m 、截面积A 为1m 2导体的电导;单位为S·m -1。电导的单位为S[西(门子)]。 在一定温度下,电解质溶液的电导λ与溶质的性质及其溶度c 有关。为了便于比较不同溶质的溶液的电导,常采用摩尔电导m λ。它表示在相距1cm 的两平行电极间,放置含有1单位物质的量电解质的电导,其数值等于电导率k 乘以此 溶液的全部体积。若溶液的浓度为)dm · mol (c 3-,于是溶液的摩尔电导为 k 10kV 3m -==λ (2.4) m λ的单位为12mol ·m ·S -。 根据式(2.2),弱电解质溶液的溶度c 越小,弱电解质的解离度α越大,无限稀释时弱电解质也可看作是完全解离的,即此时的%100=α。从而可知,一定温
顶空气相色谱测定桶装纯净水中乙醛含量方法的建立
顶空气相色谱测定桶装纯净水中乙醛含量方法的建立 【摘要】用顶空气相色谱法测定桶装纯净水中乙醛含量。此次测定使用气相色谱Agilent 7890,配CTC自动进样器,选用HP-5毛细管色谱柱,采用程序升温进行分析以确定乙醛出峰时间,用外标法进行定量。在0.01~1mg/L范围内,检出限=0.05mg/L,回归方程式Y=5.02719X+0.08512,r=0.09904,方法回收率=93.3%,RSD=3.06%。 【关键词】气相色谱;顶空;水;乙醛 1 乙醛的危害 在水厂净水工艺中,因使用消毒剂而产生消毒副产品(DBPs),其中包含乙醛;乙醛是合成树脂合成工业和药物工业的重要原料之一,生活用水和水源水均存在被乙醛污染的可能性。低浓度的乙醛会引起眼、鼻及上呼吸道刺激症状及支气管炎,高浓度的乙醛有麻醉作用,头痛、嗜睡、神志不清及支气管炎、腹泻,严重可致死,且醛类具有致癌的危险性[1]。乙醛为无色易挥发液体,有刺激性气味,沸点20.8℃,热稳定性强,因此可使用顶空气相色谱法进行分析。顶空分析法的理论依据主要为道尔分压定律、亨利定律、拉乌尔定律,一般地,顶空瓶中被分析物的浓度正比于溶液中被分析物的浓度,既分析物的峰面积正比于注入的分析物的含量。使用外标法制作标准曲线,可计算出被测样品的浓度。现行标准GB11934-1989《水源水中乙醛、丙烯醛卫生检验标准方法气相色谱法》[2]和GB/T 5750.10-2006《生活用水检验方法消毒副产品》[3]检测乙醛都使用气相色谱填充柱法,采用水体直接进样,方法乙醛最低检出限分别为0.24mg/L、0.3mg/L。目前国内国外对部分水中挥发性烃类物质的测定都采用顶空气相色谱法,使用顶空进样可以减少样品前处理、减小溶剂峰、减轻GC进样口和色谱柱污染程度、减轻质谱离子源污染程度,同时顶空进样法灵敏度高、精密度与线性好。笔者建立顶空气相色谱法对桶装纯净水中乙醛含量进行测定。 2 试验方法 2.1 仪器与试剂 2.1.1 仪器 Agilent GC-7890,配氢火焰离子化检测器(FID),色谱柱为HP-INNOWAS 30m×250μm×0.25μm 色谱柱,Agilent G6509B CTC自动进样系统 2.1.2 试剂 乙醛(色谱纯);乙醛标准储备液:精密称取适量纯品乙醛0.01g,定容到100mL容量瓶中,得100mg/L(纯水为超纯水);
乙醛氧化制乙酸仿真步骤(精)
开车前准备(酸洗反应系统:过程正在评分 145.00 145.00 该过程历时6258秒 S0开启尾气吸收塔T103的放空阀V45(50%.(为节省时间,可使用“快速灌液” S1开启氧化液中间贮罐V102的现场阀V57(50%,向其中注酸 S2开启V102的输液泵 P102,向第一氧化塔T101注酸 S3 打开T101进酸控制阀FIC112 S4 V102的液位LI103超过50%后,关闭阀V57,停止向V102注酸 S5 T101的液位LIC101大于2%后,关闭泵P102,停止向T101注酸 S6 关闭T101注酸控制阀FIC112 S7 开启 T101的循环泵P101A/B的前阀V17 S8 开启泵P101A,酸洗第一氧化塔T101 S9打开酸洗回路阀V66 S10打开酸洗回路的流量控制阀FIC104(20% (开启约为一分钟S11关闭泵P101A,停止酸洗 S12关闭酸洗回路的流量控制阀FIC104 S13开启 T101的氮气控制阀FIC101,将酸压至第二氧化塔T102中 S14开启T101底阀V16,向T102压酸 S15开启T102底阀V32,由T101向T102压酸 16开启T102的底部控制阀V33,由T101向T102压酸 17T102液位LIC102大于0后,关闭T101的进氮气控制阀FIC101 (约为3分钟) 18 开启T102的进氮气控制阀FIC105,向 V102压酸 S19 开启V102的回酸阀V59,将T101、T102中的酸打回V102 S20 压酸结束后,关闭T102的进氮气控制阀FIC105 (FI120为0时关) S21 压酸结束后,关闭T101的底阀V16 S22压酸结束后,关闭T102底阀V32 S23压酸结束后,T102的底部控制阀V33 S24压酸结束后,关闭V102的回酸阀V59 S25开启 T101的压力调节阀PIC109A,放空T101内的气体 S26开启T102的压力调节阀PIC112A,放空T102内的气体 S27放空结束,关闭T101的压力调节阀PIC109A S28放空结束,关闭T102的压力调节阀PIC112A 建立循环:过程正在评分 30.00 30.00 该过程历时4849秒 S0开启泵P102,由V102向T101中注酸 S1 全开T101注酸控制阀FIC112 S2 当LIC101大于30%时,开启LIC101(开度约50%),根据LIC101液位随时调整 S3 开启T102底阀V32,向T102进酸 S4 当LIC102大于30%时,开启LIC102(开度约50%),根据LIC102液位随时调整 S5 开启T102的现场阀V44,向精馏系统出料,建立循环配制氧化液:过程正在评分 85.00 81.47 该过程历时3920秒 S0 将LIC101调至30%左右,停泵P102 S1 关闭T101注酸控制阀FIC112 S2 关闭T101的液位控制器LIC101 S3开启乙醛进料调节阀 FICSQ102(缓加,根据乙醛含量AIAS103来调整其开度,使AIAS103约为7.5% S4
乙醛氧化制醋酸精致工段
乙醛氧化制醋酸精制工段 第一章概述 大庆醋酸装置是大庆三十万吨乙烯一期工程的组成部分。此装置是依靠国内技术力量,参考上海石油化工总厂的实际生产情况,由上海医药设计院设计。大庆醋酸装置是西德引进乙醛装置的配套工程,起始原料为乙烯,乙烯氧化生成乙醛,再由乙醛为原料氧化生成醋酸。 醋酸装置设计年生产能力为成品醋酸7万吨/年。同时生产副产品混酸700吨/年,醋酸甲酯650吨/年。1997年10月改扩建,年生产能力为10万吨。 第二章生产方法及工艺路线 一生产方法及反应机理。 乙醛首先氧化成过氧醋酸,而过氧醋酸很不稳定,在醋酸锰的催化下发生分解,同时使另一分子的乙醛氧化,生成二分子乙酸。氧化反应是放热反应。 CH3CHO+O2→CH3COOOH CH3COOOH+CH3CHO→2CH3COOH 在氧化塔内,还有一系列的氧化反应。 乙醛氧化制醋酸的反应机理一般认为可以用自由基的链接反应机理来进行解释,常温下乙醛就可以自动地以很慢的速度吸收空气中的氧而被氧化生成过氧醋酸:过氧醋酸以很慢的速度分解生成自由基。 自由基引发一系列的反应生成醋酸。但过氧醋酸是一个极不安定的化合物,积累到一定程度就会分解而引起爆炸。因此,该反应必须在催化剂存在下才能顺利进行。催化剂的作用是将乙醛氧化时生成的过氧醋酸及时分解成醋酸,而防止过氧醋酸的积累、分解和爆炸。 二工艺流程简述。 1、装置流程简述 本装置反应系统采用双塔串联氧化流程,乙醛和氧气首先在全返混型的反应器——第一氧化塔T-101中反应(催化剂溶液直接进入T-101内)然后到第二氧化塔T-102中再加氧气进一步反应,不再加催化剂。一塔反应热由外冷却器移走,二塔反应热由内冷却器移除,反应系统生成的粗醋酸进入蒸馏回收系统,制取成品醋酸。 蒸馏采用先脱高沸物,后脱低沸物的流程。
报告示例:实验三__醋酸解离度和解离常数的测定
山东轻工业学院实验报告 成绩 课程名称 基础化学实验1 指导教师 周磊 实验日期 院(系) 专业班级 实验地点 实验楼A 座412 学生姓名 学号 同组人 实验项目名称 醋酸解离度和解离常数的测定 一、实验目的 1. 学习正确使用酸度计。 2. 进一步练习溶液的配制与酸碱滴定的基本操作。 3. 用 pH 法测定醋酸的解离度和解离常数。 二、实验原理 HAc 为一元弱酸,在水溶液中存在如下解离平衡: HAc = H + + Ac - K a 起始浓度 (mol ?L -1) c 0 0 平衡浓度 (mol ?L -1) c –c α c α c α K a 表示 HAc 的解离常数 , α 为解离度 , c 为起始浓度。根据定义: 醋酸溶液总浓度 c 可以用 NaOH 标准溶液滴定测定。配制一系列已知浓度的醋酸溶液,在一定温度下,用酸度计测出其 pH 值,求出对应的 [H + ],再由上述公式计算出该温度下一系列对应的 α 和K a 值。取所得的一系列K a 值的平均值,即为该温度下醋酸的解离常数。 三、主要仪器和试剂 仪器 :酸度计, 碱式滴定管 (50mL), 锥形瓶 (250mL), 移液管 (25mL), 吸量管 (5mL), 容量瓶 (50mL), 烧杯 (50mL) 试剂:HAc 溶液, NaOH 标准溶液, 酚酞 四、实验步骤(用简洁的文字、箭头或框图等表示) 1. 醋酸溶液浓度的测定 2. 配制不同浓度的醋酸溶液 2 [H ]1a c K c θ ααα += = -
3. 不同浓度醋酸溶液pH 值的测定 五、结果记录及数据处理 表1 醋酸溶液浓度的测定 表2 HAc解离度和解离常数的测定
酒精中醛的测定
白酒中醛含量的测定(以乙醛计) 一、实验目的 掌握用碘量法测定白酒中醛含量的方法和原理。 二、实验原理 食用酒精中的醛与亚硫酸氢钠发生加成反应,生成α-羟基磺酸钠,过量的亚硫酸氢钠用碘氧化。 CH3CHO+NaHSO3=CH3CH(OH)(SO3Na) 剩余的NaHSO3与已知过量的I2作用,其反应式为: NaHSO3 + I2 +H2O == NaHSO4 + 2HI 用Na2S2O3滴定剩余的碘,便可以测出白酒中的总醛量 2Na2S2O3 +I2 == Na2S4O6+2NaI 三、实验药品 K2Cr2O7、0.1mol\L Na2S2O3溶液、1:1HCL、Na2CO3、固体KI、碘标准溶液(0.05mol·L-1)、淀粉溶液(0.5%)、NaHSO3(0.05mol·L-1)、锥形瓶、碘量瓶 四、实验步骤 1、配置0.10 mol\L Na2S2O3溶液500mL 称取13g Na2S2O3·5H2O ,溶于500mL新煮沸的冷蒸馏水中,加0.1g Na2CO3,保存于棕色瓶中,放置一周后进行标定。 配制0.05mol·L-1碘标准溶液500mL 称取6.49-6.51g碘及17g碘化钾,溶于100mL水中,稀释定容至500mL,摇匀,贮存于棕色瓶中。 2、Na2S2O3溶液的标定
准确称取约0.12g K2Cr2O7于碘量瓶中,加25ml水溶解,并加2gKI和5mlHCL,稀释至100mL摇匀放置10分钟后用Na2S2O3溶液进行滴定至溶液变为浅黄绿色时加5ml淀粉指示剂,用Na2S2O3溶液继续滴定至溶液由兰色变为浅(亮)绿色时为止。平行标定3次。 标定反应为: Cr2O72- + 6I- + 14H+ = 2Cr3+ +3I2 +7H2O 2S2O32- + I2 = 2I- + S4O62- 3、碘标准溶液的标定 准确移取25.00mL配制好的碘标准滴定溶液,置于碘量瓶中,加100mL 水(15—20℃),用硫代硫酸钠标准滴定溶液[C(Na2S2O3)=0.1mol/L]滴定,近终点(微黄色)时,加5mL淀粉指示剂,继续滴定至溶液蓝色消失。 原理:2S2O32- + I2 = 2I- + S4O62- 平行测定三次。 4、 NaHSO3浓度的标定 准确吸取25.00mL碘标准溶液三份,分别置于250mL碘量瓶中,准确加入10.00mL NaHSO3溶液,盖上塞子5min,使其充分反应,然后加入2mL HCl (1:1),并立即用0.1mol·L-1Na2S2O3标准溶液滴定至颜色变为浅黄色。再加2mL淀粉溶液,继续用0.1mol·L-1Na2S2O3标准溶液滴定至蓝色刚好褪去即为终点。根据Na2S2O3标准溶液的用量和碘标准溶液的用量,计算NaHSO3溶液的浓度。平行测定三次。 5、白酒中醛含量的测定 用移液管移取25.00mL白酒于250mL碘量瓶中,加15mL去离子水,再用移液管移取10.00mL亚硫酸氢钠溶液,混匀,于暗处放置30分钟其间时常摇动。取出,加入25.00mL0.05 mol\L碘标准溶液溶液,摇匀,即用
乙醛氧化制醋酸总结
1.乙醛氧化制醋酸DCS图第一氧化塔温度怎么控制? 开大、关小换热器E102入口调节阀V20来控制第一氧化塔温度。 2. 一辈子活得就是这一颗人心! 但是善良,要有个度,因为总有人利用你的善良伤害你。 人善,人欺,天不欺;人好,心好,有好报 为人行善,你把善良给对了人,别人就会对你感恩; 为人行善,你把善良给错了人,那么别人就会让你寒心。 真心待人,你把心软给对了人,别人会感谢你情深意重; 真心待人,你把心软给错了人,那就会让你痛心疾首。 心软做人,你把宽容给对了人,别人会对你热忱款待; 心软做人,你把宽容给错了人,别人就会让你窝心难受。 人善,人欺,天不欺;人好,心好,有好报 你做人谦让可以,但要看情况, 如果遇到善解人意的人,那么就会各退一步; 如果遇到得寸进尺的人,那么就会更近一步。 你待人善良可以,但要看什么样的人, 如果遇到有良心的人,他就会知恩图报;
如果遇到没良心的人,他就会卸磨杀驴。 人善,人欺,天不欺;人好,心好,有好报 现实这么的残酷,别想拿什么装无辜。 改变不了的事就别太在意,太在意只会让自己更伤心, 留不住的人就试着学会放弃,强行留下,也是留下人,却留不住心,受了伤的心就尽力自愈,没有人会替你治疗, 活在世上,除了生死,都是小事,别为难自己。 04、淑女就是未进化的比卡丘。绅士就是披着羊毛的狼。 想在朋友圈文雅地爆粗,这些句子最适合不过了 05、世界上的脑残这么多,可是你却成了其中的佼佼者。 06、谢你抢了我对象,让我知道他是人模狗样。 07、生下来的人没有怕死的,怕死的都没生下来,所以谁都别装横! 08、我的心就算是驴肝肺,也足以喂饱一条狗的胃了。 想在朋友圈文雅地爆粗,这些句子最适合不过了 09、勃起不是万能的,但不能勃起却是万万都不能的! 10、过去一直喜欢她的胸怀宽广,其实那也无非是一片飞机场! 11、长得真有创意,活得真有勇气! 12、大哥,把你脸上的分辨率调低点好吗? 想在朋友圈文雅地爆粗,这些句子最适合不过了 13、谁骂我傻B我跟谁好,我就喜欢和2B交朋友。 14、你若废我现在,我必废你将来。 15、承诺,就像放屁,当时惊天动地,过后苍白无力。
实验二、醋酸解离常数的测定
醋酸解离常数的测定 目的要求 (1)了解对消法测电动势的基本原理,熟悉EM-3C 电子电位差计的使用方法; (2)学习电极及盐桥的使用方法,学会电池的装配方法; (3)掌握可逆电池电动势测定的应用。 基本原理 利用各种氢离子指示电极与参比电极组成电池,即可从测得的电池电动势算出溶液的pH 值,常用指示电极有:氢电极、醌氢醌电极和玻璃电极。今讨论醌氢醌(Q·H 2Q)电极。Q·H 2Q 为醌(Q)与氢醌(H 2Q)的等分子化合物,在水溶液中部分分解。 (Q·H 2Q) (Q) (H 2Q) 醌氢醌在水中溶解度很小。将待测pH 溶液用Q·H 2Q 饱和后,再插入一只光亮Pt 电极就构成了Q·H 2Q 电极,可用它构成如下电池: Hg(l)|Hg 2Cl 2(s)|饱和KCl 溶液‖由Q·H 2Q 饱和的待测pH 溶液(H +)|Pt(s) Q·H 2Q 电极反应为: Q +2H ++2e – →H 2Q 因为在稀溶液中+ +H H a c =,所以: ????=- 2 2 Q H Q Q H Q 2.303pH RT F
2 可见,Q·H 2Q 电极的作用相当于一个氢电极,电池的电动势为: 2 Q H Q 2.303pH RT E F ????+-?=-=- -饱和甘汞 2 Q H Q pH () 2.303F E RT ???=--? 饱和甘汞 (1) 其中2Q H Q ??=0.6994 – 7.4 × 10–4 (t – 25),?饱和甘汞=0.2412 – 6.6l×10–4 (t –25) – 1.75×10–6 (t –25)2。 在HAc 和NaAc 组成的缓冲溶液中,由于同离子效应,当达到解离平衡时, HAc 0, HAc c c ≈, 0, NaAc Ac c c -≈。根据酸性缓冲溶液pH 的计算公式为 0, HAc HAc a a 0, NaAc Ac pH pK (HAc)lg pK (HAc)lg c c c c -=-=- 对于由相同浓度HAc 和NaAc 组成的缓冲溶液,则有 a pH pK (HAc)= 本实验中,量取两份相同体积、相同浓度的HAc 溶液,在其中一份中滴加NaOH 溶液至恰好中和(以酚酞为指示剂),然后加入另一份HAc 溶液,即得到等浓度的HAc-NaAc 缓冲溶液,测其pH 即可得到a pK (HAc)及a K (HAc)。 一、仪器 EM-3C 电子电位差计1套;Pt 电极1支;饱和甘汞电极1只;烧杯;移液管。 二、试剂 盐桥;KCl 饱和溶液;醌氢醌(固体);未知浓度醋酸溶液;氢氧化钠溶液0.1mol·L –1;2g/L 酚酞乙醇溶液。 三、实验步骤
VDA275-LCDAD方法测定汽车内甲醛 乙醛 丙烯醛 丙酮的含量
VDA275-LCDAD方法测定汽车内甲醛乙醛丙烯醛丙酮的含量 参考:VDA275 汽车内甲醛测定 EN 322 –木板的含水率测定,1993年 ISO/ TS 17226,皮革化学测试-甲醛含量的测定 1. 目的和应用 该方法用于车内甲醛,乙醛,丙烯醛,丙酮释放量的测定。该方法可用于对零部件进行生产时的核查。一定程度上可被用于材料开发和进行收样时的控制。 2. 原理 测试中,取一定质量和尺寸的样品放入盛有蒸馏水的1升封闭的玻璃瓶内,在某一固定温度提取一定的时间。待提取完毕并冷却后,被溶解的甲醛,乙醛,丙烯醛,丙酮用2.4 -二硝基苯肼(DNPH)衍生,反应后的DNPH衍生物用液相色谱(LC)分离和紫外(UV)或二极管阵列检测器(DAD)进行检测。其结果用(mg/kg)表示。 The reaction can be expressed by the following formula: 该反应可用下列公式表达: 3.试剂和标准溶液
3.1 2.4 -二硝基苯肼(DNPH),分析纯 3.2 乙腈,HPLC级 3.3 高氯酸,GR级 3.4 去离子水 3.5 DNPH溶液,称0.600±0.01克的DNPH,用乙腈溶解,转移到100毫升棕色容量瓶中,加0.2毫升高氯酸,并用乙腈定容。 3.6 Standard substances 标准品 3.7 标准储备液和中间液的配制 3.7.1 1000mg/L甲醛、丙酮标准储备溶液的配制 对于甲醛,将甲醛标准品溶液用一定量的水稀释,浓度为1000mg/L,冰箱中可保存3个月。 对于丙酮,称取重量0.0500 g标准品,用水溶解并稀释到50 mL,冰箱中该溶液可保存3个月。 3.7.2 100mg/L 甲醛,乙醛,丙烯醛,丙酮混合中间溶液的配制: 分别吸取1mL 4种2种标准储备液(1000mg/L, 3.7.1)和1000mg/L
必修2第三章第3节乙醇乙酸知识点汇总
第3节 生活中两种常见的有机物 知识点二 乙醇 一、 乙醇的物理性质:乙醇俗称酒精,是无色透明,有特殊香味,易挥发的液体,密度比水小,工业酒精含乙醇约95%。含乙醇达99.5%以上的酒精称无水乙醇。75%乙醇是优良的有机溶剂。 注意:1.乙醇密度小于水,但二者混合时并不分层,原因是乙醇和水互溶所以不能用于除萃取溴水中的溴单质。2.固体酒精并不是固态酒精,而是饱和醋酸钙溶液与酒精混合形成的凝胶。 二、 乙醇的分子组成和结构 乙醇的分子式为C2H6O ,结构式为 结构简式为CH3CH2OH 或C2H5OH 比例模型 三、 乙醇的化学性质 (一)乙醇的取代反应 1.乙醇与活泼金属的反应 2CH 3CH 2OH +2Na →2CH 3CH 2ONa +H 2↑ 金属钠的变化 气体燃烧现象 检验产物 水 钠浮在水面上,熔成闪亮小球,并四处游动,发出“嘶嘶”的响声,钠球迅速变小,最后消失 气体在空气中燃烧,发出淡蓝色火焰 向反应后的溶液中滴加酚酞,溶液变红,说明有碱性 物质生成 乙醇 钠沉于无水酒精底部,不熔成闪亮小球,也不发出响声,反应缓慢 气体在空气中安静地燃烧,火焰呈淡蓝色,倒扣在火焰上方的干燥烧杯壁有水滴 向反应后的溶液中滴加酚酞,溶液变红,说明有碱性物质生成;向烧杯中加入澄清石灰水无明显现象,证明 无二氧化碳生成 结论: ①水与钠反应比乙醇与钠反应剧烈,密度:水>钠>乙醇,乙醇钠显碱性CH 3CH 2ONa (aq )水解显碱性。 CH 3CH 2ONa +H —OH CH 3CH 2OH +NaOH ②本反应是取代反应,也是置换反应.羟基上的氢原子被置换。 ③乙醇与金属钠的反应比水与金属钠的反应平缓得多,说明羟基中的氢原子不如水分子中的氢原子活泼。 2HO —H +2Na 2NaOH +H 2↑ ④其他活泼金属也能与CH3CH2OH 反应,如 C —C —O —H H H H H H
乙醛氧化制醋酸氧化工段
乙醛氧化制醋酸工艺——氧化工段 目录 第一章概述 (2) 第二章生产方法及工艺路线 (3) 2.1生产方法及反应机理 (3) 2.2工艺流程简述 (4) 2.2.1 装置流程简述 (4) 2.2.2 氧化系统流程简述 (5) 第三章工艺技术指标 (6) 3.1控制指标 (6) 3.2分析项目 (7) 第四章岗位操作法 (7) 4.1冷态开车/装置开工 (7) 4.1.1 开工应具备的条件 (7) 4.1.2 引公用工程 (8) 4.1.3 N2吹扫、置换气密 (8) 4.1.4 系统水运试车 (8) 4.1.5 酸洗反应系统 (8) 4.1.6 全系统大循环和精馏系统闭路循环 (8) 4.1.7 第一氧化塔配制氧化液 (9) 4.1.8 第一氧化塔投氧开车 (9) 4.1.9 第二氧化塔投氧 (11) 4.1.10 吸收塔投用 (11) 4.1.11氧化塔出料 (11) 4.2正常停车 (12) 4.2.1 氧化系统停车 (12) 4.3紧急停车 (12) 4.3.1 事故停车 (12) 4.3.2 紧急停车 (12) 4.4岗位操作法 (14) 4.4.1 第一氧化塔 (14) 4.4.2 第二氧化塔(T102) (15) 4.4.3 洗涤液罐 (15) 4.5联锁停车 (15)
第一章 概述 乙酸又名醋酸,英文名称为acetic acid ,是具有刺激气味的无色透明液体,无水乙酸在低温时凝固成冰状,俗称冰醋酸。在16.7℃以下时,纯乙酸呈无色结晶,其沸点是118℃。乙酸蒸气刺激呼吸道及粘膜(特别是对眼睛的粘膜),浓乙酸可灼烧皮肤。乙酸是重要的有机酸之一。其结构式是: 乙酸是稳定的化合物;但在一定的条件下,能引起一系列的化学反应。如:在强酸(H 2SO 4或HCl )存在下,乙酸与醇共热,发生酯化反应: 乙酸是许多有机物的良好溶剂,能与水、醇、酯和氯仿等溶剂以任意比例相混合。乙酸除用作溶剂外,还有广泛的用途,在化学工业中占有重要的位置,其用途遍及醋酸乙烯、醋酸纤维素、醋酸酯类等多种领域。乙酸是重要的化工原料,可制备多种乙酸衍生物如乙酸酐、氯乙酸、乙酸纤维素等,适用于生产对苯二甲酸、纺织印染、发酵制氨基酸,也作为杀菌剂。在食品工业中,乙酸作为防腐剂;在有机化工中,乙酸裂解可制得乙酸酐,而乙酸酐是制取乙酸纤维的原料。另外,由乙酸制得聚酯类,可作为油漆的溶剂和增塑剂;某些酯类可作为进一步合成的原料。在制药工业中,乙酸是制取阿司匹林的原料。利用乙酸的酸性,可作为天然橡胶制造工业中的胶乳凝胶济,照相的显像停止剂等。 乙酸的生产具有悠久的历史,早期乙酸是由植物原料加工而获得或者通过乙醇发酵的方法制得,也有通过木材干馏而获得的。目前,国内外已经开发出了乙酸的多种合成工艺,包括烷烃、烯烃及其酯类的氧化,其中应用最广的是乙醛氧化法制备乙酸。下面主要介绍乙醛氧化法制备乙酸。 C H 3OH O
醋酸解离常数的测定缓冲溶液法
醋酸解离常数的测定(缓冲溶液法) 实验目的 1. 利用测缓冲溶液pH 的方法测定弱酸的pKa 。 2. 学习移液管、容量瓶的使用方法,并练习配制溶液。 实验原理 在HAc 和NaAc 组成的缓冲溶液中,由于同离子效应,当达到解离平衡时, ()()0c HAc c HAc ≈,()()0c Ac c NaAc -≈。酸性缓冲溶液pH 的计算公式为 ()() ()c HAc pH pKa HAc lg c Ac θ-=-()()()00c HAc pKa HAc lg c NaAc θ =- 对于由相同浓度HAc 和NaAc 组成的缓冲溶液,则有 ()pH pKa HAc θ= 本实验中,量取两份相同体积、相同浓度的HAc 溶液,在其中一份中滴加NaOH 溶液至溶液呈粉红色后,然后混合,即得到等浓度的HAc-NaAc 缓冲溶液,测其pH 即可得到()pKa HAc θ及()Ka HAc θ。 仪器、药品及材料 仪器:pHs-2C 型酸度计,容量瓶(50ml )3个(编号为1,2,3号),烧杯(50ml 编号为1,2,3,4,5号)5个,移液管(25ml )1支,吸量管(10ml )1支,洗耳球1个。 药品:HAc (0.10 mol ·L -1),NaOH (0.10 mol ·L -1),酚酞。 材料:碎滤纸。 实验步骤 1.用酸度计测定等浓度的HAc 和NaAc 混合溶液的pH (1)配制不同浓度的HAc 溶液 实验室备有标以编号的小烧杯和容量瓶。用4号烧杯盛已知浓度的HAc 溶液。用10ml 吸量管从烧杯中吸取5.00ml 、10.00ml 0.10 mol ·L -1 HAc 溶液分别放入1号、2号容量瓶中,用25ml 移液管从烧杯中吸取25.00ml 0.10 mol ·L -1 HAc 溶液放入3号容量瓶中,分别加入去离子水至刻度,摇匀。 (2)制备等浓度的HAc 和NaAc 混合溶液
醋酸-氧化装置操作规程(乙醛氧化制醋酸仿真软件)
乙醛氧化制醋酸仿真软件——氧化工段 北京东方仿真控制技术有限公司 仿真教学事业部
第一章概述 大庆醋酸装置是大庆三十万吨乙烯一期工程的组成部分。此装置是依靠国内技术力量,参考上海石油化工总厂的实际生产情况,由上海医药设计院设计。 大庆醋酸装置是西德引进乙醛装置的配套工程,起始原料为乙烯,乙烯氧化生成乙醛,再由乙醛为原料氧化生成醋酸。 醋酸装置设计年生产能力为成品醋酸7万吨/年。同时生产副产品混酸700吨/年,醋酸甲酯650吨/年。1997年10月改扩建,年生产能力为10万吨。
第二章生产方法及工艺路线 一生产方法及反应机理。 乙醛首先氧化成过氧醋酸,而过氧醋酸很不稳定,在醋酸锰的催化下发生分解,同时使另一分子的乙醛氧化,生成二分子乙酸。氧化反应是放热反应。 CH3CHO+O2→CH3COOOH CH3COOOH+CH3CHO→2CH3COOH 在氧化塔内,还有一系列的氧化反应。 乙醛氧化制醋酸的反应机理一般认为可以用自由基的链接反应机理来进行解释,常温下乙醛就可以自动地以很慢的速度吸收空气中的氧而被氧化生成过氧醋酸:过氧醋酸以很慢的速度分解生成自由基。 自由基引发一系列的反应生成醋酸。但过氧醋酸是一个极不安定的化合物,积累到一定程度就会分解而引起爆炸。因此,该反应必须在催化剂存在下才能顺利进行。催化剂的作用是将乙醛氧化时生成的过氧醋酸及时分解成醋酸,而防止过氧醋酸的积累、分解和爆炸。 二工艺流程简述。 1、装置流程简述 本装置反应系统采用双塔串联氧化流程,乙醛和氧气首先在全返混型的反应器——第一氧化塔T-101中反应(催化剂溶液直接进入T-101内)然后到第二氧化塔T-102中再加氧气进一步反应,不再加催化剂。一塔反应热由外冷却器移走,二塔反应热由内冷却器移除,反应系统生成的粗醋酸进入蒸馏回收系统,制取成品醋酸。 蒸馏采用先脱高沸物,后脱低沸物的流程。 粗醋酸经氧化液蒸发器E-201脱除催化剂,在脱高沸塔T-201中脱除高沸物,然后在脱低沸塔T-202中脱除低沸物,再经过成品蒸发器E-206脱除铁等金属离子,得到产品醋酸。 从低沸塔T-202顶出来的低沸物去脱水塔T-203回收醋酸,含量99%的醋酸又返回精馏系统,塔T-203中部抽出副产物混酸,T-203塔顶出料去甲酯塔T-204。甲酯塔塔顶产出甲酯,塔釜排出废水去中和池处理。 2、氧化系统流程简述 乙醛和氧气按配比流量进入第一氧化塔(T-101),氧气分两个入口入塔,上口和下口通氧量比约为1:2,氮气通入塔顶气相部分,以稀释气相中氧和乙醛。 乙醛与催化剂全部进入第一氧化塔,第二氧化塔不再补充。氧化反应的反应热由氧化液冷却器(E-102)移去,氧化液从塔下部用循环泵(P-101)抽出,经过冷却器(E-102)循环回塔中,循环比(循环量:出料量)约110~120。冷却器出口氧化液温度为60℃,塔中最高温度为75~78℃,塔顶气相压力0.2Mpa(表),出第一氧化塔的氧化液中醋酸浓度在92~94×10-2,从塔上部溢流去第二氧化塔(T-102)。 第二氧化塔为内冷式,塔底部补充氧气,塔顶也加入保安氮气,塔顶压力0.1Mpa(表),塔中最高温度约85℃,出第二氧化塔的氧化液中醋酸含量为97~98×10-2。 第一氧化塔和第二氧化塔的液位显示设在塔上部,显示塔上部的部分液位。 出氧化塔的氧化液一般直接去蒸馏系统,也可以放到氧化液中间贮罐(V-102)暂存。中间贮罐的作用是:正常操作情况下做氧化液缓冲罐,停车或事故时存氧化液,醋酸成品不合格需要重新蒸馏时,由成品泵(P-402)送来中间贮存,然后用泵(P-102)送蒸馏系统回炼。
1。醋酸解离常数的测定
实验一 醋酸解离常数的测定 一、实验目的 1.了解弱酸溶液pH 值测定原理、方法及解离常数的计算。 2.掌握pH 计的正确操作和使用。 二、实验原理 1.溶液的解离度 醋酸CH 3COOH 即HAc ,在水溶液中,存在下列解离平衡: HAc( aq ) + H 2O( l ) H 3O + (aq) + Ac - ( aq ) (1-1) 或简写为 HAc( aq ) H + ( aq ) + Ac -( aq ) 如果HAc 的起始浓度为c ,当达到解离平衡时 c eq (H +) = c eq (Ac -) (1-3) 其解离度 c c c c eq eq ) (Ac )(H -+== α (1-4) 其解离常数 }} { {()} { θ θ θc c c c c c eq eq eq HAc )(Ac )(H ) HAc Ka(-+= (1-5) 式中c θ为标准浓度,其值为1mol·dm -3。将( 1-3 )式代入( 1-5 ),得 ()()θ ααc c c c 2 -= ) HAc Ka( (1-6) 简化后得 () αα-=1c 2 ) HAc Ka( (1-7) 当解离度α< 5% 时,1-α≈1,对于一般的弱酸来说 K a ≈ cα2 (1-8) 则,解离度 c a K ≈ α (1-9)
K a 与α都可用来表示酸的强弱,但α随浓度c 而变。在一定温度时,K a 不随c 而变,是一个常数。 2.测量原理 pH 玻璃电极是一种应用广泛的离子选择性电极。将玻璃电极(作为指示电极)与饱和甘汞电极(作为参比电极)或由二者制成的复合电极(图1-1)插入溶液,组成测量电池(图1-2)。 该电池的电动势与溶液的pH x 值在25℃时存在下列关系, E x = K′+ 0.0592pH x (1-10) 在实际测量时,一般是用已知pH s 值的标准缓冲溶液对仪器进行定位校正: 图1-1pH 电极示意图 玻璃电极 电极帽 导线 玻璃电极 塑亮 插棒 球泡 参比电极(甘汞电极) 复合电极 电极帽 导线 参比电极 塑亮 插口 液接界 电极帽 导线 玻璃电极 参比电极 保护套 球泡 保护套 插口
高考化学知识点过关培优训练∶乙醇与乙酸附详细答案
高考化学知识点过关培优训练∶乙醇与乙酸附详细答案 一、乙醇与乙酸练习题(含详细答案解析) 1.“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室制取乙酸乙酯。回答下列问题: (1)浓硫酸的作用是:________________________。 (2)饱和碳酸钠溶液的主要作用是__________________________________________。 (3)通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是_____。 (4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是_________________。 (5)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是_______。 (6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)________。 ①单位时间里,生成1mol乙酸乙酯,同时生成1mol水 ②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸 ③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸 ④正反应的速率与逆反应的速率相等 ⑤混合物中各物质的浓度不再变化 【答案】催化作用和吸水作用吸收随乙酸乙酯蒸出的乙酸和乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到防止倒吸分液防止暴沸②④⑤ 【解析】 【分析】 (1)浓硫酸具有脱水性、吸水性及强氧化性; (2)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;(3)挥发出来的乙酸和乙醇易溶于饱和碳酸钠溶液,导管伸入液面下可能发生倒吸;(4)乙酸乙酯不溶于水; (5)根据可逆反应平衡状态标志的判断依据进行分析。 【详解】 (1)乙酸与乙醇在浓硫酸作催化剂加热条件下生成乙酸乙酯,由于反应为可逆反应,同时浓硫酸吸水有利于平衡向生成乙酸乙酯的方向移动, 故答案为:催化作用和吸水作用; (2)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,主要是利用了乙酸乙酯难溶于饱和碳酸钠,乙醇与水混溶,乙酸能被碳酸钠吸收,易于除去杂质, 故答案为:吸收随乙酸乙酯蒸出的乙酸和乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到; (3)导管若插入溶液中,反应过程中可能发生倒吸现象,所以导管要插在饱和碳酸钠溶液的液面上,目的是防止倒吸,故答案为:防止倒吸; (4)乙酸乙酯不溶于水,则要把制得的乙酸乙酯分离出来,应采用的实验操作是分液,故答案为:分液; (5)①单位时间内生成1mol乙酸乙酯,同时生成1mol水,都表示正反应速率,不能说
乙醛氧化制醋酸
1.1概述 乙酸在常温下是一种有强烈刺激性酸味的无色液体。乙酸的熔点16.6℃(289.6 K )。沸点117.9℃(391.2 K )。相对密度1.05,闪点39℃,爆炸极限4%~17%(体积)。纯的乙酸在低于熔点时会冻结成冰状晶体,所以无水乙酸又称为冰醋酸。乙酸易溶于水和乙醇,其水溶液呈弱酸性。乙酸盐也易溶于水。乙酸是重要的有机酸之一。其结构式是: 乙酸是稳定的化合物;但在一定的条件下,能引起一系列的化学反应。如:在强酸(H 2SO 4或HCl )存在下,乙酸与醇共热,发生酯化反应: 乙酸的生产具有悠久的历史,早期乙酸是由植物原料加工而获得或者通过乙醇发酵的方法制得,也有通过木材干馏而获得的。目前,国内外已经开发出了乙酸的多种合成工艺,包括烷烃、烯烃及其酯类的氧化,其中应用最广的是乙醛氧化法制备乙酸。下面主要介绍乙醛氧化法制备乙酸。 1.2生产方法及反应机理 乙醛首先与空气或氧气氧化成过氧醋酸,而过氧醋酸很不稳定,在醋酸锰的催化下发生分解,同时使另一分子的乙醛氧化,生成二分子乙酸。氧化反应是放热反应。 CH 3CHO+O 2→CH 3COOOH CH 3COOOH+CH 3CHO→2CH 3COOH 总的化学反应方程式为: CH 3CHO + 1/2O 2 → CH 3COOH + 292.0kj/mol 在氧化塔内,还有一系列的氧化反应,主要副产物有甲酸、甲酯、二氧化碳、水、醋酸甲酯等。 CH 3COO OH→CH 3OH+CO 2 CH 3OH+CO 2→HCO OH+ H 2O CH 3COOOH+ CH 3COO H→CH 3COOCH 3+ CO 2+ H 2O CH 3OH+ CH 3COO H→+ H 2O CH 3OH→CH 4+CO CH 3CH 2OH+ CH 3COO H→CH 3COOC 2H 5 + H 2O CH 3CH 2OH+ HCOO H→HCO OC 2H 5 + H 2O 3CH 3CHO+3O 2→HCO OH+ 2CH 3COOH+ CO 2+ H 2O 4CH 3CHO+5O 2→4CO 2+ 4H 2O 3CH 3CHO+2O 2→CH 3CH (OCOCH 3) 2+ H 2O C H 3C OH O
乙醛氧化制醋酸的基本原理
乙醛氧化制醋酸基本原理 一、反应方程式: 乙醛首先氧化成过氧醋酸,而过氧醋酸很不稳定,在醋酸锰的催化下发生分解,同时使另一分子的乙醛氧化,生成二分子醋酸。氧化反应是放热反应。 CH3CHO+O2 CH3COOOH (1)CH3COOOH+CH3CHO 2CH3COOH (2)在氧化塔内,还进行下列副反应: CH3COOOH CH3OH+CO2(3)CH3OH+O2 HCOOH+H2O (4)CH3COOOH+ CH3COOH CH3COOCH3+CO2+H2O (5)CH3OH+ CH3COOH CH3COOCH3+H2O (6) CH3CHO CH4+CO (7) CH3CH2OH+ CH3COOH CH3COOC2H5+H2O (8) CH3CH2OH+ HCOOH HCOOC2H5+H2 (9) 3CH3CHO+3O2 HCOOH+ CH3COOH+CO2+H2O (10) 2CH3CHO+5O2 4CO2+4H2O (11) 3CH3CHO+O2 CH3CH(OCOCH3)2+H2O (12) 2CH3COOH CH3COCH3+CO2+H2O (13) CH3COOH CH4+CO2 (14) 乙醛氧化制醋酸的反应机理一般认为可以用自由基的连锁反应机理来进行解释。常温下乙醛就可以自动地以很慢的速度吸收空气中
的氧而被氧化生成过氧醋酸。 二、反应条件对化学反应的影响: 1、物系相态: 氧化过程可以在气相中进行,也可以在也相中进行。 在气相状态下,乙醛和氧气或空气相混合,氧化反应极易进行,而不必使用催化剂。但是由于空气密度小、热容小、导热系数小,乙醛氧化反应放出的大量热量极难排出,系统温度难以控制,造成恶性爆炸事故。因而气相氧化过程没有得到实际应用。 工业上实际使用的液相过程,向装有乙醛的醋酸溶液的氧化塔中通入氧气或空气,氧气首先扩散到液相,再被乙醛所吸收,借催化剂的作用使乙醛氧化为醋酸。由于液体的密度较大,热容量也大,传热速率高,热量很容易通过冷却管由工业水带走,不易产生局部过热,反应温度能有效地加以控制,确保安全生产。 2、催化剂: 采用催化剂能使反应过程显著加速,特别是能加速过氧醋酸的分解。这样可以避免过氧醋酸的积聚,消除爆炸性危险。变价金属盐,如铁、钴、锰、镍、铜、铬的盐类均可作催化剂。 工业中常用醋酸锰作为乙醛氧化制醋酸的催化剂。同时,国内对锰、钴、镍复合催化剂也进行了一定的研究工作。 另外一些重金属盐是负催化剂,它们的存在使反应速度减慢,比没有催化剂存在时还要慢。按其反应速度的影响顺序排列如下:
