中药制剂提取车间批生产记录模版精编版

磷酸肌酸钠原料药批生产记录知识讲解
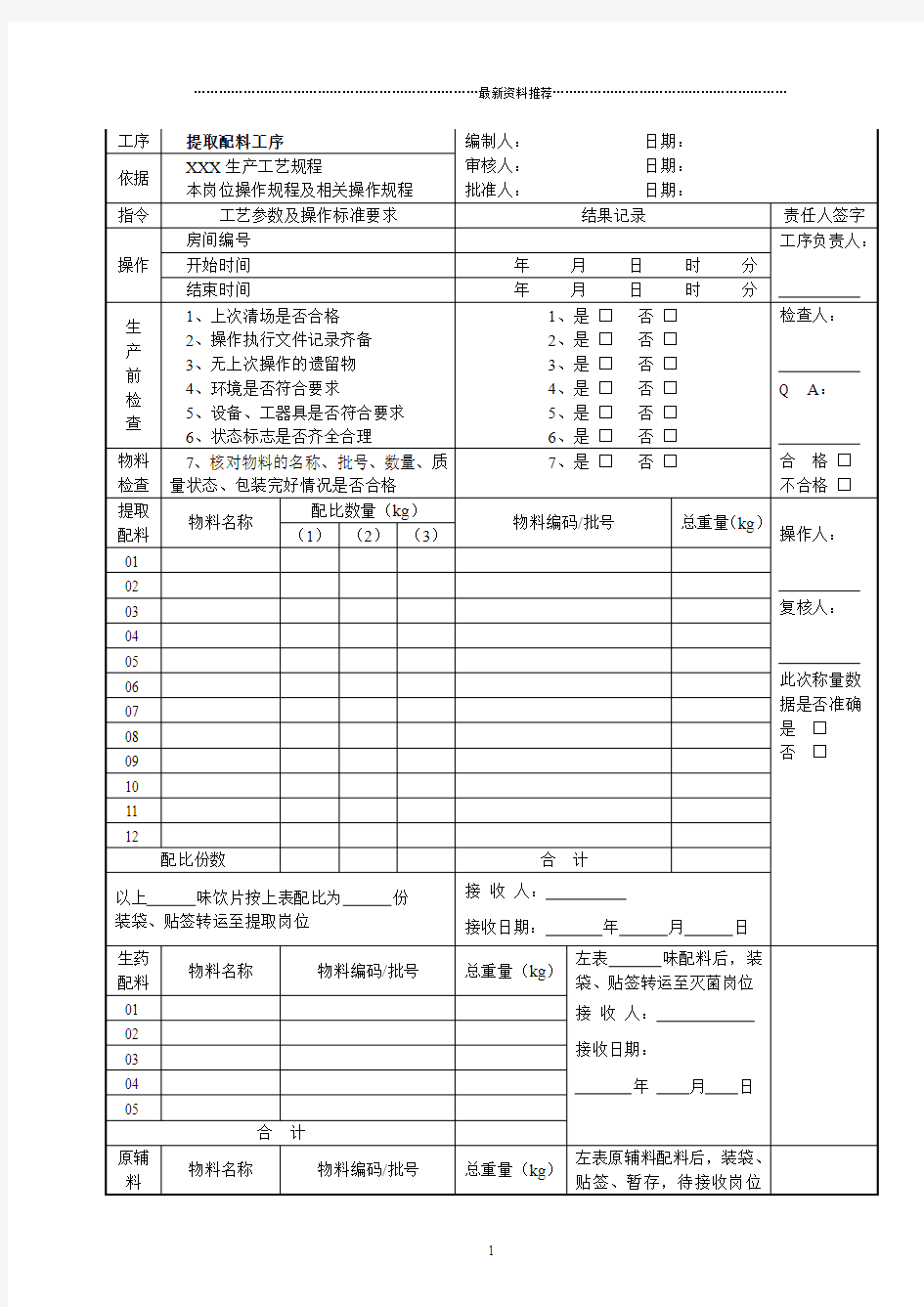
磷酸肌酸钠原料药批 生产记录
兔肉处理岗位生产指令单 格式号:YL·G02-07-006-01-LJ-01 生产指令指令日期指令号 生产日期生产批号 投料量兔肉 kg 指令者复核者接受者 本岗位本批生产小结兔肉收率>25% 兔肉合格品 kg ×100%= % 领用兔肉 kg 岗位负责人: 年月日 工艺员评价1.本批生产过程无偏离规程作业。□ 2.本批生产过程中工艺卫生符合要求。□ 3.本批清场符合要求。□ 4.本批生产记录清晰、完整。□ 工艺员: 年月日
兔肉处理岗位操作记录 格式号:YL·Z02-02-107-01 生产批号 生产日期年月日时分—时分 操作指令及工艺参数实际操作记录 按《兔肉处理岗位标准操作规程》[YL·Z02-02-107]进行操 作。 1生产前检查 上批清场合格证 清洁状态标识 设备运行状态标识 公用系统 2挂状态标识 3根据生产指令领取所需原辅料 4操作过程 4.1将领用兔肉用纯化水洗两遍,洗净血垢后,再用注射用水冲洗一遍,将水控干,用手术刀片将兔肉剔下,再用不锈钢菜刀切成1cm左右的小块,装入保鲜袋中冻存,标明品名、批号、数量和生产日期。 4.2及时填写操作记录及物料结存台帐。 4.3操作前用纯化水清洗工具和双手。 5清场 5.1本批生产文件及状态标识及时清除。 5.2容器具已清洁。 5.3清洁墙面、门窗、地面。 5.4清除废弃物。 5.5清洁废物桶。有□无□ 已清洁□待清洁□ 备用□其它□ 正常□异常□ 已挂状态标识□ 领用兔肉 kg 非用肉组织 kg 不合格 kg 兔肉合格品 kg 兔肉收率 % 时间:时分至时分 已清除□未清除□ 已清洁□未清洁□ 已清洁□未清洁□ 已清除□未清除□ 已清洁□未清洁□ 检查情况:合格□不合格□检查人: 操作者:复核者:
中药制剂生产
中药制剂生产基础知识 第一章片剂 第一节概述 一、中药片剂的含义 中药片剂系指药材提取物、药材提取物加药材细粉或药材细粉与适宜辅料混合匀压制 而成的圆片状或异型片状的制剂。主要供内服,亦有外用。 片剂问世于 10 世纪后叶,而中药片剂创用于 20 世纪 50 年代。近些年来,由于新技术、新工艺、新设备、新辅料的应用,中药片剂的剂型理论、生产技术日臻完善,中药片剂的品种不断增加,质量迅速提高,已发展成为目前临床应用最广泛的广泛的剂型之一。 二、中药片剂的特点 主要优点:①剂量准确,因病人近片服用,而片内药物均匀、含量差异小;②质量稳定,因系固体剂型,且某些易氧化变质或潮解的药物,可借助包衣或包合作用加以保护,水分、光线、空气对其影响较小;③生产机械化、自动化程度高、产量大、成本低,药剂卫生易达标;④服用、携带、贮藏等较文便;⑤品种丰富能满足医疗、预防用药的不同需求。 缺点在于:①制备或贮藏不当会影响片剂崩解、吸收;②某些中药片剂易引湿受潮;含挥发性成分的片剂,久贮时其成分含量下降;③片剂中药物的溶出度和生物利用度较胶囊剂、散剂稍差;④儿童和昏迷病人不易吞服。 三、片剂的分类按给药途径结合制法与作用,片剂可分为以下几类: (一)内服片 系供口服,在胃肠道崩解、吸收而发挥局部或全身疗效的片剂。 1.普通压制片(素片)系指药物与辅料混合后,经加工压制而成的片剂。一般不包衣的片剂多属此类,如安胃片、葛根芩连片。 2.包衣片系指在压片(常称片心)外包衣膜的片剂。如三七伤药片、盐酸黄连素片。 3.咀嚼片指在口中嚼碎后咽下的片剂,多用于维生素类及治疗胃部疾患的药物。如酵母片、乐得胃片。 4.分散片系指遇水能迅速崩解形成具较大粘性的均匀的混悬性水分散体的片剂。这种片剂一般由药物和崩解剂及溶胀辅料组成。可吞服,也可放入水中迅速分散后口服,还可咀嚼或含吮。如复方阿司区林分散片。
生产记录表格
生产记录表格 不符合项分布表.doc 事故隐患整改通知书.doc 伤亡人员登记卡.doc 作业时间研究记录单.doc 作业标准汇总表.doc 全民(或非全民)职工伤亡事故原因分析.doc 内部审核检查表.doc 劳动防护用品发放卡片.doc 安全员每日巡检记录.doc 安全技术交底记录.doc 安全生产会议纪录.doc 工伤复工人员安全教育登记表.doc 工作量汇总表(一).doc 工程项目安全技术措施费使用记录.doc 应急预案演练记录.doc 放射性同位素出入库单.doc 文明施工检查记录.doc 新职工三级安全安全教育卡.doc 施工现场安全检查表.doc 施工班组每日安全活动记录.doc 时间研究记录表.doc 特种作业人员登记表.doc 生产产品状况记录表.doc 生产用料记录单.doc 生产记录表格-设备事故台帐.doc 生产记录表格-设备事故报表.doc 生产记录表格-设备检查记录.doc 生产记录表格不符合报告.doc 生产记录表格交通事故报表.doc 生产记录表格产品尺寸表.doc 生产记录表格体检日期.doc 生产记录表格噪声检测记录.doc 生产记录表格图面记录表.doc 生产记录表格处罚通知书.doc 生产记录表格材料-HSE会议签到表.doc 生产记录表格材料-领用记录单.doc 生产记录表格环境检测记录.doc 生产记录表格设备分布台帐.doc 生产记录表格设备运转记录.doc 考核作业人员记录表.doc 设备修理验收单.doc 设备维修(保养)纪录.doc
违章人员教育登记表.doc 部门机器运转日记.doc
安全技术交底记录 注:本表一式三份,交底人、被交底人、安全部门各一份。
中药制剂生产厂房设施规范
中药制剂生产厂房设施规范 第八条中药材和中药饮片的取样、筛选、称重、粉碎、混合等操作易产生粉尘的,应当采取有效措施,以控制粉尘扩散,避免污染和交叉污染,如安装捕尘设备、排风设施或设置专用厂房(操作间)等。 ?检查时需注意: —是否采取有效措施控制处理过程粉尘扩散;排风设施是否经过适当过滤后排放。 —是否采取有效措施对筛选后药材进行区分。—检查捕尘设备是否经过必要的清洁,避免交叉污染。 第九条中药材前处理的厂房内应当设拣选工作台,工作台表面应当平整、易清洁,不产生脱落物。 ?检查时需注意: —拣选工作台面积是否与生产规模相适应;避免不同品种、批号药材同时进行拣选。 第十条中药提取、浓缩等厂房应当与其生产工艺要求相适应,有良好的排风、水蒸汽控制及防止污染和交叉污染
等设施。 ?检查时需注意: —涉及有机溶媒提取的,提取、浓缩厂房设计及内部照明设施 是否符合防爆要求。 —提取、浓缩是否设置有效的排风、水蒸汽控制措施,避免操作间墙面发生霉变污染产品。 第十一条中药提取、浓缩、收膏工序宜采用密闭系统进行操作,并在线进行清洁,以防止污染和交叉污染。采用密闭系统生产的,其操作环境可在非洁净区;采用敞口方式生产的,其操作环境应当与其制剂配制操作区的洁净度级别相适应。 ?检查时需注意:—采用密闭系统操作的,应有验证数据证明收膏及储存过程可有效避免外界环境对浸膏的污染; —密闭系统的呼吸器是否经过完整性检测; 是否对密闭系统进行密闭性的验证,是否对密闭系统进行清洁验证,并依照验证结果制 定清洁规程,并遵照执行; 采用敞口方式收膏的,收膏操作间洁净级别是否与制 剂要求的洁净级别一致;如口服类为D级。 第十二条中药提取后的废渣如需暂存、处理时,应当有专用区
英文 原料药批生产记录 模板
BATCH PRODUCTION RECORD The following code has been given to the finished product. Revision level: Reasons for Revision:
INPUT DETAILS
Product Name: Flunixin meglumine Doc No: Batch No: Stage: Ⅰ PRODUCT OUTPUT DETAILS Out put weight/ Output Molecule mass Actual yield ratio calculation: Yield ratio = -------------------------------------------------- Input weight / Input Molecule mass Calculated by Verified by
Product Name: Flunixin meglumine Doc No: Batch No: Stage: Ⅰ Op. No Operation Date Time (hrs) Remarks Done by Checked by From To Duration 01 Make sure that R2201 is clean and dry 02 Charge 98kg of purified water , 53kg of MA , 38.7kg of CA , and 3.67kg of TS into R2201 03 Start agitation and keep for 15~20minutes 04 Heat to reflux and maintain the reflux for 2 hours at 10±5℃ 05 Prepare 36% potassium hydroxide solution by adding 25.2kg of potassium hydroxide and 44.8kg of purified water 06 Add 30.5kg of hydrochloric acid and 9.5kg of purified water to prepare another 23% hydrochloric acid solution 07 Then charge excess 4 kg of purified water to R2201 08 Adjust the reaction mass at pH=9 by dropping 36% potassium hydroxide solution 09 Cool the temperature below 10℃ and recheck whether pH is still at 9~10, if not , add 36% potassium hydroxide further to correct it 10 Make sure that ST2202 is dry and clean 11 Centrifuge the mass from R2201 and wash the wet cake and R2201 with 100kg of purified water (clean the R2201 as per procedure specified in Page No of) 12 Spin dry for 40~50minutes and introduce mother liquid back R2201 Note: Shift in–charge should cross check the S. No:and shall sign in ‘checked by’ column.
中药制剂化车间
中药制剂净化车间:是指根据《药品生产质量管理规范(2010年修订)》的要求,适合中药制剂的生产工艺、工序,而建立的空气洁净度为D级的洁净车间。 中药制剂的质量与中药材和中药饮片的质量、中药材前处理和中药提取工艺密切相关。应当对中药材和中药饮片的质量以及中药材前处理、中药提取工艺严格控制。措施如下: 1.在中药材前处理以及中药提取、贮存和运输过程中,应当采取 措施控制微生物污染,防止变质。 2.中药材前处理的厂房内应当设拣选工作台,工作台表面应当平 整、易清洁,不产生脱落物。中药提取、浓缩等厂房应当与 其生产工艺要求相适应,有良好的排风、水蒸汽控制及防止 污染和交叉污染等设施。 3.中药提取、浓缩、收膏工序宜采用密闭系统进行操作,并在线 进行清洁,以防止污染和交叉污染。采用密闭系统生产的, 其操作环境可在非洁净区;采用敞口方式生产的,其操作环 境应当与其制剂配制操作区的洁净度级别相适应。浸膏的配 料、粉碎、过筛、混合等操作,其洁净度级别应当与其制剂 配制操作区的洁净度级别一致。中药饮片经粉碎、过筛、混 合后直接入药的,上述操作的厂房应当能够密闭,有良好的 通风、除尘等设施,人员、物料进出及生产操作应当参照洁 净区管理。
4.中药注射剂浓配前的精制工序应当至少在D级洁净区内完成。 非创伤面外用中药制剂及其它特殊的中药制剂可在非洁净厂房内生产,但必须进行有效的控制与管理。 空气洁净度是指洁净环境中空气含悬浮粒子量的多少的程度,通常空气中含尘浓度高则空气洁净度低,含尘浓度低则空气洁净度高。就是以每立方米空气中的最大允许粒子数来确定其空气洁净度等级。济南欧凯净化设备公司专业承接各类无菌净化车间,上百个成功的案例使我们积累了丰富的施工和设计经验。可拨0 5 3 1 – 8 2 6 3 1 3 7 5 ,1 3 7 8 9 8 0 6 6 4 5 张经理咨询。 A:车间空气净化原理 净化车间的空气净化方式为物理过滤,一般要经过初效过滤、中效过滤、高效过滤等三个过滤段。 气流→初效净化→加湿段→加热段→表冷段→中效净化→风机送风→管道→高效净化风口→吹入房间→带走尘埃细菌等颗粒→ 回风百叶窗→初效净化重复以上过程,即可达到净化目的。 B、车间结构材料 1).结构部分一般净化厂房墙、顶板材一般多采用50mm厚的夹芯彩钢板制造,其特点为美观、刚性强、保温性能好、 易施工。圆弧墙角、门、窗框等一般采用专用净化专用型 材制造。
CTD格式申报资料(原料药)最新版本
CTD格式申报资料撰写要求(原料药) 一、目录 3.2.S 原料药 3.2.S.1 基本信息 3.2.S.1.1 药品名称 3.2.S.1.2 结构 3.2.S.1.3 理化性质 3.2.S.2 生产信息 3.2.S.2.1 生产商 3.2.S.2.2 生产工艺和过程控制 3.2.S.2.3 物料控制 3.2.S.2.4 关键步骤和中间体的控制 3.2.S.2.5 工艺验证和评价 3.2.S.2.6 生产工艺的开发 3.2.S.3 特性鉴定 3.2.S.3.1 结构和理化性质 3.2.S.3.2 杂质 3.2.S.4 原料药的质量控制 3.2.S. 4.1 质量标准 3.2.S. 4.2 分析方法 3.2.S. 4.3 分析方法的验证 3.2.S. 4.4 批检验报告 3.2.S. 4.5 质量标准制定依据 3.2.S.5 对照品 3.2.S.6 包装材料和容器 3.2.S.7 稳定性 3.2.S.7.1 稳定性总结 3.2.S.7.2 上市后稳定性承诺和稳定性方案 3.2.S.7.3 稳定性数据 二、申报资料正文及撰写要求 3.2.S.1 基本信息 3.2.S.1.1药品名称 提供原料药的中英文通用名、化学名,化学文摘(CAS)号以及其它名称(包括国外药典收载的名称)。 3.2.S.1.2 结构 提供原料药的结构式、分子式、分子量,如有立体结构和多晶型现象应特别说明。 3.2.S.1.3 理化性质 提供原料药的物理和化学性质(一般来源于药典和默克索引等),具体包括如下信息:性状(如外观,颜色,物理状态);熔点或沸点;比旋度,溶解性,溶液pH, 分配系数,解离常数,将用于制剂生产的物理形态(如多晶型、溶剂化物、或水合物),粒度等。 3.2.S.2 生产信息 3.2.S.2.1生产商
2.化学仿制原料药CTD格式申报资料撰写要求讲述
附件2 化学仿制原料药CTD格式申报资料撰写要求 一、目录 3.2.S 原料药 3.2.S.1 基本信息 3.2.S.1.1 药品名称 3.2.S.1.2 结构 3.2.S.1.3 理化性质 3.2.S.2 生产信息 3.2.S.2.1生产商 3.2.S.2.2生产工艺和过程控制 3.2.S.2.3物料控制 3.2.S.2.4关键步骤和中间体的控制 3.2.S.2.5工艺验证和评价 3.2.S.2.6生产工艺的开发 3.2.S.3 特性鉴定 3.2.S.3.1结构和理化性质 3.2.S.3.2杂质 3.2.S.4 原料药的质量控制 3.2.S. 4.1质量标准 3.2.S. 4.2分析方法 3.2.S. 4.3分析方法的验证
3.2.S. 4.4批检验报告 3.2.S. 4.5质量标准制定依据 3.2.S.5对照品 3.2.S.6包装材料和容器 3.2.S.7稳定性 3.2.S.7.1稳定性总结 3.2.S.7.2上市后稳定性承诺和稳定性方案 3.2.S.7.3稳定性数据 二、申报资料正文及撰写要求 3.2.S.1 基本信息 3.2.S.1.1药品名称 提供原料药的中英文通用名、化学名,化学文摘(CAS)号以及其他名称(包括国外药典收载的名称),应与中国药典或上市产品收载一致。 3.2.S.1.2 结构 提供原料药的结构式、分子式、分子量,如有立体结构和多晶型现象应特别说明,应与中国药典或上市产品收载一致。 3.2.S.1.3 理化性质 提供文献(一般来源于药典和默克索引等)收载的原料药的物理和化学性质,具体包括如下信息:性状(如外观、颜色、物理状态);熔点或沸点;比旋度,溶解性,溶液pH, 分配系数,解离常数,将用于制剂生产的物理形态(如多晶型、溶剂化物、或水合物),粒度等。 列表提供与已上市产品或药典收载标准进行理化性质比较研究的资
中药制剂技术实训教学大纲
中药制剂技术实训教学大纲 一、课程任务及性质 《中药制药技术综合实训教程》是中药及其相关专业的一门专业实训课,是以《药品生产质量管理规范》(GMP)、中药制剂技术、中药制药设备、中药炮制技术、中药化学实用技术等基本理论和基本技能为基础,以制药工序、岗位标准操作法、设备标准操作规程等为目标进行岗前培训的一门综合实训课程。本教材分为药品生产管理必备知识、中间体制备、中药制剂生产和综合实训四篇。在第二篇、第三篇中,以岗位设置和设备使用为主线,进行一些制药设备的标准操作规程、清洁消毒标准操作规程和维护、保养标准操作规程等内容的实训;在综合实训中,以工艺为主线,进行常用剂型的制备实训。通过演示性、验证性、情境模拟性、综合性、设计性等教学方法来更好地完成本门课的实训任务。 通过本教程的实训可弥补教学工作中的不足,提高学生理论知识和各项制药技能的综合运用能力,缩短教学与生产间的差距,实现零距离就业,使学生更好地胜任中药制剂生产、管理方面的工作,本教程在内容上,既体现了各学科间的有机渗透,又将学生置身于生产岗位,体验制药生产的全过程,充分体现了以全面素质为基础、以能力为本位的指导思想,注重培养学生树立“质量第一,安全生产”的意识,提高学生综合应用能力、实际操作能力及创新能力。为学生实现职业岗位的变换和全面发展、终身发展奠定基础。 本课程采用的是化学工业出版社出版发行、蔡翠芳主编的《中药制药技术综合实训教程》 二、实践课程教学安排表
注:⒈实践课程类型,包括演示性、验证性、情境模拟性、综合性、设计性等。 ⑴演示性实验/实训:指为便于学生对客观事物的认识,以直观演示的形式,使学生了解其事物的形态结构和相互关系、变化过程及其规律的教学过程。 ⑵验证性实验/实训:指以加深学生对所学知识的理解,掌握实验/实训方法与技能为目的,验证课堂讲授某一原理、理论或结论,以学生为具体实验操作主体,通过现象衍变观察,数据记录、计算、分析直至得出被验证的原理、理论或结论的实验/实训过程。 ⑶情境模拟性实验/实训:指通过设置具体生动的模拟情境,帮助学生巩固理论知识,学习特定场景中所需的操作技能的实验/实训。 ⑷综合性实验/实训:指实验/实训内容涉及本课程的综合知识或与本课程相关课程知识的实验/实训。 ⑸设计性实验/实训:指给定实验/实训目的、要求和条件,由学生自行设计方案并加以实现的实验/实训。 ⒉教学地点指本实验/实训的教学地点,如XXX实验/实训室(实训中心)、XXX实训基地。 ⒊建议分组人数指分组实验/实训时每组学生建议人数,如4人/组或6-8人/组等。
生产记录模板一套
三、生产记录(变动记录) 圈舍号变动 日期 出生 数量 畜禽调入畜禽(产品)调出(出售)死亡 数量 淘汰 数量 存栏数量 记录人 签名 备注数量来源数量去向 注:圈舍号填写畜禽饲养的圈、舍、栏的编号或名称,不分圈、舍、栏的此栏不填。变动日期填写出生、调入、调出、死亡和淘汰的日期。畜禽调入填写从外部(包括外圈、舍、栏)调入的数量,从场(小区)外调入的应在备注栏注明动物检疫合格证明编号,并将检疫证明原件粘贴在记录背面。调出去向要能识别到具体的单位。死亡和淘汰的需要在备注栏注明死亡和淘汰的原因。存栏数填写存栏总数,为上次存栏数+变动数量(出生+调入-调出-死亡-淘汰)之和。对于蛋鸡和奶牛的饲养者,畜禽(产品)调出(出售)栏为鸡蛋、牛奶的销出数量和销售去向。
四、投入品购进记录 购进日期通用 名称 商品 名称 规格购进数量生产厂家销售商 保管人 签名 备注 注:投入品主要指饲料、兽药、疫苗、消毒剂等。规格:预混料、浓缩料一般是指在配合饲料中的添加比例,饲料添加剂、药物饲料添加剂、兽药、消毒剂一般是指主成分的含量浓度或效价单位。
五、饲料、饲料添加剂和加药饲料(指饲料中含有药物添加剂)使用记录 圈舍号通用 名称 商品 名称 开始 使用 日期 生产厂家 批号/ 生产日期 药物添加 剂名称 休药 期 停止 使用 日期 使用 总量 记录人 签名 备注 注:养殖场自加工饲料的,生产厂家栏填写自加工。在外购饲料或自加工饲料中添加使用了饲料药物添加剂的,应写明饲料药物添加剂的通用名称、休药期和停止使用日期。停止使用日期、使用总量待该批投入品全部使用完比或停止使用后填写。
