生理实验分析

实验目的:分析反射弧的组成,了解反射弧的完整性与反射活动的关系实验对象:蟾蜍实验方法:
1. 制备脊蟾蜍。用刺蛙针于蟾蜍头部枕骨大孔处刺入颅腔将脑组织拆毁,保留脊髓,制成脊蟾蜍。
2. 用铁夹夹住脊蟾蜍下颌,悬吊在铁支架上。
观察项目:
分析:对实验结果进行分析。
1、反射活动的实现需要感受器来感受外界刺激
2、反射活动的实现需要传入传出神经来传导兴奋
3、反射活动的实现需要反射中枢来信号分析并发出指令 4是反射,5是反应
反射:是在中枢神经系统的参与下,机体对刺激的规律性反应。完成反射活动必须有完整的反射弧。如排尿反射、排便反射。反应:接受刺激后机体活动状态的改变。反应的表现形式:兴奋与抑制。如在除去脑、脊髓(及中枢神经系统)后刺激肌肉,肌肉依然有反应。结论:在本实验中可得什么结论。
在中枢神经系统参与下机体对刺激发生的有适应意义的反应过程称为反射。反射活动的结构基础是反射弧。反射弧由感受器、传入神经纤维、反射中枢、传出神经纤维和效应器5个部分构成。反射弧的结构和功能的完整性是实现反射活动的必要条件。反射弧的任何环节发生障碍或受到破坏,这一反射活动就将发生紊乱或不能出现。
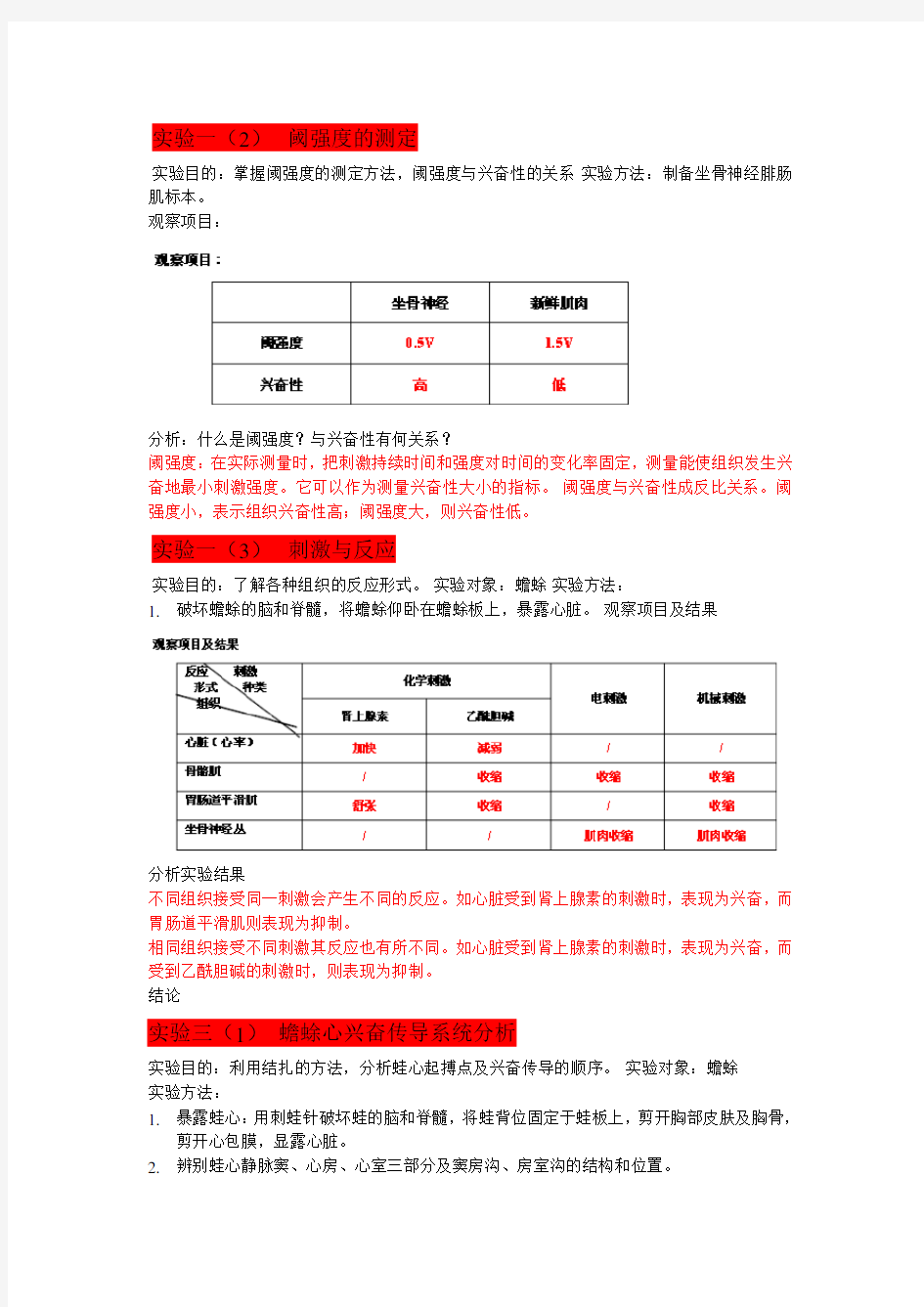
实验目的:掌握阈强度的测定方法,阈强度与兴奋性的关系实验方法:制备坐骨神经腓肠肌标本。
观察项目:
分析:什么是阈强度?与兴奋性有何关系?
阈强度:在实际测量时,把刺激持续时间和强度对时间的变化率固定,测量能使组织发生兴奋地最小刺激强度。它可以作为测量兴奋性大小的指标。阈强度与兴奋性成反比关系。阈强度小,表示组织兴奋性高;阈强度大,则兴奋性低。
实验一(3)刺激与反应
实验目的:了解各种组织的反应形式。实验对象:蟾蜍实验方法:
1.破坏蟾蜍的脑和脊髓,将蟾蜍仰卧在蟾蜍板上,暴露心脏。观察项目及结果
分析实验结果
不同组织接受同一刺激会产生不同的反应。如心脏受到肾上腺素的刺激时,表现为兴奋,而胃肠道平滑肌则表现为抑制。
相同组织接受不同刺激其反应也有所不同。如心脏受到肾上腺素的刺激时,表现为兴奋,而受到乙酰胆碱的刺激时,则表现为抑制。
结论
实验三(1)蟾蜍心兴奋传导系统分析
实验目的:利用结扎的方法,分析蛙心起搏点及兴奋传导的顺序。实验对象:蟾蜍
实验方法:
1.暴露蛙心:用刺蛙针破坏蛙的脑和脊髓,将蛙背位固定于蛙板上,剪开胸部皮肤及胸骨,
剪开心包膜,显露心脏。
2.辨别蛙心静脉窦、心房、心室三部分及窦房沟、房室沟的结构和位置。
观察项目:
1. 观察蛙心静脉窦、心房、心室三部分跳动的顺序及计算其跳动频率。
2. 结扎房室沟:于房室沟处穿引一细线后作一结扎,阻断心房和心室之间的传导,观察静脉窦、心房、心室各自的跳动频率有何变化?
3. 结扎窦房沟:用细镊子在主动脉干下方穿引一细线,再用玻璃针将心尖翻向头端,暴露心脏背面,于静脉窦与心房之间的半月形纤维环(窦房沟)处作一结扎,以阻断静脉窦与心房之间的传导。待心房和心室恢复跳动后,观察计算静脉
窦、心房和心室各自的跳动频率。
将上述各项观察结果填入下列表格。
注意事项:
1. 作结扎时,结扎部位必须准确,勿将静脉窦或心房结扎住。
2. 若结扎房室沟后,心房、心室停搏过长时间,可用玻璃针作人工刺激,使其恢复自主跳动后再计数。
思考题:
两次结扎后静脉窦、心房、心室为何跳动频率不一致?哪一部分的跳动频率更接近于正常心跳频率?这说明正常心搏起点在何处?心脏兴奋传导的顺序如何?
1、实验中,结扎房室沟后,心室停跳,这是因为心房与心室之间的兴奋传导受阻;结扎窦房沟后,心房、心室停跳,这是因为静脉窦与心房之间的兴奋传导受阻。
而结扎房室沟后,心室跳动频率为0;结扎静脉窦后,心房、心室跳动频率为0,是因为静脉窦的超驱动压抑对潜在起搏点的控制。在正常情况下,心房、心室在静脉窦的兴奋驱动下而“被动”产生兴奋,这种“被动”的兴奋频率远远超过它们本身的自动兴奋频率。一旦静脉窦发放的冲动中断,心房、心室不能立即按其自身的节律使心脏搏动,而是需要一定时间才能从被压抑状态中恢复过来,这就是心房、心室跳动频率为0的原因。
2、静脉窦的跳动频率更接近于正常心跳频率。
3、正常的心跳起搏点在静脉窦
实验三(2)期前收缩和代偿间歇
实验目的:学习在体蛙心跳曲线的记录方法,并通过对期前收缩和代偿间歇的观察,了解心肌兴奋性变化特点。
实验对象:蟾蜍
实验方法:
1. 用刺蛙针破坏蛙的脑和脊髓。暴露心脏。
2. 将换能器插头插入1通道,刺激输出电缆插入刺激输出插孔。
3. 在心舒期用蛙心夹夹住心尖约1mm,将蛙心夹上的连线系于张力换能器的着力点上,使拉直的系线与着力点所在的平面垂直,张力的大小,以描记出适宜的心跳曲线为宜,并注意使心脏收缩时曲线为上升支,舒张时为下降支;连接刺激电极,使两电极与心脏充分接触,再与刺激输出电缆相接。待描记出一段心跳曲线后,开始实验。
观察项目:
1. 记录正常心跳曲线,观察心室收缩和舒张曲线。
2. 分别在心收缩期和舒张早期给予刺激,观察曲线是否有变化。
3. 分别在心舒张中、晚期给予刺激,观察曲线是否有变化
注意事项:
1. 破坏蛙的脑和脊髓要完全,以免肢体的活动干扰记录。
2. 实验过程中,应经常用任氏液湿润心脏。
3. 安放在心室上的刺激电极应避免短路。
4. 不要连续刺激心脏。检查是否有刺激输出,可用刺激电极刺激蛙腹壁肌肉或大腿肌肉。思考题:
1. 讨论期前收缩和代偿间歇产生的原因。
正常情况下,心房肌或心室肌分别接受静脉窦传来的兴奋进行活动。
刺激落在静脉窦引起的心室肌或心房肌兴奋的相对不应期或超常期内,心肌可引起一次提前出现的收缩,这就是期前收缩产生的原因。
如果窦性兴奋紧接在期前兴奋之后到达心房或心室,由于正处在期前兴奋的有效不应期内,故不能引起心房或心室新的收缩,即出现一次“脱失”,需待下一次窦房结的兴奋到来才能引起新的收缩。这就是代偿性间歇产生的原因。
2. 心肌的有效不应期长有何生理意义?
心肌的有效不应期长,就不会像骨骼肌一样,一个收缩未结束,又接着下一个收缩,形成强直收缩;而是进入舒张期后,再做下一个收缩,从而保持收缩和舒张的交替进行,使心脏能有序地射血和充盈。
3. 当心率过速或过缓时,期前收缩后是否会出现代偿间歇?为什么?
①当期前收缩之后的下一次窦性兴奋落在期前兴奋的相对不应期和超常期内时,就不会出现代偿性间歇,这种情况一般发生在心率过缓时。
②当期前收缩之后的下一次窦性兴奋落在期前兴奋的有效不应期内时,会出现代偿性间歇,心率过快时,一般会出现代偿性间歇。
实验四动脉血压的神经和体液调节
实验目的:观察某些神经和体液因素对动脉血压的调节作用。
实验对象:家兔
实验方法:
1. 麻醉并固定动物:用3%戊巴比妥钠溶液按1ml/kg体重从耳缘静脉缓缓注入将动物麻醉,
2. 气管插管:剪去颈部毛,于颈部正中纵向切开皮肤5~7cm,暴露并分离出气管,行气管插管术。
3. 分离左侧减压神经和迷走神经,各穿一不同颜色细线备用。分离左侧颈总动脉并穿线备用,分离右侧颈总动脉并
插管连接压力换能器。
4. 连接、调试仪器,开始实验。
观察项目及实验结果
分析:
结论:
注意事项:
1. 分离减压神经与迷走神经时操作要轻巧,切勿用力牵扯神经。
2. 每项实验后,应等血压基本恢复并稳定后再进行下一项。
实验讨论:(各1分)
1)夹闭颈总动脉,血压升高:
2)牵拉颈总动脉,血压下降,心率减慢
3)刺激完整减压神经及其中枢端均可引起血压下降,而刺激该神经外周端基本不变:
兔减压神经是传入神经,其作用是将主动脉弓感受器发出的冲动传入延髓心血管中枢,反射性引起血压降低。因此,刺激完整的减压神经或其中枢端,使传入中枢的冲动增加,致血压明显下降,而刺激其外周端虽又冲动传向外周,但不会引起血压变化。
4)刺激迷走神经末梢外周端,引起血压下降
在实验中,多用刺激右迷走神经外周端,其中的副交感神经纤维兴奋,释放乙酰胆碱,乙酰胆碱与心肌细胞膜上的M受体结合,产生负性变时,变力,变传导作用,出现心率减慢,心输出量下降,血压下降。
5)静脉注射去甲肾上腺素后血压升高:
去甲肾上腺素主要与α受体结合,也可与心肌β1受体结合,但与血管平滑肌的β2受体结合的能力较弱。
注射去甲肾上腺素,去甲肾上腺素与心肌细胞的β1受体结合,使心输出量增多;与血管壁上的a受体结合,使血管收缩,外周阻力增大,故动脉血压升高。
血压升高又使压力感受性反射活动加强,压力感受性反射对心脏的效应超过去甲肾上腺素对心脏的直接效应,心率减慢。
6)静脉注射肾上腺素后血压升高
肾上腺素与心肌细胞的β1受体结合,使心输出量增多;与血管壁上的a受体结合,使血管收缩,外周阻力增大,故动脉血压升高。
实验五呼吸运动的调节、胸内负压的测定
实验目的: 1. 通过描记呼吸运动曲线,观察各种因素对呼吸运动的影响。 2.
观察胸内负压值及其在呼吸运动时的变化。
实验对象:家兔
实验方法:
1. 麻醉并固定动物:用3%戊巴比妥钠溶液按1ml/kg体重从耳缘静脉缓缓注入将动物麻醉,然后仰卧固定于手术台上。
2. 气管插管:剪去颈部毛,于颈部正中纵向切开皮肤5~7cm,暴露并分离出气管,行气管插管术。
3. 分离两侧迷走神经,各穿一根线备用。
4. 在剑突下呼吸最明显的地方,连接张力换能器,开机,调试仪器,开始实验。
观察项目及实验结果
胸内负压测定:吸气末 ------------m m H2O
呼气末 ------------m m H2O
分析
结论:
注意事项:
1.观察呼吸运动的变化应包括其频率和幅度的变化。
2.每项观察项目前均应有正常呼吸曲线作对照。
3.每项观察项目不宜过长,看到呼吸运动曲线有变化后立即停止刺激。
1、中度或轻度缺氧时,血液中的氧分压降低,刺激外周化学感受器,兴奋传至延髓呼吸中枢,使呼吸加快加深
2、吸入少量二氧化碳,血液中的二氧化碳分压升高
①二氧化碳通过血脑屏障由血液进入脑脊液,与水发生反应并生成H+和HCO3- H+可刺激中枢化学感受器,进而刺激呼吸中枢,使呼吸加快加深,这是主要途径。
②二氧化碳分压也可刺激外周化学感受器,反射性地兴奋延髓呼吸中枢,使呼吸加快加深。
3、增大呼吸无效腔对呼吸运动的影响增加气道长度后家兔呼吸张力增加,呼吸频率增加。增加气道长度等于增加无效腔,增加无效腔使肺泡气体更新率下降,引起血中PCO2、PO2-下降,刺激中枢和外周化学感受器引起呼吸运动会加深加快;另外,气道加长使呼吸气道阻力增大,减少了肺泡通气量,反射性呼吸加深加快;增加家兔气道长度可使家兔通气量增加,呼吸频率加快
4、切断一侧迷走神经后,由于这一侧迷走神经的神经冲动传递受阻,使得呼吸运动的调节受阻,呼吸减慢减弱;随后由于迷走神经为混合神经,另一侧迷走神经将起到呼吸调节作用,此时发挥负反馈调节作用,加速吸气和呼气活动的交替。
5、切断双侧颈迷走神经后,动物的呼吸运动呈慢而深的变化迷走神经中含有肺牵张反射的传人纤维。肺牵张反射中的肺扩张反射(亦称吸气抑制反射)的生理作用,在于阻止吸气过长过深,促使吸气及时转人呼气,从而加速了吸气和呼气动作的交替,调节呼吸的频率和深度。当切断两侧颈迷走神经后,中断了肺牵张反射的传人通路,肺牵张反射的生理作用被消除,因此呈现出慢而深的呼吸运动,使吸气延长。
6、电刺激引起迷走神经兴奋,肺扩张反射加强,使呼吸提前切断转入呼气,因此呼吸频率加快,幅度减小。
生理学实验报告
生理学实验报告 实验题目: 蛙的体循环血压、心肌收缩和心电图(ECG)的同步记录与分析 课程名称:生理学实验 专业:10级生物技术及应用(基地班) 教室:A414 学生姓名:徐棒夏凡女 学号:10350083 10350081 指导老师:龙天澄张碧鱼陈笑霞 日期:2012年5月15日 一.实验目的 1.学习并掌握蛙的体循环血压、心肌收缩和心电图(ECG)的同步记录 2.记录和分析植物神经系统和重要神经递质对血压、心电(心肌的电生理特性)和心搏(心肌的收缩特性)的影响。 二.动物与器械 青蛙;蛙心插管、常用手术器械、计算机采集系统、蛙心夹、YP100压力换能器、三通管、注射器、保护电极、露丝电极、一维位移微调器、固定针、蜡盘、培养皿、污物缸、棉线、纱布、滴管、小烧杯;任氏液、石蜡油、肾上腺素溶液、乙酰胆碱溶液、肝素溶液;
三.实验原理 神经与体液因素对心血管功能的调节可通过心肌收缩力、心电图和血压的变化反映出来。尤其是血压的指标直接反映了心输出量和外周阻力的变化,可以较好的评价整体的心血管功能。 本实验用青蛙主动脉插管法,直接测量血压,并同步记录心搏和心电图。记录和分析植物神经系统和重要神经递质对血压、心电(心肌的电生理特性)和心搏(心肌的收缩特性)的影响。 四.实验步骤 1. 分离迷走交感混合神经干 按常规方法用探针刺毁蟾蜍的脑和脊髓,将动物背位放在蛙板上。把左侧下颌角与前肢间的皮肤纵向剪开,用镊子紧贴下颌角分离皮下组织。找到体轴走向的提肩胛肌,小心地将提肩胛肌横向剪断,即可见到其下方的血管神经束(皮动脉,颈静脉和迷走-交感混合干)。在迷走—交感混合干下方穿一线,用玻璃分针分离开神经,用湿生理棉球暂将神经覆盖,以避免神经干燥。 2. 暴露心脏 在胸骨柄后方的皮肤上先剪开一小的切口,再自切口处向左右两侧锁骨外侧方向剪开皮肤,切口成V形,把切开的皮肤掀向头端。在胸骨柄后方的腹肌上也剪一小切口,沿身体正中方向剪开剑突和胸骨(剪子尖向上翘以免损伤血管和心脏),剪断左右乌喙骨和锁骨及提臂肌,使胸部创口也呈V形。可见到心包和心脏。用眼科剪剪开心包膜,在心脏舒张时夹上蛙心夹。蛙心夹拴线的另一端与张力换能器相连(换能器的输出端与生理信号采集处理系统的一个输入通道相连)。 3. 主动脉插管 YP100压力换能器的直端和侧端管上加装三通管。从侧管注入液体石蜡,将系统内气泡赶净。用装有50%柠檬酸钠溶液(肝素-任氏液)的注射器连接于侧端管上,直端管上连接心脏插管。 用线结扎动脉的远心端,在左主动脉分叉处穿线备用。用手术剪在结扎处与穿线处剪一V形口,将插管经V形口插入动脉圆锥适当深度。穿线结扎并固定于插管上。
植物生理学实验课程
《植物生理学实验》课程大纲 一、课程概述 课程名称(中文):植物生理学实验 (英文):Plant Physiology Experiments 课程编号:18241054 课程学分:0.8 课程总学时:24 课程性质:专业基础课 前修课程:植物学、生物化学、植物生理学 二、课程内容简介 植物生理学是农林院校各相关专业的重要学科基础课,是学习相关后续课程的必要前提,也是进行农业科学研究和指导农业生产的重要手段和依据。本实验课程紧密结合理论课学习内容,加深学生对理论知识的理解。掌握植物生理学的实验技术、基本原理以及研究过程对了解植物生理学的基本理论是非常重要的。本大纲体现了植物生理学最实用的技术方法。实验内容上和农业生产实践相结合,加强学生服务三农的能力。实验手段和方法上,注重传统、经典技术理论与现代新兴技术的结合,提高学生对新技术、新知识的理解和应用能力。 三、实验目标与要求 植物生理学实验的基本目标旨在培养各专业、各层次学生有关植物生理学方面的基本研究方法和技能,包括基本操作技能的训练、独立工作能力的培养、实事求是的科学工作态度和严谨的工作作风的建立。开设植物生理学实验课程,不仅可以使学生加深对植物生理学基本原理、基础知识的理解,而且对培养学生分析问题、解决问题的能力和严谨的科学态度以及提高科研能力等都具有十分重要的作用。 要求学生实验前必须预习实验指导和有关理论,明确实验目的、原理、预期结果,操作关键步骤及注意事项;实验时要严肃认真专心操作,注意观察实验过程中出现的现象和结果;及时将实验结果如实记录下来;实验结束后,根据实验结果进行科学分析,完成实验报告。 四、学时分配 植物生理学实验课学时分配 实验项目名称学时实验类别备注 植物组织水势的测定3学时验证性 叶绿体色素的提取及定量测定3学时验证性 植物的溶液培养及缺素症状观察3学时验证性 植物呼吸强度的测定3学时设计性 红外CO2分析仪法测定植物呼吸速率3学时设计性选修 植物生长物质生理效应的测定3学时验证性 植物种子生活力的快速测定3学时验证性
生理实验报告2红细胞计数
红细胞计数 一、实验目的: 学习、掌握应用稀释法计数红细胞的方法 二、实验原理: 1.血液中血细胞数很多,直接计数有一定难度,需要将血液稀释到一定倍数,然后用血细胞计数板计数。 2.在显微镜下计数一定容积的稀释血液中的红细胞,之后需要将其换算成每升血液中所含的红细胞数。 三、实验用品: 器具:显微镜、血细胞计数板、小试管、采血管、1mL和5mL移液管、玻璃棒、刺血针、干棉球 试剂:哺乳动物红细胞稀释液、蒸馏水、75%酒精 四、实验方法与步骤: 1.采血 2.稀释:用移液管取10微升血液,加至2mL红细胞稀释液中3.充池:将盖玻片的一边与计数池的纵线末端接触,然后缓慢放下,使盖玻片平放在计数室两侧的隆起上,醮少许红细胞稀释液靠近盖玻片乾元,靠毛细管作用将稀释液冲入计数池,于高倍镜下观察红细胞分布情况 4.静置计数板2~3min 待经红细胞下沉后,大方格四角以及中央取5个4×4中方格红细胞数,用高倍镜或低倍镜计数
5.计数,计算 注意事项: 1.保证计数板和盖玻片清洁;以防影响计数结果的准确性。 2.一次完成充池,如充池过少、过多、有气泡或出现任何碎片,应拭净计数板及盖玻片后重新操作。 3.充池后平放计数板,不能移动盖玻片。 4.计数板中细胞如果严重分布不均,应重新充池计数。 5.凡压线的细胞应按照数上不数下、数左不数右的原则,避免漏数或重复计数。 五、实验结果观察与记录以及分析: 1.结果计算:(53+113+76+60+64)/5=73.2 每16格平均73.2个红细胞,红细胞数: 73.2×25×200×10×1000000=3.66×10的12次方个/升 2.显微镜下图片 ①空白计数板: 低倍镜:
测定各生理指标的试验方法
测定各生理指标的试验方法 1.4.1 电导率的测量(浸泡法)[5] 取大小相当的植物叶片(尽量保证叶片的完整性,少含茎节),用自来水洗净后再用蒸馏水冲洗3次,用滤纸吸干表面水分,将叶片剪成适宜长度的长条(避开主脉),快速称取鲜样,每份0.1g,分别置于10ml去离子水的刻度试管中,盖上玻璃塞置于室温下浸泡处理12h,用电导仪测定浸提液电导(R1),然后沸水浴加热30min,冷却至室温后摇匀,再次测定浸提液电导(R2)。根据公式:相对电导率=R1/R2×100% 算出电导率。 1.4.2 超氧化物歧化酶(SOD)活性的测定(氮蓝四唑法)[5] 取各株植物相同部位的叶片(去叶脉)0.5g于预冷的研钵中,加1ml预冷的磷酸缓冲液在冰浴上研磨成浆,加缓冲液使最终体积为5ml。取1.5~2ml于4000r/min 下离心10min,上清液即为SOD粗提取液。取32支试管(30支测定管,2支对照管),分别加入1.5ml0.05mol/l磷酸缓冲液、0.3ml130nmolMet溶液、0.3ml750μmol/l NBT溶液、0.3mol100μmol/l EDTA液、0.3ml20μmol/l核黄素、0.05ml酶液(其中2支对照管以缓冲液代替酶液)、0.25ml蒸馏水,混匀,将一支对照管置于暗处,其他各管于4000lx日光下反应20min(要求各管受光情况一致,温度高时缩短,低时延长)。反应结束后,以不照光的对照管做空白,分别测定其他各管的吸光度。 计算公式:SOD总活性(U/g)=[(A CK -A E )×V]/(0.5×A CK ×W×Vt) 注:SOD总活性以每克样品鲜质量的酶单位表示(U/g);A CK 为照光对照管的 吸光度;A E 为样品管的吸光度;V为样品液总体积(ml);Vt为测定时样品用量(ml);W为样品鲜质量(g)。 1.4.3 过氧化物酶(POD)活性的测定(愈创木酚法) [5] 酶液提取:取5.0g植物叶片,洗净,剪碎,放入研钵中。加适量的磷酸缓冲液研磨成匀浆。将匀浆液全部转入离心管中,于3000rmp离心10min,上清液转入25ml容量瓶中。沉淀用5ml磷酸缓冲液再提取2次,上清液并入容量瓶中,定容至刻度,低温下保存备用。分别在各试管中加入0.05mol/l磷酸缓冲液 2.9ml,2%H2O21.0ml,0.05mol/l愈创木酚1.0ml和0.1ml酶液来制备酶活性测定
生理学实验报告一
生理学实验报告 一、实验题目: 1.实验员:马冰(0941054) 2.时间:2011年10月10日 3.组号:第二组 4.班级:09生科 二、实验目的 1.熟悉并掌握生物信号采集处理系统 2.掌握蛙类坐骨神经腓肠肌标本和坐骨神经干标本的制备技术 3.观察不同刺激强度、刺激频率对骨骼肌收缩形式的影响 4.观察电刺激对神经兴奋性、兴奋传导的影响 5.熟悉阈强度、最适刺激强度及单收缩、完全强直收缩之间的关系 三、实验原理 兴奋性:可兴奋组织对外界刺激发生反应的能力(或细胞受刺激时产生动作电位的能力)。 兴奋:也就是动作电位,指可兴奋细胞受阈刺激或阈上刺激时,细胞在静息电位的基础上发生一次迅速的、短暂的并可扩布的电位变化。 阈强度:在刺激持续时间和刺激强度-时间变化率固定时,引起可兴奋细胞产生动作电位的最小刺激强度,也叫阈值或阈刺激。 阈刺激或阈上刺激产生动作电位,其特点:①“全或无”现象;②进行长距离无衰减传递(神经纤维、骨骼肌细胞等)。 阈下刺激引起局部电兴奋,其特点:①幅度在阈下刺激的范围内,随刺激强度的增大而升高;②在细胞膜上可进行电紧张性扩布,即衰减性传播;③可以相互融合(时间总和、空间总和)。 最适刺激强度:引起肌肉产生最大收缩时的最小刺激强度。 单收缩:肌肉受到一次短促的刺激时,会产生一次机械性收缩和舒张的过程。 兴奋性作为三大基本生命现象(新陈代谢、兴奋性、生殖)具有重要的生理意义。那么,什么叫兴奋性呢?它是指可兴奋组织对外界刺激发生反应的能力。所有可兴奋组织产生兴奋
(也就是动作电位)都必须有一个条件:刺激。 刺激包括三方面的内容:刺激强度、刺激时间、刺激强度-时间变化率。其中,刺激强度就是电刺激的脉冲电压,刺激时间就是某个单刺激所持续的时间。 刺激强度对骨骼肌收缩形式的影响(固定刺激的时间和刺激强度-时间变化率):单根神经纤维或肌纤维对刺激的反应是“全或无”式的。但在神经纤维肌肉标本中,则表现为当刺激强度很小时(阈下刺激),不能引起神经纤维动作电位的产生和肌肉的收缩;当刺激强度在一定范围内变动时,肌肉收缩的幅度与之成正比。因为坐骨神经干中含有数千万条粗细不等的神经纤维,其兴奋性各不相同。弱刺激只能使其中少量兴奋性高的神经纤维先兴奋,并引起它所支配的少量肌纤维收缩。随着刺激强度逐渐增大,发生兴奋的神经纤维数目逐渐增多,其所引起收缩的肌纤维数目亦增多,结果肌肉收缩幅度随刺激强度的增加而增强。当刺激达到某一强度时,神经干中全部神经纤维兴奋,它们所支配的全部肌纤维也都发生兴奋和收缩,从而引起肌肉的最大收缩。此后,若再增加刺激强度,肌肉收缩幅度将不再增加。我们把引起肌肉产生最大收缩时的最小刺激强度叫最适刺激强度。 刺激频率对骨骼肌收缩形式的影响(把刺激强度固定在最适刺激强度,把单刺激改为连续单刺激):刺激频率就是单位时间内连续刺激的次数。随着刺激频率的增高,肌肉的反应依次表现为单收缩、不完全强直收缩和完全强直收缩: ⑴如果刺激频率很小时,每相邻两个刺激的间隔时间很大,当其大于肌肉收缩的收缩期和舒张期之和时,肌肉表现为一个个的单收缩。单收缩包括收缩期及舒张期。前者占时较后者为短。 ⑵当逐渐增加刺激频率,使新的刺激引起的肌肉收缩落在前一个刺激引起肌肉收缩的舒张期,这样,肌肉在连续未完全舒张的基础上就开始新的收缩,形成锯齿样的不完全强直收缩张力曲线。 ⑶当刺激频率继续增大时,新的刺激引起肌肉收缩落在前一次刺激引起肌肉收缩的收缩期,这样,肌肉在连续收缩不全的基础上出现新的收缩,形成一个类似方波的完全强直收缩张力曲线。 四、实验方法和步骤 (见生理学实验指导P36,P40,P44) 五、实验对象 蟾蜍
生理学实验报告-蛙心灌流
实验名称: 蛙类离体心脏灌流 课程名称:生理学实验 指导教师:龙天澄张碧鱼陈笑霞 实验人:叶永锋08344031 学院:海洋学院 实验时间:2009年12月09日
一、【目的要求】 1、学习斯氏离体蛙心灌流法。 2、了解心肌的生理特性。 3、观察Na+,K+,Ca2+及肾上腺素(Adr),乙酰胆碱(ACh)等对离体心脏活动的影响。 二、【原理】 将离体蛙心(失去神经支配的蛙心)保持在适宜的环境中,在一定的时间内仍然能够保持节律性收缩,心脏正常的节律性活动需要一个适宜的理化环境,离体心脏也是如此,离体心脏脱离了机体的神经支配和全身体液因素的直接影响,可以通过改变灌流液的某些成分,观察其对心脏活动的作用。心肌细胞的自律性、兴奋性、传导性及收缩性,都与钠、钾及钙等离子有关。血钾浓度过高时(高于7.9mmol/L),心脏兴奋性、自律性、传导性及收缩性都下降,表现为收缩力减弱、心动过缓和传导阻滞,严重时心脏可停搏于舒张期。血钙浓度升高时,心脏收缩力增强,过高可使心室停搏于收缩期。血钙浓度降低,心肌收缩力减弱。血中钠离子浓度的轻微变化,对心肌影响不明显,只有发生明显变化时,才会影响心肌的生理特性。肾上腺素可使心率加快、传导加快及心肌收缩力增强,乙酰胆碱则与肾上腺素的作用相反。 三、【实验仪器】 青蛙、常用手术器械、蛙板(或蜡盘)、蛙心夹、计算机采集系统、张力传感器、支架、双凹夹、双针形露丝刺激电极、滴管、培养皿(或小烧杯)、纱布、棉线、橡皮泥、任氏液。蛙心套管(斯氏套管或八木氏套管)、套管夹、0.65%NaCl、5%NaCI、2%CaCl2、1%KCl、1:5 000肾上腺素、1:10 000乙酰肌碱、300U/mL肝素。 四、【方法与步骤】 1、斯氏蛙心插管法 (1)一只青蛙,双毁髓后背位置于蜡盘中, 按前面的方法暴露心脏。仔细识别心脏周围的大 血管(见右图)。在左主动脉下方穿一线,于动脉 圆锥处结扎(动物个体小时,结扎位置可靠上些)。 再从左右两主动脉下方穿一线,并打一活结备 用。左手提起主动脉上的结扎线,右手用眼科剪 在结扎线下方、沿向心方向将动脉上壁剪一斜 口。选择大小适宜的蛙心套管,然后将盛有少量 (套管内2~3 cm高度)任氏液(内加入一滴肝素溶 液)的斯氏蛙心套管,山开口处插入动脉圆锥(见右图)。当套管尖端到达动脉圆锥基部时,应将套管稍稍后退,使尖端向动脉圆锥的背部后下方及心尖方向推进,经主动脉瓣插入心室腔内(于心室收缩时插入,但不可插得过深,以免心室壁堵住套管下口)。此时可见套管中血液冲人套管,并使液面随心脏搏动而亡下移动,表明操作成功(否则需退回并重新插入)。用滴管吸去套管中的血液,更换新鲜任氏液。稳定住套管后,轻轻提起备用线,将左、右主动脉连同插入的套管用双结扎紧(不得漏液),再将结线固定在套管的小玻璃钩上,然后剪断结扎线上方的血管。轻轻提起套管和心脏,看清静脉窦的位置,于静脉窦下方剪断有牵连的组织,仅保留静脉窦与心脏的联系,使心脏离体(切勿损伤静脉窦)。用任氏液反复冲洗心室内余血,
神经生理学模拟实验报告材料
实用文档专业:应用心理学 : 学号:日期:地点:汪加诚3110102422 2016.1024 医学楼 C512 实验报告 课程名称:实验名称: 神经生理学指导老师:成绩: 同组学生:神经干不应期的测定实验类型:模拟实验 一、实验目的 了解蛙类坐骨神经干产生动作电位后其兴奋性的规律性变化。学习绝对不应期和相对不 应期的测定方法。 二、实验原理 神经组织和其他可兴奋组织一样,在接受一次刺激产生兴奋以后,其兴奋性将会发生规 律性的变化,依次经过绝对不应期、相对不应期,超常期和低常期,然后再回到正常的兴奋 水平。 采用双脉冲刺激的方法。将两刺激脉冲间隔由最小逐渐增大时,开始只有第一个刺激脉 冲刺激产生动作电位(action potential, AP),第二个刺激脉冲刺激不产生 AP,当两刺激脉 冲间隔达到一定值时,此时第二个刺激脉冲刚好能引起一极小的 AP,这时两刺激脉冲间隔即 为绝对不应期。继续增大刺激脉冲间隔,这时由第二个刺激脉冲刺激产生的 A P逐渐增大,当 两刺激间隔达到某一值时,此时由第二个刺激脉冲刺激产生的 AP,其振幅刚好和由第一个刺 激产生的 A P相同,这时两刺激脉冲间隔即为相对不应期。 三、材料和方法 【材料】:蟾蜍或蛙;标本屏蔽盒、任氏液、微机生物信号采集处理系统。 【实验方法】: 1.系统连接和仪器参数设置 (1)RM6240 系统:点击“实验”菜单,选择“肌肉神经”或“生理科学实验项目”菜 单中的“神经干兴奋不应期的测定”或“神经干兴奋不应期的自动测定”项目。系统进入该 实验信号记录状态。仪器参数:1通道时间常数 0.02s、滤波频率 1KHz、灵敏度 4mV,采样频率 80KHz,扫描速度 1ms/p。双刺激激模式,最大刺激强度,刺激波宽 0.1ms,起始波间隔 30 ms,延迟 2ms,同步触发。
动物生理学实验设计
动物生理学实验设计 班级:09级生物技术本一班 小组成员:李水琴姚燕兵罗泉清龙伟雄 实验设计内容 一、课题名称:静脉注射和口服等量生理盐水对小白鼠尿量的影响 二、实验目的:通过对小白鼠注射和口服等量生理盐水,了解尿液生 成过程,进一步熟悉掌握肾小管的功能。 三、基本原理: 生理盐水对尿液的影响:加大了血液中水的含量,冲淡了血 液,增加人体的排尿量.肾脏为了维持体内水的平衡,通过生 成尿液来实现.尿的生成来源于血浆,通过肾小球的滤过,肾 小管的吸收,肾小管的徘汇和分泌这三个过程来完成.在这 三个过程中,除了生成尿液外,肾脏同时根据体内水分的多 少对尿量进行调节,而保持水的平衡,维持人的正常生活.
四、材料与用品:小白鼠数只、生理盐水200ml、25%氨基甲酸乙酯 溶液、纱布、棉线、注射器、试管、试管夹等五、注意事项: 1.实验前给小白鼠多喂些食物,或用导尿管向小白鼠胃中灌入40—50ml 清水,以增加其基础尿流量; 2.实验中需多次进行耳缘静脉注射,注射时应从耳缘静脉远端开始,逐步移近耳根。手术的创口不宜过大,防止动物的体温下 降,影响实验; 3.输尿管手术的难度较大,应注意防止导管被血凝块堵塞,或被扭曲而阻断尿液的流通。 六、方法与步骤: 1、小白鼠抓取、称重、麻醉:抓取3只体型相近、健康指数大致 一致的小白鼠称重,然后用25%氨基甲酸乙酯溶液(按1g/kg 或4ml/kg用量),从耳缘静脉注入,小白鼠麻醉成功后,使其仰卧并用绳固定在兔台上备用,并标号、记录数据; 2、分别对上述上三只小白鼠进行注射、口服30ml等量生理盐水 和空白对照处理;
3、在胱底部找到并分离两侧输尿管,在输尿管靠近膀胱处用细线 结扎,另穿一细线打松结备用,略等片刻,待输尿管充盈后,提起结扎细线,在管壁上用眼科剪剪一小斜口,从斜口向肾脏方向插入口径适当的预先充满生理盐水的输尿管插管,结扎固定,用试管收集尿液。 4、三小时后,每隔半小时,观察小白鼠尿量变化(滴/分),做 好记录,并绘制成曲线图观察。
病理生理实验报告
实验一组织晶体渗透压改变在水肿发生中 的作用(水肿) 实验目的:通过实验了解组织晶体渗透压的改变在水肿发生中的意义,加深对水肿发生机理的理解。 实验动物:蟾蜍2只,要求体重、大小相仿。 器材与药品: 200克电子天平1台,盛水玻璃缸2个,2m1注射器连4号针头2支,脱脂棉球、纱布块适量。0.65%氯化钠液和20%氯化钠液各10ml。 实验方法: 1. 取蟾蜍2只分别称重,注意观察背部外形。 2. 向一只蟾蜍背部淋巴囊内注入0.65%氯化钠液(即蛙生理盐水)2 m1,向另一只蟾蜍背部淋巴囊内注入20%氯化钠液2ml(蟾蜍皮下淋巴囊分布见图2-1),然后分别放入装有水的玻璃缸内。 3.1小时后由水中取出蟾蜍,擦掉体表浮水后分别称重,同时仔细观察背部外形改变。 4. 解剖蟾蜍:由椎骨孔破坏神经系统。重点观察背部淋巴囊的变化。解剖观察其它脏器和解剖结构。 实验结果:将观测到的各种实验结果记入下表内 注前体重注前背部外 形注后体重注后背部外 形 注0.65%氯 化钠 141.2g 正常平坦146.3g 正常平坦
注20%氯化 141.8g 正常平坦169.5g 变肥 钠 结果分析:实验中这两只蟾蜍分别注射了不同浓度的氯化钠溶液,组织晶体渗透压升高,两只都有一定的吸水能力,注射低浓度氯化钠溶液的青蛙吸水较少,体重只有轻微的增长,体型无明显变化;注射高浓度氯化钠溶液的青蛙吸水较多,体重有大幅度的增长,体型出现明显变化。结果表明晶体在体内的浓度越高,吸水性越强。 心得:
实验二缺氧 实验目的:通过复制外呼吸性缺氧、血液性缺氧及组织中毒性缺氧的动物模型。 实验动物:成年小白鼠4只. 器材与药品: 1.外呼吸性缺氧:带有橡皮塞的250毫升广口瓶1只(见图3—1),搪瓷盘1只、镊子、剪子各2把,100g电子天平1台。钠石灰(NaOH.CaO)10g,凡士林1瓶。 2.血液性缺氧:带有管道瓶塞的250m1广口瓶和三角烧瓶各2只,酒精灯1盏,三角架3个,充满一氧化碳的皮球胆1只,弹簧夹4个,lml注射器1支。甲酸、浓硫酸各300ml,2%亚硝酸钠溶液10ml 3.组织中毒性缺氧:1 m1注射器1支。0.04%氰化钾溶液。 实验方法: 一、外呼吸性缺氧 1.取小白鼠重只称重后放入广口瓶内,瓶内预先加入钠石灰5g。观察动物一般状况,如呼吸频率、呼吸状态,皮肤、粘膜色彩、精神状态等。 2.旋紧瓶塞,用弹簧夹夹闭通气胶管,防止漏气。记录时间,观察上述各项指标的变化,直至动物死亡。待本次实验内容全部完成之后,一起剖检动物,对比观察血液颜色的改变和其它变化(以下皆同)。 二、血液性缺氧 (一)一氧化碳中毒
生理学实验设计
生 理 实 验 设 计 实验课题:筒箭毒对神经—肌肉接头处得兴奋传递得影响 实验成员:星期五下午第四实验室第二组 筒箭毒对神经—肌肉接头处兴奋传递得影响 实验假设 筒箭毒能与乙酰胆碱竞争神经肌接头处得nm受体,使肌肉松弛。 实验原理与目得 神经肌肉接头处得兴奋传递过程有三个重要得环节: 一就是钙离子促进神经轴突中得囊泡膜与接头前膜发生融合而破裂; 二就是囊泡中得乙酰胆碱释放到神经肌肉接头间隙; 三就是乙酰胆碱与接头后膜上得受体结合,引发终板电位。 乙酰胆碱(Acetylcholine,ACh)就是一种重要得神经递质,就是连接每个运动神经元与骨骼肌之间得信使。如果ACh得传递受阻,肌肉就不能收缩。箭毒就是美印第安人在猎箭头部涂抹得一种毒药,它能够占用并阻塞ACh 受体得位置,能竞争性阻断ACh得去极化作用致使神经递质不能影响肌肉、能与ACh 竞争神经肌接头处得nm胆碱能受体,但不激动受体,因而使骨骼肌松弛、抗胆碱酯酶药可拮抗其肌肉松弛作用,新斯得明就是胆碱酯酶抑制剂,可通过抑制胆碱酯酶增减乙酰胆碱在肌接头间隙得浓度。故筒箭毒过量可用适量新斯得明解救。筒箭毒与乙酰胆碱竞争性结合乙酰胆碱受体,注射新斯得明后使突触间隙内得乙酰胆碱浓度升高
而使竞争性增强,故乙酰胆碱与受体接触增多,从而使肌无力症状减弱。 本实验得目得就是探索筒箭毒对神经--肌接头处兴奋传递得影响极其相关机制;观察筒箭 毒得肌松作用,分析其作用点;了解新斯得明对抗筒箭毒得作用。 实验对象 大白鼠,体重250g以上 实验器材与药品 Powerlab一套(主机,刺激器,张力换能器),手术器械一套,小动物人工呼吸机,气管插管,棉线,大头针,铁架台,注射器0.001g%筒箭毒碱,0。005g%新斯得明,25%乌拉坦,1。5%普鲁卡因,生理盐水 实验方法 1、大鼠称重,麻醉;25%乌拉坦腹腔注射0。5ml/100g麻醉。然后仰卧固定于鼠手术床上,分离气管及颈外静脉,分别插入气管插管与静脉插管,准备好人工呼吸机。数分钟后翻正反射消失,即可进行实验; 2、分离坐骨神经;在髋关节后,坐骨结节内凹陷处切开皮肤,钝性分离肌肉,暴露一段坐骨神经,用浸有1、5%普鲁卡因得棉线围绕坐骨神经打一个结,在坐骨神经干上做传导阻滞麻醉,排除下行干扰; 3、分离腓神经;在外侧剪开皮肤,钝性分离肌肉组织,分离腓神经,神经穿线备用; 4、分离胫前肌;将大鼠两前肢固定在手术台(仰卧),从后置踝关节正前方向剪开小腿皮肤,剪断踝关节前部韧带,分离胫前肌肌腱,沿胫骨分离胫前肌(注意不要损伤血管),在踝部得胫前肌肌腱处扎线,与结扎线远端切断肌腱; 5、安装并设定powerlab记录肌张力得chart设定文件;调定刺肉毒碱对神经肌肉接头处处兴奋传递得影响 6、连接仪器;手术操作完成后,将胫前肌与powerlab得张力换能器向连接,腓神经处安放刺激电极。最适负荷设定为10g左右。稳定一段时间后,于给药前记录一段正常得肌肉收缩曲线; 7. 缓慢静脉注射0。001%筒箭毒碱0.1ml/100g,从仪器上观察肌肉收缩曲线得变化情况; 8。待肌肉收缩曲线再次稳定或完全消失后,停止刺激,同时缓慢静脉注射0。005%新斯得明0、15ml/100g,观察肌肉收缩曲线得变化情况、 预期结果 注射筒箭毒后肌肉收缩曲线幅度变小甚至消失,即肌肉处于肌无力状态,注射新斯得明后肌肉收缩曲线又基本恢复正常,即肌肉恢复正常收缩状态; 结果分析 从神经传来得兴奋,通过神经-肌肉接头传递给肌纤维膜,就是以化学递质乙酰胆碱为中介进行得,其全过程可分为:(1)接头前过程、(2)神经递质在间隙得扩散。(3)接头后过程、 如果就是筒箭毒作用于突触前膜,即不能释放乙酰胆碱,那么无论就是否有新斯得明,后膜中均无乙酰胆碱,所以在注射新斯得明后仍然就是肌无力状态,即不会出现预期结果; 如果就是筒箭毒作用于突触间隙,即与突触前膜释放得乙酰胆碱结合,抑制其发挥作用,那么无论就是否有新斯得明,后膜中均无可发挥肉毒碱对神经肌肉接头处处兴奋传递得影响作用得乙酰胆碱,所以在注射新斯得明后仍然就是肌无力状态,即不会出现预期结果; 而如果就是筒箭毒作用于突触后膜,即与乙酰胆碱竞争性结合乙酰胆碱受体,注射新斯得明后使突触间隙内得乙酰胆碱浓度升高而使其竞争性增强,使乙酰胆碱与受体接触增多,从而使肌无力症状减弱,使肌肉收缩曲线幅度增强,即会出现预期结果; 综上所述,假设成立。 注意事项
生理实验报告尿生成
影响尿生成的因素和利尿药的作用 实验目的 1.学习膀胱插管 2.分析影响尿生成的因素 实验原理 尿生成包括肾小球的滤过,肾小管和集合管的选择性重吸收和分泌,凡是能影响这些过程的因素都能影响尿生成和尿量的变化。 实验步骤 麻醉 气管插管 分离右侧迷走神经左侧颈总动脉 膀胱插管 实验记录 正常尿量:13d/min 20ml生理盐水:20d/min 2uADH:6d/min 10ml葡萄糖:16d/min NE: 8d/min 速尿:25d/min 剪断并结扎右迷走神经:1d/min 结果分析 快速注射生理盐水时: 1.大量快速输入生理盐水→血浆白蛋白稀释→血浆胶渗压↓→有效滤过压↑→GFR ↑→尿量↑ 2.大量快速输入生理盐水→血容量↑→左心房扩张→心肺感受器(+)→迷走神经传 入↑→抑制ADH的合成与释放→远曲小管、集合管对水的重吸收↓尿量↑ 3.大量快速输入生理盐水→肾血浆流量↑→血浆胶渗压升高的速度减慢→滤过平衡点 靠近出球小A端→产生滤过作用的毛细胞血管长度↑→GFR↑→尿量↑ 注射ADH: 1.主要:ADH与V2受体结合→兴奋性G蛋白→激活腺苷酸环化酶→cAMP↑→激活蛋白激酶A→AQP-2镶嵌在管腔膜上→管腔膜上的水通道↑→对水的通透性↑→渗透浓度梯度→重吸收的水量↑尿量↓ 2.增强髓袢升支粗段对NaCl的重吸收,增加内髓集合管对尿素的通透性→提高髓质渗透浓度,有利于尿的浓缩,尿量↓ 注射葡萄糖时: 葡萄糖浓度超过肾糖阈→小管液葡萄糖浓度↑→渗透压↑保留一部分水→ Na+被稀释
→重吸收Na+↓,小管液中Na+↑→渗透作用→肾小管对水的重吸收↓→尿量↑ 注射去甲肾上腺素: 1. NE+α受体结合→入球小A和出球小A收缩→肾小球毛细血管血压↓→有效滤过压↓→GFR↓→尿量↓ 2. NE+近球细胞β2受体→刺激球旁细胞释放肾素→血管紧张素Ⅱ、醛固酮↑→增加肾小管对钠离子的吸收→尿量↓ 3. NE+ 近端小管和髓袢上α1受体→对钠离子、氯离子和水的重吸收↑→尿量↓ 注射速尿: 呋塞米抑制髓袢升支粗段 Na+-K+-2Cl-同向转运体→降低管内外渗透浓度梯度→尿量↑ 刺激迷走神经: 迷走神经传入释放Ach→心肌细胞M受体→心率↓→心输出量↓,肾血流量↓→肾小球滤过率↓→尿量↓
植物生理学实验指导
植物生理学实验指导 Prepared on 24 November 2020
植物生理学实验指导
目录
植物材料的采集、处理与保存 植物生理实验使用的材料非常广泛,根据来源可划分为天然的植物材料(如植物幼苗、根、茎、叶、花等器官或组织等)和人工培养、选育的植物材料(如杂交种、诱导突变种、植物组织培养突变型细胞、愈伤组织、酵母等)两大类;按其水分状况、生理状态可划分为新鲜植物材料(如苹果、梨、桃果肉,蔬菜叶片,绿豆、豌豆芽下胚轴,麦芽、谷芽,鳞茎、花椰菜等)和干材料(小麦面粉,玉米粉,大豆粉,根、茎、叶干粉,干酵母等)两大类,因实验目的和条件不同,而加以选择。 植物材料的采集和处理,是植物生理研究测定中的重要环节。在实际工作中,往往容易把注意力集中在具体的仪器测定上,而对于如何正确地采集和处理样品却不够注意,结果导致了较大的实验误差,甚至造成整个测定结果的失败。因此,必须对样品的采集、处理与保存给予足够的重视。 一、原始样品及平均样品的采取、处理 植物生理研究测定结果的可靠性(或准确性),首先取决于试材对总体的代表性,如果采样缺乏代表性,那么测定所得数据再精确也没有意义。所以,样品的采集除必须遵循田间试验抽样技术的一般原则外,还要根据不同测定项目的具体要求,正确采集所需试材。目前,随着研究技术的不断发展,应该不断提高采样技术的水平。 在作物苗期的许多生理测定项目中都需要采集整株的试材样品,在作物中后期的一些生理测定项目中,如作物群体物质生产的研究,也需要采集整株的试材样品,有时虽然是测定植株的部分器官,但为了维持器官的正常生理状态,也需要进行整株采样。 除研究作物群体物质生产外,对于作物生理过程的研究来说,许多生理指标测定中的整株采样,也只是对地上部分的采样,没有必要连根采样,当然对根系的研究测定例外。采样时间因研究目的而不同,如按生育时期或某一特殊需要的时间进行。除逆境生理研究等特殊需要外,所取植株应是能代表试验小区正常生育无损伤的健康植株。
生理生化实验报告
微生物实验报告 微生物的生理生化实验 侯汶青201300140031 组别:周四下午五组 同组者:李璇、李倩茜实验完成时间:2014年12月6号 一、实验目的 1、证明不同微生物对各种有机大分子物质的水解能力不同,从而说明不同微生物有着不同的酶系统。 2、掌握进行微生物大分子物质水解试验的原理和方法。 3、了解糖发酵的原理,掌握通过糖发酵鉴别不同微生物的方法。 4、了解吲哚和甲基红试验的原理以及其在肠道细菌鉴定中的意义和方法。 5、熟习生理生化反应培养基的配制原理和一般方法步骤。 6、巩固无菌实验操作。 二、实验器材 1、菌种: 枯草芽孢杆菌、大肠杆菌、变形杆菌、铜绿假单胞菌(大分子水解实验); 大肠杆菌、变形杆菌(糖发酵实验); 大肠杆菌、产气杆菌(吲哚实验); 大肠杆菌、产气杆菌(甲基红实验); 2、培养基: (1)固体淀粉培养基,固体油脂培养基(淀粉和油脂的大分子水解实验);(2)葡萄糖发酵培养基、乳糖发酵培养基试管每组共5支,而且内装有倒置的德汉氏小管(糖发酵实验); (3)蛋白胨水培养基(吲哚实验) (4)葡萄糖蛋白胨水培养基(甲基红实验) 3、溶液和试剂: 卢戈氏碘液,乙醚,吲哚试剂,甲基红试剂,蒸馏水,去离子水、氢氧化钠溶液、中性红试剂、溴甲酚紫乙醇溶液等 4、仪器或其他用具: 成套培养皿,试管,玻璃棒、酒精灯,烧杯,德汉氏小管,接种环、吸管、滴管、洗耳球、无菌操作台、量筒、试管架等 三、实验原理 1、微生物的生理生化反应原理:在所有生活细胞中存在的全部生物化学反应称之为代谢。代谢过程主要是酶促反应过程。许多细菌产生胞外酶,这些酶从细胞中释放出来,以催化细胞外的化学反应。各种细菌由于具有不同的酶系统,致使它们能利用不同的底物,或虽然可以利用相同的底物,却产生不同的代谢产物,因此可以利用各种生理生化反应来鉴别细菌。 微生物代谢重要特征之一,就是代谢类型的多样性,因此使得微生物在自然
生理生化实验方法2
Ray Kuo 2008 菌种的生理生化分析 1.2 放线菌形态观察。 在高氏一号培养基[4]、蔗糖蔡氏琼脂培养基、葡萄糖-天门冬素琼脂培养基及甘油淀粉谷氨酸盐琼胶培养基[11]上,插片培养菌种,观察其基内菌丝体以及气生菌丝体的颜色。 将培养基融化后,以每皿15-18ml的量倾倒平板,待凝固,将放线菌划线接种在皿中,然后取无菌的盖玻片以45度角插入培养基内,盖玻片插入深约1/3(玻片必须于接种线垂直),每皿可以插2-3片。盖上皿盖,置于28℃培养,菌丝将沿玻片向上生长,定期观察。 [12] 菌株生理生化特性测定 明胶液化 将待检菌种接种于柱型明胶培养基[8]表面(不用穿刺)28℃下培养,分别在5,10,20及30天各观察一次液化情况。观察前将菌种管冷藏20-30分钟,如明胶不液化则仍是固体状态,若呈液体即为液化。明胶的水解是由于菌种所产生的蛋白酶的作用。 牛奶凝固与胨化测定 将牛奶10000rpm离心,去上层油脂成脱脂牛奶。将代测定菌株接种于脱脂牛奶中,28℃下培养,分别在3,6,10,20及30天各观察一次。如牛奶出现凝块,则为凝固。这是由于凝乳酶或发酵乳糖时产酸的作用,依据凝固原因的不同,尚有酸凝和酶凝脂粉。牛奶中的酪蛋白在蛋白酶的作用下被水解,使牛奶变得清亮而透明,此为胨化。凝固速度在开始的3-6天最快。 淀粉水解测定 将待检菌接种于淀粉培养基平板上。28℃培养10天至20天后在培养基表面加入碘液。若有淀粉酶产生,则淀粉变成糊精或糖而被吸收利用,菌落遇碘液不显蓝色,可在培养物周围形成无色透明圈。圈的大小表示淀粉酶产生的强弱。如不产生淀粉酶,则菌落周围遇碘成蓝色。 纤维素水解 将菌种接种于滤纸条上,接种材料最好是孢子(不带培养基)置28℃培养30天后观察。滤纸条分解表明产生了纤维素酶,滤纸条无变化者为阴性。 硫化氢产生实验 将待检菌接种于含柠檬酸铁(即Tresner’s)有机培养基斜面上,置28℃培养10天左右(视菌苔生长成丛为宜)观察结果。如产生褐色则说明有H 2S产生,H 2S与柠檬酸铁结合产生黑色硫化铁。 酪氨酸水解 将待检菌接种到斜面培养基上,适温培养3-7天,观察斜面,若有黑色素即为阳性反应,说明菌种具有酪氨酸酶。 碳源利用试验] 细菌能否利用某些含碳化合物作为唯一碳源,反映细菌是否含有代谢这种含碳化合物的酶,因而可以作为鉴定的依据。 菌种收集后应经离心洗涤制成菌悬液,以避免带入它种碳源,干扰实验结果。基础培养
生理实验分析
实验目的:分析反射弧的组成,了解反射弧的完整性与反射活动的关系实验对象:蟾蜍实验方法: 1. 制备脊蟾蜍。用刺蛙针于蟾蜍头部枕骨大孔处刺入颅腔将脑组织拆毁,保留脊髓,制成脊蟾蜍。 2. 用铁夹夹住脊蟾蜍下颌,悬吊在铁支架上。 观察项目: 分析:对实验结果进行分析。 1、反射活动的实现需要感受器来感受外界刺激 2、反射活动的实现需要传入传出神经来传导兴奋 3、反射活动的实现需要反射中枢来信号分析并发出指令 4是反射,5是反应 反射:是在中枢神经系统的参与下,机体对刺激的规律性反应。完成反射活动必须有完整的反射弧。如排尿反射、排便反射。反应:接受刺激后机体活动状态的改变。反应的表现形式:兴奋与抑制。如在除去脑、脊髓(及中枢神经系统)后刺激肌肉,肌肉依然有反应。结论:在本实验中可得什么结论。 在中枢神经系统参与下机体对刺激发生的有适应意义的反应过程称为反射。反射活动的结构基础是反射弧。反射弧由感受器、传入神经纤维、反射中枢、传出神经纤维和效应器5个部分构成。反射弧的结构和功能的完整性是实现反射活动的必要条件。反射弧的任何环节发生障碍或受到破坏,这一反射活动就将发生紊乱或不能出现。
实验目的:掌握阈强度的测定方法,阈强度与兴奋性的关系实验方法:制备坐骨神经腓肠肌标本。 观察项目: 分析:什么是阈强度?与兴奋性有何关系? 阈强度:在实际测量时,把刺激持续时间和强度对时间的变化率固定,测量能使组织发生兴奋地最小刺激强度。它可以作为测量兴奋性大小的指标。阈强度与兴奋性成反比关系。阈强度小,表示组织兴奋性高;阈强度大,则兴奋性低。 实验一(3)刺激与反应 实验目的:了解各种组织的反应形式。实验对象:蟾蜍实验方法: 1.破坏蟾蜍的脑和脊髓,将蟾蜍仰卧在蟾蜍板上,暴露心脏。观察项目及结果 分析实验结果 不同组织接受同一刺激会产生不同的反应。如心脏受到肾上腺素的刺激时,表现为兴奋,而胃肠道平滑肌则表现为抑制。 相同组织接受不同刺激其反应也有所不同。如心脏受到肾上腺素的刺激时,表现为兴奋,而受到乙酰胆碱的刺激时,则表现为抑制。 结论 实验三(1)蟾蜍心兴奋传导系统分析 实验目的:利用结扎的方法,分析蛙心起搏点及兴奋传导的顺序。实验对象:蟾蜍 实验方法: 1.暴露蛙心:用刺蛙针破坏蛙的脑和脊髓,将蛙背位固定于蛙板上,剪开胸部皮肤及胸骨, 剪开心包膜,显露心脏。 2.辨别蛙心静脉窦、心房、心室三部分及窦房沟、房室沟的结构和位置。
生理学实验报告
生理学实验报告 坐骨神经-腓肠肌标本的制备 一、实验目的及要求 学习蛙类动物双毁髓的方法 掌握制备坐骨神经-腓肠肌标本的操作技术,为此后有关的神经肌肉实验打下基础。 二、实验原理 蛙或两栖类动物的一些基本生命活动及生理功能与温血动物近似,而且其离体组织需要的生活条件非常简单,易于控制和掌握。因
此在生理学实验中,坐骨神经-腓肠肌标本是研究神经肌肉生理最常用的对象,经常用来研究神经肌肉的兴奋性、刺激与反应的规律、肌肉收缩的特点、兴奋性的周期性变化等。 三、实验对象 蟾蜍或蛙。 四、实验器材及药品 蛙类手术器械一套(金属探针1根,粗剪刀、眼科剪刀各1把,圆头镊子、眼科镊子各1把,玻璃分针2根),蛙板和玻璃板各1块,培养皿,滴管,废物缸、锌铜弓,丝线,棉花;任氏液。 五、实验方法及步骤 1、双毁髓:左手握蟾蜍,背部向上。用食指按压其头部前端,拇指压住躯干的背部,使头向前俯;右手持毁髓针,由两眼之间中线向后方划触,触及两耳后腺之间的凹陷处即是枕骨大孔的位置。将毁髓针由凹陷处垂直刺入枕骨大孔,然后针尖向前刺入颅腔,在颅腔内搅动,以毁脑组织。再将毁髓针退至枕骨大孔,针尖转向后方,与脊柱平行刺入椎管,以捣毁脊髓。脊髓彻底捣毁时,可看到蟾蜍后肢突然蹬直,然后瘫软,此时的动物为双毁髓动物。 2、剥制后肢标本:左手持手术镊提起两前肢之间背部的皮肤,右手持手术剪横向剪断皮肤,然后往后肢方向撕剥皮肤。剪开腹壁肌肉,用手术镊提起内脏,翻向头部,在看清支配后肢的脊神经发出部位后,于其前方剪断脊柱。 3、分离两后肢:将去皮的后肢腹面向上置于解剖盘上,右手持
金冠剪纵向剪开脊柱,再剪开耻骨联合,使两后肢完全分离。 4、分离坐骨神经:将一侧后肢的脊柱端腹面向上,用玻璃分针沿脊神经向后分离坐骨神经,股部沿腓肠肌正前方的股二头肌和半膜肌之间的裂缝,找出坐骨神经,剪断盖在上方的梨状肌,完全暴露坐骨神经,剪去支配腓肠肌之外的分支,再剪去脊柱及肌肉,只保留坐骨神经发出部位的一小块脊柱骨。 5、分离股骨头:沿膝关节剪去股骨周围的肌肉,保留股骨的后2/3,剪断股骨。 6、游离腓肠肌:在腓肠肌跟腱下穿线并结扎,提起结扎线,剪断肌腱与胫腓骨的联系,游离腓肠肌,剪去膝关节下部的后肢,保留腓肠肌与股骨的联系,制备出完整的坐骨神经-腓肠肌标本。标本应包括:坐骨神经、腓肠肌、股骨头和一段脊柱骨四部分。 7、检验标本:用任氏液沾湿的锌铜弓的两极接触神经,如腓肠肌发生收缩,则标本机能正常,把标本固定在肌槽上。 8、连接好装置,调节适宜的灵敏度及刺激强度,开动记录仪,走纸速度为10mm/s,用手控触发开关,以单脉冲刺激神经,记录肌肉的单收缩曲线。 9、分别用1 Hz、2 Hz、3 Hz、4 Hz、6 Hz、12 Hz、24 Hz、30Hz 等频率去刺激坐骨神经,记录肌肉的收缩曲线。 六、分析及讨论 七、思考题 ?1.剥去皮肤的后肢,能用自来水冲洗吗?为什么?
生理学设计性实验
不同pH值对牛蛙离体心脏收缩活动的影响 2008231144 赖泽红生科一班 摘要:本实验主要是采用斯氏蛙心插管法,在保持灌流液高度恒定的情况下,分别以不同pH值的溶液对牛蛙离体心脏进行灌流,经张力换能器、RM6240D型生物信号采集处理系统与处理系统记录心肌的活动过程,探讨不同pH对离体心脏活动的影响,以揭示酸碱度与心脏收缩活动的关系。 关键词:pH值;离体心脏;收缩活动 生理状态下,血液pH值保持在7.35—7.45,这是保证细胞惊醒正常代谢和机能活动的基本条件。在生命活动的过程中,体内不断生成酸性或碱性产物,机体通过多方面的调解活动,使血液pH值保持在正常范围内。然而,一旦机体酸碱调节失衡,会导致体内酸中毒或碱中毒,对机体造成影响。心脏直接与血液接触,心肌细胞的收缩活动容易受血液pH值的影响。本实验通过用不同PH值的灌流液灌流牛蛙离体心脏,观察其对心脏某些功能的影响,以揭示酸碱度与心脏收缩活动的关系,用离体牛蛙心脏,排除了在体时的神经体液干扰,故实验结果更为可靠。 一、实验材料: 1、实验仪器:RM6240D型生物信号采集处理系统、张力换能器、pH酸度计。 2、常用器械:蛙板或蜡盘,蛙心夹、蛙心套管,滴管,培养皿或小烧杯,玻璃板、容量瓶,移液管、量筒、污物缸,纱布,棉线,
常用手术器械。 3、药品:任氏液, HCL溶液,NaOH溶液。 4、实验动物:牛蛙2-4只(雌雄不限)。 二、实验步骤与方法 1、药品配制 (1)任氏液配制 母液及容量成分 NaCl、 KCl 、CaCl2 、NaH2PO4 、NaHCO3 、葡萄糖、蒸馏水,注: 表内各成分除葡萄糖以 g 为单位外,均以 ml 为单位. 任氏液的配制方法:一般先将各成分分别配制成一定浓度的母液,而后按所要的容量混合。需要注意的是:CaCl2 应在其他母液混合并加入蒸馏水后,再边搅拌边加入,以防钙盐生成。另外,葡萄糖应在用前临时加入,否则不宜久置。两栖类的为PH6.5-7.0 (2)不同PH浓度的任氏液配制。 不同PH值灌流液的配制。首先,校整酸度计。先将酸度计“PH-mv”开关拨到位置。打开电源开关,指示灯亮,预热30分钟。取下放蒸馏水的小烧杯,并用滤纸轻轻地吸去玻璃电极上多余水珠,在小烧杯内放入选择好的已知的PH值准确的缓冲溶液。将电极浸入。根据标准缓冲液的PH,将量程开关拧到 0~7 或 7~14 处。调节控温钮指示的温度与室温相同,调节零点,使指针在PH为7.0处。轻轻按下或稍许转动读数开关使开关卡住。调节定位旋钮,使指针恰好指在标准缓冲溶液的PH值处。放开读数开关,重复操作,直到数
